化学平衡习题及答案
化学平衡习题和答案

第五章 化学平衡 选择题1. 对于化学平衡, 以下说法中不正确的是(A) 化学平衡态就是化学反应的限度 (B) 化学平衡时系统的热力学性质不随时间变化 (C) 化学平衡时各物质的化学势相等 (D) 任何化学反应都有化学平衡态 答案:C 。
正确的说法应为0BB Bνμ=∑2. 下面的叙述中违背平衡移动原理的是(A) 升高温度平衡向吸热方向移动 (B) 增加压力平衡向体积缩小的方向移动 (C) 加入惰性气体平衡向总压力减少的方向移动 (D) 降低压力平衡向增加分子数的方向移动 答案:C 。
加入惰性气体平衡向总压力增大的方向移动3.要使一个化学反应系统在发生反应后焓值不变, 必须满足的条件是 (A) 温度和内能都不变 (B) 内能和体积都不变(C) 孤立系统 (D) 内能, 压力与体积的乘积都不变 答案:D 。
因ΔH =ΔU +Δ(pV )4. 在等温等压下,当反应的Δr G m ∃ = 5kJ·mol -1时,该反应能否进行?(A) 能正向自发进行 (B) 能逆向自发进行 (C) 不能判断 (D) 不能进行 答案:C 。
应该用Δr G m 判断而不是Δr G m ∃。
5.已知反应 2NH 3 = N 2 + 3H 2,在等温条件下,标准平衡常数为0.25,那么,在此条件下,氨的合成反应1/2 N 2 + 3/2 H 2 = NH 3 的标准平衡常数为:(A) 4 (B) 0.5 (C) 2 (D) 1 答案:C 。
6.反应 2C(s) + O 2,其r G m ∃/(J·mol -1) = -232600 - 167.7T /K ,若温度升高,则: (A) r G m ∃ 变负,反应更完全 (B) K p ∃ 变大,反应更完全 (C) K p ∃ 变小,反应更不完全 (D )无法判断答案:C7.对于气相反应,当体系总压力p 变化时(A) 对K f ∃ 无影响 (B) 对K r 无影响 (C) 对K p ∃ 无影响 (D) 对K f ∃ 、K r 、K p ∃ 均无影响 答案:A 。
高中化学《化学平衡》练习题(附答案解析)

高中化学《化学平衡》练习题(附答案解析)学校:___________姓名:___________班级:___________一、单选题1.煤气化的主要反应为:C(s)+H 2O(g)高温 CO(g)+H 2(g)下列有关叙述错误的是( ) A .升高温度 反应速率加快B .将块状固体粉碎 反应速率加快C .平衡时 CO 的浓度不再变化D .平衡时 反应就停止了2.工业生产氨气的适宜条件中不包括( )A .用浓硫酸吸收产物B .用铁触煤作催化剂C .温度500℃左右D .压强为20~50MPa3.在绝热的某刚性容器中置入1molF 2和3molClF 3 发生反应:F 2(g)+ClF(g)ClF 3(g)。
下列说法中能够判断该反应一定处于平衡状态的有( )A .F 2(g)与ClF(g)体积之比恒定不变B .F 2(g)与ClF 3(g)速率之比恒定不变C .混合物中Cl 元素质量分数恒定不变D .断裂1molF —F 键 同时生成3molF —Cl 键4.下列化工生产中未使用催化剂的是( )A .合成氨B .制纯碱C .乙烯水化D .SO 2转化为SO 35.下列过程中 需要增大化学反应速率的是( )A .钢铁腐蚀B .食物腐败C .塑料老化D .工业合成氮6.通过缩小反应容器体积而增大压强对下列反应的速率无影响的是( )A .CO 2(g)+Ca(OH)2===CaCO 3↓+H 2OB .H 2(g)+I 2(g)2HI(g)C .NaCl +AgNO 3===AgCl ↓+NaNO 3D .N 2(g)+3H 2(g)2NH 3(g)7.下列叙述正确的是( )A .升高温度 可降低活化能B .反应2SiO (s)2C(s)Si(s)2CO(g)+=+必须在高温下才能自发进行 则有H 0∆>C .合成氨生产中将NH 3液化分离 可加快正反应速率D .任何可逆反应 其平衡常数变大 反应物的转化率变小8.对于反应: (g)+ I 2(g) (g)+2HI(g) △H>0.达到平衡后 欲增加环戊烯的平衡转化率 可采取的措施有( )A .恒压条件下通入惰性气体B .降低温度C .增大环戊烯浓度D .将容器体积减小到原来的一半9.当其他条件不变时 下列说法正确的是( )A .增加反应物的质量 一定能加快反应速率B .用粉状锌代替块状锌与稀硫酸反应一定会加快反应速率C .当反应物与生成物浓度相等时 可逆反应一定已达到化学平衡状态D .在合成氨反应中 增大N 2浓度一定可以使H 2的转化率达到100%10.乙烯气相直接水合反应制备乙醇:24225C H (g)H O(g)C H OH(g)+。
化学平衡练习题及答案

化学平衡练习题一、是非题,下列各题的叙述是否正确,对的画√错的画×1、 对于理想气体反应,等温等容下添加惰性组分时平衡不移动。
( )2、指定状态下的 ∆r G 或∑μνB OB B 就是定温定压下G ~ξ 曲线上某一点切线的斜率。
( ) 3、化学反应达到平衡时,反应的摩尔吉布斯函数∆r G m =0。
( )4、恒T 、p 、W ˊ=0下,化学反应的平衡条件为:0r m B B G νμ∆=∑= 。
( )5、某一反应在等温等压且无非体积功的条件下∆r m G > 0 ,则该反应不能正向进行。
( )6、理想气体化学反应()()()A g B g C g →+,在恒温下增大总压时,反应物转化率将增大.( )7、对理想气体反应:0 = ∑νB B ,在定温定压下当∑νB 〉0时,随着惰性气体的加入而平衡向右移动。
( )8、由∆r G =-RT ln K ,因为K 是平衡常数,所以∆r G 是化学反应达到平衡时的摩尔吉布斯函数变化值。
( )9、等温等压且不涉及非体积功条件下,一切吸热且熵减小的反应,均不能自动发生。
( )10、 对于B B 0ν≠∑的理想气体反应,等温等压下添加惰性组分时平衡不移动。
( )11、标准平衡常数变了,平衡一定会移动。
反之,平衡移动了,标准平衡常数一定会改变。
( )12、对理想液态混合物中的反应,标准平衡常数K (T )≈B eq B B )χ(ν∏K x .( )13、任何一个化学反应都可以用标准摩尔吉布斯函数来判断反应的方向。
( )14、某反应的平衡常数是一个不变的常数。
( )15、在一定温度和压力下,某反应的∆r G> 0,所以要选用合适的催化剂,使反应得以进行.( )二、选择题1、温度升高时,固体氧化物的分解压力(分解反应是吸热反应):( )。
(1)降低;(2)增大;(3)恒定;(4)无法确定。
2、 HgO (s)的标准摩尔生成吉布斯函数 ∆f G 为— 58。
化学平衡-习题及答案

化学平衡复习题一、判断题:1、H3PO4溶液中,c (PO43- ) = K(H3PO4 ) mol·L-1。
.................................................()2、催化剂只能改变反应的活能,不能改变反应的热效应。
........................................()3、由CaCO3和CaO 构成的封闭系统,在任何条件下都不能使反应CaCO3 (s) CaO (s) + CO2 (g) 达到平衡。
................................................................()3、MnS (s) + 2 HAc Mn2+ + 2 Ac- + H2 S 反应的标准平衡常数K= K( MnS )·[ K( HAc ) ]2 / [ K( H2S )·K( H2S ) ]。
............. ()4、密闭容器中,A、B、C 三种气体建立了如下平衡:A (g) + B (g) C (g),若保持温度不变,系统体积缩小至原体积的2时,则反应商Q与平衡常数的关系3是:Q = 1.5 K。
..........................................................................()5、根据同离子效应,沉淀剂加入越多,其离子沉淀越完全。
. ()6、在一定温度下,随着可逆反应2SO2 (g) + O2 (g) 2SO3 (g) 的进行,p (O2 )、p (SO2 ) 不断减少,p (SO3 ) 不断增大,所以标准平衡常数K不断增大。
.....................................()二.选择题:1、在一恒压容器中,某温度、100.0 kPa 条件下,将1.00 mol A 和2.00 mol B 混合,按下式反应:A (g) + 2B (g) C (g)。
化学平衡(习题及答案)解析

101kPa大气平衡的水中此c(O2)。[大气中p(O2)=21.0kPa]
解:
K ceq (O2 ) / c pO2 / p
20℃时: K 1.38 103 1.38 103 1
K
ceq (O2 ) / c pO2 / p
ceq (O2 ) / c 21.0 /101
1.38103
ceq(O2)=2.87×10-4(mol·dm-3)
对于放热反应, ΔrHm⊙ <0,温度升高, K⊙减小, Q> K⊙,平衡向逆向移动。
对于吸热反应, ΔrHm⊙ >0,温度升高, K⊙增大, Q <K⊙,平衡向正向移动。
2.反应3H2(g)+N2(g)=2NH3(g) △rHmθ>0,在密闭容器该反应达 到平衡时,若降低温度,平衡 向逆反应方向移动;若恒容条 件下,充入惰性气体,增加系统的总压力,则平衡 不移动。
A、K1θ+K2θ
B、K1θ-K2θ
C、K1θ×K2θ
D、K1θ/K2θ
6.合成氨反应3H2(g)+N2(g)=2NH3(g)在恒压下进
行时,若向体系中加入Ar,则氨的产率( A )
A、减小 B、增大 C、不变 D、无法判断
2
General Chemistry
Chapter 5 Homework
二、填空题 1.对放热反应,化学平衡常数K值随温度升高而 减小 随温 度降低而 增大 。
C、小于35%
D、无法知道
3.反应CO2(g)+H2(g)=CO(g)+H2O(g) △rHmθ>0,若要提高 CO的产率,可采用的方法是 ( )C
A、增加总压力
B、加入催化剂
化学平衡练习题带答案
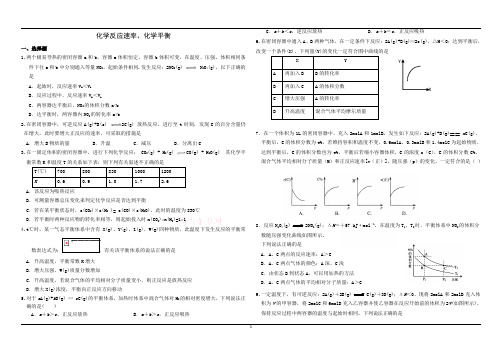
化学反应速率、化学平衡一、选择题1.两个极易导热的密闭容器a和b,容器a体积恒定,容器b体积可变,在温度、压强、体积相同条件下往a和b中分别通入等量NO2,起始条件相同.发生反应:2NO2(g) N2O4(g),以下正确的是A.起始时,反应速率V a<V bB.反应过程中,反应速率V a<V bC.两容器达平衡后,NO2的体积分数a<bD.达平衡时,两容器内NO2的转化率a>b2.在密闭容器中,可逆反应A(g)+B(s) 2C(g) 放热反应,进行至t时刻,发现C的百分含量仍在增大,此时要增大正反应的速率,可采取的措施是A.增大B物质的量 B.升温 C.减压 D.分离出C3.在一固定体积的密闭容器中,进行下列化学反应: CO2(g) + H2(g) CO(g) + H2O(g) 其化学平衡常数K和温度T的关系如下表:则下列有关叙述不正确的是T(℃) 700 800 830 1000 1200K0.6 0.9 1.0 1.7 2.6A.该反应为吸热反应B.可测量容器总压变化来判定化学反应是否达到平衡C.若在某平衡状态时,c(CO2)×c(H2 )= c(CO)×c(H2O),此时的温度为830℃D.若平衡时两种反应物的转化率相等,则起始投入时n(CO2):n(H2)=1:14.t℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:,有关该平衡体系的说法正确的是A.升高温度,平衡常数K增大B.增大压强,W(g)质量分数增加C.升高温度,若混合气体的平均相对分子质量变小,则正反应是放热反应D.增大X(g)浓度,平衡向正反应方向移动5.对于a A(g)+b B(g) c C(g)的平衡体系,加热时体系中混合气体对H2的相对密度增大,下列说法正确的是( )A.a+b>c,正反应放热B.a+b>c,正反应吸热C.a+b<c,逆反应放热D.a+b=c,正反应吸热6.在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)2c(g),△H<0;达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是X YA 再加入B B的转化率B 再加入C A的体积分数C 增大压强A的转化率D 升高温度混合气体平均摩尔质量7.在一个体积为1L的密闭容器中,充入2molA和1molB,发生如下反应:2A(g)+B(g)==x C(g),平衡后,C的体积分数为w%,若维持容积和温度不变,0.6molA、0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数也为w%。
化学平衡复习题及答案

化学平衡复习题及答案化学平衡是化学中一个重要概念,涉及到反应物和生成物在一定条件下达到动态平衡的状态。
以下是一些化学平衡的复习题及答案,以帮助学生更好地理解和掌握这一概念。
题目一:定义题什么是化学平衡?答案一:化学平衡是指在一个封闭系统中,正向反应和逆向反应以相同的速率进行,系统内各组分的浓度保持不变的状态。
题目二:计算题在一定温度下,一个反应体系中,A和B反应生成C和D。
已知初始时[A] = 0.1 mol/L,[B] = 0.2 mol/L,[C] = [D] = 0。
反应达到平衡时,[C] = 0.05 mol/L。
假设反应的化学方程式为:\[ A + B \rightleftharpoons C + D \]求平衡时[A]、[B]、[D]的浓度。
答案二:根据平衡时[C] = 0.05 mol/L,可以推断出[A]和[B]各消耗了0.05 mol/L。
因此,平衡时[A] = 0.1 - 0.05 = 0.05 mol/L,[B] = 0.2 - 0.05 = 0.15 mol/L。
由于反应是1:1进行的,[D]的浓度也将是0.05 mol/L。
题目三:理解题为什么在化学平衡中,正向反应和逆向反应的速率相等时,并不意味着反应已经停止?答案三:在化学平衡中,正向反应和逆向反应的速率相等意味着它们以相同的速率进行,但这并不意味着反应停止。
实际上,反应物和生成物仍然在不断地转化,只是转化的速率保持恒定,因此宏观上看起来像是反应停止了。
题目四:判断题如果在一个化学平衡体系中增加反应物的浓度,平衡会向哪个方向移动?答案四:根据勒夏特列原理,增加反应物的浓度会使平衡向生成物的方向移动,以减少系统的压力或浓度差。
题目五:应用题在工业生产中,如何通过调节外界条件来提高某一化学反应的产率?答案五:可以通过以下方式提高化学反应的产率:1. 增加反应物的浓度。
2. 减少生成物的浓度,例如通过连续移除生成物。
3. 改变温度,通常升高或降低温度可以使平衡向吸热或放热的方向移动。
化学平衡习题集(含答案)

化学平衡习题集1.如图所示,一定条件下将1mol A2气体和3molB2气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示。
在恒温恒压下发生如下反应:A2+3B2 2AB3。
当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率是A.20% B.40%C.60%D.无法确定2.可逆反应a A(s)+b B(g) c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是:A.达到平衡后,加入催化剂则C%增大B.达到平衡后,若升高温度,平衡向右移动C.化学方程式中b < c +d D.达平衡后,增加A的量,有利于平衡向右移动3.一定温度下,把2. 0体积的N2和6. 0体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H22NH3。
已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为..c mol·L-1的是A。
1.0体积的N2和3。
0体积的H2 B。
2。
0体积的N2、6。
0体积的H2和4.0体积的NH3C. 4。
0体积的NH3和1.0体积的H2 D。
2.0体积的NH34.根据下列有关图象,说法正确的是A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0B.由图Ⅱ知,反应在t6时,NH3体积分数最大C.由图Ⅱ知,t3时采取降低反应温度的措施D .图Ⅲ在10L 容器、850℃时反应,由图知,到4min 时,反应放出51.6kJ 的热量 5.已知某可逆反应mA (g )+ nB(g ) pC (g ),在密闭容器中进行,下图表示在不同反应时间t 、温度T 和压强P 与反应物B 在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( )A 、T 1〈T 2、P 1>P 2、m+n 〉p ,⊿H <0;B 、T 1>T 2、P 1〈P 2、m+n 〉p,⊿H >0;C 、T 1〉T 2、P 1〈P 2、m+n<p ,⊿H >0;D 、T 1<T 2、P 1>P 2、m+n 〈p,⊿H 〈0; 6.可逆反应2NH 3N 2+3H 2在密闭容器中进行,达到平衡状态的标志是( )①单位时间内生成n mol N 2的同时生成2n mol NH 3 ②单位时间内生成n mol N 2的同时生成3n mol H 2 ③用NH 3、N 2、H 2的物质的量浓度变化表示的反应速率之比为2∶1∶3 ④各气体的浓度不再改变 ⑤混合气体的平均相对分子质量不再改变 A 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学平衡习题及答案
化学平衡习题及答案
化学平衡是化学反应中达到动态平衡的状态,反应物和生成物之间的摩尔比例
在一定时间内保持不变。
在学习化学平衡的过程中,习题是非常重要的一部分,通过解答习题可以帮助我们加深对化学平衡的理解。
本文将为大家提供一些化
学平衡的习题及其答案,希望能对大家的学习有所帮助。
习题一:考虑以下反应:N₂(g) + 3H₂(g) ⇌ 2NH₃(g),在一个封闭容器中,
开始时有2 mol N₂和6 mol H₂,经过一段时间后,平衡时封闭容器内有多少
摩尔的NH₃?
答案:根据反应物的摩尔比例,1 mol N₂与3 mol H₂反应生成2 mol NH₃。
因此,当N₂和H₂的摩尔数分别减少2 mol和6 mol时,NH₃的摩尔数增加
4 mol。
习题二:考虑以下反应:CO(g) + H₂O(g) ⇌ CO₂(g) + H₂(g),在一个封闭容器中,开始时有2 mol CO和4 mol H₂O,经过一段时间后,平衡时封闭容器
内有多少摩尔的CO₂?
答案:根据反应物的摩尔比例,1 mol CO与1 mol H₂O反应生成1 mol CO₂
和1 mol H₂。
因此,当CO和H₂O的摩尔数分别减少2 mol和2 mol时,
CO₂的摩尔数增加2 mol。
习题三:考虑以下反应:2H₂(g) + O₂(g) ⇌ 2H₂O(g),在一个封闭容器中,
开始时有3 mol H₂和2 mol O₂,经过一段时间后,平衡时封闭容器内有多少
摩尔的H₂O?
答案:根据反应物的摩尔比例,2 mol H₂与1 mol O₂反应生成2 mol H₂O。
因此,当H₂和O₂的摩尔数分别减少4 mol和2 mol时,H₂O的摩尔数增加4 mol。
习题四:考虑以下反应:N₂O₄(g) ⇌ 2NO₂(g),在一个封闭容器中,开始时有4 mol N₂O₄,经过一段时间后,平衡时封闭容器内有多少摩尔的NO₂?答案:根据反应物的摩尔比例,1 mol N₂O₄生成2 mol NO₂。
因此,当
N₂O₄的摩尔数减少4 mol时,NO₂的摩尔数增加8 mol。
习题五:考虑以下反应:C(s) + CO₂(g) ⇌ 2CO(g),在一个封闭容器中,开始时有2 mol C和2 mol CO₂,经过一段时间后,平衡时封闭容器内有多少摩尔的CO?
答案:根据反应物的摩尔比例,1 mol C与1 mol CO₂反应生成2 mol CO。
因此,当C和CO₂的摩尔数分别减少2 mol和2 mol时,CO的摩尔数增加4 mol。
通过解答以上习题,我们可以看到化学平衡的关键在于反应物和生成物之间的摩尔比例。
在平衡状态下,反应物和生成物的摩尔数会达到一定的平衡值,而不再发生明显的变化。
理解和掌握化学平衡的概念和计算方法对于化学学习是非常重要的,希望以上习题及其答案能够帮助大家更好地理解和应用化学平衡的知识。
