华南理工大学分析化学期末考试复习 练习题
2019年分析化学试题(B卷)

光度等于:
A 2 A ; B A/2 ; C 2lgA;D lg A/2
6.某碱样为 NaH CO3 和 Na2CO3 的混合液,用 HCL 标准溶液滴定,先以酚酞为指示
《 分析化学 》试卷第 1 页 共 6 页
学号
姓名
剂,耗去 HCL 溶液体积为 V1,继以甲基橙为指示剂,又耗去 HCL 溶液体积为 V2,V1 与 V2 的关系是:
18. 若分光光度计的仪器测量误差ΔT=0.5%,在 T=50%时,由测量引起的浓
度相对误差为:
A.1.0%
B.1.4%
C.1.8%
D.2.2%
19.以铁铵矾为指示剂的佛尔哈德法,其测定的酸度条件为: A. [H+]=1.0×10-6;B. [H+]=1.0×10-10; C. [H+]>0.3mol/L;D.与介质酸度无关
2. 所有答案请直接答在试卷上(或答题纸上);
3.考试形式:闭卷;
4. 本试卷共四大题,满分 100 分, 考试时间 120 分钟。
题号 一
二
三
四
总分
得分
评卷人
专业
一、单项选择题(请将答案填入下表,每题 1 分,共 20 分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 答案
20.将磷矿石中的磷以 MgNH4PO4 形式沉淀;再灼烧为 Mg2P2O7 形式称重;计算 P2O5 含量时的换算因数算式是:
A. M / M
rP2O 5
rMgNH4 PO4
C M / 2M
rP2O 5
rMg2 P2O7
B M / 2M
rP2O 5
分析化学期末考试题 (2)

分析化学期末考试题(卷)班级学号姓名一、名词解释(每小题4分)氧化还原反应透光率偶然误差恒重滴定突跃二、填空(每小题2分)1、在氧化还原反应中,失去电子的物质称为------,得到电子的物质称为------。
2、标定盐酸时常用------作基准物质,标定氢氧化钠时常用-------作基准物质。
3、配合物一般是由------和--------组成。
4分光光度法定量分析方法主要有--------,----------,----------。
5、滴定管根据构造的不同,分为----------和-----------。
6、测定值和真实值之间的差值称为---------。
7、影响指示剂变色的主要因素是-------,--------,----------,----------。
8、分析化学的任务是-------------------------------------------。
9、配合物的稳定程度通常用--------或--------表示。
10、分光光度法定量分析中的标准曲线法的横坐标代表-------,纵坐标代表--------。
三、单项选择题(每小题2分)1、能够用直接配制法配制滴定液的试剂必须是( )A 纯净物B 化合物C 混合物D 基准物质2、标定N a OH滴定液时常用的基准物质是()A草酸钠B苯甲酸C硼酸D邻苯二甲酸氢钾3、银量法不能测定()A CI-B I-C A c-D CN-4、高锰酸钾滴定法应在下列哪一种溶液中进行()A强酸性溶液B弱酸性溶液C中性溶液 D 碱性溶液5、分光光度法主要是利用了物质对光的( )现象A 选择性吸收B 反射C 散射D 折射6、EDTA不能直接滴定的离子是()A F e2+B Z n2+C C a2+D N a+7、配离子与外界离子之间相结合的化学键是()A 离子键B 配位键C 氢键D 共价键8、滴定反应中作还原剂的滴定液是()A N a OHB HCIC N a2S2O3D HNO39、滴定分析中已知准确浓度的试剂溶液称为()A 滴定液B 指示剂C 溶液D 被滴定液10、用万分之一分析天平进行称量时,结果以应记录到以克为单位小数点后几位()A 一位B 二位C 三位D 四位11、按任务分类的分析方法为()A 无机分析和有机分析B 定性、定量和结构分析C、常量分析与微量分析D、化学分析与仪器分析12、无论金属离子是几价的,EDTA与之配合时其比例关系为()A 1:1B 1:2C 2:3D 1:413、透光率T=100%时,吸光度A= ( )A 1 B0C10D∞14、铬黒T指示剂在水中的颜色()A红色B蓝色C酒红色D黄色15、用盐酸标准溶液滴定相同体积的氢氧化钠溶液时,四个学生记录的消耗盐酸溶液体积如下,哪一个正确()A24.0mlB24.2mlC24.10mlD24ml四、简答题1、朗伯—比尔定律的数学表达式及物理意义是什么(6分)2、如何减小测量中的系统误差?(6分)3、命名下列配合物,并指出其中的中心离子、配位体、配位原子和配位数(8分)(1)[A g(NH3)2]OHa)k3[F e(SCN)6]五、计算题(10分)精密吸取KM n O4样品溶液5.00ml,加蒸馏水稀释至25.00ml.另配制KM n O4标准溶液的浓度为25ug/ml.在525nm处,用1cm厚的吸收池,测得样品和标准溶液的吸光度分别为0.220和0.250,求原样品溶液中KM n O4的浓度。
2021化学分析应化-分析化学试卷(完美版)

题号
一
二
三
得分
评卷人
总分
一、选择题(每题 2 分,共 30 分)
1. 关于偶然(随机)误差叙述正确的是(
)
A. 大小误差出现的概率相等
B. 正负误差出现的概率相等
C. 负误差出现的概率大于正误差
D. 数据分布有一定范围但无特定规律
A. 0.025
B. 0.050
C. 0.10
D. 0.15
) mol·L-1
4. 滴定分析中,一般利用指示剂颜色的突变来判断等当点的到达。在指示剂变色时停止滴定,这
一点称为( )
A. 等当点 B. 滴定终点
C. 滴定误差
D. 化学计量点
5. 用配位滴定法测定铝盐,做法是控制适当条件,然后加入过量的 EDTA,加热煮沸完全反应后,
再用标准锌溶液滴定,该法的滴定方式是( )
A. 间接滴定法 B. 置换滴定法 C. 返滴定法 D. 直接滴定法
6. 利用下列反应进行氧化还原滴定时, 其滴定曲线在化学计量点前后为对称的是( )
A. 2Fe3++Sn2+=Sn4++2Fe2+ C. Ce4++Fe2+=Ce3++Fe3+
B. I2+2S2O32-=2I-+S4O62D. Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
D. 化合能力不同
15. 晶型沉淀的沉淀条件是( )
A. 热 稀 搅 慢 陈 B. 热 浓 搅 快 陈
分析化学(期末考试及答案)

分析化学(答案在最后一页)一、单选题1.有些指示剂可导致EDTA与MIn之间的置换反应缓慢终点拖长,这属于指示剂的()(A)僵化现象(B)封闭现象(C)氧化变质现象(D)其它现象2.在pH为4.42的水溶液中,EDTA存在的主要型体是()(A)H4Y (B)H3Y-(C)H2Y23. 用双指示剂法测某碱样时,若V1<V2,则组成为()(A) NaOH+Na2CO3 (B)Na2CO3(C) NaOH (D)Na2CO3+NaHCO34.酸碱滴定法选择指示剂时可以不考虑的因素是()(A)指示剂的颜色变化(B)指示剂的变色范围(C)指示剂相对分子量的大小(D) 滴定突跃范围5.某弱碱HA的Ka=1.0x10-5,其0.10mol--1溶液的pH值为()(A) 3.00 (B) 5.00 (C) 9.006. 在分光光度分析中,用1cm的比色皿测得某一浓度溶液的透光率为T,若浓度增加一倍,透光率为()(A)T2 (B)T/2 (C) 2T (D)√T7.示差分光光度法所测吸光度相当于普通光度法中的()(A)Ax (B) As (C)As-Ax (D)Ax-As8.测定铁矿石铁含量时,若沉淀剂为Fe(OH)3.称量形为Fe2O3,以Fe3O4表示分析结果,其换算因数是()(A)M Fe3O4M Fe2O3(B)M Fe3O4M Fe(OH)3(C) 2M Fe3O43M Fe2O39.用BaSO4沉淀法测S2-时,有Na2SO4共沉淀,测定结果()(A)偏低(B)偏高(C) 无影响(D)无法确定10.以K2CrO4为指示剂测定Cl-时应控制的酸度为()(A)PH为11-13 (B)PH为6.5-10.0(C) PH为4-6 (D)PH为1-311.pH=10.36的有效数字位数是()(A)四位(B)三位(C) 两位(D)一位12.下列四种离子中,不适于用莫尔法,以AgNO3溶液直接滴定的是()(A)Br-(B) CI-(C)CN-(D)I-13.下列属于自身指示剂的是()(A)邻二氮菲(B)淀粉指示剂(C) KMnO4 (D)二苯胺磺酸钠14.在Ca2+、Mg2+、Fe3+、Al3+混合溶液中,用EDTA测定Fe3+、Al3+含量时,为了消除Ca2+、Mg2+的干扰,最简便的方法是()(A)沉淀分离法(B)控制酸度法(C) 配位掩蔽法(D)溶剂萃取法15.用双指示剂法测某碱样时,若V1>V2,则组成为()(A)NaOH+Na2CO3 (B) NaOH (C) Na2CO3 (D)Na2CO3+NaHCO316.下列滴定中只出现一个滴定突跃的是( )(A)HCI滴定Na2CO3(B)HCI滴定NaOH+Na3PO4(C)NaOH滴定H2C2O4(D)NaOH滴定H3PO417.某弱碱MOH的Kb=1.0x10-5,其0.10moll-1溶液的pH值为()(A)3.00 (B)5.00 (9) 9.00 (D)11.0018.减小随机误差的措施是( )(A)增加平行测定次数(B)校正测量仪器(C) 对照试验(D)空白试验19.有色配位化合物的摩尔吸光系数与下列()因素有关(A)配位化合物的稳定性(B)有色配位化合物的浓度(C)入射光的波长20.在吸收光谱曲线上,随着物质浓度的增大,吸光度A增大,而最大吸收波长将()(A)为零(B)不变(C) 减小(D)增大21.用重量法测定Ca2+时,应选用的沉淀剂是()(A) H2SO4 (B)Na2CO3 (C)(NH4)2C2O4 (D)Na3PO422.为了获得纯净而且易过滤的晶形沉淀,要求()(A)沉淀的聚集速率大于定向速率(B)溶液的过饱和度要大(C)沉淀的相对过饱和度要小(D)溶液的溶解度要小23.以K2CrO4为指示剂测定Cl-时,应控制的酸度为()(A)pH为1-3 (B)pH为4-6 (C)pH为6.5-10.024.可用于滴定I2的标准溶液是( )(A)H2SO4 (B)KbrO3 (C) Na2S2O325. 用下列哪一标准溶液滴定可以定量测定碘?()(A) Na2S (B)Na2SO3 (C) Na2SO4 (D)Na2S2O326.用重铬酸钾法测定铁矿石中铁的含量时选用下列哪种还原剂?()(A)二氯化锡(B)双氧水(C)铝(D)四氯化锡27.用SO42-使Ba2+形成BaSO4沉淀时,加入适当过量的SO42-,可以使Ba2+沉淀的更完全,这是利用何种效应?()(A)盐效应(B)酸效应(C) 络合效应(D)溶剂化效应(E)同离子效应28.用0.1mol/LHCl滴定0.1mol/LNaOH时的pH突跃范围是9.7-4.3,若用1mol/LHCI滴定1mol/LNaOH时的pH突跃范围是()(A)9.7~4.3 (B)8.7~4.3 (C) 10.7 ~3.3 (D)8.7~5.329.衡量色谱柱柱效能的指标是( )(A) 相对保留值(B) 分离度(C)塔板数(D)分配系数30.若两电对在反应中电子转移数分别为1和2,为使反应完全程度达到99.9%,两电对的条件电位差至少应大于()(A)0.09V (B) 0.18V (C) 0.27V (D)0.36V31.佛尔哈德法测Ag+,所用滴定标准溶液、pH条件和应选择的指示剂是()(A)NH4SCN,碱性,K2CrO4;(B)NH4SCN,酸性,NH4Fe(SO4)2(C) AgNO3,酸性,NH4Fe(SO4)2(D)AgNO3,酸性,K2Cr207;(E)NH4SCN,碱性,NH4Fe(SO4)232. 用异烟酸-吡唑酮作显色剂可测定水中CN-的含量,浓度为Cmol/L的氟化物溶液显色后,在一定条件下测得透光率为T,若测量条件不变,只改变被测物浓度为1/3C,则测得的透光率'T为()(A)T1/2 (B)T1/3 (C) T1/4 (D)T/333. EDTA与金属离子形成整合物时,其整合比一般为()(A) 1:1 (B) 1:5 (C) 1:6 (D) 1:434.已知H3PO4的pKa1=2.12,pKa2=7.20,pKa3=12.36,若用NaOH滴定H3PO4,则第二个化学计量点的pH值约为()(A)10.7 (B)9.7 (C) 7.7 (D)4.935.需0.1MHCl溶液,请选最合适的仪器量取浓酸()(A) 量筒(B)容量瓶(C) 移液管(D)酸式滴定管36.下列各酸碱对中,属于共轭酸碱对的是()(A)H2CO3-CO32-(B)H3O+--OH-(C) HPO42---PO43 (D)NH3+CH2COOH-NH2CH2COO-37.下列有关随机误差的论述中不正确的是()(A)随机误差是由一些不确定的偶然因素造成的(B)随机误差出现正误差和负误差的机会均等(C)随机误差在分析中是不可避免的(D)随机误差具有单向性38.欲取50ml某溶液进行滴定,要求容器量取的相对误差≤0.1%,下列容器中应选哪种?()(A) 50ml滴定管(B)50ml容量瓶(C) 50ml量筒(D)50ml移液管39.使用碱式滴定管滴定的正确操作方法应是下面哪种?()(A)左手捏于稍高于玻璃近旁(B)右手捏于稍高于玻璃球的近旁(C)左手捏于稍低于玻璃球的近旁40.配制0.1M的NaS2O3标准液,取一定量的Na2S2O3晶体后,下列哪步正确?()(A) 溶于沸腾的蒸馏水中,加0.1gNa2CO3放入棕色瓶中保存(B)溶于沸腾后冷却的蒸馏水中,加0.1gNa2CO3放入棕色瓶中保存(C) 溶于沸腾后冷却的蒸馏水中,加0.1gNa2CO3放入玻璃瓶中保存41.如果要求分析结果达到0.1%的准确度,滴定时所用滴定剂溶液的体积至少应为多少ml?()(A) 10ml (B) 10.00ml (C) 18ml (D) 20ml42.EDTA在PH<1的酸性溶液中相当于几元酸?()(A) 3 (B) 5 (C) 4 (D) 2 (E) 643.不含其它干扰性杂质的碱试样,用0.1000MHCl滴定至酚酞变色时,用去Hcl20.00ml加入甲基橙后,继续滴定至终点又用去HCl10.00ml,此试样为下列哪种组成?()(A) NaOH,Na2CO3 (B)Na2cO3(C)Na2CO3,NaHCO3 (D)NaHCO3,NaOH44.用含有微量杂质的草酸标定高锰酸钾浓度时,得到的高锰酸钾的浓度将是产生什么结果?()(A) 偏高(B)偏低(C) 正确(D)与草酸中杂质的含量成正比45.用邻苯二甲酸氢钾滴定1mol/LNaOH溶液时,最合适的指示剂是( )(A)甲基红(PH=4.4~6.2)(B)百里酚酞(PH=9.4~10.6)(C)酚酞(PH=8.3~10.0)(D)甲基橙(PH=3.1~4.4)46.间接碘量法中,硫代硫酸钠标准溶液滴定碘时,应在哪种介质中进行( )(A)酸性(B)碱性(C)中性或微酸性(D)HCL介质47.用碘量法进行氧化还原滴定时,错误的操作是( )(A)在碘量瓶中进行(B)避免阳光照封(C)选择在适宜酸度下进行(D)充分摇动48.选择氧化还原指示剂时,应该选择( )(A)指示剂的标准电位愈接近滴定终点电位好(B)指示剂的标准电位愈接近滴定终点电位的差越大越好(C)指示剂的标准电位越负越好(D)指示剂的标准电位越正越好49.酸碱滴定中指示剂选择依据是( )(A)酸碱溶液的浓度(B)酸碱滴定PH突跃范围(C)被滴定酸或碱的浓度(D)被滴定酸或碱的强度50.对于滴定分析法,下述( )是错误的.(A)是以化学反应为基础的分析方法(B)滴定终点的到达要有必要的指示剂或方法确定(C)所有的化学反应原则上都可以用于滴定分析(D)滴定分析的理论终点和滴定终点经常不完全吻合51.Na2S2O3放置较长时浓度将变低的原因为( )(A)吸收空气中的CO2.(B)被氧化(C)微生物作用52.直接配制标准溶液时,必须使用( )(A)分析纯试剂(B)高纯或优级纯试剂(C)基准物53. SI为( )的简称(A)国际单位制的基本单位(B)国际单位制(C)法定计量单位54.分析化学中常用的法定计量单位符号Mr其代表意义为( )(A)质量(B).摩尔质量(C)相对分子质量(D).相对原子量55.我国化工部标准中规定:基准试剂颜色标记为()(A)红色(B)蓝色(C)绿色(D)浅绿色56.做为基准试剂,其杂质含量应略低于( )(A)分析纯(B)优级纯(C)化学纯(D)实验试剂57.下面数据中是四位有效数字的是()(A)0.0376 (B)1396(C)0.07520 (D)0.050658.市售硫酸标签上标明的浓度为96%,一般是以( )表示的(A)体积百分浓度(B)质量体积百分浓度(C)质量百分浓度59.下列计量单位中属于我国选定的非国际单位制( )(A)米(B)千克(C)小时(D)摩尔1-5:ACDCA 6-10:ADCAB 11-15:CDCBA 16-20:CDACB 21-25:CCCCD 26-30:AEBBC 31-35:BBABA 36-40:CDDBB 41-45:DEABC 46-50:CDABC 51-55:CCBCD 56-59:BCCC二、判断题1.称量物体时应将物体从天平左门放入左盘中央,将砝码从右门放入右盘中央(√)2.称量物体的温度,不必等到与天平室温度一致即可进行称量(×)3. 天平需要周期进行检定,砝码不用进行检定(×)4.在滴定管下端有尖嘴玻璃管和胶管连接的称为酸式滴定管(×)5.打开干燥器的盖子时,应用力将盖子向上掀起(×)6.圆底烧瓶不可直接用火焰加热(√)7.玻璃容器不能长时间存放碱液(√)8.准确度高必须要求精密度也高,但精密度高,并不说明准确度也高,准确度是保证精密度的先绝条件(×)9.准确度的高底常以偏差大小来衡量(×)10.所谓饱和溶液是指再也不能溶解溶质的溶液(×)11.在溶解过程中,溶质和溶剂的体积之和一定就是溶液的总体积(×)12.容量分析一般允许滴定误差为1%(×)13.酸碱滴定中有时需要用颜色变化明显的变色范围较窄的指示剂即混合指示剂(√)14.天平室要经常敞开通风,以防室内过于潮湿(×)15.滴定管内壁不能用去污粉清洗,以免划伤内壁,影响体积准确测量(√)。
分析化学试卷 05A卷 华工

(A)
பைடு நூலகம்
(C)
H
H
2
2
PO
PO
4
4
HPO
HPO
2
4
2
4
7. 以 0.1000 molL-1NaOH 滴定 20 mL 0.1000 molL-1 某弱酸 HA(pKa=6.00)溶液,则滴定 至化学计量点的 pH 值为:
(A)8.00
(B)9.00
8. 用 EDTA 滴定 Bi3+时,可用于掩蔽 Fe3+的掩蔽剂是:
2. 已知某溶液 pOH 为 0.076,则 OH-活度 OH 等于:
(A)0.8 molL-1
4
14
(B)0.84 molL-1 (C)0. 839 molL-1
3. 为了使采集的试样具有代表性,正确的做法是: (A)应集中在某一部位取样 (B)应分别在各部位取样后混合 (C)对某产品生产排放废水监测,应在厂总废水池中取样 (B)大体积液体应从底部取样
(A)三乙醇胺
(B)KCN
9. EDTA 滴定中,金属离子指示剂的选择应符合的条件有: (A)在任何 pH 下,指示剂的游离色(In)要与配合色(MIn)不同 (B)K(MY)>K(MIn) (C)滴定的 pH 与指示剂变色的 pH 相同 (D)K(MY)<K(MIn)
10. KMnO4 氧化 Cl-的速率很慢,但是当溶液中同时存在有 Fe3+时,反应速率则会加快,这 是因为发生了:
4. 今有 0.400 molL-1 HCl 溶液 1 L,欲将其配制成浓度为 0.500 molL-1 溶液,需加入 1.00
molL-1 HCl:
(A)200.0 mL
华南理工大学有机化学期末复习试卷(含答案)
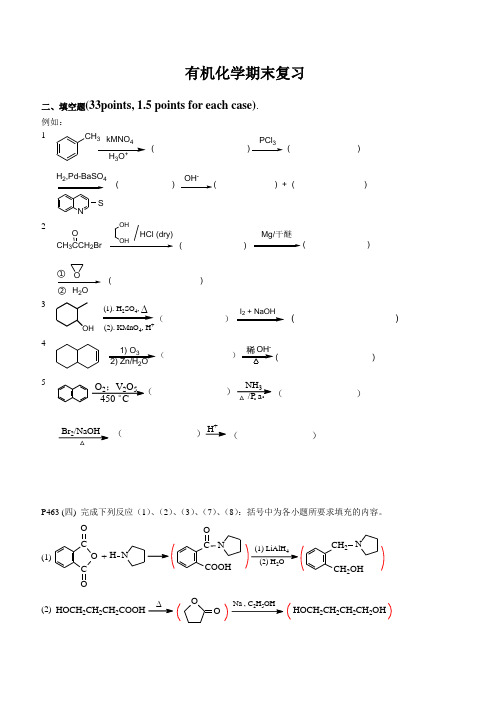
有机化学期末复习二、填空题(33points, 1.5 points for each case). 例如: 1CH 3kMNO43+( )PCl 3( )H 2,Pd-BaSO 4NS( )OH -2CH 3CCH 2BrMg/干醚HCl (dry)OH OHO H 2OO( )( )( )①②3OH(1). H SO ,∆(2). KMnO 4, H+))(41) O 32) Zn/H 2O- )5NH 3/P a Br 2/NaOHH +△△..O 2;V 2O 5 C 。
450( ( )( )( )P463 (四) 完成下列反应(1)、(2)、(3)、(7)、(8):括号中为各小题所要求填充的内容。
(1)C O CO ONH +COOHCON 4(2) H 2OCH 2OHCH 2N(2) HOCH 2CH 2CH 2COOH25∆OOHOCH 2CH 2CH 2CH 2OH(3)CH 2=C COOHCH 3323CH 2=CCOClCH 3CH 2=C COOCH 2CF 3CH 3(7)C NH CO O22COOHNH 2(8)COOHCHOCOClH , Pd-BaSO 3P509,15.15 写出下列季铵碱受热分解时,生成的主要烯烃结构。
P522,15.23 完成下列反应式。
P527,(八) 写出下列反应的最终产物:(1) CH 2ClNaCNLiAlH 4(CH 3CO)2O(CH 2CH 2NHCOCH3)(2)NO Fe, HCl22NO (CH 3)2N )(3)CH 3(CH 2)2CH=CH HBr ROORCN Na CO OH 2O, HO -( CH 3(CH 2)2CH 2CH 2NH 2 )(4)O322N(CH 3)2O)P616,20.2 写出下列反应式中(A )~ (H)的构造式。
三、选择题(反应快慢,鉴别试剂,物质的稳定性,能否发生某种反应等) 例如:P404,11.8 指出下列化合物中,哪个可以进行自身的羟醛缩合。
华南理工大学分析化学B卷(答案)

《分析化学》试卷答案(B 卷)一、选择题题号1234567891011121314151617181920答案C C B C B A C D B C B C A A C A C B C D二、填空题:1、缩分2、在指定的概率下,真实值将在测定平均值附近的一个区间;平均值愈接近真值,平均值愈可靠。
3、减小、增大4、12.95、中性或弱碱性、使被AgCl 吸附的Cl -释放出来6、待测物和固定相、溶解能力7、四位,2位8、H=A+B/u+Cu9、共沉淀、吸留和包藏10、获得单色光,加和性11、2I --2e -== I 2, I 2+2S 2O 32-==S 4O 62-+2I -12、反应产生的Mn 2+可起催化作用,使以后的反应加速;或Mn 2+的自动催化作用13、选择性强、杂质离子对待测离子的干扰14、使欲测组分转变为一定价态的步骤。
15、Na +<Ca 2+<Al 3+<Th 4+16、阳、阴17、色谱柱、检测器18、吸光度读数范围的选择19、敏感膜(薄膜)三、判断题:题号12345678910答案√╳╳╳╳√╳╳╳╳四、计算题1. 解:由已知,当吸光度A =0.434时,吸光度测量误差最小mol/L 541034.31103.1434.0-⨯=⨯⨯==b A c κ设应称取x 克试样x =0.16g51034.31.069.580012.0-⨯⨯效x ⇒2. 解:141000.110001000.000.1--⋅⨯=⨯==∆L mol V c V c x s s1/)110(-∆-∆=S E x c c 141059.0/004.041090.5)110(100.1----⋅⨯=-⨯⨯=L mol c x 原水样:C X =5.90×10-4×10=5.90×10-3mol/L 3.解:1.245102.239.233500.1%00.3504.14239.233500.1%00.65102.2500.1%00.35500.1%00.654444424==⨯⨯+⨯⨯=⨯⨯+⨯⨯MSO MSO MSO BaSO SO Na BaSO M M M M M M 4.解:3 Fe 2O 3~Cr 2O 7%70.285000.02795.04230.0%90.555000.02795.010005000.069.159300.3501667.0032323232=-====⨯⨯⨯⨯==m m W m m W O Al O Al O Fe O Fe 5. 解(1)(min)64.720.1)20.180.5(40.140.1,11,21,1,21,2=+-⨯=+===M R R R R t t r t t t r (2)(3)cmH n L r r R n 6.491.0496496140.140.159.1161162221,21,22=⨯==≈⎪⎭⎫ ⎝⎛-⨯⨯=⎪⎪⎭⎫ ⎝⎛-=效效效效6.解:配成溶液的浓度:3CaCO 12310004.109.100102502513.03333---⋅⨯=⨯⨯==L mol M V m c CaCO CaCO CaCO CaCO (1)p H >12时无酸效应,故EDTA 溶液浓度()()59.121.111.180.564.72)(212)1()2(=+-⨯=+-=b b R R W W t t R11221009331.090.2600.2510004.13---⋅=⋅⨯⨯==L mol L mol V V c c CaCO EDTA (2)mLg c M T EDTA O Fe EDTA O Fe /0007450.0009331.069.15920001200013232/=⨯⨯==7.解:所得数据从小到大依次排列:4.71%,4.85%,4.86%,4.86%,4.87%,4.88%,4.90%,4.92%,4.99%,所以:4.71%或4.99%可能为异常值。
分析化学期末试卷[1]
![分析化学期末试卷[1]](https://img.taocdn.com/s3/m/bcabd5e24afe04a1b071def0.png)
分析化学(一)期末考试试卷(A)(闭卷120分钟)学号姓名专业年级重修标记□一、填空题( 共5题10分)1. 用重量法测定As2O3的含量时,将As2O3溶于NaOH溶液,处理为AsO43-,然后形成Ag3AsO4沉淀,过滤,洗涤,将沉淀溶于HNO3后,再以AgCl形式沉淀和称重,则换算因数表示为________________。
2. 某显色剂R与金属离子M和N分别形成有色络合物MR和NR,在某一波长测得MR 和NR的总吸光度A为0.630。
已知在此波长下MR 的透射比为30%, 则NR的吸光度为_________。
3 某人用HCl标准溶液来标定含CO32-的NaOH溶液(以甲基橙作指示剂),然后用NaOH 溶液去测定某试样中HAc,得到的w(HAc)将会_______。
又若用以测定HCl-NH4Cl溶液中的w(HCl),其结果会_________。
(填偏高、偏低或无影响)4. 以下滴定应采用的滴定方式分别是:(填A,B ,C ,D)(1) 佛尔哈德法测定Cl- ____(2) 甲醛法测定NH4+ ____(3) KMnO4法测定Ca2+ ____(4) 莫尔法测定Cl- ____(A)直接法(B)回滴法(C)置换法(D)间接法5.测得某溶液pH值为2.007,该值具有______位有效数字,氢离子活度应表示为______________。
二、选择题( 共10题20分)1. 下列有关总体平均值的表述中正确的是----------------------------------------------------()(1)随机变量有向某个中心值集中的趋势(2)无限多次测定的平均值既为总体平均值(3) 总体平均值就是真值(4) 正态分布的总体平均值为零(A )1,2 (B)3,4 (C)1,3 (D)2,42.用PbS 作共沉淀载体,可从海水中富集金。
现配制了每升含0.2µgAu 3+的溶液10L,加入足量的Pb 2+,在一定条件下,通入H 2S,经处理测得1.7µgAu 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
复习提纲:第一章分析化学导言1. 分析化学的定义(掌握)2. 分析化学的任务(了解):知道什么是定性、定量及结构分析3. 分析化学的分类:化学分析法和仪器分析法定义和特点(掌握);常量、半微量、微量和超微量分析时所对应按待测组分的含量(掌握);其他分类(了解)4. 分析化学的发展趋势(了解)5. 定量分析一般过程(了解)6. 结果的表达(固体试样用百分含量表示!液体或气体视要求而定)复习提纲:第二章样品的采集、制备及处理1. 样品的采集基本原则:代表性、不变性和取样量适当(掌握)采集方式:随机取样(掌握)、针对性取样、周期性取样等随机性取样原则(掌握):总体中各部分有相同的被采集概率;在一定准确度要求下,尽可能降低采样费用固体样品最小采集质量:Q Kd2(掌握)固体样品的制备:四分法缩分及缩分次数(掌握)2. 样品的处理目的和基本要求(掌握);要知道样品处理过程是整个分析过程中耗时最久且引入误差最大的环节!无机样品的处理:溶解(常用酸碱的使用,常识);熔融(掌握);半熔法(了解)有机样品的处理:消解(掌握);溶解和萃取(了解)复习提纲:第三章定量分析中的误差及数据处理1. 误差的基本概念误差的表征:误差的定义及表示(掌握);偏差的定义和各种表示方法(掌握)准确度(误差)和精密度(偏差)的关系(掌握)误差的分类:系统误差的特点、来源和消除办法、空白实验(掌握);随机误差的特点、来源及减小办法(掌握);过失(了解)误差的传递:要知道分析过程中误差是不断积累的,最终误差取决于误差最大的环节,设计实验时应控制各环节误差水平接近;极值误差的定义及其在称样质量和滴定体积控制中的应用(掌握)2. 分析结果的正确表达可疑数据(过失)的判断:Q检验法和格鲁布斯检验法(掌握)显著性检验:测量值与标准值的比较的t检验(掌握);两组数据精密度比较的F检验((掌握))和两组数据测量值比较的F+t检验(了解)置信区间(分析结果的正确表达):(掌握)3. 有效数字的定义、加减和乘除的运算规则、关于有效数字的若干规定(掌握)一、单选题(共30小题)1. 下列不属于系统误差性质的是( )A. 重复性B. 数据很小C. 单向性D. 误差大小基本不变2. 下列不属于系统误差产生原因的是( )A. 方法不完善B. 试剂纯度不够C. 仪器未经校正D. 操作失误3. 下列分析过程中不会产生系统误差的是( )A. 沉淀重量法中使用定性滤纸,使最后灰分加大B. 使用分析天平时,天平零点稍有变动C. 试剂中含有少量的被测组分D. 以含量为99%的邻苯二甲酸氢钾作基准物标定碱溶液4. 下列哪种情况所产生的误差属于系统误差( )A. 指示剂的变色点与化学剂量点不一致B. 滴定管读数最后一位估计不准C. 称样时,砝码数值记错D. 称量过程中,天平零点稍有变动5. 下列哪种措施可用于消除分析方法中系统误差( )A. 增大试样称量质量B. 操作时细心、认真C. 增加测定次数D. 进行仪器校准6. 下列关于随机误差的论述中不正确的是( )A. 分析过程中不可避免B. 正、负误差出现的概率相等C. 具有单向性D. 由一些不确定的偶然因素造成 7. 下述关于随机误差的正态分布曲线的论述中错误的是( )A. 横坐标x 值等于总体平均值μ时,曲线出现极大值B. 曲线与横坐标之间所夹面积的总和代表所有测量值出现的概率,其值为1C. 标准偏差σ越小,测量值越分散,曲线越平坦D .分布曲线以x=μ点做纵坐标为其对称轴呈镜面对称,说明正负误差出现概率相等8. 在下列表述中,最能说明偶然误差小的是( )A. 高精密度B. 与已知含量的试样多次分析结果的平均值一致C. 标准偏差大D. 仔细校正所用的天平、容量仪器等9. 下列可用于减小定量分析中偶然误差的方法是( )A. 校正测定结果B. 进行对照实验C. 增加平行测定次数D. 进行空白实验10. 从精密度就可以断定分析结果可靠的前提是( )A. 随机误差小B. 系统误差小C. 平均误差小D. 增加平行实验的次数11. n 次测定结果平均值的标准偏差x s 和单次测量结果的标准偏差s x 之间关系的正确表达式是( ) A. n /s s x x = B. n /s s x x = C. n /s s x x = D. x x s s >12. 下列关于置信区间定义,正确的是( )A. 以真值为中心的某一区间包括测定结果的平均值的几率B. 在一定置信度下,以测量平均值为中心的包括总体平均值的范围C. 真值落在某一可靠区间的几率D. 在一定置信度下,以真值为中心的可靠范围13. 有两组分析数据,要比较它们的测量精密度有无显著性差异,应采用( )A. F 检验B. t 检验C. Q 检验D. 格鲁布斯法14. 有一组平行测定的分析数据,要判断其中是否有异常值,可采用( )A. F 检验B. t 检验C. 方差分析D. 格鲁布斯法15. 对同一试样用两种不同的测量方法进行分析,得到两组数据,若想判断两组数据之间是否存在显著性差异应采用( )A. u 检验B. t 检验C. F+t 检验D. F 检验16. 用25 mL 移液管移出的溶液体积应记为( )A. 25 mLB. 25.0 mLC. 25.00 mLD. 25.000 mL17. 四位学生用重量法同时对分析纯BaCl 2⋅2H 2O 试剂中Ba 的质量分数各测三次,所得结果及标准偏差如下,其中结果最好的是( )已知:3.244M O H 2BaCl 22=⋅;()3.137Ba Ar = A. 42.55x =;%5.1s =B. 18.56x =;%1.2s =C. 22.56x =;%21.0s =D. 10.55x =;%20.0s =18. 滴定分析中通常要求称量误差≤±0.1%,若分析天平精度为0.1 mg ,则至少应称取多少样品( )A. 0.1 gB. 0.2 gC.0.05 gD. 1.0 g19. 下列是95%置信度下某试样测量结果的报告,请问哪份报告更为合理( )A. ()%2.036.25±B. ()%24.036.25±C. ()%243.036.25±D. ()%2432.036.25±20. 下列数值中,有效数字为四位的是( )A. π=3.141B. pH=10.50C. CaO%=25.30D. 222.3021. 下列数据不是四位有效数字的是( )A. pH=11.26B. [H +]=0.1020C. Cu%=10.26D. [Pb 2+]=12.28×10-422. 测得某种新合成的有机酸pKa 为12.35,其Ka 值应表示为( )A. 4.467⨯10-13B. 4.47⨯10-13C. 4.5⨯10-13D. 4⨯10-1323. 已知某溶液的pH 为11.02,其氢离子活度的正确表示为( )A. 9.550⨯10-12 mol ⋅L -1B. 9.55⨯10-12 mol ⋅L -1C. 9.5⨯10-12 mol ⋅L -1D. 1⨯10-11 mol ⋅L -124. 误差的有效数字位数通常为( )A. 1~2位B. 2~3位C. 四位有效数字D.算出多少就多少 25. 定量分析中,对测定结果误差的要求是( )A. 越大越好B. 越小越好C. 等于零D. 在允许范围内即可26. 甲乙丙丁四人同时分析一矿物中的含硫量,取样均为3.5 g ,下列哪份报告合理( )A. 甲:0.04%B. 乙:0.042%C. 丙:0.0421%D. 丁:0.04211%27. 欲测定石英(SiO 2)中的Fe 、Al 、Ca 、Mg 的含量,应采用下列哪组试剂分解试样( )A. HF+H 2SO 4B. H 2SO 4+HNO 3C. H 2SO 4+H 3PO 4D. HClO 4+HNO 328. 欲进行硅酸盐的全分析,宜采用下列哪种熔剂分解试样( )A. K 2S 2O 7B. KHSO 4C. Na 2CO 3D. NaHCO 329. 欲测定钢铁中的磷含量,选择下列哪组试剂分解试样最合适( )A. HClB. HNO 3+H 2SO 4C. H 2SO 4D. H 2SO 4+HCl30. 某组分的质量分数按下式计算而得:s m /M v c w ⋅⋅= ,若c =0.1020±0.0001 mol ⋅L -1,V = 30.02±0.02 mL ,M =50.00±0.01 g ⋅mol -1,m =0.2020±0.0001 g ,则对w 的误差而言( )A. V 项引入的最大B. c 项引入的最大C. M 项引入的最大D. m 项引入的最大二、填空题(共15小题,30个空)1. 决定正态分布曲线形状的两个参数为:______和______;它们分别反应了测量值的_____________和____________。
2. 在少量数据的统计处理中,当测定次数相同时,置信度水平越高,置信区间越________,包含真值的可能性越________。
3. 测量值之间的接近程度称为____________,说明测量值的____________,在不存在操作失误的前提下,该值是由____________引起的。
4. 不加待测试样,按照试样分析步骤和条件,平行进行的分析实验,称为____________,通过它可以消除由试剂、蒸馏水及器皿引入的杂质造成的____________。
5. 在分析过程中,下列情况各造成何种误差(或过失):(1)移液管转移溶液后残留量稍有不同____________;(2)过滤沉淀时出现穿滤现象____________;(3)蒸馏水中含有微量杂质___________。
6. 置信度一定时,增加测定次数n ,置信区间变________;n 不变时,置信度提高,置信区间变_______。
7. ()000.1/80.2400.251010.0-⨯的结果的正确表示为________________。
8. 测定水产品中的残留Hg ,宜采用哪种样式处理方式____________。
9. 测得某溶液pH=2.007,该值具有________位有效数字,氢离子活度的正确表示为____________。
10. 样本标准偏差在计算式的分母中引入n-1,它被称为________,是指_______________________,当测量次数非常多时,该值与测量次数的区别将变得很小。
11. 50 mL 滴定管的读数精度为±0.01mL ,则由读数引起的滴定体积的最大绝对误差为________ mL 。
