第6章 离域pi键
专题:离域大π键

原子轨道垂直于键轴以“肩并肩”方式 重叠形成的化学键称为π键,因为杂化轨 道不能形成π键,所以只有未杂化的p轨 道才能形成π键。
定义
在多原子分子中如有相互平行的p轨道,它们
连贯重叠在一起构成一个整体,p电子在多个原子
间运动形成π型化学键,这种不局限在两个原子之
间的π键称为离域π键,或共轭大π键,简称大π键。
中心原子N、C
成键配原子
外界
N:5-3=2
0
0
C:4-3=1(4个)
6 5
呋喃
中心原子 杂化方式
O: sp2 C: sp2
形成大π键的P轨道电子数
中心原子O、C
成键配原子
外界
O:6-4=2
0
0
C:4-3=1(4个)
6 5
吡啶
中心原子 杂化方式
N: sp2 C: sp2
形成大π键的P轨道电子数
中心原子N、C
里,电子在这个大
n n
键中可以自
由移动,所以石墨能导电,故也可
以说石墨中含有金属键。
典例5:CO2
• CO2的C原子采取SP杂化,它的两个未参与杂化的p轨道在空间 的取向是跟sp杂化轨道的键轴互相垂直(垂直于分子平面)。
这两个未杂化的p轨道可形成π键。所以CO2分子里应有两套大π
键。其结构如下图。为3原子4电子的p-p大π键,符号为
分子中的大π键可用符号 nm 表示,其中m代
表参与形成的大π键原子数,n代表参与形成的大
π
键
电
子数(
如苯分子
中的大π键可表
示为
6 6
)
成键条件
1. 所有原子共面,中心原子采取sp杂化或sp2杂化。 2. 每一原子提供一个能量相近、对称性匹配的价层轨道 3. 轨道中的电子总数<轨道数的两倍
离域π键教学浅谈
离域π键教学浅谈陶 宁 方 力 在无机化学教学中,“离域π键”的教学是一个重点、难点问题,许多学生对离域π键难以准确理解,实际应用时,对分子(或离子)中的成键情况不能完整地判断出来。
另外,对离域π键的准确理解,也为后续课程有机化学的学习打下基础,下面就离域π键的教学谈谈笔者的看法。
1.什么是离域π键首先,应该使学生搞清楚什么是离域π键,在此之前学生已学过σ键和π键,σ键和π键通常可称为定域键,因为这些键电子活动范围局限在两个原子间。
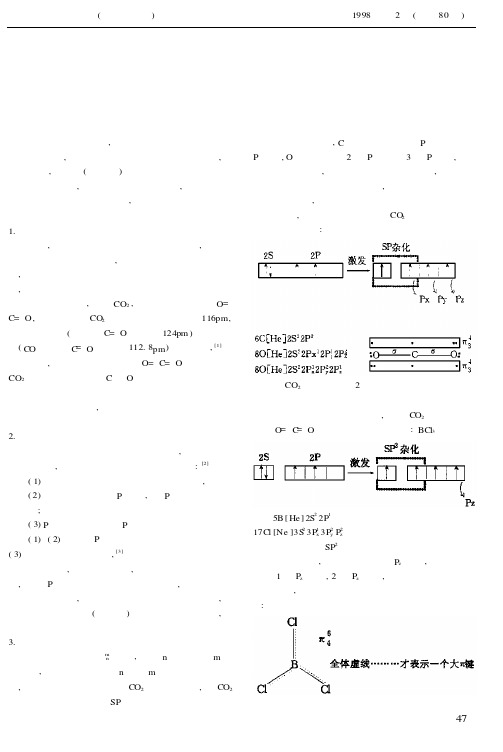
但是,实验发现有些分子或离子不能用定域键的结构来满意地表达其性质,例如CO2,通常其结构式写作O= C=O,而实验测得CO2分子中碳氧键键长为116pm,介于碳氧双键(乙醛中C=O键长为124pm)和碳氧叁键(CO分子中C=O键长为112.8pm)键长之间,[1]比双键短些,比叁键长些。
因而用O=C=O结构式表示CO2是不够恰当的。
在C与O之间还有额外的结合力存在。
即存在着离域π键。
由三个或三个以上原子形成的π键称为离域π键,离域π键也称为大π键、多原子π键、共轭π键。
2.形成离域π键的条件使学生搞清楚形成离域π键的条件,是判断离域π键的关键,形成离域π键需要满足三个条件:[2](1)参与成键的原子必须处于同一平面上,(2)每一原子有一个P轨道,各P轨道间必须互相平行;(3)P电子的数目小于P轨道数目的两倍。
(1)、(2)保证了P轨道之间产生最大程度的重叠。
(3)是按照分子轨道理论,[3]几个原子轨道组合可产生几个分子轨道,在一般情况下,成键和反键轨道各占半数,如果P电子数目为轨道数目的二倍,则成键和反键轨道都被占满,能量的降低与升高正好相互抵销,不能有效成键。
而分子(或离子)之所以形成离域π键,是使体系能量进一步降低。
3.离域π键符号和表示方法离域π键符号用πm n表示,其中n为原子数m为电子数,上述符号可读成“n原子m电子大π键”。
现在,来分析一下前面提出的O分子的结构,在O 分子中中心碳原子除以S杂化轨道分别与两个氧原子形成两个σ键外,C原子还剩下二个P轨道和二个P电子,O原子各剩下2个P轨道和3个P电子,它们都与键轴相垂直,满足了生成大π键的条件,各组轨道中的电子是在整个分子间运动,而不是局限在某两个原子之间运动,由于这种键的对称性和π键一样“肩并肩”地重叠,所以也称为大π键。
结构化学课件:离域p键和共轭效应

在SO32–, SO42–中,硫原子采用sp3杂化,与氧原 子形成s键,氧原子还把两个p轨道的孤对电子反 馈到硫原子的空d轨道中,但是这两个反馈电子的 键很弱,从键长和键能看,S-O键介于单键和双键 之间,由一个s键和两个p-d p键构成,总效果近似 于一个双键。 SO32–不可能由S和O的p轨道构成共 轭大p键,因为p电子数正好为p轨道的2倍。
O¯
羧酸在电离出氢离子后,由碳和
R
C
氧的一个p轨道可以形成3中心4电 子的共轭大p键Hale Waihona Puke 因此羧酸具有酸性。O
酚酞
OH
OH
NaOH
C
OH
C
O
CO
无色
O
形成三个不相连的
共轭p键。
COO¯ 红色
三个苯环和中心碳原子、
羧酸根、氧原子形成 Π2243
共轭p键。
共轭p键范围越大,那么基态和第一激发态之间能隙越小,从 而显示出的颜色的波长也越长。水溶液中的酚酞在紫外区, 所以无色,加碱后,波长变长,显示红色。
注: 2p轨道内层只有s电子,两个p轨道可以充分 接近形成p-p p键,因此p-p p键一般只限于2p-2p 之间,间或存在于2p-3p之间,比如CS2和SO2。
氮的化合物 NO2分子中氮以sp2杂化,两个杂化轨道与氧原子 形成两个s键,关于分子结构有三种观点: 1 另外一个杂化轨道是单电子,未杂化的孤对电 子与每个氧原子的一个p轨道(单电子)形成共轭p 键(3中心4电子),分子为V形。 2 另外一个杂化轨道是孤对电子,未杂化的单电 子与每个氧原子的一个p轨道(单电子)形成共轭p 键(3中心3电子),分子为V形。 3 在1和2两种结构间共振。
H
H C C CH2
离域π键简便计算方法

离域π键简便计算方法
1. 嘿,你知道吗?计算离域π键可以先从简单的分子结构入手呀!比
如说苯,六个碳原子形成一个六边形,那中间的π键不就很明显嘛!这样是不是一下子就好理解啦?
2. 哇塞,还有一种办法就是看原子的共平面情况哦!就像丁二烯,几个原子在一个平面上,那离域π键不就出来啦,这不是挺容易发现的嘛!
3. 嘿!想想那种共轭体系呀,找出那些能互相作用的轨道,不就能找到离域π键啦。
就好比乙烯,多明显的共轭呀,很容易就能算出离域π键啦!
4. 哎呀呀,还可以通过电子的分布来判断呢!当电子分布得很有规律时,离域π键通常就在那里啦。
比如环戊二烯,观察电子分布,离域π键就显
而易见咯!
5. 嘿,你试过从分子的对称性入手不?对称性高的分子,离域π键也
会有特征哦!就像一些对称的大分子,找找看,离域π键就藏在那里等你发现呢!
6. 哇哦,别忘了还有能量的角度呀!能量越低,离域π键越稳定呀。
像是一些稳定的化合物,从能量方面思考,离域π键就不难算出啦!
7. 哈哈,其实多做些例子就熟练啦!就像丙烯,自己试着去分析分析,离域π键的计算方法不就掌握啦!
我觉得呀,掌握这些方法,计算离域π键就不再是难题啦,多好玩多有趣呀!。
离域π键定义

离域π键定义
离域π键通常是指在某些分子中,参与共轭体系的π电子的游动不局限在
两个碳原子之间,而是扩展到组成共轭体系的所有碳原子之间。
这种现象被称为离域。
原子轨道垂直于键轴以“肩并肩”方式重叠所形成的化学键称为π键。
在离域π键的形成过程中,参与的原子多数处于同一平面上,并且这些原子有相互平行的p轨道。
p轨道上的电子总数必须小于p轨道数的2倍。
离域π键也被称为非定域键。
在一些分子中,例如二氧化碳(CO2),中
心碳原子采取sp杂化(两条不满的p轨道),而且氧原子也有不成对的p
电子,这三个原子中就在两个方向上形成了各有四个电子的两个离域π键。
此外,大π键是3个或3个以上原子彼此平行的p轨道从侧面相互重叠形
成的π键,通常指芳香环的成环碳原子各以一个未杂化的2p轨道,彼此侧向重叠而形成的一种封闭共轭π键。
以上内容仅供参考,如需更多信息,建议查阅化学专业书籍或咨询化学专家。
第6章 离域pi键模版范本

1 2
C3H5+
1 2 2 1
C3H5
1 2 2 2
C3H5-
2. 离域的类型 (1)n>m,缺电子离域 键
丙烯基
2
阳离子
3
三甲苯基 阳离子
18 19
(2)n=m,等电子离域 键或正常离域 键
4 4
6 6
10 10
(3) n<m,多电子离域 键
4 3
6 4
6 4
3. 离域键的判断
m n
结构化学 —— 第六章 共轭分子的结构
第六章
二 离域键形成条件和类型
1. 离域键的形成条件
) 参与离域分子轨道的原子应在同一个平面上且 提供一个相互平行并垂直于该原子平面的 p 轨道。
B)总的 电子数小于参与形成离域分子轨道数的二
倍: nm m<2n
n —— 原子轨道数 m —— 电子数
nm
3 2 1
1 0.37171 0.60152 0.60153 0.37174 2 0.60151 0.37172 0.37173 0.60154
CH2
1
CH CH
2
3
C4H2
四个分子轨道
碳1,1
碳2 ,2
碳3 ,3
碳4 ,4
1 0.37171 0.60152 0.60153 0.37174 2 0.60151 0.37172 0.37173 0.60154 3 0.60151 0.37172 0.37173 0.60154 4 0.37171 0.60152 0.60153 0.37174
p12 2c11c12 c21c22 c31c32 2 0.3717 0.6015 0.6015 0.3717
离域pi键 前线分子轨道理论

CH2
1
CH
2
CH
3
CH2
4
四个分子轨道
碳1,1 碳2 ,2 碳3 ,3 碳4 ,4
1 0.3717 1 0.6015 2 0.6015 3 0.3717 4 2 0.6015 1 0.3717 2 0.3717 3 0.6015 4 3 0.6015 1 0.3717 2 0.3717 3 0.6015 4 4 0.3717 1 0.6015 2 0.6015 3 0.3717 4
4 3
6 4
6 4
3. 离域键的判断
m n
(1)先尽可能形成s键,没有参与杂化的p轨道参与形成键 (2)只有s和p原子轨道,则每个原子的价轨道只有4个,最 多形成4个共价键(包括s键,键和孤对电子) 对于非直链分子,最多形成一个离域键。 m 对于直链分子,可有两个离域 n 键。 (3) 确定原子的杂化方式,以及s键数目,键数目。
p12 2c11c12 c21c22 c31c32 2 0.3717 0.6015 0.6015 0.3717 0.6015 0.3717 0.4472 p23 2c12c13 c22c23 c32c33
第i个MO上的电子在第j个原子附近的电荷密度
j n c
i
2 i ij
丁二烯
j c11 c22 c33 c44
CH2
1
CH
2
CH
3
CH2
4
丁二烯基态,4个电子填充在ψ1和ψ22个BMO上
1 0.3717 1 0.6015 2 0.6015 3 0.3717 4 2 0.6015 1 0.3717 2 0.3717 3 0.6015 4
2025年高考化学一轮复习基础知识讲义—大π键(离域π键)(新高考通用)

2025年高考化学一轮复习基础知识讲义—大π键(离域π键)(新高考通用)【必备知识】定义:3个及以上原子构成离子团或分子中,原子有彼此平行的未参与杂化的p轨道电子连贯重叠在一起,构成π型化学键,又称离域或共轭大π键。
条件:①原子在同一平面或直线;②中心原子sp或sp2杂化(若提供d轨道则中心原子应为sp3d杂化)。
表示:πn m(m:参与形成大π键的原子数;n:参与形成大π键的电子数,n<2m)分析方法——图示法分析步骤:①判断出中心原子杂化方式,并画出σ键。
②未成对电子优先形成大π键。
例:用图示法表示下列物质的大π键物质图示解析所有C原子均采取sp2杂化,1、4号C原子的两个sp2杂化轨道分别与H原子的1s轨道成键,一个sp2杂化轨道与2、3号C原子的sp2杂化轨道成键,这样4个C原子具有一个含一个孤电子的未参与杂化的2p轨道,它们是相互平行的,形成Π44。
中心原子C采取sp2杂化,6个C原子具有一个含一个孤电子的未参与杂化的2p轨道,它们是相互平行的,形成Π66。
CO32-中心C原子采取sp2杂化,周围三个O原子的未成对电子的2pz轨道优先参与形成Π键,各提供一个2p电子,再加上得到两个电子,即Π64。
C O例、用图示法表示下列物质的大π键物质图示表示物质图示表示Π65Π66Π65Π65 SO2Π43NO2-Π43 BF3Π64NO3-Π64SO3Π64有配位键ClO2Π53有配位键其他分析方法:①Π电子总数计算:n=价电子数-σ键电子总数-孤对电子总数=价电子总数- 杂化轨道数目×2- 孤电子对数×2②等电子体:如3原子16电子微粒CO2、CS2、N2O、COS、N-、SCN-,有两套Π43;3原子18电子微粒SO2、O3、NO2-,有Π43;4原子24电子微粒SO3、BF3、NO3-、CO32-,有Π64。
【题型突破】1、(2020 山东卷)B3N3H(无机苯)的结构与苯类似,也有大π键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
pab ni cia cib
i
丁二烯基态,4个电子填充在ψ1和ψ22个BMO上
1 0.3717 1 0.6015 2 0.6015 3 0.3717 4 2 0.6015 1 0.3717 2 0.3717 3 0.6015 4
p12 2c11c12 2c21c22 2 0.3717 0.6015 2 0.6015 0.3717 0.8943
p23 0.447
CH2
1
CH
2
CH
3
CH2
4
2 1 1 丁二烯的激发态 1 , 4个电子填充在ψ1,ψ2和ψ3 这3个MO上。 2 3
CH2
1
0.894
CH
2
0.447 3
CH
CH2
4
1 0.37171 0.60152 0.60153 0.37174 2 0.60151 0.37172 0.37173 0.60154 3 0.60151 0.37172 0.37173 0.60154
(4) 由Pauli原理,电子尽量自旋平行并分占不同的轨道
n: 参与共轭的p轨道数 m: 参与共轭的电子数
m N Q Q es elp e
CO2
O C O
杂化类型 参与离 离域轨道 域的原 子轨道 价电子
m n
几何结构
离域轨道
直线型
sp杂化
p2
,
m1 3
m2 3
N=16 m=8
成。
3. 颜色
E=2
E=1.236
n=2
n=4
n=6
n=8
n=10
n=12
22 22
番茄红素
一些染料或指示剂,由于形成大π键,使电子活
动范围增大,因而改变它的显色范围。例如,指
示剂酚酞原为无色,与碱反应形成大π键,颜色
变红。
26 24
4. 酸碱性
O R C
O
34
H
O
CH2
CH
sp 2
N原子
sp3
6 6
78
66
s
Nmax=1.732
丁二烯基态的各原子自由价
CH2
1
0.894
CH
2
0.447 3
CH
CH2
4
N1=P12=0.8943 F1 = Nmax-N1
N2=P12+ P23=0.894+0.447 F2 = Nmax-N2
= 1.732-0.894=0.838
=1.732-0.894-0.447=0.391
j
第i个MO上的电子在第j个原子附近的电荷密度
j n c
i
2 i ij
丁二烯
j c11 c22 c33 c44
CH2
1
CH
2
CH
3
CH2
4
丁二烯基态,4个电子填充在ψ1和ψ22个BMO上
1 0.3717 1 0.6015 2 0.6015 3 0.3717 4 2 0.6015 1 0.3717 2 0.3717 3 0.6015 4
n
m
3 2 1
1
2
1 2
2
1
1 2
2
2
C 3H 5
+
C 3 H5
C 3H 5-
2. 离域的类型 (1)n>m,缺电子离域 键
丙烯基 阳离子
2 3
三甲苯基 阳离子
18 19
(2)n=m,等电子离域 键或正常离域 键
4 4
6 6
p12 2c11c12 c21c22 c31c32 2 0.3717 0.6015 0.6015 0.3717 0.6015 0.3717 0.4472 p23 2c12c13 c22c23 c32c33
2 0.6015 0.6015 0.3717 0.3717 0.3717 0.3717 0.7236
O C O H
10 9
C
C
H
8 8
三 分子图与共轭性质
电荷密度 键级 自由价 分子图及其应用
电荷密度
离域π键的MO为: i ci11 ci 22 cij j cij j 该πMO电子云或电子概率密度为ψi2,而且
2 2 2 2 2 d c c c c ij 1 i1 i2 ij i j
C
O
H
56
OH
78
O C
O
10 9
H
CH
OH
CH
CH
CH
CH
O
78
NH2
78
CH3 H3C
NH3
CH3
C
Cl
NH2
CH
CH3
NH2
CH3 H3C
O
C
CH3
NH2
H2N
C
NH2
46
H3C
Cl
3
H2C
CH
2
Cl
4 3
H2C
CH
Cl2 34
NH2+X-
NH2
N原子
结构化学 —— 第六章 共轭分子的结构
第六章
二 离域键形成条件和类型
1. 离域键的形成条件
) 参与离域分子轨道的原子应在同一个平面上且 提供一个相互平行并垂直于该原子平面的 p 轨道。 B)总的 电子数小于参与形成离域分子轨道数的二 倍: nm m<2n n —— 原子轨道数 m —— 电子数
2 34
+ N2O, NO2 , N3 , CS2
N
NO2
几何结构
O
O
参与离 离域轨道 域的原 子轨道 离域轨道
杂化类型
价电子
非直线型
sp2杂化
p
3m
N=17 m=3
33
SO2
S O O
参与离 离域轨道 域的原 子轨道 离域轨道
几何结构
杂化类型
价电子
非直线型
sp2杂化
p
3m
亲核基团在电荷密度最小处反应。
亲电基团在电荷密度最大处反应。 如果电荷密度相等,各种基团均在自由价最 大处发生反应。
丁二烯的 1 、 4C 上自 由价大,易发生加 成和取代。
萘的 1 、 4 、 5 、 8 位自 由价大,易发生自由 基反应。
亲 电 基 团 NO2+ 将 在 苯胺的邻、对位发 生取代反应。
N=18 m=4
34
O3
Cl
ClO2
几何结构
O
杂化类型
Cl
O
O
价电子
O
离域轨道
参与离 离域轨道 域的原 子轨道
直线型 非直线型
sp杂化 sp2杂化
p2
3m , 3m
1
2
N=19 m=11 N=19 m=5
35 , 36
35
p
3m
O3
Cl2O
几何结构 杂化类型 参与离 离域轨道 域的原 子轨道 价电子 离域轨道
10 10
(3) n<m,多电子离域 键
4 3
6 4
6 4
3. 离域键的判断
m n
(1)先尽可能形成s键,没有参与杂化的p轨道参与形成键 (2)只有s和p原子轨道,则每个原子的价轨道只有4个,最 多形成4个共价键(包括s键,键和孤对电子) 对于非直链分子,最多形成一个离域键。 m 对于直链分子,可有两个离域 n 键。 (3) 确定原子的杂化方式,以及s键数目,键数目。
分子图及其应用 将电荷密度、键级、自由价的数值以一定格式标 在分子的结构式中,构成分子图。 自由价
电荷密度
总键级
分子图的应用 可推断键的性质及分子的稳定性。
键级可直接反映各键的相对强弱、键长的相对
大小以及π键的成分多少。 可估计分子极性和计算偶极矩。 可判断分子静态化学活性。
自由基在自由价最大处发生反应。
自由价
经典结构概念:自由价是分子中尚保留的能够
再化合的剩余化合价。
MOT定义:自由价为原子的最大成键度与其总
成键度之差,即:Fr=Nmax-Nr。
Nr:原子r与周围其它原子的键级,即
N r Prs
s
CH2
1
CH
2
CH
3
CH2
4
Nr:原子r与周围其它原子的键级之总和,即
N r Prs
亲核基团 NH2- 在吡啶 的 2 、 6 位发生邻位取 代,自由基 Br 也易发 生邻位取代反应。
离域键与共轭分子的性质
1. 分子的稳定性
CH2 CH3
CH2
CH CH2
CH2
Cl Cl
34
H 3C
CH2
CH2
Cl
H2C
CH
CH2
Cl
32
H2C
CH
CH2
20 20
C
C
2. 电性质 四氰基奎诺二甲烷( TCNQ )能与四硫代富瓦烯 (TTF)组成有机半导体,正是由于离域π键的形
2 2 1 2c11 2c21 2 (0.3717)2 2 (0.6015)2 1.00
同理求得,
ρ2=ρ3=ρ4=1.00
丁二烯π44键的电荷密度在4个C原子附近分布均匀, CH2 CH CH2 CH 且相等。 4 2 3 1
