常用溶液配制方法题库1-2-10
溶液配比练习题

溶液配比练习题溶液配比问题是化学中一个重要且常见的概念。
通过合理的溶液配比,我们可以控制溶液的浓度、体积和化学反应的进行。
以下是一些溶液配比练习题,帮助你更好地理解和应用这个概念。
题一:酒精溶液配制要配制500 mL含有50%(体积分数)酒精的酒精溶液,现在手头有纯度为95%(体积分数)的酒精和纯净水。
请问,需要分别加入多少毫升的酒精和水?解析:设需要加入的酒精体积为x mL,则纯净水的体积为(500 - x) mL。
根据溶液配比的基本原则,酒精在溶液中的体积分数可以用下式表示:50% = (x mL 酒精) /500 mL × 100%由于酒精的纯度为95%,所以可得到以下方程:50% = (x mL 酒精) /500 mL × 100% = 95%解得:x = (50% × 500 mL) / 95% = 263.16 mL (约)因此,需要加入约263.16 mL的酒精和(500 - 263.16) ≈ 236.84 mL的纯净水。
题二:溶液浓度调整现有200 mL浓度为30%(质量分数)的盐酸溶液。
要将其浓度调整为10%,应加入多少毫升的纯盐酸和适量的纯净水?解析:设需要加入的纯盐酸体积为x mL,则加入纯净水的体积为(200 - x) mL。
根据浓度调整的原理,溶液中盐酸的质量分数可以由下式表示:10% = (x g 盐酸)/(200 g 盐酸 + 800 g 水) × 100%根据已知浓度30%可以求得以下方程:30% = (60 g 盐酸)/(200 g 盐酸 + 800 g 水) × 100%解方程得:x = (10% × 1000 mL × 60 g 盐酸)/(30% × 1000 g - 10% ×1000 g) ≈ 66.67 mL (约)因此,应加入约66.67 mL的纯盐酸和适量的纯净水来调整溶液浓度为10%。
溶液配置考试题库答案

溶液配置考试题库答案# 溶液配置考试题库答案一、选择题1. 溶液的浓度表示方法不包括以下哪一项?A. 质量百分浓度B. 体积百分浓度C. 摩尔浓度D. 质量浓度答案:D2. 以下哪种物质不能用于配制标准溶液?A. 纯水B. 纯盐酸C. 纯硫酸D. 杂质含量较高的硫酸答案:D3. 配制100mL 0.1mol/L的NaOH溶液,需要NaOH固体的质量是多少?A. 0.1gB. 0.40gC. 4.0gD. 40g答案:B4. 配制溶液时,使用容量瓶的目的是:A. 便于搅拌B. 便于过滤C. 便于量取准确体积D. 便于加热答案:C5. 配制溶液时,以下操作错误的是:A. 使用磁力搅拌器搅拌B. 使用玻璃棒搅拌C. 直接将固体溶质倒入容量瓶中D. 定容后用蒸馏水洗涤容量瓶答案:C二、填空题1. 配制溶液时,通常使用_______来量取溶剂。
答案:量筒2. 标准溶液的配制需要使用_______。
答案:分析天平3. 配制溶液时,定容后需要用玻璃棒搅拌,以使溶液_______。
答案:均匀4. 配制溶液时,如果定容后液面低于刻度线,应该_______。
答案:重新配制5. 配制溶液时,使用容量瓶的目的是为了确保溶液的_______。
答案:体积准确三、简答题1. 简述配制溶液时的一般步骤。
答案:配制溶液的一般步骤包括:计算所需溶质的质量或体积,称量或量取溶质,将溶质溶解在一定量的溶剂中,转移溶液至容量瓶中,用蒸馏水定容至标线,摇匀,最后将溶液转移到适当的容器中保存。
2. 为什么配制溶液时需要使用蒸馏水?答案:配制溶液时使用蒸馏水是为了确保溶液的纯度,避免杂质对实验结果的影响。
蒸馏水是经过蒸馏过程去除杂质的水,具有较高的纯度。
四、计算题1. 需要配制250mL 0.5mol/L的硫酸溶液,若硫酸的密度为1.84g/cm³,求需要多少体积的98%浓硫酸?答案:首先计算所需硫酸的质量,然后根据浓硫酸的密度和浓度计算所需体积。
溶液配制及浓度
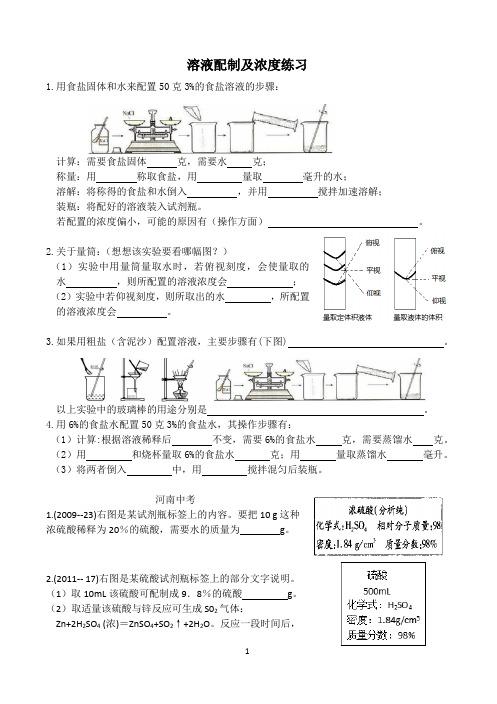
溶液配制及浓度练习1.用食盐固体和水来配置50克3%的食盐溶液的步骤:计算:需要食盐固体克,需要水克;称量:用称取食盐,用量取毫升的水;溶解:将称得的食盐和水倒入,并用搅拌加速溶解;装瓶:将配好的溶液装入试剂瓶。
若配置的浓度偏小,可能的原因有(操作方面)。
2.关于量筒:(想想该实验要看哪幅图?)(1)实验中用量筒量取水时,若俯视刻度,会使量取的水,则所配置的溶液浓度会;(2)实验中若仰视刻度,则所取出的水,所配置的溶液浓度会。
3.如果用粗盐(含泥沙)配置溶液,主要步骤有(下图)。
以上实验中的玻璃棒的用途分别是。
4.用6%的食盐水配置50克3%的食盐水,其操作步骤有:(1)计算:根据溶液稀释后不变,需要6%的食盐水克,需要蒸馏水克。
(2)用和烧杯量取6%的食盐水克;用量取蒸馏水毫升。
(3)将两者倒入中,用搅拌混匀后装瓶。
河南中考1.(2009--23)右图是某试剂瓶标签上的内容。
要把10 g这种浓硫酸稀释为20%的硫酸,需要水的质量为g。
2.(2011-- 17)右图是某硫酸试剂瓶标签上的部分文字说明。
(1)取10mL该硫酸可配制成9.8%的硫酸g。
(2)取适量该硫酸与锌反应可生成S02气体:Zn+2H2SO4 (浓)=ZnSO4+SO2↑+2H2O。
反应一段时间后,12溶还可能生成另一种气体,请解释其原因。
3.(2012--14)右图是某输液瓶标签上的部分内容。
由此可知,葡萄糖由种元素组成,其中碳元素的质量分数为。
要把10 g 这种葡萄糖溶液稀释为2%的溶液,需要水的质量为g 。
4.(2014--21)(3分)生产、生活中常需配制溶液。
(1)配制一瓶右图所示溶液需氯化钠___________g 。
(2)配制一定质量分数的氯化钠溶液时,下列哪些操作会导致溶液的质量分数偏小?请说明偏小的原因。
①用量筒量取水时仰视读数;②往烧杯中加水时有水溅出;③称量含不溶性杂质的氯化钠来配制溶液;④将配制好的溶液往试剂瓶中转移时有少量溅出。
(完整版)溶液配制与稀释典型习题+详解

(完整版)溶液配制与稀释典型习题+详解溶液配制练习一、固—水例1:配制50 g质量分数为5%的氯化钠钠溶液,需要氯化钠多少克?水多少亳升?解析:这是溶液配制最基本、最典型的类型。
可由公式:溶质质量=溶液质量×溶质质量分数;溶剂质量=溶液质量—溶质质量和体积=质量/密度直接计算。
氯化钠质量=50 g×5%=2.5 g 水的质量=50 g—2.5 g =47.5 g水的体积=47.5 g/1 g/ ml=47.5 ml例2:配制500 ml质量分数为10%的氢氧化钠溶液(密度为1.1 g/cm3)需要氢氧化钠和水的质量各多少?解析:此题涉及溶液密度,要注意转化成质量来计算。
溶液中只有质量有加和关系,体积不能直接进行和差计算。
氢氧化钠溶质质=500 ml1.1 g/cm310%=55 g水的质量=500 ml1.1 g/cm3-55 g=495 g(不要计算成500—55=445)二、液—水例3:用25%的氯化钠溶液和水配制30kg10%的食盐溶液。
需要25%的氯化钠溶液和水各多少kg?解析:紧紧抓住配制前后的等量关系是关键。
可以利用配制前后溶质、溶剂的相对应相等来列方程解决。
设需要25%的氯化钠溶液和水质量为x和y25%x=30k g10%,解得x=12k g;Y=30k g—12k g=18k g例4:某工厂化验室配制5000 g20%的盐酸,需要38%的盐酸(密度为1.19 g/cm3)和水各多少毫升?解析:可以直接利用质量列方程计算。
设需要30%的盐酸体积为x,水的体积为y,5000 g×20%=x×1。
19 g/cm338% 解得x=2212 mlY=5000 g—2212 ml×1.19 g/cm338% =2453 ml三、液—液例5:要配制20%的食盐溶液100 g,需要10%和50%的食盐溶液各多少亳升?解析:此题可根据溶液配制前后的溶质、溶剂、溶液相等来列出议程组解决。
溶液配制方法

溶液配制方法一、指示剂配制1.0.3%二甲酚橙指示剂:称取0.15g二甲酚橙,加5ml无水乙醇,用水稀释至50ml。
2.5g/L液体铬黑T:称取0.5g铬黑T和2.0g氯化羟胺,溶于乙醇,用乙醇稀释至100ml,此使用前配备。
贮存于100ml棕色试剂瓶中。
3.固体铬黑T:称取1.0g铬黑T和100g氯化钠研磨混合均匀,贮存于100ml棕色广口瓶中备用。
4.1%紫脲酸胺:1g紫脲酸胺与100g固体氯化钠混合,研磨,烘干。
5.1g/L酚酞指示剂:称取0.1g酚酞指示剂,加乙醇100ml溶解混合。
6.10 g/L酚酞指示剂:称取1.0 g酚酞指示剂,加乙醇100ml溶解混合。
7.甲基红—溴甲酚绿指示剂:1份2g/L甲基红乙醇溶液与三份1g/L溴甲酚绿乙醇溶液混合。
8.甲基红-亚甲基蓝指示剂:一份甲基红乙醇溶液(1g/L)与两份亚甲基蓝乙醇溶液(1g/L)混合。
9.品红试剂(0.15%):称取0.15g酸性品红,加75ml水,加热到品红溶解,冷却到室温,加4ml盐酸搅拌。
再加15ml10%亚硫酸钠溶液搅匀,放置过夜,加活性炭过滤于100ml容量瓶中。
二、标准溶液的配制1.钴标准溶液:称取3.000g金属钴(99.98%)置于250ml烧杯中,加少量蒸馏水润湿,盖上表面皿,缓慢加入20ml硝酸,加热溶解完全后,洗表面皿及烧杯壁于烧杯中,移入1000ml容量瓶中,用蒸馏水稀释至刻度,摇匀。
此溶液1ml含钴3.000mg。
2.铁氰化钾标准溶液:C﹝K3Fe(CN)6﹞=0.03mol/L,称取9.9g铁氰化钾溶于水中,并稀释至1000ml,摇匀,贮存于棕色瓶中。
3.硫酸钴标准溶液:C(CoSO4)=0.15mol/L,称取4.2g硫酸钴(CoSO4·7H2O)溶于水中,并稀释至1000ml,摇匀,此溶液1ml含钴大约0.9mg。
4.锂标准贮存溶液:称取 5.3228g光谱纯级碳酸锂(预先于110℃、烘2个小时置于干燥器中冷却)置于250ml烧杯中,加少量水润湿,盖上表面皿,沿杯壁缓慢加入15ml盐酸,待溶解后转入1000ml容量瓶中,用蒸馏水定容。
溶液的配制练习题

溶液的配制练习题实验一溶液的配制班级:学号:姓名:分数一、是非判断题:(每小题3分,共30分)(1)将从移液管中取出的液体放入容器时,应吹出尖端留下的液滴。
()2.移液管或吸量管在使用前需洗涤和润洗,润洗方法即先用滤纸将管口内外水珠吸去,再用被移溶液润洗三次,润洗后的溶液应该弃去。
()3. 固定容量时,将容量瓶放在桌上,使刻度线和视线保持水平,并滴下蒸馏水,直到弯月面下边缘与标记线相切。
()4.使用天平时,取砝码必须用镊子,其原因主要是可轻轻地将砝码放在托盘上,天平不易损坏。
()5. 在制备SbCl 3溶液时,通常使用一定量的6 mol-1 HCl溶解SbCl 3,然后用水稀释至刻度。
()6.容量瓶在闲置不用时,应在瓶塞及瓶口处垫一纸条,以防粘结。
()7.配制溶液过程中,当溶液达到容量瓶的2/3容量时,应将容量瓶拿起,盖上瓶塞,颠倒摇匀使溶液初步混匀。
(8)吸取5.00ml、10.00ml、25.00ml等整体积溶液,一般使用相应大小的移液管。
移液管通常用于测量小体积而非整数体积的溶液。
()9.开始使用电子天平前,应检查水平仪气泡是否在中间位置,否则应调整。
()10.差减称量法(减量法)由两次称量之差得到试样质量的称量方法。
二、选择题:(每小题6分,共48分)1.在小烧杯中溶解固体溶质,必要时加热。
溶解后将溶液转移至容量瓶中时,以下操作的误差为()。
a.趁热转移b.使玻璃棒下端和容量瓶颈内壁相接触,但不能和瓶口接触c.缓缓使溶液沿玻璃棒和颈内壁全部流入容量瓶内d、用洗涤瓶仔细冲洗玻璃棒和烧杯内壁2-3次,并将洗涤液移入容量瓶中12.在溶液制备过程中,需要下列哪种容器来测量25.00溶液?(a)量筒B.移液管C.量杯D.移液管3.在配制溶液的实验中,下列洗干净的玻璃仪器中,使用时必须用待装的标准溶液或试液润洗的是()。
a、量筒B.烧杯C.移液管D.容量瓶4。
在下面的实验操作中,一般来说,不应该相互接触的是()。
溶液配制试题及答案

溶液配制试题及答案一、选择题1. 配制100mL 0.1mol/L的NaOH溶液,需要NaOH的质量是多少?A. 0.4gB. 4gC. 0.04gD. 40g答案:B2. 配制溶液时,如果使用的容量瓶没有完全干燥,对所配溶液的浓度有何影响?A. 浓度偏高B. 浓度偏低C. 无影响D. 无法确定答案:C二、填空题1. 配制溶液时,若称取的溶质质量偏小,则所配溶液的浓度将______。
答案:偏低2. 配制溶液时,若定容时液面未与刻度线相切,则所配溶液的浓度将______。
答案:偏低三、计算题1. 现有10g NaCl,需要配制成100mL 0.2mol/L的溶液,问需要多少水?答案:首先计算NaCl的摩尔数:10g / (58.44g/mol) = 0.171mol。
然后计算所需溶液体积:0.171mol / 0.2mol/L = 0.855L。
最后计算所需水的体积:0.855L - 0.1L = 0.755L。
2. 现有100mL 0.5mol/L的HCl溶液,需要稀释成50mL 0.1mol/L的溶液,问需要多少水?答案:首先计算稀释前后HCl的摩尔数不变:0.5mol/L * 0.1L =0.05mol。
然后计算稀释后溶液的体积:0.05mol / 0.1mol/L = 0.5L。
最后计算所需水的体积:0.5L - 0.1L = 0.4L。
四、实验操作题1. 描述配制100mL 0.1mol/L的NaOH溶液的步骤。
答案:首先,使用天平称取4g NaOH固体。
然后,将NaOH固体溶解在适量蒸馏水中,转移到100mL容量瓶中,并用蒸馏水定容至刻度线。
最后,摇匀溶液,使其充分混合。
2. 在配制溶液时,如何避免溶液浓度的误差?答案:在配制溶液时,应确保使用准确的称量工具和容量瓶,严格按照操作步骤进行。
在称量溶质时,应使用干燥的容器和工具,避免溶质吸湿。
在定容时,应确保液面与刻度线相切,避免误差。
化学溶液配制实验练习题

化学溶液配制实验练习题化学溶液配制实验练习题化学溶液配制是化学实验中常见的一项实践操作,通过将溶质溶解在溶剂中,可以得到所需浓度和体积的溶液。
这项实验对于学生来说是一项重要的训练,既能够加深对化学理论知识的理解,也能够培养实验操作的技能。
在化学溶液配制实验中,常常会遇到一些练习题,下面我们来看几个例子。
1. 问题:要制备100 mL浓度为0.1 mol/L的硫酸溶液,已知硫酸的摩尔质量为98 g/mol,应该使用多少克硫酸?解答:根据浓度的定义,浓度(C)等于溶质的摩尔数(n)除以溶液的体积(V)。
C = n/V已知浓度为0.1 mol/L,体积为100 mL,将体积单位转换为升:V = 100 mL = 0.1 L将已知的浓度和体积代入公式,可以得到摩尔数:0.1 mol/L = n/0.1 Ln = 0.1 mol/L × 0.1 L = 0.01 mol根据硫酸的摩尔质量,可以计算出所需的质量:质量 = 摩尔质量× 摩尔数质量= 98 g/mol × 0.01 mol = 0.98 g所以,需要使用0.98克的硫酸来制备100 mL浓度为0.1 mol/L的硫酸溶液。
2. 问题:要制备500 mL浓度为0.5 mol/L的氯化钠溶液,已知氯化钠的摩尔质量为58.44 g/mol,应该使用多少克氯化钠?解答:同样根据浓度的定义,浓度(C)等于溶质的摩尔数(n)除以溶液的体积(V)。
C = n/V已知浓度为0.5 mol/L,体积为500 mL,将体积单位转换为升:V = 500 mL = 0.5 L将已知的浓度和体积代入公式,可以得到摩尔数:0.5 mol/L = n/0.5 Ln = 0.5 mol/L × 0.5 L = 0.25 mol根据氯化钠的摩尔质量,可以计算出所需的质量:质量 = 摩尔质量× 摩尔数质量= 58.44 g/mol × 0.25 mol = 14.61 g所以,需要使用14.61克的氯化钠来制备500 mL浓度为0.5 mol/L的氯化钠溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常用溶液配制方法题
库1-2-10
问题:
[单选,A1型题]配制100ml的0.2molL盐酸(36.46molL),已知市售盐酸的浓度为37%,比重1.19,所需盐酸的体积为()
A.1.66L
B.1.66ml
C.1.98ml
D.1.98L
E.1.66×10ml
问题:
[单选,A1型题]以下关于当量的概念错误的是()
A.当量浓度是指1L溶液中所含溶质的Eq数(1ml溶液中所含溶质的mEq数)表示的浓度,表示为μ
B.已知NaOH的分子量为40,计算NaOH当量为40
C.当量浓度的单位可以用1ml溶液中所含溶质的Eq数表示
D.当量的计算方法为分子量与阳离子的价数的比值
当量浓度是指1L溶液中所含溶质的Eq数(1ml溶液中所含溶质的mEq数)表示的浓度。
表示为μ,其中体积和Eq数一一对应。
问题:
[单选,A1型题]缓冲溶液能够对抗外来少量强酸强碱的原因,错误的是()
A.多元酸的酸式盐及其对应的次级盐,弱碱及其对应的盐,弱酸极其对应的盐所组成的缓冲溶液的作用机制相似
B.以醋酸-醋酸钠缓冲系为例,NaAc是缓冲溶液的抗酸成分
C.以醋酸-醋酸钠缓冲系为例,HAc是缓冲溶液的抗碱成分
D.缓冲作用是有一定限度的,一旦强酸、强碱量过大,缓冲溶液将丧失原有缓冲能力
E.起到缓冲作用的两种以上的组成成分都可以组成缓冲溶液
缓冲溶液可由下列三种成对的组分组成,它们分别是弱酸及其对应的盐,多元酸的酸式盐及其对应的次级盐,弱碱及其对应的盐。
(免费小游戏 /)
问题:
[单选,A1型题]制备75%乙醇,即将75ml纯乙醇加入25ml蒸馏水,因此其百分浓度可计为()
A.重量-重量百分浓度
B.重量-体积百分浓度
C.体积-体积百分浓度
D.体积-重量百分浓度
E.以上均可
百分浓度的标准定义是每100份溶液中所含溶质的份数,用符号(%)表示,其包括重量-重量(gg)即每100g溶液中所含溶质的克数,重量-体积(gml)即100ml溶液中所含溶质的克数,体积-体积百分浓度(mlml)即每100ml溶液中所含溶质的毫升数。
其用公式表示为百分浓度=(溶质的份数/溶液的份数)×100%。
问题:
[单选,A1型题]制备伊红溶液,应采用的百分浓度计量方法是()
A.重量-重量百分浓度
B.重量-体积百分浓度
C.体积-体积百分浓度
D.体积-重量百分浓度
E.以上均可
百分浓度的标准定义是每100份溶液中所含溶质的份数,用符号(%)表示,其包括重量-重量(gg)即每100g溶液中所含溶质的克数,重量-体积(gml)即100ml溶液中所含溶质的克数,体积-体积百分浓度(mlml)即每100ml溶液中所含溶质的毫升数。
其用公式表示为百分浓度=(溶质的份数/溶液的份数)×100%。
问题:
[单选,B型题]二甲胂酸缓冲液的pH范围是()
A.pH2.2~3.6
B.pH5.29~8.04
C.pH2.6~7.0
D.pH5.0~7.4
E.pH5.2~8.6
查常用缓冲溶液的配制表。
问题:
[单选,B型题]枸橼酸-磷酸缓冲液的pH范围是()
A.pH2.2~3.6
B.pH5.29~8.04
C.pH2.6~7.0
D.pH5.0~7.4
E.pH5.2~8.6
查常用缓冲溶液的配制表。
问题:
[单选,B型题]磷酸盐缓冲溶液的pH范围是()
A.pH2.2~3.6
B.pH5.29~8.04
C.pH2.6~7.0
D.pH5.0~7.4
E.pH5.2~8.6
查常用缓冲溶液的配制表。
