胃癌靶向治疗课件
合集下载
优质医学胃癌靶向治疗进展PPT演示课件
Lordick F, et al. 2012 ESMO Abstract LBA3.
.
EXPAND:OS和PFS
Lordick F, et al. 2012 ESMO Abstract LBA3.
0
3
6
9
12
15
18
21
24
27
30
33
36
39
42
0.0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.870.970.850.63
0.1002———
Median progression-free survival (PFS)亚洲欧洲美洲
5.3 mos5.6 mos4.4 mos4.4 mos
6.7 mos6.7 mos6.9 mos5.9 mos
0.800.920.710.65
0.0037———
.
REGARD:Ramucirumab二线治疗
转移性胃或胃食管交界腺癌的III期研究
多中心、随机、双盲、安慰剂对照III期研究两组患者基线特征均衡主要终点:OS次要终点:PFS,12周PFS率,ORR和安全性
Fuchs CS, et al. 2013 ASCO GI Abstract LBA5.
PL:安慰剂
69733
20021114
60634
人种
白人亚裔
208110
6333
199121
5936
年龄
中位
61(25-83)
61(24-84)
>=65岁
126
38
123
37
性别
男性
.
EXPAND:OS和PFS
Lordick F, et al. 2012 ESMO Abstract LBA3.
0
3
6
9
12
15
18
21
24
27
30
33
36
39
42
0.0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.870.970.850.63
0.1002———
Median progression-free survival (PFS)亚洲欧洲美洲
5.3 mos5.6 mos4.4 mos4.4 mos
6.7 mos6.7 mos6.9 mos5.9 mos
0.800.920.710.65
0.0037———
.
REGARD:Ramucirumab二线治疗
转移性胃或胃食管交界腺癌的III期研究
多中心、随机、双盲、安慰剂对照III期研究两组患者基线特征均衡主要终点:OS次要终点:PFS,12周PFS率,ORR和安全性
Fuchs CS, et al. 2013 ASCO GI Abstract LBA5.
PL:安慰剂
69733
20021114
60634
人种
白人亚裔
208110
6333
199121
5936
年龄
中位
61(25-83)
61(24-84)
>=65岁
126
38
123
37
性别
男性
胃癌靶向治疗PPT教案

Incidence of KRAS mutations in gastric cancer?
Study Zhao et al., Int J Cancer 2004; 108:167 Lee et al., Oncogene 2003; 22: 6942
Kim et al., Hum Genet 2003; 114:118
EGFR表达升高与以下临床病理因素相关:
进展期胃癌+淋巴结转移
生存期缩短 (EJC 2001; 37:S9-S15)
07/23/2007
EGF receptor signaling pathway: A rationale for personalized therapy
Ligand: AREG/EREG Target for EGFR-ERBITUX
EXPAND Phase III
Cisplatin
80mg/m2 d1
R
Capecitabine 1000mg/m2 twice daily; d1-14
q3w
A
Cetuximab 400mg/m2 loading dose,
then 250mg/m2 per week
N
• Until radiographically documented PD or unacceptable toxicity
MYC Angiogenesis
MEK MAPK
Cyclin D1
Cyclin D1
Invasion and metastasis
Survival (anti-
apoptosis)
Yarden Y, Sliwkowski MX. Nat Rev Mol Cell Biol 2001;2:127–137; Chakravarti A, et al. Cancer Res 2002;62:4307–4315; Baselga J. Eur J Cancer 2001;37(Suppl. 4):S16–S22; Kawanaka H, et al. Life Sci 2001;69:3019–3033
Study Zhao et al., Int J Cancer 2004; 108:167 Lee et al., Oncogene 2003; 22: 6942
Kim et al., Hum Genet 2003; 114:118
EGFR表达升高与以下临床病理因素相关:
进展期胃癌+淋巴结转移
生存期缩短 (EJC 2001; 37:S9-S15)
07/23/2007
EGF receptor signaling pathway: A rationale for personalized therapy
Ligand: AREG/EREG Target for EGFR-ERBITUX
EXPAND Phase III
Cisplatin
80mg/m2 d1
R
Capecitabine 1000mg/m2 twice daily; d1-14
q3w
A
Cetuximab 400mg/m2 loading dose,
then 250mg/m2 per week
N
• Until radiographically documented PD or unacceptable toxicity
MYC Angiogenesis
MEK MAPK
Cyclin D1
Cyclin D1
Invasion and metastasis
Survival (anti-
apoptosis)
Yarden Y, Sliwkowski MX. Nat Rev Mol Cell Biol 2001;2:127–137; Chakravarti A, et al. Cancer Res 2002;62:4307–4315; Baselga J. Eur J Cancer 2001;37(Suppl. 4):S16–S22; Kawanaka H, et al. Life Sci 2001;69:3019–3033
晚期胃癌的靶向治疗进展PPT教案

研究设计
入组标准 ➢ 曲妥珠单抗治疗进展时HER2+(IHC 3+或 FISH +); ➢ 阿法替尼治疗前后需获取活检标本,用于蛋白质组学、二代测序(NGS)
和建立异种移植瘤(PDX);
➢ 89Zr-曲妥珠单抗 PET成像技术用于基线期和治疗后活检时。
IV期曲妥珠单抗治疗后PD
0
1
8
周
HER2+ EG
➢ EGFR抑制剂:全军覆没
➢ 其他的靶点有待探索:parp酶抑制剂,FGFR抑制剂,…
ToGA 研究:曲妥珠单抗
全球、多中心、随机、开放III期临床研究
3803 位患者接受筛选1 810 HER2-阳性* (22.1%)
HER2-阳性* 晚期胃癌患者
(n=584)
a由研究者的判别来选择;GEJ, 胃食管连接部 *通过中心实验室检测IHC(3+)和/或FISH(+)
n=30
(阶段 1 + 2)
1
CPD化紫多C(PDPaaoo杉西hhhcccc疗ylleeeeii醇他sttttaaiaammc赛xxxxie8aeee(o0olnlll研788’77tstm500hh5究5gCmm/memem者hmgggorrgg2/选///aai//mmmcmmw2epp择k2222)//qyywwqq)或3k3k3(woPowwkrrhkkysician’s Choice)
主要终点:OS 次要终点:PFS、ORR、DOR、CBR、安全性、帕妥珠单抗药代动力学和PRO
Tabernero J, et al. 2013 ASCO Abstract TPS4150.
T-DM1治疗胃癌: GATSBY III期试验 Ongoing!
阶段 1**
最新:胃癌抗血管分子靶向治疗课件-文档资料

阿帕替尼对受体酪氨酸激酶活性的抑制
作用靶点
IC50(nM)
阿帕替尼
索拉非尼
舒尼替尼
帕唑帕尼
VEGFR-1
70
--
2
10
VEGFR-2
2
90
9
30
VEGFR-3
--
--
17
47
PDGFR-β
537
--
8
84
c-kit
420
68
--
74
FGFR-1
>10000
580
--
--
FLT-3
--
58
--
--
与同类小分子酪氨酸激酶抑制剂相比,对VEGFR-2具有更强的选择性。
—— Apatinib -- -- Placebo
主要研究终点– OS ( PPS 人群)
Group
n
mOS (95% CI), months
P value
HR(95%CI)
Apatinib
136
7.6(6.3-8.5)
0.0027
0.616 (0.447-0.849)
Placebo
71
5.0(4.3-5.9)
基线数据及患者特性
RAM+PTX (N+330)
PBO+PTX (N+335)
n
%
n
%
地区
1 澳洲/欧洲/美国 2 美洲/南美洲 3 亚洲
198 23 109
69 7 33
200 21 114
60 6 34
人种
白人 亚裔
208 110
63 33
199 121
作用靶点
IC50(nM)
阿帕替尼
索拉非尼
舒尼替尼
帕唑帕尼
VEGFR-1
70
--
2
10
VEGFR-2
2
90
9
30
VEGFR-3
--
--
17
47
PDGFR-β
537
--
8
84
c-kit
420
68
--
74
FGFR-1
>10000
580
--
--
FLT-3
--
58
--
--
与同类小分子酪氨酸激酶抑制剂相比,对VEGFR-2具有更强的选择性。
—— Apatinib -- -- Placebo
主要研究终点– OS ( PPS 人群)
Group
n
mOS (95% CI), months
P value
HR(95%CI)
Apatinib
136
7.6(6.3-8.5)
0.0027
0.616 (0.447-0.849)
Placebo
71
5.0(4.3-5.9)
基线数据及患者特性
RAM+PTX (N+330)
PBO+PTX (N+335)
n
%
n
%
地区
1 澳洲/欧洲/美国 2 美洲/南美洲 3 亚洲
198 23 109
69 7 33
200 21 114
60 6 34
人种
白人 亚裔
208 110
63 33
199 121
胃癌靶向治疗新进展PPT课件

31.6%
17.6% 11.8%
从随机开始时间(月)
一项国际多中心,随机,双盲,安慰剂对照,3期临床研究,在北美,中美,南美,欧洲,亚洲,澳大利亚和非洲的29个国家,
119个中心进行,时间2009年10月6日至2012年1月26日,纳入355名一线含铂类或含FU方案化疗后进展的晚期胃或EGJ腺癌,
2:1随机接受RAM或安慰剂治疗,治疗直至影像学确认疾病进展,毒性不耐受或死亡。研究主要终点OS
6.5m
4.7m
总生存期(月)
FAS集:全分析方案集
—— 阿帕替尼 . -- -- 安慰剂
23 ASCO 2014.Abstract #4003
在PPS集中阿帕替尼显著延长 晚期胃癌患者总生存时间
PPS集中,阿帕替尼组的mOS较安慰剂组延长2.6个月(P=0.0027)
分组 例数 mOS (95% CI), 月
p=0.0001
月 ORR
一项全球性,安慰剂对照,双盲,III期研究,研究时间:2010年12月~2012年9月,纳入665名一线含铂类或含FU方案化疗后4个 月内进展的转移性胃或EGJ腺癌,随机接受RAM+P或安慰剂+P治疗,治疗直至疾病进展,毒性不耐受或死亡。主要终点:OS
.
9
Wilke H, et al. J Clin Oncol 2014; 32 (3_suppl): Abstract LBA7.
贝伐单抗 Ramucimumab
Tivantinib
DNA SSB
厄洛替尼 吉非替尼
拉帕替尼,阿法替尼
达可替尼
持续SSB
PARP抑制 Olaparib
PARP
BRCA2 BRCA1
DNA DSB
胃癌分子靶向治疗(研究生课程)(1)

胃癌分子靶向治疗
北京大学肿瘤医院 消化内科 沈琳
精品课件
胃癌靶向治疗多遭遇失败
止于II期 紫杉醇 奥沙利铂 吉西他滨
2001 2002
培美曲塞 厄洛替尼 吉非替尼
索拉非尼 舒尼替尼 伊沙匹隆……
2003
IF vs. CF 伊立替康1
2004 2005 2006
2007
AVAGAST 安维汀2
2008 2009
行观察
aChosen at investigator’s discretion GEJ, gastroesophageal junction
精品课件
1Bang et al; Abstract 4556, ASCO 2009
OS in IH胃C2癌+/F靶IS向H+治or疗IHC3+
(exploratory analysis)
• 曲妥珠单抗耐药问题
• Beyond Her-2?
• 曲妥珠单抗耐药问题 • 二线TDM-1 • 帕妥珠单抗 • Her-3靶点联合Her-2靶点
V325 多西他赛4
CLASSIC7 XELOX
9. Waddel T, et al. 2012 ESMO Abstract 667PD.
10. Lordick F, et al. 2012 ESMO Abstract LBA3. 11. Bang YJ, et al. 2013 ASCO GI Abstract 11. 12. /ct2/show/NCT00879333.
− advanced vs metastatic − GC vs GEJ − measurable ห้องสมุดไป่ตู้s non-measurable − ECOG PS 0-1 vs 2 − capecitabine vs 5-FU
北京大学肿瘤医院 消化内科 沈琳
精品课件
胃癌靶向治疗多遭遇失败
止于II期 紫杉醇 奥沙利铂 吉西他滨
2001 2002
培美曲塞 厄洛替尼 吉非替尼
索拉非尼 舒尼替尼 伊沙匹隆……
2003
IF vs. CF 伊立替康1
2004 2005 2006
2007
AVAGAST 安维汀2
2008 2009
行观察
aChosen at investigator’s discretion GEJ, gastroesophageal junction
精品课件
1Bang et al; Abstract 4556, ASCO 2009
OS in IH胃C2癌+/F靶IS向H+治or疗IHC3+
(exploratory analysis)
• 曲妥珠单抗耐药问题
• Beyond Her-2?
• 曲妥珠单抗耐药问题 • 二线TDM-1 • 帕妥珠单抗 • Her-3靶点联合Her-2靶点
V325 多西他赛4
CLASSIC7 XELOX
9. Waddel T, et al. 2012 ESMO Abstract 667PD.
10. Lordick F, et al. 2012 ESMO Abstract LBA3. 11. Bang YJ, et al. 2013 ASCO GI Abstract 11. 12. /ct2/show/NCT00879333.
− advanced vs metastatic − GC vs GEJ − measurable ห้องสมุดไป่ตู้s non-measurable − ECOG PS 0-1 vs 2 − capecitabine vs 5-FU
消化系统肿瘤的分子靶向药物治疗ppt课件

分子生物学
肿瘤部位(实体)
肿瘤组织
*
各种靶向治疗药物在中国的上市时间
2000
2001
2002
2003
2004
2005
2006
2007
美罗华 MabThera
希罗达 Xeloda
赫赛汀 Herceptin
格列卫 Glivec
易瑞沙 Iressa
特罗凯 Tarceva
爱必妥 Erbitux
恩度Endostatin
肿瘤血管生成理论
Judah Folkman 教授 1971年,提出“肿瘤的生长依赖于新生血管生成”这一观点,开创了一个新的研究领域。 肿瘤的生长有两个明显不同的阶段,即无血管的缓慢生长阶段和有血管的快速增殖阶段。 大部分实体瘤可长期处于无血管的休眠 ( dormant )状态, 肿瘤细胞依靠被动扩散获得营养, 最大直径小于2mm。
*
靶向治疗的不良反应
变态反应或者其他过敏反应。 过敏反应:静脉输注开始几分钟。尤其于首次输液时发生率较高 手足皮肤反应:麻木感、烧灼感、红斑、肿胀、皮肤变硬、起茧、起疱、发干、脱屑或皲裂等,在手足的受力区往往症状更严重 腹泻 高血压: ≥160/100mmHg和/或出现相应症状需要治疗
4
对常规化疗和放疗抗拒
5
能手术切除的病人占很小一部分
பைடு நூலகம்
STI571 produced response rates of 60% PR and 20% SD > 6 mos in metastatic GIST.
特 点
1
占胃肠道肿瘤10%
*
CT 扫描结果:肿瘤体积缩小
2000年6月27日
2000年10月4日
肿瘤部位(实体)
肿瘤组织
*
各种靶向治疗药物在中国的上市时间
2000
2001
2002
2003
2004
2005
2006
2007
美罗华 MabThera
希罗达 Xeloda
赫赛汀 Herceptin
格列卫 Glivec
易瑞沙 Iressa
特罗凯 Tarceva
爱必妥 Erbitux
恩度Endostatin
肿瘤血管生成理论
Judah Folkman 教授 1971年,提出“肿瘤的生长依赖于新生血管生成”这一观点,开创了一个新的研究领域。 肿瘤的生长有两个明显不同的阶段,即无血管的缓慢生长阶段和有血管的快速增殖阶段。 大部分实体瘤可长期处于无血管的休眠 ( dormant )状态, 肿瘤细胞依靠被动扩散获得营养, 最大直径小于2mm。
*
靶向治疗的不良反应
变态反应或者其他过敏反应。 过敏反应:静脉输注开始几分钟。尤其于首次输液时发生率较高 手足皮肤反应:麻木感、烧灼感、红斑、肿胀、皮肤变硬、起茧、起疱、发干、脱屑或皲裂等,在手足的受力区往往症状更严重 腹泻 高血压: ≥160/100mmHg和/或出现相应症状需要治疗
4
对常规化疗和放疗抗拒
5
能手术切除的病人占很小一部分
பைடு நூலகம்
STI571 produced response rates of 60% PR and 20% SD > 6 mos in metastatic GIST.
特 点
1
占胃肠道肿瘤10%
*
CT 扫描结果:肿瘤体积缩小
2000年6月27日
2000年10月4日
肿瘤靶向治疗及护理ppt课件

植物类:干扰微管系统导致细胞分裂增殖受阻
抗代谢药:干扰核酸/蛋白质的合成/代谢
抗增殖药物仅作用于肿瘤细胞,部分细胞可产生耐药
肿瘤血管异常,血浆渗漏 组织压↑,药物递送↓
残存的肿瘤细胞继续得到血供,恢复生长
除抗细胞增殖药物治疗外, 肿瘤治疗的另一重要环节是 针对肿瘤微环境, 抑制肿瘤血管生成
肿瘤无血供,仅靠弥散获取营养时,体积不超过2mm3,处于静息期
靶向药物治疗前的评估要点
靶向药物护理常规(2013修订)
Cetuximab是EGFR的lgG1单克隆抗体 应用于结直肠癌,如化疗进展改用爱必妥与CPT11仍然有效,在一线爱必妥+FOIFOX或FOIFRI有较高疗效 联合化疗或放疗对头颈部鳞癌显示出很高的抗癌活性。
(2006年7月22日在上海上市)
差
强
治疗效果
差别很大
效果明显
不良反应
消化道和造血系统
少有,但独特反应
教学目标
什么是靶向治疗
靶向药物分类
靶向药物护理
4
1
2
3
各种靶向治疗药物在中国的上市时间
2000
2001
2002
2003
2004
2005
2006
2007
美罗华
赫赛汀
格列卫
易瑞沙
多吉美
爱必妥
特罗凯
2008
索坦
靶向药物
单 抗
用药中出现左心功能不全时应停药。 曲妥珠单抗治疗相关的充血性心衰可能相当严重,特别在与蒽环类药物和环磷酰胺合用时,但大多数治疗后症状好转。治疗药物通常包括利尿药,强心苷类药和或ACEI类。 在10%的患者中可出现急性超敏性反应,包括寒战和/或发热等的症候群,很少需停用,抗组胺药、抗炎药物及皮质激素类药物可预防。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
胃癌靶向治疗
目前正在研究中的胃癌治疗靶点与靶向药物
西妥昔单抗 帕尼单抗
曲妥珠单抗 VEGF 贝伐珠单抗
Figitumumab Hh
GDC-0449
厄洛替尼 吉非替尼
拉帕替尼
Ptch-1 Smo
HER-1 HER-2 VEGFR PDGFR Met IGF-1R
Ras Raf MEK
GSK089
P13K
Phase II Study
Regimen
N
Response (%)
TTP/OS
Bang 2007
Sunitinib
38
3%
NS
Muro 2008
Gold 2008 Hecht 2008 Lqbal 2007
RAD001 Cetuximab Lapatinib
24
0%
55
2%
21
0%
47
7%
胃癌靶向治疗
晚期胃癌药物治疗的优化策略
基于优效性检验的 胃癌一线化疗方案
替换药物
添加药物
其他策略
铂类药物 氟尿嘧啶类 分子靶向 替换 药物替换 药物
序贯治疗
诱导化疗 /维持化疗
目标:延长生存
胃癌靶向治疗
ToGA (XP/FP±H)
AVAGAST
(XP±BV)
胃癌靶向治疗
胃癌 EGFR 表达
• 包括EGF家族在内的各类生长因子及其受体在胃癌中呈过
Cetuximab +FOLFIRI
25
Jhawer 2009 Bev+Modified DCF 36
Bev+Cisplatin+
Shah et al. 20061
Irinotecan
34
Enzinger et al. Bev+Irino/Docet
2008
/Cisplatin
22
RR(%) 56% 52% 56% 64% 65%
68%
TTP/OS 8.1/28.2
mos
8/16 mos 12 mos / 16mos 8.3/12.3
Mos
NS
1.Shah et al. J Clin Oncol,2006;24;6201; 2.DL Fabio et al. ESMO,2006,Abstr胃ac癌t 1靶0向77治PD疗; 3.Pinto et al. Ann Oncol 2007; 4.Lordick et al. Ann Oncol 2008
• EGFR表达升高与以下临床病理因素相关:
– 进展期胃癌+淋巴结转移
– 生存期缩短 (EJC 2001; 37:S9-S15)
07/23/2007
胃癌靶向治疗
EGF receptor signaling pathway: A rationale for personalized therapy
Ligand: AREG/EREG Target for EGFR-ERBITUX
索拉非尼 ቤተ መጻሕፍቲ ባይዱ尼替尼
Akt
PTEN Gli-1
ERK
依维莫司
mTOR
细胞生存/增殖
Wong H, Yau T. The Oncologist 2012; 17:346-358.
胃癌靶向治疗
合理治疗靶点的标准
n 与肿瘤的恶性表型相关 n 重要脏器与组织中很少表达 n 分子特性与生物学行为相关 n 能在临床较易获得的样本中重复检测 n 与临床预后相关 n 当该靶点被阻断、干扰或抑制时,对高度表达该靶点
Target for EGFT-TK
inhibitor
pY
P13K pY
EGFR-TK
pY GRB2
SOS
RAS RAF
PTEN
STAT AKT
PP
Gene transcription Cell-cycle progression
MYC
JUN FOS
Proliferation/ maturation Chemotherapy/ radiotherapy resistance
的患者应有一定的临床反应,对不表达该靶点者,应 无或产生较少临床反应
胃癌靶向治疗
胃癌的分子靶点寻找
n KRAS MT n BRAF MT n EGFR MT n C-met 扩增 n HER-2 过表达
<10% <5% <5% <10%(IHC >40%) 10-25%
胃癌靶向治疗
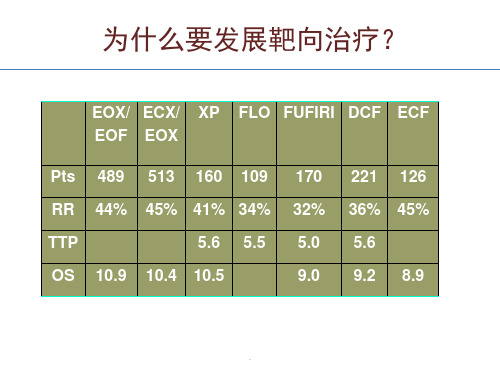
单药应用疗效有限( Phase 2)
度表达 (Gastric Cancer 2004; 7:61-77)
– 免疫组化染色提示胃癌组织中EGFR表达率为59,5%- 86% (JCO2006; 24:4922-4927; ASCO2007 #4526)
– RT-PCR检测提示胃癌组织中EGFR基因扩增率约 62% (World J Gastroenterol 2007; 13:3605-3609)
分子靶向治疗——困惑的临床
n 理解分子靶点 n 理解疗效与特异性毒性反应 n 药物机理与临床研究结果的解读 n 分子靶向治疗药物的应用实践 n 做到真正的translational research
n指导临床研究设计 n指导临床指南
胃癌靶向治疗
近十年的晚期胃癌临床研究
n MAGIC in NEJM (Cunningham,2006) n TAX 325 in JCO (Eric Van Cutsem,2006) n REAL-2 in NEJM (Cunningham,2008) n ML-17032 in Ann Oncology(Kang,2009) n FLAGS in ASCO GI(Ajani,2009) n ToGA in ASCO (Eric Van Cutsem & Bang,2009) n AVAGAST in ASCO (Kang, 2010) n GRANIT-1 ((Eric Van Cutsem , 2012) n REAL-3 ( Waddell, 2012) n ……
MYC Angiogenesis
MEK MAPK
Cyclin D1
Cyclin D1
Invasion and metastasis
Survival (anti-
apoptosis)
Yarden Y, Sliwkowski MX. Nat Rev Mol Cell Biol 2001;2:127–137; Chakravarti A胃, e癌t a靶l.向C治an疗cer Res 2002;62:4307–4315; Baselga J. Eur J Cancer 2001;37(Suppl. 4):S16–S22; Kawanaka H, et al. Life Sci 2001;69:3019–3033
NS
1.8 mos/ 4 mos --
2 mos/ 5mos
靶向+化疗:成绩较好(Phase 2)
Phase II Study
Regimen
N
Lordick et al.20064
Cetuximab +FUFOX
28
Di Fabio et al.20062
Cetuximab +FOLFIRI
27
Pinto et al. 20063
目前正在研究中的胃癌治疗靶点与靶向药物
西妥昔单抗 帕尼单抗
曲妥珠单抗 VEGF 贝伐珠单抗
Figitumumab Hh
GDC-0449
厄洛替尼 吉非替尼
拉帕替尼
Ptch-1 Smo
HER-1 HER-2 VEGFR PDGFR Met IGF-1R
Ras Raf MEK
GSK089
P13K
Phase II Study
Regimen
N
Response (%)
TTP/OS
Bang 2007
Sunitinib
38
3%
NS
Muro 2008
Gold 2008 Hecht 2008 Lqbal 2007
RAD001 Cetuximab Lapatinib
24
0%
55
2%
21
0%
47
7%
胃癌靶向治疗
晚期胃癌药物治疗的优化策略
基于优效性检验的 胃癌一线化疗方案
替换药物
添加药物
其他策略
铂类药物 氟尿嘧啶类 分子靶向 替换 药物替换 药物
序贯治疗
诱导化疗 /维持化疗
目标:延长生存
胃癌靶向治疗
ToGA (XP/FP±H)
AVAGAST
(XP±BV)
胃癌靶向治疗
胃癌 EGFR 表达
• 包括EGF家族在内的各类生长因子及其受体在胃癌中呈过
Cetuximab +FOLFIRI
25
Jhawer 2009 Bev+Modified DCF 36
Bev+Cisplatin+
Shah et al. 20061
Irinotecan
34
Enzinger et al. Bev+Irino/Docet
2008
/Cisplatin
22
RR(%) 56% 52% 56% 64% 65%
68%
TTP/OS 8.1/28.2
mos
8/16 mos 12 mos / 16mos 8.3/12.3
Mos
NS
1.Shah et al. J Clin Oncol,2006;24;6201; 2.DL Fabio et al. ESMO,2006,Abstr胃ac癌t 1靶0向77治PD疗; 3.Pinto et al. Ann Oncol 2007; 4.Lordick et al. Ann Oncol 2008
• EGFR表达升高与以下临床病理因素相关:
– 进展期胃癌+淋巴结转移
– 生存期缩短 (EJC 2001; 37:S9-S15)
07/23/2007
胃癌靶向治疗
EGF receptor signaling pathway: A rationale for personalized therapy
Ligand: AREG/EREG Target for EGFR-ERBITUX
索拉非尼 ቤተ መጻሕፍቲ ባይዱ尼替尼
Akt
PTEN Gli-1
ERK
依维莫司
mTOR
细胞生存/增殖
Wong H, Yau T. The Oncologist 2012; 17:346-358.
胃癌靶向治疗
合理治疗靶点的标准
n 与肿瘤的恶性表型相关 n 重要脏器与组织中很少表达 n 分子特性与生物学行为相关 n 能在临床较易获得的样本中重复检测 n 与临床预后相关 n 当该靶点被阻断、干扰或抑制时,对高度表达该靶点
Target for EGFT-TK
inhibitor
pY
P13K pY
EGFR-TK
pY GRB2
SOS
RAS RAF
PTEN
STAT AKT
PP
Gene transcription Cell-cycle progression
MYC
JUN FOS
Proliferation/ maturation Chemotherapy/ radiotherapy resistance
的患者应有一定的临床反应,对不表达该靶点者,应 无或产生较少临床反应
胃癌靶向治疗
胃癌的分子靶点寻找
n KRAS MT n BRAF MT n EGFR MT n C-met 扩增 n HER-2 过表达
<10% <5% <5% <10%(IHC >40%) 10-25%
胃癌靶向治疗
单药应用疗效有限( Phase 2)
度表达 (Gastric Cancer 2004; 7:61-77)
– 免疫组化染色提示胃癌组织中EGFR表达率为59,5%- 86% (JCO2006; 24:4922-4927; ASCO2007 #4526)
– RT-PCR检测提示胃癌组织中EGFR基因扩增率约 62% (World J Gastroenterol 2007; 13:3605-3609)
分子靶向治疗——困惑的临床
n 理解分子靶点 n 理解疗效与特异性毒性反应 n 药物机理与临床研究结果的解读 n 分子靶向治疗药物的应用实践 n 做到真正的translational research
n指导临床研究设计 n指导临床指南
胃癌靶向治疗
近十年的晚期胃癌临床研究
n MAGIC in NEJM (Cunningham,2006) n TAX 325 in JCO (Eric Van Cutsem,2006) n REAL-2 in NEJM (Cunningham,2008) n ML-17032 in Ann Oncology(Kang,2009) n FLAGS in ASCO GI(Ajani,2009) n ToGA in ASCO (Eric Van Cutsem & Bang,2009) n AVAGAST in ASCO (Kang, 2010) n GRANIT-1 ((Eric Van Cutsem , 2012) n REAL-3 ( Waddell, 2012) n ……
MYC Angiogenesis
MEK MAPK
Cyclin D1
Cyclin D1
Invasion and metastasis
Survival (anti-
apoptosis)
Yarden Y, Sliwkowski MX. Nat Rev Mol Cell Biol 2001;2:127–137; Chakravarti A胃, e癌t a靶l.向C治an疗cer Res 2002;62:4307–4315; Baselga J. Eur J Cancer 2001;37(Suppl. 4):S16–S22; Kawanaka H, et al. Life Sci 2001;69:3019–3033
NS
1.8 mos/ 4 mos --
2 mos/ 5mos
靶向+化疗:成绩较好(Phase 2)
Phase II Study
Regimen
N
Lordick et al.20064
Cetuximab +FUFOX
28
Di Fabio et al.20062
Cetuximab +FOLFIRI
27
Pinto et al. 20063
