抗生素的生物效价测定法(管碟法)
抗生素效价计算过程
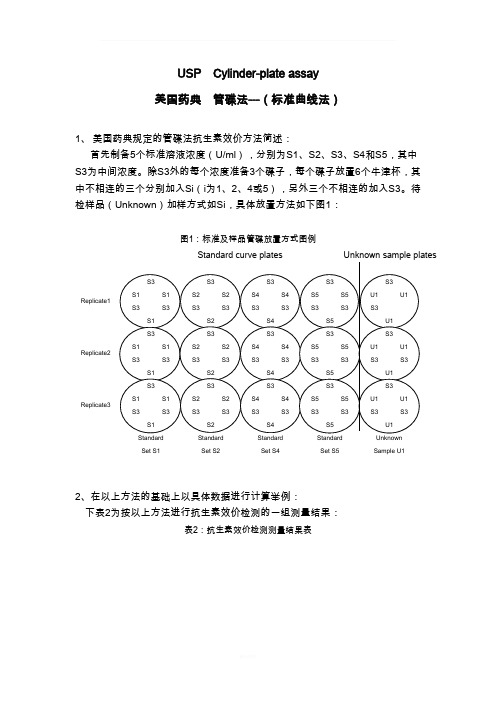
USP Cylinder-plate assay 美国药典 管碟法---(标准曲线法)1、 美国药典规定的管碟法抗生素效价方法简述:首先制备5个标准溶液浓度(U/ml ),分别为S1、S2、S3、S4和S5,其中S3为中间浓度。
除S3外的每个浓度准备3个碟子,每个碟子放置6个牛津杯,其中不相连的三个分别加入Si (i 为1、2、4或5),另外三个不相连的加入S3。
待检样品(Unknown )加样方式如Si ,具体放置方法如下图1:图1:标准及样品管碟放置方式图例2、在以上方法的基础上以具体数据进行计算举例: 下表2为按以上方法进行抗生素效价检测的一组测量结果:表2:抗生素效价检测测量结果表Replicate1Replicate2Replicate3Set S1 Set S2 Set S4 Set S5 Sample U1备注:Zone1、3、5表示每个平皿中不相连的三个S3的直径值;Zone2、4、6表示每个平皿中不相连的三个Si的直径值;U1表示待测样品1。
2.1 进行初始计算:对于每种浓度的三个平板,分别求出得到的9个中间浓度标准品的平均值以及9 个Si和U1直径的平均值。
例如:15.867=(16.1,15.6,15.8,16.0……15.8)9个数据的平均值14.167=(14.6,14.1,13.5,14.5……14.1)9个数据的平均值2.2 变异性的适用性检查:然后求出每三个平板得到的9个数值的标准偏差(包括标准对照和样品的),进而计算出其相对标准偏差值(RSD,该值应不超过10%)。
例如:标准偏差0.200 = s(16.1, . . ., 15.8)相对标准偏差1.3% = (0.200/15.867) *1002.3 进行平板间的差异校正:计算公式如下。
X C = X S– (X R– P)X C = 标准品平均值的校正值X S = 原始的标准品的平均值X R = 对照值的平均值P = 校正值例如:14.022 = 14.167 – (15.867 – 15.722) = 14.167 – 0.1452.4 建立标准曲线:标准曲线由2.3计算的标准品平均值的校正值Xc和标准品浓度值的对数值构成。
抗生素微生物检定管碟法在中国药典2005版的应用及操作要点

抗生素微生物检定法可分为:(1)稀释法;(2)比浊法;(3)琼脂扩散法(管碟法和打孔法)。
各国药典通常采用后两种方法测定抗生素的效价。
管碟法:利用抗生素在摊布特定试验菌的固体培养基内成球面形扩散,形成含一定浓度抗生素球形区,抑制了试验菌的繁殖而呈现出透明的抑菌圈。
此法系根据抗生素在一定浓度范围内,对数剂量与抑菌圈直径(面积)呈直线关系而设计,通过检测抗生素对微生物的抑制作用,比较标准品与供试品产生抑菌圈的大小,计算出供试品的效价。
原理:利用抗生素在固体培养基中的平面扩散作用,依据量反应平行线原理并采用交叉实验设计方法,在相同实验条件下通过比较标准品(已知效价)和供试品两者对所接种试验菌产生的抑菌圈(直径或面积)大小,来测定供试品效价的一种方法。
管碟法的操作步骤:1、预试验:确定最佳的试验条件:调整试验菌的浓度、使用量、抗生素终浓度、培养基等,使抑菌圈的大小符合规定:一剂量法中心点的抑菌圈直径应在16~17.5mm,二剂量法高剂量浓度标准品溶液所致的抑菌圈直径在18~22mm,三剂量法中间剂量浓度标准品溶液所致的抑菌圈直径在15~18mm。
2、试验准备:双碟、钢管、毛细滴管、吸管的清洗及灭菌;容量瓶、定量吸管的清洗;培养基、缓冲液的准备、半无菌间的紫外消毒等。
3、双碟的制备:每只双碟加底层培养基约20ml,待培养基凝固后,将双碟放入35~37℃培养箱中,待用。
4、供试品、标准品溶液的制备:估计供试品的效价,根据试验要求设计供试品、标准品溶液稀释步骤,平行制备供试品、标准品相关剂量的溶液。
5、菌层的制备:注意菌层培养基温度;根据预试验确定加入菌层培养基的菌液量,注意制备菌层的速度和平整度。
6、滴加抗生素溶液:注意标准品、供试品高、低剂量溶液滴加顺序,保证滴加速度和加量的均匀一致。
7、双碟的培养:根据培养温度的要求在培养箱中进行培养,培养箱中水平碟放的双碟数以不超过三层为宜。
8、抑菌圈的测量:抑菌圈测量仪的使用,每组试验双碟应在相同的测量参数下进行测量。
管碟法

实验2 管碟法测定土霉素生物效价一、目的要求1、了解管碟法测定抗生素生物效价的基本原理。
2、学会管碟法测定抗生素效价方法,并学习抗生素发酵过程一些重要生理生化指标分析。
二、基本原理衡量抗生素发酵液中抗菌物质的含量称效价。
抗生素效价测定可采用化学法或生物效价测定法。
抗生素生物检定法是利用抗生素对细菌(或真菌)的杀死或抑制的程度,作为客观指标来衡量维生素中有效成分的效力的一种方法。
此法检测灵敏性高,由微量抗生素即可检出(0.5u/ml)。
因此,微生物检定法被作测定抗生素效价的一种经典方法。
生物效价测定有稀释法、比浊法、扩散法三大类。
管碟法是扩散法的一种。
本实验采用管碟法测定抗生素的效价。
管碟法就是利用有一定体积的不锈钢制的小管(牛津杯),将抗生素溶液装满小杯,在含有敏感试验菌的琼脂培养基上进行扩散渗透,经过一定时间后,抗生素扩散到适当的范围,产生透明的抑菌圈。
抑菌圈的半径与抗生素在管中的总量(单位)、抗生素的扩散系数(cm2/h)、扩散时间(即抗生素溶液注入钢管至出现抑菌圈所需的时间)、培养基的厚度(mm)和最低抑菌浓度(u/ml)等因素有关。
抗生素总量的对数和抑菌圈直径的平方呈直线关系。
因此,抗生素效价可以由抑菌圈的大小来衡量。
将已知效价的土霉素标准液先制成标准曲线,比较已知效价标准液与未知效价的被检品溶液的抑菌圈的大小,就可算出样品中抗生素的效价。
三、实验材料1、培养基(供摊布平板用)蛋白胨6g 酵母膏6g 牛肉膏1.5g 葡萄糖1g 琼脂15—18g蒸馏水1000ml pH:6.8 1.05kg/cm?/SPAN> 121.3?/SPAN>C灭菌20分钟2、菌种:黄色八叠球菌(Sarcina flava)3、土霉素碱标准品4、仪器:玻璃试管、试管架、吸管(1ml,2ml,10ml)、吸耳球、离心管、容量瓶、烧杯、三角瓶(5 00ml)、量筒(250ml,500ml,1000ml)、玻璃棒、温度计、牛津杯、镊子、培养盘、恒温箱、台秤等管碟法测定抗生素效价一、目的和要求1、了解管碟法的原理。
管碟法抗生素效价测量实验

管碟法抗生素效价测量实验抗生素的生物检定是以抗生素对微生物的抗菌效力作为效价的衡量标准,具有与应用原理相一致、用量少和灵敏度高等优点。
管碟法是琼脂扩散法中的一种,已被各国药典广泛采用,作为法定的抗生素生物检定方法。
当抗生素在菌层培养基中扩散时,会形成抗生素浓度由高到低的自然梯度,即扩散中心浓度高而边缘浓度低。
因此,当抗生素浓度达到或高于mic(最低抑制浓度)时,试验菌就被抑制而不能繁殖,从而呈现透明的抑菌圈。
根据扩散定律的推导,抗生素总量的对数值与抑菌圈直径的平方成线性关系。
实验简介在管碟法抗生素效价测量实验中需要注意的影响因素分析及对策如下:管碟法是国内外常用的抗生素微生物检定法[1],利用管碟法测定抗生素效价,具有准确、直观、重复性好等优点,因而被广泛采用。
但是整个试验过程中影响结果的因素很多,任何一个环节操作不当或者忽略就会造成很大误差,导致整组试验失败。
根据实际操作中的积累经验,对管碟法中影响试验结果的因素进行如下分析及提出解决的方法。
实验器材的准备1.1 实验器材的选择试验应该选择底面平整的玻璃双碟,避免底面的凹凸影响琼脂层的厚度。
可将双碟放置在水平台上,下垫一层白纸,加入3mL水,再滴加蓝墨水,根据蓝色是否深浅一致来判断双碟底面平整程度。
小钢管则应该选择加工精细的同一批产品,这样才能保证管壁厚薄与重量均匀一致,使得小钢管在培养基中下陷相同的深度,抗生素溶液扩散均匀有可比性。
如果小钢管两端不够平,就应予剔除,否则会使抗生素溶液漏出,破坏均匀扩散现象。
1.2 实验器材的清洗抗生素试验中,玻璃双碟、小钢管往往会连续使用。
由于清洗方面的原因,它们还是容易残留上次试验中的抗生素(庆大霉素、争光霉素、链霉素等)或者被清洗用的杀菌剂(如新洁而灭、洗洁精、去污粉等)污染,以至于在下次试验中造成抑菌圈不正常的现象。
因此,在清洗时要尤为注意多用流水冲洗。
160℃干热灭菌2h后备用。
配制试验所需的样品及药品2.1 样品与标准品溶液的配制标准品与样品从冰箱取出后,使与室温平衡。
抗生素效价

用管碟法(2.2)法,测定链霉素活菌剂的效价,估计效价为1 000 000 u/g,供试品最终浓度为1.4u/ml 及0.7u/ml。
链霉素的效价测定抗生素微生物检定法本法系在适宜条件下,根据量反应平行线原理设计,通过检测抗生素对微生物的抑制作用,计算抗生素活性(效性)的方法。
抗生素微生物检定包括两种方法,即管碟法和浊度法。
测定结果经计算所得的效价,如低于估计效价的90%或高于估计效价的110%时,应调整其估计效价,重新试验。
除另有规定外,本法的可信限率不得大于5%。
第一法管碟法本法系利用抗生素在琼脂培养基内的扩散作用,比较标准品与供试品两者对接种的试验菌产生抑菌圈的大小,以测定供试品效价的一种方法。
菌悬液的制备枯草芽孢杆菌(Bacillus subtilis)悬液取枯草芽孢杆菌[CMCC(B)63501]的营养琼脂斜面培养物,接种于盛有营养琼脂培养基的培养瓶中,在35~37℃培养7日,用革兰氏染色法涂片镜检,应有芽孢85%以上。
用灭菌水将芽孢洗下,在65℃加热30分钟,备用。
短小芽孢杆菌(Bacillus pumilus)悬液取短小芽孢杆菌[CMCC(B)63202]的营养琼脂斜面培养物,照上述方法制备。
金黄色葡萄球菌(Staphylococcus aureus)悬液取金黄色葡萄球菌[CMCC(B)26003]的营养琼脂斜面培养物,接种于营养琼脂斜面上,在35~37℃培养20~22小时。
临用时,用灭菌水或0.9%灭菌氯化钠溶液将菌苔洗下,备用。
藤黄微球菌(Micrococcus luteus)悬液取藤黄微球菌[CMCC(B)28001]的营养琼脂斜面培养物,接种于盛有营养琼脂培养基的培养瓶中,在26~27℃培养24小时,或采用适当方法制备的菌斜面,用培养基Ⅲ或0.9%灭菌氯化钠溶液将菌苔洗下,备用。
大肠杆菌(Escherichia coli)悬液取大肠杆菌[CMCC(B)44103]的营养琼脂斜面培养物,接种于营养琼脂斜面上,在35~37℃培养20~22小时。
管碟法测定抗生素

管碟法测定抗生素
总结与展望
管碟法是一种经典的抗生素效价测定方法,具有操作简 便、直观等优点,广泛应用于药物研发、生产和质量控 制等领域。然而,随着科学技术的不断进步和新药的不 断涌现,管碟法也面临着一些挑战和改进的空间。未来 ,可以通过改进实验条件、优化操作流程和提高数据分 析能力等方式,进一步提高管碟法的准确性和可靠性, 为抗生素的研究和应用提供更加准确可靠的依据
操作规范:实验过程中应严格遵守无菌操作规范, 避免杂菌污染干扰 数据分析:在数据分析过程中,应采用适当的统计 方法对实验数据进行处理和分析,以获得准确可靠 的实验结果
管碟法测定抗生素
管碟法测定抗生素的优缺点
优点:(1)操作简便、直观,可快速获得实验结果; (2)适用于多种抗生素的效价测定,具有较好的通用 性;(3)可同时比较不同抗生素的ຫໍສະໝຸດ 菌效果,方便进 行药物筛选和质量控制
-
管碟法测定抗生素
A
管碟法是一种常用的抗生素效价测
定方法,其原理是将抗生素溶液置
于含有敏感菌的培养基中,通过测
定抗生素的抑菌圈大小来确定其效
价
B
下面将对管碟法测定抗生素的步骤 、注意事项和优缺点进行详细介绍
管碟法测定抗生素
管碟法测定抗生素的步骤
培养基制备:将基础培养基加热溶解,灭菌后冷却至50℃左右,加入适量敏感菌悬液 ,摇匀后倒入无菌培养皿中,待凝固后备用 抗生素溶液制备:将待测抗生素溶解于适宜溶剂中,制备成不同浓度的溶液 放置管碟:在培养皿上放置无菌管碟,轻轻按压使管底与培养基紧密接触 滴加抗生素溶液:用微量移液器将不同浓度的抗生素溶液滴加到管碟上,每个浓度至 少做3个平行试验 培养:将培养皿放入恒温培养箱中培养一定时间(一般为16-24小时),使敏感菌在培养 基上生长
管碟法测定抗生素效价详解

管碟法的操作步骤
预试验→试验准备→ 双碟底层的制备→
供试品、标准品溶液的制备→菌层的制备
→滴加抗生素溶液→双碟的培养→ 抑菌圈
的测量→结果的可靠性检验及效价测定
• 预试验:
确定最佳的试验条件:调整试验菌的浓度、 使用量、抗生素终浓度、培养基等,使抑 菌圈的大小符合规定:高剂量浓度溶液所 致的抑菌圈直径在18~22mm。高剂量与 低剂量的抑菌圈直径之差最好不小于2mm。 高低剂量之比为2:1(如高、低剂量所致的 抑菌圈差别较小时,可用4:1的剂量比率)。
• 试验准备: 双碟、钢管、毛细滴管、吸管的清洗及灭 菌;容量瓶、定量吸管的清洗;培养基、 缓冲液的准备、半无菌间的紫外消毒等。
• 供试品、标准品溶液的制备: 估计供试品的效价,根据试验要求设计供 试品、标准品溶液稀释步骤,平行制备供 试品、标准品相关剂量的溶液。
1. 称量 称量前,将标准品从冰箱取出,使与温室平衡; 供试品应放于干燥器内至少30min方可称取。供试品与标准品 应用同一天平;吸湿性较强的抗生素,在称量前1~2 h更换 天平内干燥剂。标准品与供试品的称量最好一次取样称取, 不得将已取出的标准品或供试品倒回原容器内,标准品称量 不可少于 20mg,取样后立即将称量瓶及被称物盖好,以免吸 水。样品的称样量最好不少于50mg。
一、试验前准备
• 双碟的挑选
内径约90mm,硬质玻璃或 塑料培养平皿,水平透明, 无色斑气泡
• 物品的清洗、灭菌
培养皿、钢管、刻度吸管清 洗后160℃干热灭菌2小时或 121℃高压蒸汽灭菌30min, 放置室温备用;陶瓷瓦盖要 定期清洗干燥。
牛津杯的挑选
内径(6.0±0.1)mm,高 (10.0±0.1)mm,外径 (7.8±0.1)菌的来源:检定菌种由中监所所提 供的冷冻干燥品。 检定菌的传代和接种: 芽胞杆菌3~6个月(其他细菌每个月) 用普通琼脂斜面传代1次,将新传代的培养物 代替原有的菌种,作为工作用(阳性对照)菌 种。传代和接种在菌种接种室内按无菌操作要 求进行。
管碟法测定抗生素效价

• 抑菌圈的测量:
将培养好的双碟取出,打开陶瓦盖,将钢 管倒入1:1000新洁尔灭溶液或其他消毒液 内浸泡,检查抑菌圈是否圆整,如有破圈 或不圆整圈应将碟弃去,切忌主观挑选抑 菌圈和双碟,是结果造成偏离。
抑菌圈测量仪的使用:每组试验双碟应在 相同的测量参数下进行测量。
• 结果的可靠性检验及效价测定:
冷冻菌种安瓶的接种。
•
用75%酒精棉擦净菌种安瓿的外壁,
稍干。 点燃酒精灯,将安瓿的封口,一端
在火焰上烧灼红热用毛细管吸取灭菌水少许
在灼热处,使其骤冷而炸裂,另取1支灭菌
毛细滴管,在火焰旁吸取少量灭菌水,加至
菌种管底部,将冻干菌块搅动促使溶解,随
即吸出管内菌液,分别接种至营养琼脂斜面,
将营养琼脂斜面琼脂斜面于37℃恒温培养24
一、试验前准备
• 双碟的挑选
内径约90mm,硬质玻璃或 塑料培养平皿,水平透明, 无色斑气泡
• 物品的清洗、灭菌
培养皿、钢管、刻度吸管清 洗后160℃干热灭菌2小时或 121℃高压蒸汽灭菌30min, 放置室温备用;陶瓷瓦盖要 定期清洗干燥。
牛津杯的挑选
内径(6.0±0.1)mm,高 (10.0±0.1)mm,外径 (7.8±0.1)mm,重量差异不超 过±0.01g,光洁平坦
小时。
管碟法的操作步骤
预试验→试验准备→ 双碟底层的制备→ 供试品、标准品溶液的制备→菌层的制备 →滴加抗生素溶液→双碟的培养→ 抑菌圈 的测量→结果的可靠性检验及效价测定
• 预试验:
确定最佳的试验条件:调整试验菌的浓度、 使用量、抗生素终浓度、培养基等,使抑 菌圈的大小符合规定:高剂量浓度溶液所 致的抑菌圈直径在18~22mm。高剂量与 低剂量的抑菌圈直径之差最好不小于2mm。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
抗生素的生物效价测定法测定抗生素效价的方法比较多,一般可以分为物理学方法、化学方法、生物学方法、和两种方法配合等四大类,可根据具体情况选择使用。
生物学方法以抗生素的杀菌力作为衡量效价的标准,其原理恰好和临床应用于的要求一致这是它的优点;又其灵敏度较高,需用检品的量较小,也是其它方法所不及的。
抗生素的生物效价测定法,常用的有稀释法、比浊法和扩散法(或称渗透法)。
稀释法这一方法是用培养基将检品抗生素稀释到各种浓度,并依次分装到一系列的容器内,再加入等量“试验菌种”菌种菌液,并放在37 ℃保温箱内培养一定时间,观察何种稀释度适能抑制细菌的生长,该稀释度即为测定终点(或以细菌生长所引起的PH改变及溶血现象等生化反应作为测定终点),再与同样处理的标准抗生素的终点作比较,即可求得检品的效价。
这种方法可以使用液体培养基,也可以使用固体培养基。
所用的材料及培养基都必须严格无菌,并要注意无菌操作。
由于测定终点是以有无细菌生长来判断的,因此所得结果公是一个范围。
比浊法原理及操作大致与稀释法相同。
比浊法也是将不同量的检品及标准品分别加入培养基中,观察其对“试验菌种”的效应——即细菌生长所引起的混浊。
这一方法和稀释法的区别有二:a.比浊法的稀释间隔的密度比较近,准确度高一些;b.比浊法不以细菌有无生长的区分为终点,而是将标准品浓度和细菌生长所引起的混浊度求得一定的比例,再由检品的细菌生长混浊度推算检品的效价。
这一方法易受杂质的影响,并且不适用于有色或混浊的检品。
扩散法使用固体培养基,在培养基凝固以前将“试验菌种”混合进去,在这样备妥的培养表面,可以用种种设计使检品液或含有抗生素的物质与有菌种的培养基接触。
经过培育后,由于抗生素向培养基中扩散,凡抑菌浓度所能达到之下细菌不能生长因而形成透明的抑菌范围,此种范围一般都呈圆形,称为“抑菌圈”。
扩散法有几种,或中一种叫管碟扩散法(筒称管碟法)为国际上常用的方法,在我国也作为法定的抗生素检定法。
下面我们将详细地讨论管碟法的原理和实验方法。
一、:二、管碟法测定的设计原理及计算方法管碟法所用的管子系用瓷、铝或玻璃制成,较好的用不锈钢制成,它是内径为6+毫米、外径为8+毫米、高10+毫米的圆筒形管子,管子的重量尽可能相等。
摊布固体培养基的容器可用双碟,亦可用平底下班盘。
管子放在混有菌种的固体培养基上时,可用人工放置,也可用特定的管子放置器放置。
操作步骤,一般是将固体培养基放在水浴上融化,倒在双碟上,待其凝固,然后在上面再倒一层混有菌种融化培养基。
待菌层培养基凝固后,在表面上放置管子,向管子中加满抗生素的稀释液,在37℃培养16~18小时,然后量取抑菌圈并进行计算。
(一)抑菌圈的形式小管中的抗生素向培养基中扩散(呈球面扩散),在此同时试验菌也开始生长。
抗生素浓度高于抑菌浓度之处试验菌不长,因此出现抑菌圈,其圈之边缘处恰好为抗生素的最低抑菌浓度。
抑菌圈的半径(r)与下列因素有关:(1)抗生素在管中的量(M);(2)抗生素的扩散系数(D);(3)细菌生长达到肉眼可见的时间(T);(4)培养基的厚度(H)。
其中的定量关系可用分子扩散定律来推导,得到如下所示的公式:logM= (1/r2+ log(C·ЛTH)(11-1)式中 D ——扩散系数,毫米2/小时;—T ——抗生素扩散时间(接近细菌生长到肉眼可见的时间),小时;M ——在管中抗生素总量,单位;r ——管中心到抑菌圈边缘的距离,毫米;L ——管的高度,毫米;H ——培养基的厚度,毫米;C ——最低抑菌浓度,单位/毫米。
由于此公式相当于直线方程式(y=ax+b),(logM相当于y,1/相当于斜率a,log(C·4πDTH)相当于截矩b),因此设logM为纵标,r2为横坐标时可得截矩为log(C·4πDTH),斜率为1/的直线。
(二)测定设计原理与计算公式由公式可知logM与r2成直线关系,即抗生素总量的对数值与抑菌圈半径的平方值成直线关系,因此抗生素的量可从抑菌圈大小来推算。
这就是说,抗生素总量的多少受最低抑菌浓度(C)、培养基厚度(H)、扩散系数(D)、和细菌生长时间(T)的影响,例如培养基厚度减少到H/2时则抑菌圈增大,可计算如下:…培养基厚度为H时logM= (1/r2+ log(C·4πDTH)培养基厚度为H/2时logM= (1/r2+ log(C·4πDTH/2)两式相减,化简可得:r12=·log2+r2由于πDT)为斜率的倒数、r2为原抑菌圈半径的平方值,均为已知,则增大的圈(r1)即可算出。
同理,若知细菌最低抑菌一半时,则抑菌圈的半径(r2)也将增大:¥r22=log2+r2从上可知,抗生素总量的对数值与抑菌圈的平方成直线关系,因此可作定量测定。
但由于抑菌圈的大小还受C、H、D、T的影响,所以应消除这些影响才能准确测定。
要消除这些影响,可用标准品同时对照测定(即所谓相对效价设计法),计算方法如下。
设:标准品的高单位抑菌圈为S H标准品的低单位抑菌圈为S L样品高单位的抑菌圈为U H样品低单位的抑菌圈为U L则小管听标准品总量(M)与样品总量(M’)分别为:&因log(C·4πDTH)为截距,在同一双碟上其数值是相等的,因此两者相减,它就被消去了。
因(1/)为直线的斜率,所以样品与标准品的效价比即等于斜率乘样品的抑菌圈的平方值与标准品抑菌圈平方值之差数。
此即管碟法的标准曲线法的基础,如要消除斜率(1/)的影响,可用二剂量法,即标准品用二剂量(S H及S L),样品也用二剂量(U H及U L)代入公式并计算之,即可消除斜率的影响。
计算方法如下:在这个分式中无斜率因素,即在样品与标推品对比测定时斜率可被消除。
此即为管碟法的二剂量法的计算公式(应用详见二剂量法)。
由于(U H)2、(S H)2、(U T)2、(S T)2计算太麻烦,经实验证明也可近似地用(U H)、(S H)、(U T)、(S T)来代替。
(三)图解法计算原理及作计算图的方法管碟测定时常用图解法来计算结果。
用图解法计算结果就是把公式用图来表示,其原理如下:-即当V=ob、W=ab及logK=cd时,则(即od线段表示效对数值).在方格纸上在W坐标上取logK×100值(例如logK为log2时,其值为×100),平行于V坐标划一平行线。
然后在此线段上取×100介于,此点b值即为效价101%值。
因log(101%)为,为了便于划线,故乘100。
同理C点为效价102%值,d点为99%值,依此类推。
为了便于观察,也可延长ob或oc或od线段把效价值表示在图的上方。
如此可作成一放射图形。
当logK=log4时,同理可在W坐标上取log4×100值,然后平行于V划平行线,取×100点,即为效价101%值,取×100点,即为102%,依此类推,也同样可能表示在图表的上方,成放射图形(图11-3).当K=4时,二剂量效价计算放射图见(11-4).三、管碟法的实验设计方法根据上述原理,可知效价的对数值与抑菌圈关径的平方值(抑菌圈直径)成直线关系,其直级方程式为logy=ax+b.当与标准品对照测定时,b可消除成为logθ=a(x-x’),也即效价的对数值等于斜率乘样品与标准品的抑菌圈差数,可以此作为标准曲线法测定效价。
当样品与标准品各用二剂量对比测定时,则斜率因数也可以消除,成为logθ=V/W×logK而求得效价比值(θ)。
现将此两种方法分述于下。
(一)>(二)标准曲线法材料双碟直径为90毫米;不锈钢小管外径为8+0、1毫米,内径为6+0、1毫米,高为10+毫米。
钢管重量差异不得相差+克。
培养基各种抗生素测定效价所用的培养基不完全相同,《中国药典》中均有规定。
菌种各种抗生素测定效价所用的菌种也不完全相同,《中国药典》中均有规定。
标准品由药品生物制品检定所统一分发。
每一种抗生素标准品的单位也由该所规定一般都以容易精制达到高纯度的衍生物作为标准品。
例如青霉素以青霉素G钠盐作为标准品;链霉素以链霉素盐酸盐的氯化钙复盐作为标准品;卡那霉素以含一分子结晶水的一硫酸卡那霉素作为标准品等。
当然如抗生素本身能达到较高纯度,就即可以作为标准品,如制霉菌素等。
方法在双碟上量入加热融化的底层培养基21毫升,并在碟底平均摊布,放置使其凝固,即为底层。
另取上层培养基加热融化后,冷到50℃加入适量菌液,摇匀后,于每碟中各加4毫升,使在底层上平均摊布,即为菌层。
冷却后,适当安置小管六枚,用陶瓦盖覆盖备用。
标准曲线的制法用缓冲液(各种抗生素所用缓冲液不完全相同)将标准品稀释为多种浓度,在备妥之双碟上各放适度间隔六枚小管,三枚装中心点浓度之标准液,另三枚空间管,使装液管与空间管互相间隔,以三碟为一组,在三个双碟的九个空间管中各装入一种浓度的标准液,其它浓度的标准液也如此装入。
培养后量取抑菌圈之直径,求取每组三碟的中心点浓度的抑菌圈直径平均值、各组抑菌圈直径的平均值和所有中心点浓度的抑菌圈直径的平均值。
依下法求得各种浓度之坐标,试以某一浓度的坐标为例:设中心点浓度的所有直径平均值为20毫米,而某一组碟中心点浓度的九个抑菌圈直径平均为毫米,则=,即为“更正数”;若某一浓度之九个直径平均为毫米,则+=毫米作为某一浓度之坐标值。
依同法求得各种浓度之数值后,取双周半对数图纸,以浓度为纵坐标,将各点贯串即成标准曲线,在应用时取直线范围内的各点。
样品效价的求法先估计效价。
按估计效价用缓冲液稀释到与标准液的中心点相同的浓度。
在备妥已放六枚小管之双碟上装满其中三管,另三管装满中心点浓度的标准液,令样品与标准液互相间隔。
共用三碟。
装妥后全部放入培养,然后量取抑菌圈直径,求9个标准液抑菌圈直径的平均值及9个样品液抑菌圈的平均值。
同样找出“更正数”,将样品抑菌圈直径的平均值进行校正,即自标准曲线读取样品的单位。
)为了精确起见,也可用公式计算。
设样品的直线关系为logy’=ax’+b;标准品的直线关系为logy=ax+b,则两式相减即得:log(y’/y)=a(x’-x)即log效价=(斜率)×(样品抑菌圈直径-标准品抑菌圈直径)在上式中,只要斜率已知,则log效价即可求出。
斜率可从标准曲线上直接用量角仪量出直线的倾角,其正切即为斜率。
(三)二剂量法(即四点法)材料培养基、菌种、标准品及双碟制备同标准曲线法。
方法取备妥的双碟四点,各于碟底用蜡笔作S H、S L、U H及U L四个标志。
将标准液稀释为每毫升含某一浓度(此浓度应取在标准曲线的直线范围内),及为浓度1/3或1/4的浓度(均应取在标准曲线的直线范围内)。
