离子化合物与共价化合物判断
常见共价化合物和离子化合物

常见共价化合物和离子化合物1. 前言大家好,今天我们来聊聊化合物,特别是共价化合物和离子化合物。
别担心,不会讲得太深奥,咱们轻轻松松地聊聊这些化学小知识,就像和朋友喝茶一样,轻松又愉快!你知道吗,化合物就像一个个家庭,各种元素相聚在一起,形成了不同的化学“家族”。
今天,我们就来看看这两个大家族的有趣之处。
2. 共价化合物2.1 什么是共价化合物?首先,让我们从共价化合物开始说起。
共价化合物就像是两个好朋友,共同分享一块巧克力。
它们通过“共享”电子,形成了牢不可破的联系。
这种联系就叫做共价键。
举个例子,水(H₂O)就是个典型的共价化合物。
两个氢原子和一个氧原子紧紧握住彼此的手,共同“游泳”在液体的世界里。
2.2 共价化合物的特点共价化合物的特点嘛,首先它们通常有比较低的熔点和沸点,这就像你去海滩玩的时候,太阳一照,冰淇淋就融化了,没啥阻挡力。
另外,很多共价化合物在水中不容易溶解,像是那些个性张扬的明星,宁愿在台上发光发热,也不想被藏起来。
不过,它们在有机溶剂中常常能找到“同道中人”,这就好比朋友聚会,大家一起嗨起来!3. 离子化合物3.1 什么是离子化合物?接下来,咱们聊聊离子化合物。
离子化合物就像是个大家庭,大家都是通过“传递”电子来建立联系的。
这里的电子不是分享,而是“一方把电子给了另一方”,形成了正负电荷的相互吸引。
典型的离子化合物就是食盐(NaCl),钠离子和氯离子就像两个互补的拼图块,完美契合,紧紧抱在一起。
3.2 离子化合物的特点离子化合物的熔点和沸点通常比较高,简直就像个坚韧的小战士,打不倒的感觉。
还有,离子化合物在水中通常是溶解的,形成导电的溶液,就像给电路开了个大门,电流畅通无阻。
这就是为什么咱们喝盐水时,能感觉到那种“咸”的滋味——盐溶解后变成了离子,给水增添了风味。
4. 共价与离子的比较4.1 相同之处说了这么多,共价化合物和离子化合物其实有不少共同点。
首先,它们都是由元素构成的,都是化学反应的产物;再者,它们都能形成各种不同的物质,各有千秋,像是不同的表演者,在舞台上展现自己的魅力。
离子键共价键的判断方法

离子键共价键的判断方法离子键和共价键是化学中常见的两种键类型。
离子键是由阳离子和阴离子之间的电荷相互吸引形成的,而共价键是由原子间的电子共享形成的。
判断一个化合物中是离子键还是共价键,可以通过以下几种方法。
1. 考虑元素的电负性差异。
电负性是一个元素吸引和保持共用电子对的能力。
一般来说,电负性差异大于 1.7的元素之间往往形成离子键,而差异小于1.7的元素之间则往往形成共价键。
例如,氯(Cl)和钠(Na)之间的电负性差异较大,因此氯化钠(NaCl)中存在离子键。
而氧(O)和氢(H)之间的电负性差异较小,因此水(H2O)中存在共价键。
2. 观察化合物的结构。
离子键通常形成晶体结构,而共价键通常形成分子结构。
晶体结构中的阳离子和阴离子排列有序,呈现规则的几何形状。
而分子结构中的原子通过共用电子对连接在一起,没有明显的有序排列。
例如,氯化钠(NaCl)的晶体结构呈现六方密堆积的几何形状,而水(H2O)则是以分子形式存在,没有明显的有序排列。
3. 考虑化合物的性质。
离子键通常导致化合物具有高熔点和高沸点,以及良好的电导性。
这是因为离子键中的阴阳离子之间的电荷相互吸引力较强,需要较高的能量才能破坏晶格结构。
同时,离子在熔融态或溶液中能够自由移动,导致离子化合物具有良好的电导性。
而共价键通常导致化合物具有较低的熔点和沸点,以及较差的电导性。
这是因为共价键中原子之间的电子共享较强,需要较少的能量才能破坏共价键。
同时,共价键中的电子不易移动,导致共价化合物通常不导电。
4. 分析化合物中的键长和键能。
离子键通常具有较长的键长和较大的键能,而共价键通常具有较短的键长和较小的键能。
这是因为离子键中的正负离子之间的电荷相互吸引力较强,需要较长的键长和较大的键能才能保持稳定。
而共价键中原子间的电子云重叠较强,电子云之间的相互排斥力较大,导致较短的键长和较小的键能。
可以通过考虑元素的电负性差异、观察化合物的结构、分析化合物的性质以及分析化合物中的键长和键能等方法来判断一个化合物中是离子键还是共价键。
离子键和共价键的区分
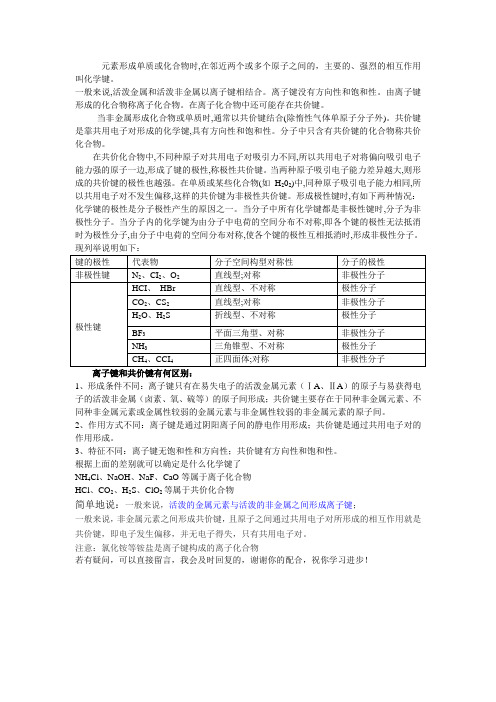
元素形成单质或化合物时,在邻近两个或多个原子之间的,主要的、强烈的相互作用叫化学键。
一般来说,活泼金属和活泼非金属以离子键相结合。
离子键没有方向性和饱和性。
由离子键形成的化合物称离子化合物。
在离子化合物中还可能存在共价键。
当非金属形成化合物或单质时,通常以共价键结合(除惰性气体单原子分子外)。
共价键是靠共用电子对形成的化学键,具有方向性和饱和性。
分子中只含有共价键的化合物称共价化合物。
在共价化合物中,不同种原子对共用电子对吸引力不同,所以共用电子对将偏向吸引电子能力强的原子一边,形成了键的极性,称极性共价键。
当两种原子吸引电子能力差异越大,则形成的共价键的极性也越强。
在单质或某些化合物(如H202)中,同种原子吸引电子能力相同,所以共用电子对不发生偏移,这样的共价键为非极性共价键。
形成极性键时,有如下两种情况:化学键的极性是分子极性产生的原因之一。
当分子中所有化学键都是非极性键时,分子为非极性分子。
当分子内的化学键为由分子中电荷的空间分布不对称,即各个键的极性无法抵消时为极性分子,由分子中电荷的空间分布对称,使各个键的极性互相抵消时,形成非极性分子。
离子键和共价键有何区别:1、形成条件不同:离子键只有在易失电子的活泼金属元素(ⅠA、ⅡA)的原子与易获得电子的活泼非金属(卤素、氧、硫等)的原子间形成;共价键主要存在于同种非金属元素、不同种非金属元素或金属性较弱的金属元素与非金属性较弱的非金属元素的原子间。
2、作用方式不同:离子键是通过阴阳离子间的静电作用形成;共价键是通过共用电子对的作用形成。
3、特征不同:离子键无饱和性和方向性;共价键有方向性和饱和性。
根据上面的差别就可以确定是什么化学键了NH4Cl、NaOH、NaF、CaO等属于离子化合物HCl、CO2、H2S、ClO2等属于共价化合物简单地说:一般来说,活泼的金属元素与活泼的非金属之间形成离子键;一般来说,非金属元素之间形成共价键,且原子之间通过共用电子对所形成的相互作用就是共价键,即电子发生偏移,并无电子得失,只有共用电子对。
共价化合物和离子化合物的区分

共价化合物和离子化合物的区分
共价化合物和离子化合物可以通过以下方面进行区分:
1.元素性质:共价化合物主要由非金属元素组成,如氢、氧、碳等,
这些元素之间通过共用电子对形成稳定结构。
而离子化合物则主要由金属元素和非金属元素组成,其中金属元素失去电子形成阳离子,非金属元素得到电子形成阴离子,这些离子之间通过静电作用相互吸引形成化合物。
2.化学键类型:共价化合物中的原子之间通过共用电子对形成共价
键,因此共价化合物具有分子结构。
而离子化合物中的离子之间通过离子键相互连接,形成离子晶体,没有独立的结构。
3.物理性质:共价化合物多为分子晶体,熔沸点较低,硬度较小,
分子间作用力较小,因此在常温常压下容易扩散,形成气体或液体。
而离子化合物多为离子晶体,熔沸点较高,硬度较大,离子间作用力较大,因此在常温常压下形成固体。
4.导电性:离子化合物都是电解质,且在水溶液和熔融状态下都可
以导电。
而共价化合物不都是电解质,若为电解质,在熔融状态下不可导电。
离子化合物和共价化合物

离子化合物和共价化合物离子化合物和共价化合物是化学中常见的两类物质,也是很多学生比较关心的课题。
在继续深入学习前,让我们先了解一下它们的基本概念。
离子化合物是一种由电荷不同的离子组成的物质,它的形成主要取决于离子的电荷亲和力,因此会有较大的离子电荷差才能形成离子化合物。
常见的离子化合物有金属氯化物、硫酸盐、硝酸盐和氯化物等。
离子化合物具有稳定的机械强度,相对熔点低,是常见的溶解剂。
共价化合物是一种由原子以共价键连接而成的物质。
原子之间的共价键受电子的共享作用而形成,原子之间的共价键是极其稳定的,因此共价化合物的稳定性相对较高,能够很好地抵抗温度的变化,有的共价化合物的熔点甚至能达到千分之一摄氏度,其中比较常见的共价化合物有水、空气、醇类以及许多有机化合物等。
一般而言,离子化合物和共价化合物在表面特性和用途上都有一定的差异。
首先,离子化合物的溶解度较高,容易溶于水,因此有着更广泛的应用,常用于生产制药、清洁剂等。
而共价化合物的分子量较大,溶解度较低,因此主要用于除去水中的有机物,或者作为催化剂等。
此外,离子化合物在形成的时候容易产生较大的能量,而共价化合物在形成的时候则要求较低的能量,因此两者的化学性质也存在较大的差异。
离子化合物主要是通过金属的氯化反应产生的,而共价化合物则主要与金属无关,是由有机物产生的,它们之间的化学反应也是由这一点引起的。
此外,由于离子化合物和共价化合物的形成机理不同,因此在国际上有独立的标准,根据这些标准来评价它们的质量,以便保证我们的使用安全。
以上就是关于离子化合物和共价化合物的一些基本知识,作为化学的一种基本概念,它们在化学方面的应用非常广泛,非常重要。
熟悉这些基本概念与技术能力,能为我们在以后的发展积累能力,为我们的实验和研究工作提供基础。
共价化合物、离子化合物

金属与非金属形成共价化合物AlCl3,AlBr3,AlI3,FeCl3,FeBr3,AuCl3,HgCl2,Hg2Cl2,醋酸铅,Mn2O7从规律上来说,除了铵盐,金属和非金属结合形成的化合物是离子化合物,但要记住几个特殊的。
三氧化二铝,三氧化二铍,氮化铝,是原子晶体,就是原子之间全部以共价键结合,是共价化合物。
金属晶体,原子晶体,分子晶体,离子晶体。
金属晶体和分子晶体你能找到吧,所以,如果不是原子晶体(原子晶体是共价化合物),那肯定就是离子晶体。
高中阶段的原子晶体有:晶体硼,晶体硅,晶体锗,金刚石,碳化硅,氮化硼,氮化铝,氮化硅,氧化铝,二氧化硅,离子化合物由阳离子和阴离子构成的化合物。
活泼金属(如钠、钾、钙、镁等)与活泼非金属(如氟、氯、氧、硫等)相互化合时,活泼金属失去电子形成带正电荷的阳离子(如Na+、K+、Ca2+、Mg2+等),活泼非金属得到电子形成带负电荷的阴离子(如F-、Cl-、O2-、S2-等),阳离子和阴离子靠静电作用形成了离子化合物。
例如,氯化钠即是由带正电的钠离子(Na+)和带负电的氯离子(Cl-)构成的离子化合物。
也有的是共价化合物。
许多碱(如NaOH、KOH、Ba(OH)2等)和盐(如CaCl2、KNO3、CuSO4 等)都是离子化合物。
在离子化合物里阳离子所带的正电荷总数等于阴离子所带的负电荷总数,整个化合物呈电中性。
多数离子化合物在固态(或晶态)时不能导电,而它的水溶液或熔融状态则能导电。
离子化合物一般说来,熔点和沸点较高,硬度较大,质脆,难于压缩,难挥发。
某些碱性氧化物,如Na2O、K2O,常见的盐类如NaCl、KF,常见的碱,如NaOH等都属于离子化合物。
常见的离子化合物常见的离子化合物:NaCl,CsCl,Na2O2,NH4Cl酸碱,以及大多数的盐~!并不是所有的碱盐!存在形式离子化合物(ionic compound)是存在于: 1、活泼金属(指第一和第二主族的金属元素)与活泼的非金属元素(指第六和第七主族的元素)之间形成的化合物(但也不全是,比如AlCl3就是共价化合物);2、金属元素与酸根离子之间形成的化合物。
离子化合物和共价化合物的区别和举例说明
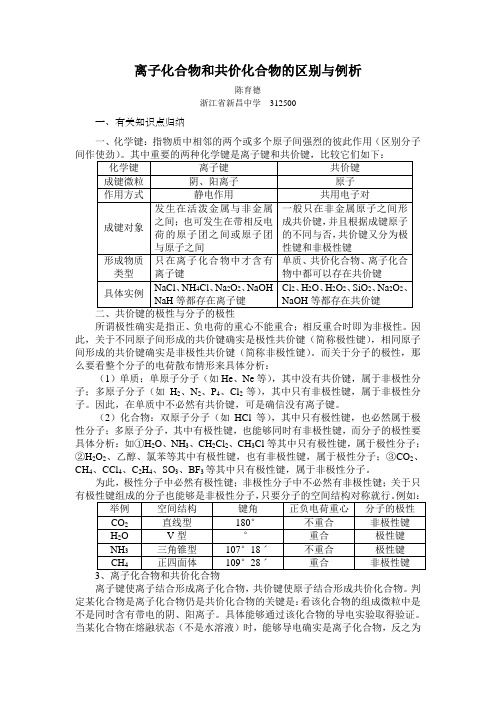
离子化合物和共价化合物的区别与例析陈育德浙江省新昌中学312500一、有关知识点归纳一、化学键:指物质中相邻的两个或多个原子间强烈的彼此作用(区别分子所谓极性确实是指正、负电荷的重心不能重合;相反重合时即为非极性。
因此,关于不同原子间形成的共价键确实是极性共价键(简称极性键),相同原子间形成的共价键确实是非极性共价键(简称非极性键)。
而关于分子的极性,那么要看整个分子的电荷散布情形来具体分析:(1)单质:单原子分子(如He、Ne等),其中没有共价键,属于非极性分子;多原子分子(如H2、N2、P4、Cl2等),其中只有非极性键,属于非极性分子。
因此,在单质中不必然有共价键,可是确信没有离子键。
(2)化合物:双原子分子(如HCl等),其中只有极性键,也必然属于极性分子;多原子分子,其中有极性键,也能够同时有非极性键,而分子的极性要具体分析:如①H2O、NH3、CH2Cl2、CH3Cl等其中只有极性键,属于极性分子;②H2O2、乙醇、氯苯等其中有极性键,也有非极性键,属于极性分子;③CO2、CH4、CCl4、C2H4、SO3、BF3等其中只有极性键,属于非极性分子。
为此,极性分子中必然有极性键;非极性分子中不必然有非极性键;关于只离子键使离子结合形成离子化合物,共价键使原子结合形成共价化合物。
判定某化合物是离子化合物仍是共价化合物的关键是:看该化合物的组成微粒中是不是同时含有带电的阴、阳离子。
具体能够通过该化合物的导电实验取得验证。
当某化合物在熔融状态(不是水溶液)时,能够导电确实是离子化合物,反之为共价化合物。
因为,熔融状态下,离子化合物中的离子键被破坏,从而使阴、阳离子自由运动,在通电时表现导电。
而共价化合物在熔融状态下仍然没有离子,不能导电。
可是,在水溶液的条件下,许多共价化合物也能够发生电离而表现导电。
(1)离子化合物中不必然有金属元素,如铵盐(NH 4Cl 、NH 4H 等),组成上没有金属元素,可是存在离子键,属于离子化合物。
离子化合物和共价化合物判断方法

离子化合物和共价化合物判断方法离子化合物和共价化合物判断方法
1、本质区别是熔融状态下是否导电,所以熔融状态下不能导电的是共价化合物,
2、能导电的是离子化合物。
3、从元素组成上区别:含有铵根的化合物一定是离子化合物,
4、氯化铝是共价化合物。
所有不含金属元素也不含铵根离子的所有化合物是共价化合物。
5、第一、二主族金属元素与第六、七主族非金属元素的化合物是离子化合物.
6、钾钠铵钙镁盐、金属元素与酸根离子(如硫酸跟离子、硝酸跟离子、碳酸跟离子)之间形成的盐等大多数盐是离子化合物(除了AlCl3、HgCl2、 ZnCl2、BeCl2等),
7、从物质类别上区别:强碱是离子化合物, 活泼金属过氧化物是离子化合物活泼金属氧化物。
8、不同种非金属元素的原子结合成的化合物(CO2、ClO2、B2H6、BF3、NCl3等)是共价化合物 *大多有机化合物(如醋酸铅)共价化合物 *少数盐(AlCl3、HgCl2、 ZnCl2、BeCl2等)、酸、弱碱、水是共价化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
By粟米
一.定义 • 1.离子化合物是由阳离子和阴离子构 成的化合物。 • 2.共价化合物是原子间以共用电子对 所组成的化合物。
二.离子化合物与共价化合物的判断
1.一般含有金属元素或铵根的化合物是离子 化合物。(除AlCl3、FeCl3和弱碱外) 2.离子化合物在熔融状态下可导电,而共价 化合物在熔融状态下不可导电。 3.离子化合物熔沸点较高,共价化合物熔沸 点较低。
【例题】
1.下列化合物:H2O、H2O2、Ca(OH)2 、 Na2O、Na2O2 、I2 、NH4NO3 、NaOH 中, 属于共价化合物的是 ,属于 离子化合物的_____________ 2.下列物质中,含有离子键的是( ) A.AlCl3 B.H2O2 C.K2O D.
