离子键与共价键的对比
化学键共价键与离子键的区别与联系

化学键共价键与离子键的区别与联系化学键是连接原子的力,它们可以通过共价键或离子键形成。
共价键和离子键是两种不同类型的键,具有不同的性质和特点。
本文将探讨共价键和离子键的区别与联系。
一、共价键的特点共价键是由两个非金属原子以共享电子对的形式形成的化学键。
在共价键中,原子通过共享外层电子,以使每个原子都能达到稳定的电子层结构。
以下是共价键的一些特点:1. 共享电子对:在共价键中,两个原子共同占据外层电子对,以达到稳定的原子构型。
这种共享是由于原子之间的相互作用力。
2. 非金属元素:共价键通常形成于非金属元素之间,因为非金属元素通常具有较高的电负性。
3. 共价键的性质:共价键具有较强的原子间相互吸引力,但它们没有明确的正负电荷。
共价键通常在分子中形成,这种形式的化学键使分子保持结构稳定。
二、离子键的特点离子键是由阳离子和阴离子之间的电荷相互吸引力形成的化学键。
在离子键中,金属和非金属元素通过转移电子而形成离子结构。
以下是离子键的一些特点:1. 电荷转移:在离子键中,金属原子失去电子形成阳离子,而非金属原子获得这些电子形成阴离子。
这种电荷转移产生了电荷不平衡,从而形成离子键。
2. 电荷吸引:阳离子和阴离子之间的电荷相互吸引力非常强大,这种相互作用力使得离子键非常稳定。
3. 结晶格排列:离子键在晶体中排列成覆盖面积广泛的结晶格。
这种有序排列使得离子化合物形成固体晶体。
三、共价键和离子键的区别与联系尽管共价键和离子键是不同类型的化学键,但它们在某些方面存在联系,同时在其他方面存在差异。
下面是它们的区别与联系:1. 形成方式:共价键是通过共享电子对形成的,而离子键是通过电荷相互吸引力形成的。
2. 元素类型:共价键通常形成于非金属元素之间,而离子键通常形成于金属和非金属元素之间。
3. 电荷转移:共价键中没有电荷转移,而离子键中存在电荷转移。
4. 化合物类型:共价键通常形成分子化合物,而离子键通常形成离子化合物。
初中化学离子键与共价键的区别与应用举例

初中化学离子键与共价键的区别与应用举例化学是自然科学中重要的一门学科,研究的是物质的组成、性质和变化规律。
在化学中,化学键是物质之间进行连接的重要方式之一。
离子键和共价键是两种常见的键的类型,它们在物质的性质和化学反应中有着不同的应用。
本文旨在探讨离子键与共价键的区别,以及它们在化学中的应用。
一、离子键和共价键的区别离子键是靠离子间的电荷相互吸引而形成的一种化学键。
它通常发生在金属和非金属之间,其中金属元素往往失去电子形成阳离子,非金属元素往往接受电子形成阴离子。
离子键的形成需要满足两个条件:一是离子之间的电荷相互吸引,二是离子之间的空间排列结构稳定。
离子键具有以下特点:1. 由正负离子之间的强电荷相互吸引形成,吸引力较强。
2. 离子间的排列形成离子晶体,具有有序的结构。
3. 离子之间的结合力较强,离子键比较稳定。
4. 离子内部的电子构型通常是稳定的惰性气体结构。
共价键是元素之间通过共享电子形成的化学键。
它通常发生在非金属元素之间或非金属与氢气的化合物中。
共价键的形成需要满足两个条件:一是共价键上的电子是由两个原子提供,形成共享电子对;二是原子间的电子云受到两个原子核的吸引力,保持稳定的共价键。
共价键具有以下特点:1. 通过共享电子对形成,电荷分布较均匀。
2. 共价键形成的分子通常呈现离散的杂化轨道结构。
3. 共价键的结合力较弱,共价分子间的相互作用较小。
4. 共价键内部的电子结构非常灵活,可以形成各种不同的共价键构型。
二、离子键和共价键的应用举例1. 离子键的应用举例:离子键在化学反应中具有重要作用,常见的应用如下:a. 阴离子与阳离子之间的离子键可以形成离子晶体,如氯化钠(NaCl),氯化钾(KCl)等。
这些化合物具有高熔点和良好的溶解性,广泛应用于冶金、制盐等产业。
b. 离子键的电离性质使得离子化合物在溶液中易电离,形成电解质。
这种电离性质被广泛应用于电池、电解、电解质溶液等领域。
2. 共价键的应用举例:共价键在有机化学和生物化学等领域中有着重要的应用,常见的应用如下:a. 环状有机化合物的形成通常依赖于共价键。
离子键和共价键

离子键和共价键1.离子键和共价键的比较离子键共价键概念带相反电荷离子之间的相互作用原子间通过共用电子对形成的相互作用成键粒子阴、阳离子原子成键实质静电作用:包括阴、阳离子之间的静电吸引作用,电子与电子之间以及原子核与原子核之间的静电排斥作用静电作用:包括共用电子对与两核之间的静电吸引作用,电子与电子之间以及原子核与原子核之间的静电排斥作用形成条件活泼金属与活泼非金属化合一般是非金属与非金属化合2.共价键的种类(1)非极性共价键:同种元素的原子间形成的共价键,共用电子对不偏向任何一个原子,各原子都不显电性,简称非极性键。
(2)极性共价键:不同元素的原子间形成共价键时,电子对偏向非金属性强的一方,两种原子,一方略显正电性,一方略显负电性,简称极性键。
3.离子键的表示方法(1)用电子式表示离子化合物的形成过程①Na2S:;②CaCl2:。
(2)写出下列物质的电子式①MgCl2:;②Na2O2:;③NaOH:;④NH4Cl:。
4.共价键的表示方法(1)用电子式表示共价化合物的形成过程①CH4:;②CO2:。
(2)写出下列物质的电子式①Cl2:;②N2:;③H2O2:;④CO2:;⑤HClO:;⑥CCl4:。
(3)写出下列物质的结构式①N2:N≡N;②H2O:H—O—H;③CO2:O===C===O。
深度思考1.(1)形成离子键的静电作用指的是阴、阳离子间的静电吸引吗?(2)形成离子键的元素一定是金属元素和非金属元素吗?仅由非金属元素组成的物质中一定不含离子键吗?(3)金属元素和非金属元素形成的化学键一定是离子键吗?(4)含有离子键的化合物中,一个阴离子可同时与几个阳离子形成静电作用吗?答案(1)既有阴、阳离子间的静电吸引,也有原子核与原子核之间、电子与电子之间的相互排斥。
(2)都不一定,如铵盐含有离子键,但它全是由非金属元素形成的。
(3)不一定,如AlCl3中的化学键就是共价键。
(4)可以,如Na2S,离子键没有方向性。
化学物质的共价键与离子键的特点与区别

化学物质的共价键与离子键的特点与区别化学物质中的化学键是构成分子和化合物的基本力量。
共价键和离子键是两种常见的化学键类型。
本文将探讨共价键和离子键的特点和区别。
共价键是一种化学键,形成于两个原子共享电子对的情况下。
这种键主要出现在非金属原子之间。
共价键的主要特点如下:1. 电子共享: 在共价键中,两个原子共享一个或多个电子对。
这种电子共享使两个原子贡献了一个或多个电子以形成一个稳定的分子。
2. 原子间相对稳定性: 共价键的形成使原子间形成一个稳定的结构。
由于两个原子共享电子,它们相互吸引并形成一个不易分离的结构。
3. 范德华力: 共价键还涉及到范德华力的作用。
这是由于电子云的不均匀分布所致,使共价键分子中的部分带正电荷,部分带负电荷。
离子键是由离子之间的电荷吸引力形成的键。
这种键通常存在于金属与非金属之间,或两个电子亲和性差别很大的原子之间。
离子键的主要特点如下:1. 电子转移: 离子键的形成涉及电子的转移,一个原子从另一个原子中获得一个或多个电子,形成正离子,而另一个原子失去一个或多个电子,形成负离子。
2. 电荷吸引: 形成离子键的关键是正负离子之间的电荷吸引力。
正负电荷之间的强烈相互吸引使得形成了一个稳定的结构。
3. 晶格结构: 由于离子键的存在,离子化合物通常形成晶格结构,其中正负离子按照规律排列。
共价键和离子键之间存在一些明显的区别:1. 电子转移: 共价键中,两个原子共享电子,而离子键中,电子由一个原子转移到另一个原子。
2. 构成元素: 共价键经常存在于两个非金属元素之间,而离子键通常存在于金属与非金属之间。
3. 结构稳定性: 共价键形成的结构通常是相对不稳定的,而离子键形成的结构通常是较为稳定的。
正文部分到此结束,根据题目的要求,我们以段落形式呈现了共价键和离子键的特点和区别。
这样的格式使得文章易于阅读,同时遵循了整洁美观的排版要求。
希望这篇文章对您有所帮助!。
离子键和共价键的区分
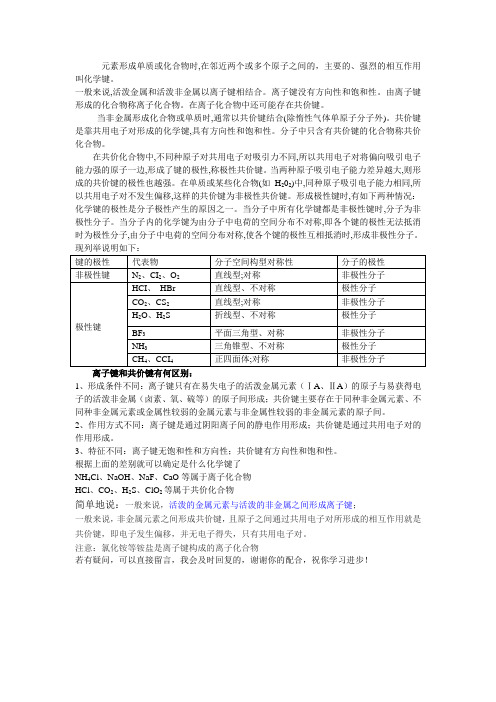
元素形成单质或化合物时,在邻近两个或多个原子之间的,主要的、强烈的相互作用叫化学键。
一般来说,活泼金属和活泼非金属以离子键相结合。
离子键没有方向性和饱和性。
由离子键形成的化合物称离子化合物。
在离子化合物中还可能存在共价键。
当非金属形成化合物或单质时,通常以共价键结合(除惰性气体单原子分子外)。
共价键是靠共用电子对形成的化学键,具有方向性和饱和性。
分子中只含有共价键的化合物称共价化合物。
在共价化合物中,不同种原子对共用电子对吸引力不同,所以共用电子对将偏向吸引电子能力强的原子一边,形成了键的极性,称极性共价键。
当两种原子吸引电子能力差异越大,则形成的共价键的极性也越强。
在单质或某些化合物(如H202)中,同种原子吸引电子能力相同,所以共用电子对不发生偏移,这样的共价键为非极性共价键。
形成极性键时,有如下两种情况:化学键的极性是分子极性产生的原因之一。
当分子中所有化学键都是非极性键时,分子为非极性分子。
当分子内的化学键为由分子中电荷的空间分布不对称,即各个键的极性无法抵消时为极性分子,由分子中电荷的空间分布对称,使各个键的极性互相抵消时,形成非极性分子。
离子键和共价键有何区别:1、形成条件不同:离子键只有在易失电子的活泼金属元素(ⅠA、ⅡA)的原子与易获得电子的活泼非金属(卤素、氧、硫等)的原子间形成;共价键主要存在于同种非金属元素、不同种非金属元素或金属性较弱的金属元素与非金属性较弱的非金属元素的原子间。
2、作用方式不同:离子键是通过阴阳离子间的静电作用形成;共价键是通过共用电子对的作用形成。
3、特征不同:离子键无饱和性和方向性;共价键有方向性和饱和性。
根据上面的差别就可以确定是什么化学键了NH4Cl、NaOH、NaF、CaO等属于离子化合物HCl、CO2、H2S、ClO2等属于共价化合物简单地说:一般来说,活泼的金属元素与活泼的非金属之间形成离子键;一般来说,非金属元素之间形成共价键,且原子之间通过共用电子对所形成的相互作用就是共价键,即电子发生偏移,并无电子得失,只有共用电子对。
共价键与离子键的区别

共价键与离子键的区别共价键和离子键是化学中常见的键类型,它们在分子和化合物的形成过程中起着重要作用。
虽然它们都是用来连接原子的,但共价键和离子键之间存在着一些明显的区别。
1. 原理不同共价键的形成是基于原子间电子的共享。
当两个非金属原子接近时,它们的外层电子轨道发生重叠,并开始共享电子。
这种共享使得原子能够同时满足共享电子对的需求,稳定地相互连接在一起。
相比之下,离子键的形成是通过原子间电子的转移实现的。
在离子键中,金属和非金属元素之间的电子转移导致正离子和负离子的形成,这些离子之间的吸引力形成了稳定的结合。
2. 电荷分布不同共价键中,由于电子是共享的,没有完全的电荷转移,所以共价键形成的分子或化合物中没有明确的正负电荷。
而在离子键中,电子发生转移,形成正离子和负离子,从而产生了明确的正负电荷。
正负离子之间的静电相互作用力使离子键保持稳定。
3. 构成物质类型不同共价键常见于非金属原子之间的连接,比如水分子(H2O)中氢原子与氧原子之间的共价键。
离子键则常见于金属与非金属原子之间的连接,比如氯化钠(NaCl)中钠离子和氯离子之间的离子键。
由于金属元素常倾向于失去电子,而非金属元素常倾向于获得电子,这使得金属和非金属之间形成了离子键。
4. 结合力不同共价键通常比离子键强。
由于共享电子的特性,共价键可以形成更强的化学键。
共价键形成的化合物通常具有较高的熔点和沸点。
而离子键强度相对较弱,容易在水中解离,形成导电溶液。
5. 构造和几何形状不同共价键的连接通常会在原子间形成一个或多个共享电子对。
这些共价键可以在分子中形成线性、平面三角形、四面体等各种几何形状。
离子键形成的晶格结构中,正离子和负离子通过电磁相互作用排列在一起,不具备共价键的几何约束。
总结起来,共价键和离子键在原理、电荷分布、构成物质类型、结合力和几何形状等方面有明显的区别。
了解和理解这些差异有助于我们更好地理解化学键的本质和不同类型化合物的特性。
共价键与离子键的区别与应用

共价键与离子键的区别与应用引言:化学是一门研究物质变化和性质的学科,其中共价键和离子键是化学反应中最常见的两种键。
本文将探讨共价键和离子键的区别,并探讨它们在生活中的应用。
一、共价键与离子键的定义和特点共价键是指两个原子通过共享电子而形成的化学键。
在共价键中,原子通过共享外层电子以达到稳定的电子构型。
共价键通常形成于非金属原子之间。
离子键是指两个原子通过电子的转移而形成的化学键。
在离子键中,一个原子失去电子而带正电荷,另一个原子获得电子而带负电荷。
离子键通常形成于金属和非金属原子之间。
二、共价键与离子键的区别1. 电子转移与电子共享:共价键是通过电子共享来形成的,原子之间共享电子以达到稳定的电子构型。
而离子键是通过电子转移来形成的,一个原子失去电子,另一个原子获得电子。
2. 构成原子性质的影响:共价键通常形成于非金属原子之间,共价化合物具有较低的熔点和沸点,通常为气体或液体。
而离子键通常形成于金属和非金属原子之间,离子化合物具有较高的熔点和沸点,通常为固体。
3. 极性与非极性:共价键可以是极性的或非极性的,取决于原子间电负性的差异。
当两个原子的电负性相等时,共价键是非极性的。
离子键通常是极性的,因为金属原子倾向于失去电子,非金属原子倾向于获得电子。
4. 溶解性:由于离子键的极性,离子化合物在水中通常具有良好的溶解性。
而共价化合物的溶解性则取决于其极性或非极性特性。
三、共价键与离子键的应用1. 共价键的应用:共价键在有机化学中具有重要的应用。
有机化合物中的碳碳共价键和碳氢共价键是构成有机分子结构的基础。
许多有机化合物,如乙烯、丙烯等,是通过共价键的形成而得到的。
2. 离子键的应用:离子键的应用广泛,特别是在无机化学和材料科学领域。
离子化合物常用于制备陶瓷材料、电池电解液、药物和肥料等。
例如,氯化钠是一种常见的离子化合物,用于调味和食品加工。
3. 共价键与离子键的转化:共价键和离子键之间可以相互转化。
化学键的共价性和离子性

化学键的共价性和离子性化学键是指连接原子的力,根据电子的共享或者转移情况,可以分为共价键和离子键两种类型。
共价键是指电子在共享的情况下形成的键,而离子键则是指电子由一个原子完全转移到另一个原子形成的键。
本文将介绍共价性和离子性的特点和区别。
一、共价性共价键是在原子间共享电子而形成的化学键。
共价键的形成是为了实现原子的稳定化。
通常情况下,原子的最外层电子层需要满足八个电子(或者称为“八隅规则”),共价键的形成能够帮助原子达到电子层的稳定状态。
共价键的特点:1. 电子的共享:两个相互连接的原子共享一个或多个电子对,以便达到电子层稳定的目的。
2. 强度:共价键强度较大,需要较大的能量才能断裂。
3. 长度:共价键的长度一般在0.1-0.2纳米之间。
4. 方向性:共价键有一定的方向性,根据原子轨道的重叠情况,共价键的方向可以有明确的确定。
共价键的形成可以通过共价化合物的例子来说明,比如水分子(H2O)。
在水分子中,氧原子和两个氢原子之间形成了两个共价键。
氧原子和氢原子共享电子对,使得氧原子可以获得两个共享电子对,达到电子层稳定的状态。
二、离子性离子键是指在电子转移的情况下形成的化学键。
当原子失去或获得电子后,形成带正电荷的阳离子和带负电荷的阴离子之间的强大电吸引力。
离子键的特点:1. 电子的转移:在离子键的形成过程中,一个原子会失去一个或多个电子,而另一个原子会获得这些电子,形成电荷相反的离子。
2. 强度:离子键的强度较大,需要较大的能量才能断裂。
3. 长度:离子键的长度较长,一般在0.2-0.3纳米之间。
离子键的形成可以通过盐类化合物的例子来说明,比如氯化钠(NaCl)。
在氯化钠中,钠原子失去一个电子形成带正电荷的钠离子(Na+),而氯原子获得这个电子形成带负电荷的氯离子(Cl-)。
由于电荷相反,钠离子和氯离子之间会产生强烈的电吸引力,形成离子键。
共价性和离子性的区别:1. 电子的共享或转移:共价键是电子共享,而离子键是电子转移。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Cl Cl Cl
Na
+
Cl
S
⑨忘记弧箭: Na +
Na+ Cl
Company Logo
一些氢化物的沸点
Company Logo
Company Logo
Company Logo
Company Logo
⒈ AB型: NaCl: Na+
MgO: Mg2+
Cl O
2-
KBr: K+
CaO:Ca2+
Br O
2-
⒉ AB2型:
MgCl2: CaBr2: ⒊ A2B型: Na2O: + Na
Cl Br
2-
-
Mg2+ Cl Ca
2+
Br
2-
O
+
+ K2S: + Na
K
S
K
+
NaOH:
Na
O H
Company Logo
Cl
+
Mg
2+
Cl
+
S
+
K
K
S
2-
K+
Company Logo
H2
H + H
H H Br Br
Br2
O2 HF H2O NH3
Br + Br
+
H +
F
+
H F H H O H
H + O N + 3 H
H N H H
Company Logo
H Cl H O H
O C O
H N H H H H C H H
Company Logo
① NaCl:
或 Na
Na +
+
Cl
Na+ Cl Na+ Cl Mg
2+
Cl
② MgO:
Mg +
O
O
-
2-
③ MgCl2: Cl + Mg + Cl ④ K2S: K
分子内只存在共价键
一般较低,个别很大
一般较小,个别很大
部分溶于水 熔融时不导电、水 溶液部分导电 一般不破坏共价键
强碱、大多数盐、 活泼金属的氧化物
酸、非金属氧化物、 非金属的氢化物
特别说明:
①含有共价键的化合物不一定是共价化合物 ②共价化合物中一定含有共价键 ③共价化合物中一定不含离子键 ④含有离子键的化合物一定是离子化合物 ⑤离子化合物中一定含有离子键 ⑥离子化合物中可能是含有共价键
Company Logo
温度/℃
250 200 150 100 50 -50 -100 -150 -200
-250
沸点
I2 I2 250 相对分子质量
熔点
100
150 Br 2
Br2 200
0
50
Cl2 Cl2
F2 F2
卤素单质的熔、沸点与 相对分子质量的关系
Company Logo
H O H O C O
Company Logo
离子化合物与共价化合物的比较
离子化合物 概念 粒子间的作 用力 熔沸点 硬度 溶解性 导电性 熔化时破坏 的作用力 实例 含离子键的化合物 共价化合物 只含共价键的化合物
肯定有离子键、 可能有共价键 较高 较大
一般易溶于水 熔融或水溶液导电 一般破坏离子键, 可能破坏共价键
H2+Cl2=2HCl
原子间通过共用电子对 所形成的相互作用 共用电子对 原子间
金属氧化物、绝大多数 非金属原子间(化合物、单质(稀 有气体单质除外)、某些金属与非 存在范围 盐、强碱、铵盐 金属原子间)
分类
对物质性 质的影响
极性键、非极性键 离子键越强,熔沸 点越高 共价键越强,ቤተ መጻሕፍቲ ባይዱ质或化 合物的稳定性越好
作用力 强弱 较强 很弱 较化学键弱,较分 子间作用力强
对物质 主要影响物质 性质的 的化学性质 影响
①影响物质的熔沸点、 溶解度等物理性质 分子间氢键的存 ②组成的结构相似的 物质,随着相对分子 在使物质的熔沸 质量的增大,物质的 点升高,在水溶 溶沸点逐渐升高 液中溶解度增大
Cl-
+17
288
Company Logo
氯化氢的形成过程
H
+1 1 7
2 +17
Cl
Company Logo
离子键与共价键对比
离子键 举例 概念 实质 成键粒子 共价键
2Na+Cl2=2NaCl
阴、阳离子间的静电 作用 静电作用 阴、阳离子(种类)
Company Logo
物质中存在的作用力比较
化学键 分子间作用力 氢键
某些强极性键的氢 概念 相邻的原子间强 分子间存在的微 化物分子间的相互 弱的相互作用 烈的相互作用 作用(静电作用) 分子间(HF、H2O、 作用力 分子内或晶体内 分子间 NH3) 范围
Company Logo
内 容 价键类型 原子种类 吸引能力
共用电子对
非极性键
极性键
共价键
相同 相当
不相同
不相当
不偏移(居于中央)
不显电性
偏移(倾向一侧)
相对带部分正电或负电
原子电性
元素化合价
判断方法 常见示例
均为0价 同种元素原子之间
(元素符号相同)
出现正价或负价 不同种元素原子之间
(元素符号不相同)
LOGO
化学键
离子键与共价键的对比
一、化学键
概念:相邻的两个或多个原子间强烈的相 互作用 理解重点:①相邻 ②原子间 ③强烈作用 分类:离子键 共价键
Company Logo
氯化钠的形成过程
Na
+11 2 8
Na+
+11
281
Na+
Cl-
Cl
+17
287
1.下列粒子的电子式错误的是:
B
2.下列化合物电子式书写正确的是:
D
Company Logo
常见错误表达: ①电荷写错: K ②电子数错: F Br
2-
-
Br
O C O Mg H
+
③该括不括:
④不该乱括: ⑤随便合并: ⑥离共判错:
2+
F
=
-
⑦错误连接: Na + ⑧位置标错:
