离子键共价键表格
2.1共价键

第一节 共价键
复习
什么叫化学键? 什么叫离子键? 什么叫共价键?
化学键:元素相互化合,相邻的原子之间产生的 强烈的化学作用力。 离子键:使阴、阳离子结合成化合物的静电作用。 共价键:原子之间通过共用电子对所形成的相互 作用。
共价键 (1)成键微粒: 原子 。 (2)成键实质: 共用电子对 。 (3)形成条件: 非金属元素的原子相结合。 (4)分类
H2O 105° V形
CO2 180° 直线形
键角一定,表明共价键具有方向性。键角是描述分子 立体结构的重要参数,分子的许多性质与键角有关。
共价键的键参数与分子的结构、性质的关系
键能 键长 键角
决定 决定
分子的稳定性 分子的空间构型
决定
分子的性质
从下表中你可以获得哪些信息?
从表中可以看出,CO分子与N2分子在许多性质上 十分相似,这些相似性,可以归结为它们具有相 等的价电子数,导致它们具有相似的化学结构。
4.等电子体可以是分子,也可以是离子
类型
实例
二原子10电子 的等电子体
N2、CO、NO+、C22-、CN-
三原子16电子 的等电子体
三原子18电子 的等电子体
CO2、CS2、N2O、NCO-、NO2+、 N3-、NCS-、BeCl2(g) NO2-、O3、SO2
四原子24电子 的等电子体
五原子32电子 的等电子体
【思考与交流】P32
2.N2、O2、F2跟H2的反应能力ቤተ መጻሕፍቲ ባይዱ次増强,从键能 的角度应如何理解这一化学事实?
从表2-1键能数据可知,N-H键、O-H键与H-F 键的键能依次增大,意味着形成这些键时放出 的能量依次增多,化学键越来越稳定。所以N2、 O2、F2与H2的反应能力依次增强。
化学中的化学键离子键与共价键

化学中的化学键离子键与共价键化学中的化学键:离子键与共价键化学键是指化学元素之间由氨基酸或同分异构物结构而成的化合物。
化学键的形成是通过共享或转移电子来实现的。
其中,离子键和共价键是化学中两种常见的键。
一、离子键离子键是由金属元素与非金属元素之间的电子转移所形成的一种强的化学键。
在离子键中,金属元素会失去电子,形成带正电荷的阳离子,而非金属元素则会获得这些失去的电子,形成带负电荷的阴离子。
阳离子和阴离子之间的静电力使它们互相吸引,从而形成了离子键。
离子键的特点如下:1. 电荷转移:离子键的形成是通过电子从金属元素转移到非金属元素来实现的。
所以,离子键的特点之一是电荷转移的存在。
2. 力量:离子键通常是强化学键,因为金属元素失去多个电子并形成多个阳离子,和非金属元素形成多个阴离子。
这导致阳离子和阴离子之间的相互作用力非常强大。
3. 结构:离子键形成的化合物呈现晶体结构。
这是因为阳离子和阴离子吸引力的平衡导致它们在空间结构中排列有序。
二、共价键共价键是由非金属元素之间通过共享电子而形成的一种化学键。
在共价键中,每个原子都为稳定而与其他原子共享电子对。
通过电子共享,原子能够填充其最外层电子壳,达到稳定的电子配置。
共价键的特点如下:1. 电子共享:共价键的形成是通过原子之间电子对的共享来实现的。
通过共享电子,每个原子都能够达到稳定的电子配置。
2. 力量:共价键通常是中等强度的化学键。
共价键的强度取决于原子间电子对的共享程度。
3. 结构:共价键形成的化合物通常具有复杂的分子结构。
由于共享电子对形成的基本单位是分子,共价键化合物的结构通常不具有晶体结构。
在化学中,离子键和共价键是两种常见的化学键类型,它们在元素和化合物的形成中起着重要的作用。
离子键通常形成于金属和非金属元素之间,而共价键通常形成于非金属元素之间。
离子键和共价键的存在使得元素能够在化学反应中结合成各种化合物,进而构建出我们周围多样性的物质世界。
离子键、共价键

离子键、共价键离子键:离子键是一种化学键,它是由电荷不同的原子(或分子)之间形成的。
金属原子和非金属原子之间以及非金属原子之间可能会形成离子键。
离子键是原子(或分子)之间电荷差异而形成的静电交互作用。
离子键通常是具有特定电荷的离子相互作用,形成的一种稳定的化合物。
离子键的特性在于,它是由两种不同的离子(正离子和负离子)之间形成的,这些离子之间的电荷一般是不平衡的,因此它们会产生强烈的相互作用,起到稳定化合物的作用。
共价键:共价键也称作共轭键或共价共轭键,是两个原子之间最常见的化学键,它是由原子之间共享一对电子来形成的。
共价键通常由两个原子之间共享一对共价电子而形成,这样它们之间就能够形成稳定的化合物。
共价键通常比离子键更加强大,因为它们是由两个原子之间共享一对电子而形成的,这意味着它们之间的电荷是平衡的,从而使得它们形成更强大的键。
共价键可以被看作是两个原子之间建立起来的一种固定的电子共享关系,一旦形成,它便会稳定的保持下去。
离子键和共价键都是一种原子和分子之间的特殊结构,是化学反应中不可缺少的部分。
离子键是由电荷不同的原子(或分子)之间形成的,它们之间的电荷一般是不平衡的,因此它们会产生强烈的相互作用,起到稳定化合物的作用。
而共价键是两个原子之间最常见的化学键,它是由原子之间共享一对电子来形成的,这样它们之间就能够形成稳定的化合物,共价键通常比离子键更加强大。
离子键和共价键都可以在水溶液中发生反应,但它们的机理却不太一样。
离子键是在水溶液中由离子的电荷差异引起的,它会导致离子间的相互作用,而共价键是由原子之间共享一对电子而形成的。
因此,当离子键和共价键在水溶液中发生反应时,它们之间的电荷是不同的,这也是它们发生反应的机理不一样的原因。
离子键和共价键都是化学反应中不可缺少的部分,它们之间的特性也不尽相同,不同的化合物就是由它们形成的稳定键所组成的,所以要想了解一种物质的性质,就必须正确理解它的化学键的特性。
离子键--共价键

H
··
C····l
氢分子旳形成:
··
H ·+ ·H → H H
一、共价键旳概念
1、定义:原子间经过共用电子对所形成旳相互作用
2、成键粒子:原子 3、成键作用力:“共用电子对”与两原子核旳作用 4、成键规律:一般同种或不同种非金属元素之间 5、存在: 非金属单质、共价化合物
讨论:只有非金属间才干形成共价键?
CH4
CO2
H2O2
H H :C :H
H
H HCH
H
•• ••
O=C=O
HOO H H-O-O-H
离子键和共价键旳比较比较 成元素离子键活泼金属与非金属元素之间
成键微粒 成键本质
键旳强弱
阳离子 ~ 阴离子
静电作用
离子电荷数多、半径小旳 键强
共价键
非金属元素之间 原子 ~原子 共用电子对
原子半径小键强
Na Cl
2-
Na O Na
Cl Mg2 Cl
注意:相同旳离子不能合并写(每个离子都 要单独写),一般对称排列. 如:
Mg2 Cl 2 ×
Na2 O × 2-
⑷、用电子式表达离子化合物旳形成过程
左侧写原子旳电子式,右侧写离子化合物旳电
子式,中间用
连接.
例:K S
2-
K KSK
Br Mg Br
Br Mg2 Br
··
·· ❖H·和 C··l原·子形成HCl过程中,能否形
成离子键?为何?
不能,因非金属元素旳原子都有取 得电子旳倾向。
❖HCl分子不是经过离子键来形成,是经过 什么方式结合旳呢?
原子之间经过共用电子对所形成旳相互 作用,叫做共价键。
氯化氢分子旳形成:
化学键(共价键和离子键)

用电子式也可以表示出物质的形成过程。
单质
H2
I2
离子化合物
NaCl的形成:
MgCl2的形成:
返回目录
退出Βιβλιοθήκη 共价化合物HFH2O
【典例 2】 已知五种元素的原子序数的大小顺序为 C >A>B>D>E,A、C 同周期,B、C 同主族,A 与 B 形成的离子化合物 A2B 中所有离子的电子数相同,其 电子总数为 30, D 和 E 可形成 4 核 10 电子分子。 试回 答下列问题: (1)写出五种元素的名称: A____,B_____,C______,D______,E________。 (2)用电子式表示离子化合物 A2B 的形成过程:_____。
(3)写出下列物质的电子式: D 元素形成的单质__________; E 与 B 形成的化合物__________; A、B、E 形成的化合物__________; D 与 E 形成的共价化合物__________。
返回目录 退出
返回目录
退出
应用 2 原子序数由小到大排列的四种短周期元素 X、Y、Z、W,其中 X、Z、W 与氢元素可组成 XH3、 H2Z 和 HW 共价化合物,Y 与氧元素可组成 Y2O 和 离子化合物 Y2O2。 (1)写出 Y2O2 的电子式_______________________。 其中含有的化学键是_____________________。 (2)用电子式表示 Z 和 Y 形成化合物的过程_______。 (3)XH3、 H2Z 和 HW 三种化合物, 其中一种与另外两 种都能反应的是__________(填写电子式)。
高中化学【基础】离子键和共价键
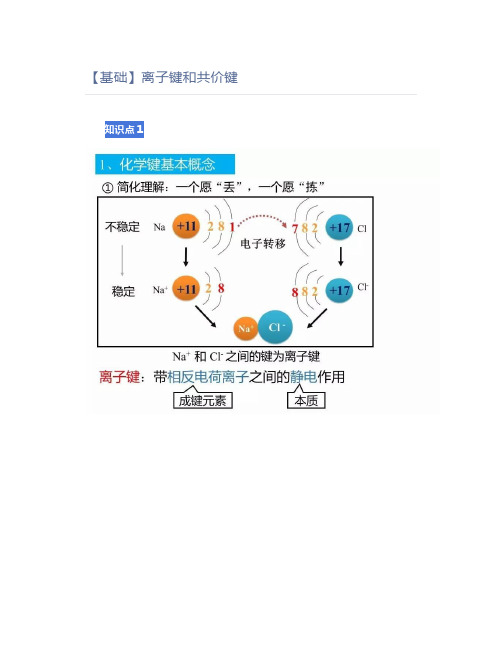
【基础】离子键和共价键知识点1知识点2综合1.定义:相邻的两个或多个原子(或离子)之间强烈的相互作用叫做化学键。
2.类型:Ⅰ离子键:由阴、阳离子之间通过静电作用所形成的化学键。
Ⅱ 共价键:原子之间通过共用电子对所形成的化学键。
①极性键:在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。
这样的共价键叫做极性共价键,简称极性键。
举例:HCl分子中的H-Cl键属于极性键。
②非极性键:由同种元素的原子间形成的共价键,叫做非极性共价键。
同种原子吸引共用电子对的能力相等,成键电子对匀称地分布在两核之间,不偏向任何一个原子,成键的原子都不显电性。
非极性键可存在于单质分子中(如H2中H—H键、O2中O=O键、N2中N≡N键),也可以存在于化合物分子中(如C2H2中的C—C键)。
以非极性键结合形成的分子都是非极性分子。
Ⅲ 金属键:化学键的一种,主要在金属中存在。
由自由电子及排列成晶格状的金属离子之间的静电吸引力组合而成。
1.离子化合物:由阳离子和阴离子构成的化合物。
大部分盐(包括所有铵盐),强碱,大部分金属氧化物,金属氢化物等。
注意:教材中在讲到离子键、共价键的形成条件时,一般讲“活泼金属与活泼非金属”元素间易形成离子键,而“非金属元素间”易形成共价键。
“活泼金属”一般指第IA族和第IIA族的钠、镁、钾、钙等金属,“活泼非金属”一般指第VIA族的氧元素和第VIIA族的氟、氯、溴等。
需要注意三个问题,一是“活泼金属”也可以与较不活泼的非金属形成离子键,如Na2S、KI等。
二是金属元素与非金属元素也可以形成共价键,如氯化铝等,不过在中学阶段,一般考查到的金属元素与非金属元素形成的化学键均为离子键。
三是非金属元素间也可以形成离子键,如NH4Cl等。
2.共价化合物:主要以共价键结合形成的化合物,叫做共价化合物。
离子键和极性共价键
离子键和极性共价键.离子键与共价键的形成过程不同,离子键是原子间得、失电子而生成阴、阳离子,然后阴、阳离子通过静电作用而形成的;共价键是原子间通过共用电子对而形成的,原子间没有得失电子,形成的化合物中不存在阴阳离子。
.离子键和共价键在成键时方向性不同,离子键在成键时没有方向性,而共价键却有方向性。
我们知道离子键是阴阳离子间通过静电引力形成的化学键。
由于阴阳离子的电荷引力分布是球形对称的,一个离子在任何方向都能同样吸引带相反电荷的离子,因此离子键没有方向性。
而共价键却大不相同,共价键的形成是成键原子的电子云发生重叠,如果电子云重叠程度越多,两核间电子云密度越大,形成的共价键就越牢固,因此共价键的形成将尽可能地沿着电子云密度最大的方向进行。
除s轨道的电子云是球形对称,相互重叠时无方向性外,其余的p、d、f轨道的电子云在空间都具有一定的伸展方向,故成键时都有方向性。
共价键的方向性,决定分子中各原子的空间排布。
原子排布对称与否,对于确定分子的极性有重要作用。
.离子键和共价键在成键时饱和性不同,离子键没有饱和性,而共价键则有饱和性。
离子键没有饱和性是指一个离子吸引相反电荷的离子数可超过它的化合价数,但并不意味着吸引任意多的离子。
实际上,由于空间效应,一个离子吸引带相反电荷的离子数是一定的。
如在食盐晶体中,一个na+吸引六个cl-,同时一个cl-吸引六个na+。
也可以说na+与cl-的配位数都是六。
共价键的饱和性,指共价键是通过电子中不成对的电子形成的。
一个原子中有几个未成对电子,就可与几个自旋方向相反的电子配对形成几个共价键。
成键后,再无未成对电子,也就再不能形成更多的键了。
我们知道如果共用电子对处于成键的两个原子中间,是非极性键;如果共用电子对稍偏向某个原子,是弱极性键;共用电子对偏向某个原子很厉害,则是强极性键;共用电子对偏向某个原子太厉害时,甚至失去电子便成为离子键了。
.因此可以说,非极性键和离子键是共价键的两个极端,而极性键则是由非极性键向离子键过渡的中间状态。
离子键、共价键、金属键,分子键
离子键、共价键、金属键,分子键
离子键:由正负两种离子通过静电作用相互结合形成的化学键。
共价键:由二元原子或分子内部的原子间共享电子形成的化学键。
共价键的力量较强,能使分子稳定存在。
金属键:由金属原子内部的自由电子通过金属离子之间的排列所形成的化学键。
金属键的特点是在很低的温度下就发生结合。
分子键:由同种或不同种原子之间的共价键形成的化学键。
可以是非极性的、极性的或者离子型的。
分子键在化学反应中有很重要的作用,它们决定了分子的结构和性质。
化学键的基本类型离子键﹑共价键金属键
H2O 2p
2s
sp3杂化
s p3
水分子的空间结构
HOH 104.5ο
含孤电子对的杂化轨道对成键轨道的斥力较大,使 成键轨道受到挤压,成键后键角较NH3分子更小, 为104.5°,分子空间构型:角形(折线形)。
7.4 用以判断共价分子几何形状的价层电子对 互斥理论 (VSEPR for judging the configuration of the covalence molecular )
A
B
BB
AB4
4
Tetrahedral
(109°28’)
AB5
5
Triangular bipyramidal*
∵ F∝Z+.Z-/(r++r-) ∴离子的电荷越高,晶体的熔点越高。
离子的半径越大,晶体的熔点越低
Mohs: 滑石1,石膏2;方解石3;萤石4;,,,,; 石英7;,,,;金刚石10。
§7.2 共价键 7.2.1 价键理论(又称VB理论)
美国化学家路易斯(G N Lewis)提出了共价键 (covalent bond)的电子理论:原子之间可以通过 共用电子使每一个原子都达到稳定的稀有气体电 子结构,从而形成稳定的分子。这种原子通过共 用电子对而形成的化学键称为共价键 ,
d 值可由晶体的 X 射线衍射 实验测定得到, 例如 MgO d = 205 pm ∵rO2-=140pm, ∴rMg2+=65pm
r+ r d
离子半径变化规律:
·同族:从上而下递增
F- < Cl- < Br- < I-
136pm 181pm 195pm 216pm
·同周期:正离子半径随电荷增加而减小;
离子键和共价键
键的两原子电荷分布不均匀,吸引电子能力强的
一方显负电性;吸引电子能力弱的一方显正电性。
·· ·· ··
HH
H C····l
电子对
不偏移
电子对
偏向Cl
第三十四页,编辑于星期三:十八点 十四分。
总结:2、共 价 键
定义: 原子间通过共用电子所形成的化学键
叫做共价键。
成键微粒: 原子
成键本质: 共用电子对 成键元素: 同种或不同种非金属元素
硫原子, 硫离子, 溴原子, 溴离子
···S··· [:S····:]2-
用电子式可以直观地
··
·· B·r··
[:B··r:]··
看到原子结构特点与键之间的关系。
也可以表示出原子或离子之间是怎样结合的
第十七页,编辑于星期三:十八点 十四分。
书写时 离子化合物的电子式:由阴、阳离子的 电子式组成,但相同离子不能合并
以共价键结合。
Na+[ ··O ··H] -
﹕﹕
过氧化钠晶体中,过氧根离子 (O2 ) 2-与
二、化学键的类型
实验1-2 金属钠在氯气中燃烧
现象:剧烈燃烧,产生大量白烟、黄色火焰 化学方程式: 2Na+Cl2 =△= 2NaCl
思考与交流 1.画出钠和氯的原子结构示意图。
2.试解释氯化钠是怎样形成的。
第六页,编辑于星期三:十八点 十四分。
氯化钠的形成
点燃
(2Na+ Cl2== 2NaCl )
★氢分子的形成:
H ·+ ·H → H H H﹣H(结构式)
··
★氯化氢分子的形成:
H ·+
·C····l: → H
··
C··l ··
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例
表四化学键、分子间作用力、氢键的比较
化学键
分子间作用力
氢键
概
念
作用力
的大小
对物质性
质的影响
存在
范围
说
明
表一离子键与共价键比较
键型
离子键
共价键
概念
微粒
作用力
形成
条件
形成
元素
表示
方法
存在
表二极性键与非极性键极性共源自键非极性共价键概念
成键原子
原子吸引电子对能力
共用电子对是否偏移
成键原子电性
判断依据
实例
表三离子化合物与共价化合物的比较
离子化合物
共价化合物
概念
粒子及
其作用力
熔沸点
导
电
性
熔化时
破坏的
作用力
判断
方法
