硫酸钠和氯化钠溶解度曲线
溶解度练习题

溶解度1、固体物质的溶解度:在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂中的溶解度。
溶解度概念四要素:①条件:在一定温度下(温度改变,则固体物质的溶解度也会改变;只有在指明温度时,溶解度才有意义)②标准:在100g溶剂里(此处100g是溶剂的质量,而不是溶液的质量)③状态:达到饱和状态(只有达到一定条件下溶解的最大值,才可称其为溶解度)④单位:溶解度是所溶解溶质的质量(常用单位为克)例题:1.下列说法正确的是()A、把10克氯化钠溶解在100克水里恰好制成饱和溶液,氯化钠的溶解度就是10克B、20 ℃时,10克氯化钠溶解在水里制成饱和溶液,故 20 ℃时氯化钠的溶解度是10克C、20 ℃时,10克氯化钠可溶解在100克水里,故 20 ℃时氯化钠的溶解度是10克D、20 ℃时,36克氯化钠溶解在100克水中恰好饱和,故 20 ℃时氯化钠的溶解度是36克2.20 ℃时,100克水中最多能溶解36克食盐,则下列说法正确的是()A、食盐的溶解度是36克B、20 ℃时食盐的溶解度是36克C、食盐的溶解度是100克D、食盐的溶解度是136克3.60 ℃时,50克水中溶解55克硝酸钾恰好饱和。
下列说法正确的是()A、硝酸钾的溶解度是 55 克B、硝酸钾的溶解度是 110 克C、60 ℃时硝酸钾的溶解度是 55 克D、60 ℃时硝酸钾的溶解度是 110 克4.把90克 10 ℃的硝酸钠饱和溶液蒸干,得到了40克硝酸钠固体,则硝酸钠在 10 ℃时的溶解度是()A、80 克B、80C、44.4 克D、44.45. 20 ℃时,将20克某物质溶解在50克水中,恰好饱和,则 20 ℃时该物质的溶解度是()A、20 克B、40 克C、20D、402、影响固体物质溶解度的因素:①内因:溶质和溶剂本身的性质②外因:温度(与溶剂量无关)大多数固体物质的溶解度随温度升高而升高,如:KNO3少数固体物质的溶解度受温度的影响很小:如NaCl极少数物质溶解度随温度升高而降低,如:Ca(OH)2例题:固体溶解度与下列因素无关的是()A 、溶质的性质B 、溶剂的性质C 、温度高低D 、溶剂的质量3、溶解性和溶解度是两个不同的概念溶解性:物质在某溶剂中溶解能力的大小(物理性质) 溶解度:表示物质的溶解性大小 溶解性易溶 可溶 微溶 难溶 溶解度(20℃ )>10g 1g~10g0.01g~1g<0.01g例题:1. 已知 20℃ 时, 100克水中最多能溶解20.1克某物质,则该物质属( ) A 、易溶 B 、难溶 C 、微溶 D 、可溶2. 已知 20℃ 时, 25克水中最多能溶解0.8克某物质,则该物质属( ) A 、易溶 B 、微溶 C 、可溶 D 、易溶4、气体的溶解度:①随温度升高而减小②随压强增大而增大例题:煮开水时,在水沸腾前就可以看到水中有气泡冒出,这是因为( ) A .温度升高使空气的溶解度变小 B .温度升高使空气的溶解度变大 C .压强增大使空气的溶解度变小 D .压强增大使空气的溶解度变大5、固体溶解度曲线(中考必考)(1)t3oC 时A 的溶解度为(2)P 点的含义(3)N 点为 ,可通过 的方法使它变为饱和(N 点也为t 3oC 时B 的饱和溶液)(4)t1oC 时A 、B 、C 溶解度由大到小的顺序(5)从A 溶液中获取A 晶体可用 的方法获取晶体 (6)从B 溶液中获取晶体,可用 的方法获取晶体(7)t2o C 时A 、B 、C 的饱和溶液各W 克,降温到t1oC 会析出晶体的有 ,无晶体析出的有 ,所得溶液中溶质的质量分数由小到大依次为(8)除去A 中的泥沙用 ,分离A 和B (B 含量少)的混合物,用例题: 1、(2011•株洲)右图是甲、乙两物质的溶解度曲线图,下列说法正确的是( )0 t 1 t 2 t 3 N t SPABC80A、t1℃时,甲、乙两物质的溶解度相等B、温度对甲、乙两物质的溶解度影响相同C、把t1℃时甲、乙两饱和溶液升温至t2℃时,两溶液仍都为饱和溶液D、把t2℃时甲、乙两饱和溶液降温至t1℃时,两溶液都析出溶质2、(2011•烟台)如图是甲、乙两种物质(不含结晶水)的溶解度曲线.下列说法中正确的是()A、甲的溶解度大于乙的溶解度B、t1℃时,50g甲的饱和溶液中有15g甲C、t2℃时甲的饱和溶液降温至t1℃变为不饱和溶液D、当甲中含有少量乙时,可以用降温结晶的方法提纯甲3、(2011•衢州)如图所示为a、b两种物质的溶解度曲线,下列有关说法中错误的是()A、b的溶解度都随温度的升高而增大B、t1℃时,b的溶解度大于a的溶解度C、t2℃时,a、b的溶解度相同,均为40克D、t3℃时,a的饱和溶液中溶质的质量分数为60%混合物的分离:(1)过滤法:分离两种固体的混合物,要求:一种物质可溶于水,另一种物质难溶于水(2)结晶法:分离两种固体的混合物,要求:一种物质的溶解度随温度变化大,另一种物质的溶解度随温度变化小结晶的两种方法蒸发溶剂,如NaCl(海水晒盐)降温结晶(冷却热的饱和溶液,如KNO3)蒸发结晶(蒸发溶剂法):将固体溶质的溶液加热(或日晒,或在风力的作用下)使溶剂蒸发,使溶液由不饱和溶液转化为饱和溶液,再继续蒸发溶剂,使溶质从溶液中析出。
无机盐在超临界水中的溶解度研究

无机盐在超临界水中的溶解度研究闫正文;廖传华;廖玮;朱跃钊【摘要】采用连续式超临界反应器,考察温度对于无机盐在超临界水中的溶解度影响.结果表明,随着温度的升高,无机盐的溶解度逐渐降低;在相同温度下,氯盐的溶解度随阳离子离子半径及电荷数的增大而减小,即NaCl>KCl>CaCl2,硫酸盐的溶解度也呈现同一规律,即Na2SO4>K2SO4>CaSO4;在相同温度下,阳离子相同,盐的溶解度随阴离子离子半径和电荷数的增大而减小,即NaCl>Na2SO4,KCl>K2SO4,CaCl2>CaSO4;当温度从380 ℃升至400 ℃时,无机盐溶解度下降趋势最快,NaCl、KCl和CaCl2的溶解度区间分别为:213.72 ×10 -6~165.24 ×10 -6, 185.81×10 -6~143.64×10 -6,80.23×10 -6~7.26×10 -6,Na2SO4、K2SO4和CaSO4的溶解度区间分别为:85.72× 10 -6~14.36×10 -6,60.24×10 -6~5.12×10 -6,0.048×10 -6~0.012×10 -6.%The solubility of inorganic salts was researched by using continuous supercritical reactor,the impact of temperature on the solubility was investigated.The results showed that:With the increase of tem-perature,the solubility of inorganic salts was reduced;At the same temperature,with the increase of cation ion radius and the number of charge,the solubility of chlorine salts are decreased:NaCl>KCl>CaCl2, and the solubility of sulfates also show the same law:Na2SO4>K2SO4>CaSO4;At the same temperature, the inorganic salts have the same anion,with the increase of anion ion radius and the number of charge, the solubility of salts arereduced:NaCl>Na2SO4,KCl>K2SO4,CaCl2>CaSO4;When the temperature from 380℃ to 400℃,the decline of the solubility of inorganic salts isfastest,the interval of the solubility of NaCl,KCl and CaCl2:213.72×10 -6~165.24×10 -6,185.81×10 -6~143.64×10 -6,80.23×10 -6~7.26×10 -6,and the interval of the solubility of Na2SO4,K2SO4and CaSO4:85.72×10 -6~14.36× 10 -6,60.24×10 -6~5.12×10 -6,0.048×10 -6~0.012× 10 -6.【期刊名称】《应用化工》【年(卷),期】2018(047)003【总页数】3页(P514-516)【关键词】超临界水氧化;温度;无机盐;溶解度【作者】闫正文;廖传华;廖玮;朱跃钊【作者单位】南京工业大学机械与动力工程学院,江苏南京 210009;南京工业大学机械与动力工程学院,江苏南京 210009;南京工业大学机械与动力工程学院,江苏南京 210009;南京工业大学机械与动力工程学院,江苏南京 210009【正文语种】中文【中图分类】TQ01;TQ110超临界水的物理、化学性质均较常态下的水发生了显著的变化,既不同于液态水,也有别于气态水[1]。
2024年中考化学专题强化训练溶解度曲线
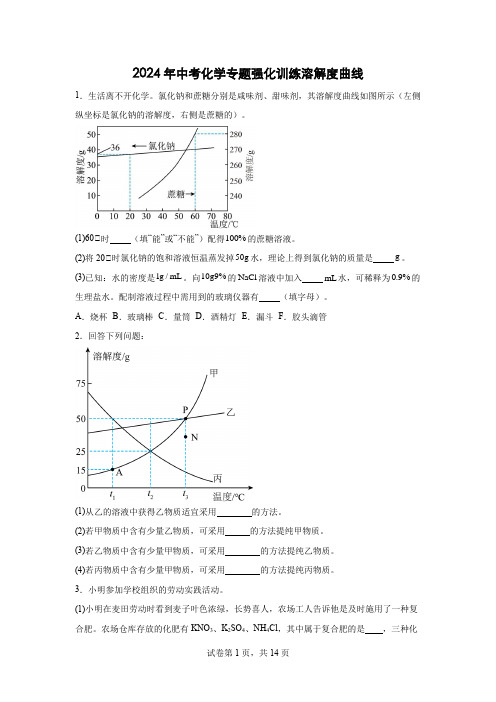
2024年中考化学专题强化训练溶解度曲线1.生活离不开化学。
氯化钠和蔗糖分别是咸味剂、甜味剂,其溶解度曲线如图所示(左侧纵坐标是氯化钠的溶解度,右侧是蔗糖的)。
(1)60℃时(填“能”或“不能”)配得100%的蔗糖溶液。
(2)将20℃时氯化钠的饱和溶液恒温蒸发掉50g水,理论上得到氯化钠的质量是g。
(3)已知:水的密度是1g/mL。
向10g9%的NaCl溶液中加入mL水,可稀释为0.9%的生理盐水。
配制溶液过程中需用到的玻璃仪器有(填字母)。
A.烧杯B.玻璃棒C.量筒D.酒精灯E.漏斗F.胶头滴管2.回答下列问题:(1)从乙的溶液中获得乙物质适宜采用的方法。
(2)若甲物质中含有少量乙物质,可采用的方法提纯甲物质。
(3)若乙物质中含有少量甲物质,可采用的方法提纯乙物质。
(4)若丙物质中含有少量甲物质,可采用的方法提纯丙物质。
3.小明参加学校组织的劳动实践活动。
(1)小明在麦田劳动时看到麦子叶色浓绿,长势喜人,农场工人告诉他是及时施用了一种复合肥。
农场仓库存放的化肥有KNO3、K2SO4、NH4Cl,其中属于复合肥的是,三种化肥包装袋上均写着防雨防潮。
其原因是 。
(2)小明想在家里尝试无土栽培,便从农场带回了三种化肥,使用时却因标记不清而无法区分KNO 3和K 2SO 4,于是到化学实验室进行鉴别。
他取少量其中一种化肥于试管中,加水溶解后,向其中滴加2~3滴某溶液,立即出现了白色沉淀,可确定所取的化肥是K 2SO 4。
请写出发生反应的化学方程式: (只写一个)。
(3)配制无土栽培营养液时,小明依据如图想先配制两种化肥的饱和溶液以备后用。
A .如图,若要提纯KNO 3则用 方法。
B .配制时,假设室温为20℃,若小明用等体积的水配制成恰好饱和的两种化肥溶液,则两种溶液中NH 4Cl 与KNO 3的质量比为 。
4.1t C 时,将a b 、两种固体物质(均不含结晶水)各25g ,分别加入盛有100g 水的烧杯中,充分搅拌后现象如图甲所示;升温到2t C 时,忽略水分蒸发,现象如图乙所示。
2023年山东青岛中考化学试题及答案

2023年山东青岛中考化学试题及答案一、选择题(本题共16小题,每小题1分,共16分)在每小题给出的四个选项中,只有一项是符合题目要求的。
1.生活中的下列变化,不涉及化学变化的是A.铁锅生锈B.牛奶变酸C.葡萄酿酒D.冰雪融化2.人体缺锌会引起多种疾病,可服用葡萄糖酸锌口服液来补锌。
这里的“锌”指的是A.原子B.分子C.元素D.单质3.下列物质属于纯净物的是A.空气B.蒸馏水C.海水D.煤4.把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是A.食盐B.面粉C.泥沙D.花生油5.空气是一种重要的资源,其中的各种成分具有广泛用途。
下列气体可用于供给呼吸的是A.氮气B.水蒸气C.氧气D.二氧化碳6.改善生态环境质量,促进人与自然和谐共生,下列做法值得提倡的是A.回收利用废旧电池B.随意丢弃用过的口罩C.燃放烟花爆竹D.工业污水未经处理直接排放7.“玉兔号”月球车上的太阳能电池板主要材料为硅。
硅元素在元素周期表中的部分信息如图所示,下列说法不正确的是A.硅的元素符号为B.硅元素属于金属元素C.硅元素的相对原子质量为28.09D.硅原子的质子数为148.化肥能为作物的生长提供所需营养元素。
尿素是一种常用的化肥,它属于A.氮肥B.磷肥C.钾肥D.复合肥9.下列物质由离子构成的是A.金刚石B.氯化钠C.氢气D.水10.“民以食为天,食以安为先”。
下列做法不符合食品安全要求是A.用甲醛溶液浸泡海鲜B.不食用霉变食品C.在食品包装袋内充入氮气D.合理使用食品添加剂11.一氧化二氮是一种麻醉剂,少量吸入后可迅速镇痛,且不会损伤心、肺、肝、肾等重要脏器。
一氧化二氮中氮元素的化合价为A. B. C. D.12.公园、车站等公共场所内设有许多直饮水机,其中水处理的过程如图所示。
步骤③对应的作用是A.吸附杂质B.过滤C.杀菌消毒D.蒸馏13.防止金属锈蚀能有效保护金属资源。
下列防锈方法中,与其它三种方法原理不同的是A.表面涂油B.表面刷漆C.覆盖塑料D.制成合金14.“宏观-微观-符号”相结合是化学学科独有的思维方式。
溶解度曲线解读

10、右图所示是A、B、C三种固体物质的溶解度曲线。
(1)C的溶解度随温度的升高而__________________。
(2)在t2℃时,将A、B两种物质的饱和溶液降温到t1℃,
A的饱和溶液中溶质的质量分数比B的饱和溶液中溶质的质量分数________(填“大”或“小”)。
(2)在40℃,等质量的甲、乙两种物质的饱和溶液,当温度降低到20℃时,
析出晶休较多的是_______________(填甲或乙)
21、运用溶解度表与溶解度曲线回答下列问题:
⑴B是的溶解度曲线。
⑵60℃时,100g水中加入100g硝酸钾,所得溶液是(填“饱和”或“不饱和”)溶液,当60℃的该溶液 降温到30℃时,析出晶体的质量为g。
t2℃时乙物质的饱和溶液变为不饱和溶液,可采取的方法是
(任填一种方法)。
30、【2009・河南】甲、乙两种物质的溶解度曲线如右图所示,
(1)30℃时,50 g水可以溶解g甲物质;
(2)要使接近饱和的乙溶液变为饱和溶液,可采取的
方法是(只填一种);
(3)将20℃等质量的甲、乙两种物质饱和溶液的温
度升高到30℃时,两种溶液的溶质质量分数的大小关系是
4、(1)如图9 - 56所示为a、b两种固体物质的溶解度曲线,根据该图可知:在T3℃ 时,a物质的溶解度是g;在℃时,a和b物质的溶解度相等.
(2)溶质的质量分数为5%~50%的葡萄糖溶液可作为注射营养液.若用10 g葡萄糖配制10%的葡萄糖溶液,加入水g.
5、运用溶解度表与溶解度曲线回答下列问题:
(3)从Y的饱和溶液中提取Y,应采用的方法是(填“冷却结晶”或“蒸发溶剂”)。
固体物质的溶解度随温度变化的规律

固体物质的溶解度随温度变化的规律Na(OH)的溶解度随温度的升高而变小NaCL的溶解度随温度的升高而几乎不变KNO3等的溶解度随温度的升高而几乎变大固体物质的溶解度随温度变化的情况可分为三类:(1)大部分固体物质溶解度随温度的升高而增大;(2)少数物质溶解度受温度的影响很小;(3)极少数物质溶解度随温度的升高而减小。
固体溶解度固体物质的溶解度是指在一定的温度下,某物质在100克溶剂里达到饱和状态时所溶解的质量,用字母s表示,其单位是“g/100g水”。
在未注明的情况下,通常溶解度指的是物质在水里的溶解度。
例如:在20℃时,100g水里最多能溶36g氯化钠(这时溶液达到饱和状态),我们就说在20℃时,氯化钠在水里的溶解度是36g。
基本信息中文名称固体溶解度外因温度、压强(气体)内因溶质和溶剂本身的性质可溶大于等于1g小于10g提示物质在水里的溶解度定义固体物质的溶解度是指在一定的温度下,某物质在100克溶剂里达到饱和状态时所溶解的质量,用字母s表示,其单位是"g/100g水"。
在未注明的情况下,通常溶解度指的是物质在水里的溶解度。
例如:在20℃时,100g水里最多能溶36g氯化钠(这时溶液达到饱和状态),我们就说在20℃时,氯化钠在水里的溶解度是36g。
【提示】如果不指明溶剂,通常所说的溶解度是指物质在水里的溶解度。
另外,溶解度不同于溶解速度。
搅拌、振荡、粉碎颗粒等增大的是溶解速度,但不能增大溶解度。
溶解度也不同于溶解的质量,溶剂的质量增加,能溶解度溶质质量也增加,但溶解度不会改变。
简介指固体物质在100g溶剂内达到饱和状态时溶解度质量。
物质的溶解性溶解性溶解度(20℃)易溶大于等于10g可溶大于等于1g小于10g微溶大于等于0.01g小于1g难(不)溶不溶小于0.01g影响物质溶解度的因素?内因:溶质和溶剂本身的性质。
外因:温度、压强(气体)。
主要影响固体的溶解度是温度。
对于大多数固体,温度越高,固体的溶解度越大。
三组分系统氯化钠-硫酸钠-水的溶解度图[参照材料]
![三组分系统氯化钠-硫酸钠-水的溶解度图[参照材料]](https://img.taocdn.com/s3/m/2b0230030912a216147929a6.png)
三组分系统氯化钠-硫酸钠-水的溶解度图表1为氯化钠(A)-硫酸钠(B)-水(C)三组分系统在50℃时的溶解度数据,将数据描绘在等边三角形的坐标图上,则得到图1。
表1 氯化钠(A)-硫酸钠(B)-水(C)在50℃时的溶解度液相组成固相氯化钠(A)硫酸钠(B)水(C)26.8 0 73.2 氯化钠25.0 3.7 71.3 氯化钠24.2 5.3 70.5 氯化钠+硫酸钠20.0 7.65 72.35 硫酸钠15.0 12.1 72.9 硫酸钠10.0 18.1 71.9 硫酸钠5.0 24.7 70.3 硫酸钠0 31.8 68.2 硫酸钠H 2O(C)NaCl(A)Na 2SO 4(B)901000102030405060708090100Na 2SO 4/%图1 氯化钠(A )-硫酸钠(B )-水(C )系统50℃溶解度图图中CbEc 区为氯化钠、硫酸钠在水中的不饱和溶液。
在该区内任意一个系统点,相数Ф=1,温度、压力已固定,故f’=C -Ф+0=3-1+0=2,即在该相区内两种盐的组成均可在一定范围内独立改变而不致引起相态及相数的变化。
c 点表示氯化钠在水中的溶解度(CA 边上无硫酸钠),cE 线是水中溶有氯化钠后,硫酸钠在其中的溶解度曲线;同理,bE 线为氯化钠的溶解度曲线,在该线上f’=C -Ф+0=3-2+0=1。
这表明,在对氯化钠饱和的溶液中(cE ),若确定氯化钠和硫酸钠两者中的一个组成,则另一个组成将随之而有定值,对于硫酸钠饱和的溶液(bE )亦可如此理解。
E点叫共饱点,即l(E)对氯化钠及硫酸钠都是饱和的。
bEB区是硫酸钠结晶区,设系统点p落在这一区域内,则平衡时分成两相,一相为固体硫酸钠,另一相为对硫酸钠饱和的硫酸钠及氯化钠的水溶液。
B(纯硫酸钠)和p的连结线与硫酸钠溶解度曲线bE的交点q表示与硫酸钠平衡的饱和溶液的组成。
按杠杆规则,s(B)的质量/溶液(q)的质量=qp/pB。
溶解度曲线及溶解度表

溶解度曲线及溶解度表1. 引言溶解度是指单位温度和压力下,溶质在溶剂中达到平衡时的最大溶解量。
溶解度曲线及溶解度表是描述物质在不同温度和压力下的溶解性的重要工具。
通过研究物质的溶解度曲线和制作相应的溶解度表,可以了解物质在不同条件下的溶解特性,为实际应用提供依据。
2. 溶解度曲线2.1 溶解度与温度关系物质的溶解度通常随着温度的升高而增大。
这是因为温度升高会增加分子热运动的速率和能量,使得分子间距离增大,从而有利于固体分子逃离晶格并进入溶液中。
以氯化钠(NaCl)为例,其在水中的溶解度随着温度升高而增大。
以下是氯化钠在不同温度下的溶解度数据:温度(℃)溶解度(g/100g水)0 35.710 38.220 40.730 43.340 45.82.2 溶解度与压力关系对于大部分固体物质来说,压力对其溶解度的影响并不显著。
但是对于气体溶解在液体中的情况,溶解度与压力成正比关系,即亨利定律。
亨利定律可以用来描述气体在液体中的溶解度。
以二氧化碳(CO2)在水中的溶解度为例,以下是二氧化碳在不同压力下的溶解度数据:压力(atm)溶解度(g/100g水)1 0.0392 0.0793 0.1184 0.1575 0.1973. 溶解度表溶解度表是一种将物质在不同温度和压力下的溶解度数据整理并呈现的表格。
通过查阅溶解度表,可以了解某种物质在特定条件下的最大溶解量。
以下是一份简单的氯化钠在不同温度下的溶解度表:温度(℃)溶解度(g/100g水)0 35.710 38.220 40.730 43.340 45.8通过这个溶解度表,我们可以看出在不同温度下氯化钠的溶解度变化情况。
例如,在0℃下,氯化钠的溶解度为35.7g/100g水,而在40℃下,氯化钠的溶解度增加到了45.8g/100g水。
4. 应用4.1 溶解过程控制通过研究物质的溶解度曲线和溶解度表,可以控制物质的溶解过程。
根据所需的溶液浓度和温度条件,可以确定需要加入的物质量,并且通过调整温度来控制物质的最终溶解量。
