2019年高考化学必考知识点双向细目表
高考化学知识点双向细目表

8化肥农药与污染
空气,土壤,水污染
55
9精细化工
表面活性剂
本文来自布克网:()
范文栏目:/fanwen/
个人总结栏目:/fanwen/grzj/
有机反应
43
6以烷、烯、炔和芳香烃的代表物为例,比较它们在组成、结构、性质上的差异。
有机物的类型,结构与性质
44
7认识卤代烃、醇、酚、醛、羧酸、酯典型代表物的组成和结构特点,知道它们的转化关系。
45
8认识糖类的组成和性质特点
46
9能说出氨基酸的组成、结构特点和主要化学性质,了解蛋白质的组成、结构和性质
高考化学知识点双向细目表
序号
内容标准
涉及相关概念及主要知识
必修模块
1
认识摩尔是物质的量的基本单位。
摩尔
2
初步学会根据物质的组成和性质对物质进行分类。
单质、化合物、有机化合物、无机化合物
3
知道胶体是一种常见的分散系
分散系、胶体
4
知道酸、碱、盐在溶液中能发生电离,通过实验事实认识离子反应及其发生的条件
酸碱盐电解质非电解质、强弱电质、电离
10
通过生产、生活中的实例了解化学能与热能的相互转化
放热反应、吸热反应、反应热
11
举例说明化学能与电能的转化关系及其应用
原电池、电解池
12
认识化学反应的速率和化学反应的限度
化学反应速率、化学反应限度
13
了解甲烷、乙烯、苯等的主要性质,知道乙醇、乙酸、糖类、油脂、蛋白质的组成和主要性质
有机化合物种类、反应
盐类的水解
24
能描述沉淀溶解平衡,知道沉淀转化的本质
沉淀溶解平衡
2019年高考化学必考基础知识复习重点清单(完整版)

性。
非金属单质的氧化性强弱与元素的非金属性十分相似,元素的非金属性越强,
单质的氧化性也越强。氟是氧化性最强的非金属单质。氧化性规律有:①活泼金属
阳离子的氧化性弱于不活泼金属阳离子的氧化性,如 Na+<Ag+;②变价金属中,高
价态的氧化性强于低价态的氧化性,如
Fe3+>
Fe2+,
MnO 4 -
>
MnO
13.非金属性
是指元素的原子在反应中得到(吸收)电子的能力。元素的原子在反应中越容
易得到电子。 元素的非金属性越强, 该元素的单质越容易与 H2 化合,生成的氢化物
越稳定,它的最高价氧化物的水化物 (含氧酸) 的酸性越强 (氧元素、 氟元素除外)。
已知氟元素是最活泼的非金属元素。它与氢气在黑暗中就能发生剧烈的爆炸反
不成盐氧化物: CO、NO
成盐氧化物:酸性氧化物: CO2、 SO2…
第 10 页 共 10 页
碱性氧化物: Na2O2、CuO… 两性氧化物: Al 2O3、 ZnO 过氧化物: Na2O2 超氧化物: KO2 26.同素异形体
由同种元素所形成的不同的单质为同素异形体。
(1)常见同素异形体:红磷与白磷; O2 与 O3;金刚石与石墨。 (2)同素异形体之间可以相互转化,属于化学变化但不属于氧化还原反应。
Na2HPO4… ③碱式盐: Cu2(OH)2CO3… ④复盐: KAl(SO 4)2·12H2O…
25.氧化物
由两种元素组成,其中一种是氧的化合物叫氧化物。
(1)氧化物的分类方法按组成分:
金属氧化物: Na2O、 Al 2O3、 Fe3O4… 非金属氧化物: NO2、CO、SO2、CO2… (2)按性质分:
2019年全国新课程卷III化学命题双向细目表

√
√
√
√
中难
36
15
回收废铁屑制备聚合硫酸铁生产工艺/铁锈成分、反应速率影响因素、酸浸及离子方程式书写、Fe2+、Fe3+性质、绿色氧化剂H2O2、常减压蒸发、信息型盐基度B的计算[选2/概理+元化+计算]
√
√
√
√
中
37
15
半导体材料GaAs/As电子排布式、I1、AsCl3分子的立体构型(VSEPR)、sp3杂化、熔点判断三类晶体、共价键(原子晶体)、GaAs晶胞中原子的体积占晶胞体积的百分率计算[选3/概理+计算]
新课标全国III卷(化学)命题双向细目表
题号
题型
分值
考查的主要内容及知识点
能力要求
知识要求
难度
要求
接受、吸收、整合化学信息的能力
分析问题和解决(解答)化学问题的能力
化学实验与探究能力
了解
理解掌握
综合应用
7
选
择
题
6
化学与生活[泡沫灭火器、腐蚀印刷电路板、漂白、玻璃蚀刻]
√
√
易
8
6
有机物[乙烷取代、乙烯加聚、乙醇与溴乙烷溶解性、乙酸官能团异构]
√
√
易
9
6
实验操作[浓硫酸稀释、装置拆卸、萃取及分液、氯气净化]
√
√
√
中
10
6
有机物[异丙苯分子式、沸点、C的共面、同系物]
√
√
√
中
11
6
原电池电解池原理[Zn/KOH/空气、充电时K+定向移动及c(OH–)变化、放电时负极反应及计算]
√
2019全国卷I高考化学双向细目表及考点对应知识点总汇

命题区间一化学基本素养的考查角度一关注“化学与技术、社会环境”的协调发展1.高考有关“化学与社会和谐发展”试题的选材热点总结(1)安全与健康——人体必需的营养元素;重金属对人体的危害;食品添加剂;有关化学与健康方面的材料等。
(2)大气污染雾霾——大气中可吸入颗粒物(PM10、PM2.5)过多,产生的主要原因有汽车尾气、化石燃料的燃烧、工业排放的废气(如:冶金、窑炉与锅炉、机电制造业等)、建筑工地和道路交通产生的扬尘。
酸雨(pH<5.6)——大气中含硫氧化物、含氮氧化物过多,与化石燃料的燃烧、工业废气的排放(如硫酸、硝酸的生产、冶金)、雷电等有关。
光化学烟雾——大气中的氮氧化物过多,与汽车尾气、化石燃料的燃烧有关。
(3)白色污染——人们对难降解的塑料垃圾(多指塑料袋)污染环境现象的一种形象称谓。
(4)能源清洁能源——天然气、氢气等在燃烧时不产生烟尘的能源;化石能源——天然气、石油和煤等能源;绿色能源——不产生负效应的能源,如氢能、风能、太阳能等;新能源——最新开发利用的能源,如氢能、风能、太阳能、核能等。
(5)无机材料一般可以分为传统的和新型的无机材料两大类。
传统的无机材料是指以二氧化硅及其硅酸盐化合物为主要成分制备的材料,因此又称硅酸盐材料,主要包括水泥、玻璃和陶瓷。
新型无机材料是指用氧化物、氮化物、碳化物、硼化物、硫化物、硅化物以及各种非金属化合物经特殊的先进工艺制成的具有某种优异性能的材料。
2.绿色化学的特点研究对环境没有任何副作用的化学试剂、化学制品和化学工艺。
它包括:(1)开发绿色反应,将原子利用率提高到100%;(2)使用无毒无害的原料;(3)选用无毒无害的催化剂;(4)使用无毒无害的溶剂;(5)发展“绿色工艺”;(6)开发和生产绿色产品。
角度二关注生产和生活中的常见物质1.熟记常见物质的俗名及化学式(1)明矾:KAl(SO4)2·12H2O(2)胆矾、蓝矾:CuSO4·5H2O(3)绿矾:FeSO4·7H2O(4)钡餐、重晶石:BaSO4(5)孔雀石(铜绿):Cu2(OH)2CO3(6)水晶、石英:SiO2(7)纯碱、苏打:Na2CO3(8)磁性氧化铁:Fe3O42.熟记生活中的下列物质(1)无机盐净水剂:氯化铁,硫酸亚铁,硫酸铁,硫酸铝,氯化铝,明矾。
2019最新高考化学必考知识点双向细目表
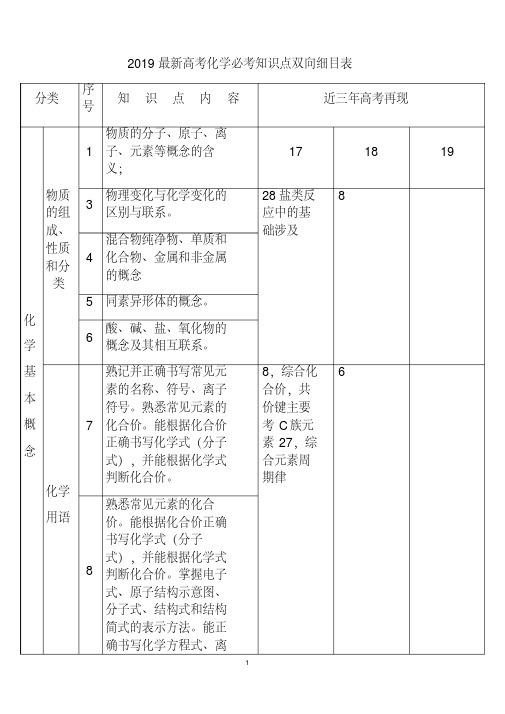
2019最新高考化学必考知识点双向细目表分类序号知识点内容近三年高考再现化学基本概念物质的组成、性质和分类1物质的分子、原子、离子、元素等概念的含义;17 18 193物理变化与化学变化的区别与联系。
28盐类反应中的基础涉及84混合物纯净物、单质和化合物、金属和非金属的概念5 同素异形体的概念。
6酸、碱、盐、氧化物的概念及其相互联系。
化学用语7熟记并正确书写常见元素的名称、符号、离子符号。
熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
8,综合化合价,共价键主要考C族元素27,综合元素周期律68熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法。
能正确书写化学方程式、离子方程式、电离方程式、电极反应式。
化学中常用计量12了解相对原子质量、相对分子质量的含义。
11,综合原子结构中等6,氧化还原涉及简单13物质的量的单位--摩尔(mol),摩尔质量、气体摩尔体积(相应单位为g·mol-1、L·mol-1)。
14物质的量浓度(mol·L-1)、阿伏加德罗常数。
15掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系。
化学反应与能量16掌握化学反应的四种基本类型:化合、分解、置换、复分解。
12氧化还原、物质的量、化学计算中等26题一问6,综合部份物质的量计算,主要得失电子守恒、部份氧化还原,中上13题氧化与离子综合10,得失电子守恒,方程式配平17理解氧化还应反应,了解氧化剂和还原剂等概念。
掌握重要氧化剂、还原剂之间的常见反应。
18能判断氧化还原反应中电子转移的方向和数目,并能配平反应方程式。
19 了解化学反应中的能量变化,吸热反应、放热26,热方程,反应11热化学书写反应7热化学书写反应反应、反应热、燃烧热和中和热及新能源的开发等概念。
2019年高考化学知识点双向细目表

2019年高考化学知识点双向细目表分类序号知识点内容近三年高考再现化学基本概念物质的组成、性质和分类1物质的分子、原子、离子、元素等概念的含义;171819 3物理变化与化学变化的区别与联系。
28盐类反应中的基础涉及84混合物纯净物、单质和化合物、金属和非金属的概念5同素异形体的概念。
6酸、碱、盐、氧化物的概念及其相互联系。
化学用语7熟记并正确书写常见元素的名称、符号、离子符号。
熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
8,综合化合价,共价键主要考C族元素27,综合元素周期律68熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法。
能正确书写化学方程式、离子方程式、电离方程式、电极反应式。
化学中常用计量12了解相对原子质量、相对分子质量的含义。
11,综合原子结构中等6,氧化还原涉及简单13物质的量的单位一摩尔(mol),摩尔质量、气体摩尔体积(相应单位为g・molT、L-mol-1)o14物质的量浓度(mol-L-1)、阿伏加德罗常数。
15掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系。
化学反应与能量16掌握化学反应的四种基本类型:化合、分解、置换、复分解。
12氧化还原、物质的量、化学计算中等26题一问6,综合部份物质的量计算,主要得失电子守恒、部份氧化还原,中上13题氧化与离子综合10,得失电子守恒,方程式配平17理解氧化还应反应,了解氧化剂和还原剂等概念。
掌握重要氧化剂、还原剂之间的常见反应。
18能判断氧化还原反应中电子转移的方向和数目,并能配平反应方程式。
19了解化学反应中的能量变化,吸热反应、放热反应、反应热、燃烧热和中和热及新能源的开发等概念。
26,热方程,反应热7分11热化学书写反应热,中等7热化学书写反应热,中等溶液20了解溶液的含义8涉及21了解溶液的组成,理解溶液中溶质的质量分数的概念。
2019年高考化学复习指导高考化学知识点覆盖双向细目表

21
原子核外电子排布规律。
√
22
元素周期律的实质。
√
23
元素周期表(长式)的结构(周期、族)及其应用。
√
24
以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系
√
25
以IA和ⅦA族为例,掌握同一主族元素性质递变规律与原子结构的关系。
√
26
金属、非金属在元素周期表中的位置及其性质递变规律。
√
48
化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。
√
电解质溶液
49
电解质的概念、强电解质和弱电解质的概念。
√
50
电解质在水溶液中的电离,以及电解质的导电性。
√
51
水的电离,离子积常数。
√
52
了解溶液pH的含义及其测定方法,能进行pH的简单计算。
√
53
弱电解质在水溶液中的电离平衡。
√
27
化学键的定义。离子键、共价键的的形成。
√
化学反应与能量
28
氧化还原反应的本质是电子转移。
√
29
常见的氧化还原反应。
√
30
常见氧化还原反应的配平和相关计算。
√
31
化学反应中能量转化的原因及常见的能量转化形式。
√
32
化学能与热能的相互转化。吸热反应、放热反应、反应热等概念。
√
33
热化学方程式的含义,能正确书写热化学方程式。
√
81
常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
√
82
常见物质进行检验、分离和提纯的方法。
√
2019年高考化学复习指导:高考化学知识点---练考覆盖双向细目表
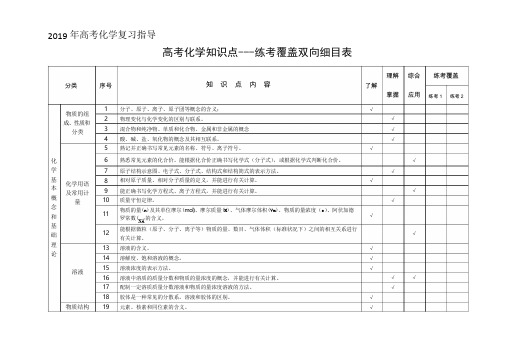
)2019 年高考化学复习指导高考化学知识点---练考覆盖双向细目表理解 综合 练考覆盖分类 序号知 识 点 内 容了解物质的组 成、性质和分类12 3 45 分子、原子、离子、原子团等概念的含义; 物理变化与化学变化的区别与联系。
混合物和纯净物、单质和化合物、金属和非金属的概念 酸、碱、盐、氧化物的概念及其相互联系。
熟记并正确书写常见元素的名称、符号、离子符号。
√√掌握√√√应用练考 1 练考 2化 6 熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),或根据化学式判断化合价。
√学 7原子结构示意图、电子式、分子式、结构式和结构简式的表示方法。
√基 本 概 念 和 基 础化学用语 及常用计量8910 1112 相对原子质量、相对分子质量的定义,并能进行有关计算。
能正确书写化学方程式、离子方程式,并能进行有关计算。
质量守恒定律。
物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(Vm)、物质的量浓度(c )、阿伏加德 罗常数(NA 的含义。
能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行 有关计算。
√√√√√理 论1314溶液的含义。
溶解度、饱和溶液的概念。
√√ 溶液1516 溶液浓度的表示方法。
溶液中溶质的质量分数和物质的量浓度的概念,并能进行有关计算。
√√√17 配制一定溶质质量分数溶液和物质的量浓度溶液的方法。
√18物质结构19胶体是一种常见的分散系。
溶液和胶体的区别。
元素、核素和同位素的含义。
√√元素周期律2021原子构成。
原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
原子核外电子排布规律。
√√22元素周期律的实质。
√23元素周期表(长式)的结构(周期、族)及其应用。
√2425以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系以IA和ⅦA族为例,掌握同一主族元素性质递变规律与原子结构的关系。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
30
掌握元素周期律的实质,了解元素周期表(长式)的结构(周期、族)及其应用。
27.
9题涉及
12题综合周期律、表
31
以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以I A 和ⅦA 族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
27综合整块知识,有图象分值,转化率计算,方向15分,中等及中上难度
8涉及27题15分综合化学平衡及速率,难度中上
33
了解化学反应的可逆性。理解化学平衡的含义及其与反应速率之间的联系。
34
理解勒沙特列原理的含义。理解浓度、温度、压强等条件对化学平衡移动的影响。
35
以合成氨工业生产为例,用化学反应速率和化学平衡的观点理解工业生产的条件。
电
解
质
溶
液
36
了解电解质和非电解质、强电解质和弱电解质的概念。
28题,共13分,综合离子反应,盐类反应,实验方案,离子检验
8,涉及离子反应量变关系
10题涉及29题15分多半,综合元素化合物知识
6,方程式书写,中下9综合反应速率图象29电解综合运用15分,涉及实验方案
37
理解离子反应的概念。
38
理解电解质的电离平衡概念。
18
能判断氧化还原反应中电子转移的方向和数目,并能配平反应方程式。
19
了解化学反应中的能量变化,吸热反应、放热反应、反应热、燃烧热和中和热及新能源的开发等概念。
26,热方程,反应热7分
11热化学书写反应热,中等
7热化学书写反应热,中等
溶液
20
了解溶液的含义
8涉及
21
了解溶液的组成,理解溶液中溶质的质量分数的概念。
2019年高考化学必考知识点双向细目表
分类
序号
知 识 点 内 容
近三年高考再现
化
学
基
本
概
念
物质的组成、性质和分类
1
物质的分子、原子、离子、元素等概念的含义;
17
18
19
3
物理变化与化学变化的区别与联系。
28盐类反应中的基础涉及
8
4
混合物纯净物、单质和化合物、金属和非金属的概念
5
同素异形体的概念。
6
酸、碱、盐、氧化物的概念及其相互联系。
54
从原子的核外电子排布,理解卤族元素(单质、化合物)的相似性和递变性。
55
掌握氯气的化学性质,了解几种重要的含卤素化合物的性质和用途。
56
了解这些元素(如:H,O,S,N,P,C,Si)的单质及某些氧化物、氢化物的性质。
57
以Na2O2为例,了解过氧化物的性质。
58
掌握硫酸、硝酸的化学性质。
59
以硫酸为列,了解化工生产化学反应原理的确定。初步了解原料与能源的合理利用、"三废处理"与环境保护以及生产过程中的综合经济效益问题。
化学反应与能量
16
掌握化学反应的四种基本类型:化合、分解、置换、复分解。
12氧化还原、物质的量、化学计算
中等26题一问
6,综合部份物质的量计算,主要得失电子守恒、部份氧化还原,中上13题氧化与离子综合
10,得失电子守恒,方程式配平
17
理解氧化还应反应,了解氧化剂和还原剂等概念。掌握重要氧化剂、还原剂之间的常见反应。
11综合同位素,物质的量计算,中等
9题,综合元素周期表,中等
27
以第1,2,3周期的元素为例,了解原子核外电子排布规律。
28
理解离子键、共价键的含义。理解极性键和非极性键。了解极性分子和非极性分子。了解分子间作用力。初步了解氢键。
29
了解几种晶体类型(离子晶体、原子晶体、分子晶体、金属晶体)及其性质。
39
了解水的电离、溶液pH等概念。
7,选择,6分,中等
10综合电离,
8涉及,
40
了解强酸强碱中和滴定的原理。
9,选择,6分,
13离子反应量变关系
41
理解盐类水解的原理。了解盐溶液的酸碱性。
10综合电离水解
中上难度
8涉及
42
理解原电池原理。初步了解化学电源。了解化学腐蚀与电化学腐蚀及一般防腐蚀方法。
10主要电解综合原电池
化学
用语
7
熟记并正确书写常见元素的名称、符号、离子符号。熟悉常见元素的化合价。能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
8,综合化合价,共价键主要考C族元素27,综合元素周期律
6
8
熟悉常见元素的化合价。能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法。能正确书写化学方程式、离子方程式、电离方程式、电极反应式。
8,选择,6分,,简单27,综合元素化合物15分
28元素周期律和元素化合物知识共15分难度中等及中上
化学反应速率
化学平衡
32
了解化学反应速率的概念,反应速率的表示方法,理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响。
13,综合考化学速率及平衡6分,中等以上难度
26,第三问速率及平衡,中上4分
22
了解饱和溶液、不饱和溶液的概念。了解溶解度的概念。了解温度对溶解度的影响及溶解度曲线。
23
初步了解结晶、结晶水、结晶水合物、风化、潮解的概念。
24
了解胶体的概念及其重要性质和应用。
7,综合胶体性质及应用,中等
化
学
基
本
理
论
物
质
结
构
25
了解原子的组成及同位素的概念。
26
理解原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的相互关系
化学
中常
用计
量
12
了解相对原子质量、相对分子质量的含义。
11,综合原子结构
中等
6,氧化还原涉及
简单
13
物质的量的单位--摩尔(mol),摩尔质量、气体摩尔体积(相应单位为g·mol-1、L·mol-1)。
14
物质的量浓度(mol·L-1)、阿伏加德罗常数。
15
掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系。
43
理解电解原理。了解铜的电解精练、镀铜、氯碱工业等反应原理。
10,选择,6分,
元
素
及
其
化
合
物
常
见
金
属
元
素
的
性
质
44
了解金属钠的物理性质,掌握钠和镁化学性质。
45
从原子的核外电子排布,理解ⅠA 、ⅡA族元素(单质、化合物)的相似性和递变性。
46
以氢氧化钠为例,了解重要的碱的性质和用途。了解钠的重要化合物。
47பைடு நூலகம்
了解金属的通性,金属冶炼的一般原理。初步了解金属的回收和资源保护。
48
掌握Fe和Al的化学性质。
49
掌握常见金属的活动顺序。
50
以Fe(Ⅱ)Fe(Ⅲ)的相互转化为例,了解变价金属元素的氧化还原性。
51
了解铝的重要化合物。
52
初步了解合金的概念。
常
见
非
金
属
元
素
的
性
质
53
以氯为例,了解卤族元素的物理性质和化学性质。
