第二章 原子结构和晶体的结合力
第二章 晶体的结合

范德瓦尔斯力的分类: 1)葛生互作用力:取向力,固有电偶
极矩间的作用力(极性分子晶体中) 2)德拜互作用力:感应力,感应电偶极
矩间的作用力(极性分子晶体中) 3)伦敦互作用力:弥散力,瞬时电偶极
矩间的作用力(非极性分子晶体中)
一、极性分子结合 因为两极性分子同性相斥,异性相吸,有使偶极矩 排成一个方向的趋势。
r
12
A6
r12
j
1 a1j2
,
A6
j
1 a6j
2.2.4 离子晶体的结合能
若两个离子间的互作用势为
r
e2
40r
b rn
I族元素:Li、Na、K、Ru、Cs具有最低的负 电性,它们的晶体是最典型的金属。负电性 较低的元素对电子束缚较弱,容易失去电子, 因此形成晶体时便采取金属性结合。 IV族至VI族元素:具有较强的电负性,它们 束缚电子比较牢固,获取电子的能力较强, 这种情况适于形成共价结合。 IV族元素:最典型的结构是金刚石结构,金 刚石结构直接反映了共价结合的特点。
2.2.3 分子晶体的结合能
惰性气体分子间的相互作用是瞬时偶极矩与
瞬时感应偶极矩间的作用,类同于极性分子
与非极性分子的吸引势,所以一对分子间的
互作用势能为
r
A r6
B r12
引入两个参量
A2 4B
,
1
B 6 A
r
4
r
12
原子间吸引力和排斥力的来源: 吸引力:异种电荷的库仑引力。 排斥力: 1.同种电荷的静电排斥。
固体物理:第二章 晶体的结合

晶体为什么形成这么有序的结构?
7
原子结合成晶体时,原子的外层电子要作重新
分布
不同分布产生了不同类型的结合
力
不同类型的结合力,导致了晶体结合
的不同类型。
+ = 原子
原子核+ 芯电子(稳定、满壳层)
价电子
原子外层的芯电子层对相互作用贡献不大,价电子的
相互作用
决定了原子间的相互作用后的性质。
同一种原子,不同的结合类型中具有不同的电子云分布,因此呈现出
10
我们讲到:
原子外层的芯电子层对相互作用贡献不大,价电子相互
作用
决定了原子间相互作用的性质。
原来中性的原子能够结合成晶体,除了外界的压力和温度 等条件的作用外,主要取决于原子最外层电子的作用。没 有一种晶体结合类型,不是与原子的电性有关的。
下面我们来系统学习一下:18
各壳层容纳的电子数
19
能量最低原理 “电子优先占据最低能态”
20
21
22
原子捕获电子的能力(电性)
一、电离能
定义:使原子失去一个电子所需要的能量称为原子的电离能。 从原子中移去第一个电子所需要的能量为第一电离能,从正1 价离子中再移去一个电子所需要的能量为第二电离能。
Na + 5.14 eV Na+ + e
23
电离能的大小可以用来度量原子对价电子的束缚强弱。 电离能越大,越难失去电子;电离能越小,越易失去电 子,金属性越强。 在一个周期内,从左到右,电离能不断增加。
24
二、电子亲和能
定义:一个中性原子获得一个电子成为负离子所释放出的能 量称为电子亲和能,亲和过程不能看成是电离过程的逆过程。 电子亲和能越大,那么得到电子的能力越大。 电子亲和能一般随原子半径的减小而增大。因为原子半径小, 核电荷对电子的吸引力较强,对应较大的互作用势。
材料科学基础 第二章 固体材料的结构

第二章固体材料的结构固体材料的各种性质主要取决于它的晶体结构。
原子之间的作用结合键与晶体结构密切相关。
通过研究固体材料的结构可以最直接、最有效地确定结合键的类型和特征。
固体材料主要包括:金属、合金、非金属、离子晶体、陶瓷研究方法:X光、电子、中子衍射——最重要、应用最多§2-1 结合键结合键——原子结合成分子或固体的结合键决定了物质的物理、化学、力学性质。
一切原子之间的结合力都起源于原子核与电子间的静电交互作用(库仑力)。
不同的结合键代表了实现结构)的不同方式。
一、离子键典型的金属与典型的非金属元素就是通过离子键而化合的。
从而形成离子化合物或离子晶体由共价键方向性特点决定了的SiO2四面体晶体结构极性共价键非极性共价键五、氢键含有氢的分子都是通过极性共价键结合,极性分子之间结合成晶体时,通过氢键结合。
例如:H 2O ,HF ,NH 3等固态冰液态水§2-2 金属原子间的结合能一、原子作用模型固态金属相邻二个原子之间存在两种相互作用:a) 相互吸引——自由电子吸引金属正离子,长程力;b) 相互排斥——金属正离子之间的相互排斥,短程力。
平衡时这二个力相互抵消,原子受力为0,原子处于能量最低状态。
此时原子间的距离为r0。
§2-3 合金相结构基本概念♦合金——由两种或两种以上的金属或金属非金属元素通过化学键结合而组成的具有金属特性的材料。
♦组元、元——组成合金的元素。
♦相——具有相同的成分或连续变化、结构和性能的区域。
♦组织——合金发生转变(反应)的结果,可以包含若干个不同的相,一般只有一到二个相。
♦合金成分表示法:(1) 重量(质量)百分数A-B二元合金为例m B——元素B的重量(质量m A——元素A的重量(质量合金中的相分为:固溶体,化合物两大类。
固溶体金属晶体(溶剂)中溶入了其它元素(溶质)后,就称为固溶体。
一、固溶体的分类:♦按溶质原子在溶剂中的位置分为:置换固溶体,间隙固溶体♦按溶解度分为:有限固溶体,无限固溶体♦按溶质原子在溶剂中的分布规律分为:有序固溶体,无序固溶体置换固溶体:溶质原子置换了溶剂点阵中部分溶剂原子。
7、晶体的结合力(第二章)详解

A Wi A (e)
原子半径、有效核电荷和原子的 电子构型 电离能的意义:反映了元素原子失
电子的难易,电离能越大,失电子
越难,金属性越弱,电离能越小, 金属性越强。
电离能变化规律:
A:同周期元素而言,ⅠA族第一电离能小,ⅦA族第一电离能最大,从左到右总体 呈现增大趋势. B:同主族,从上到下,第一电离能逐渐减弱
胞是体心立方结构。碳原子
熔于铁的体心立方组织叫铁 素体--单相α 相 。 纯 铁 在 912℃ 以 上 的 晶 胞也是一个立方体 -- 面心立 方结构。碳原子熔于铁的面 心立方组织叫奥氏体。
第 26 页
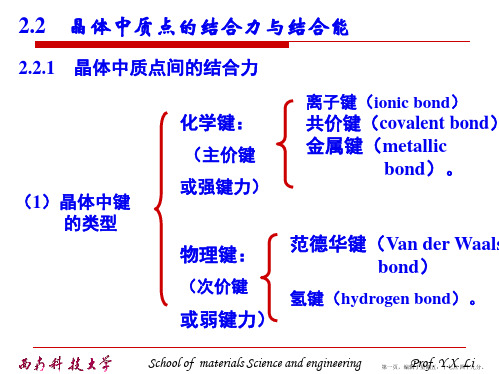
§2.2 晶体的结合类型
Page 27
不同金属的熔点,在很宽的范围内变化。铅的熔点:327度,锡的熔
第 21 页
§2.2 晶体的结合类型
三、金属结合(金属晶体)
(1)元素族:
大多数的元素是金属,周期表上I, II
族元素及过渡元素(Cu, Al, Mg, Zn, Ni)
(2)结合方式: 原子的最外层电子形成共有化的电子云,剩下的原子实(正离子)具有 稳定的满壳层结构。 (3)结合力: 原子实(正离子)和电子云之间的静电库仑力。无饱合性和方向性。 原子实与电子云之间的作用,不存在明确的方向性,原子实与原子实
原子中各壳层可以容纳的最多电子数
壳层 (主量子数)
K(n=1)
L(n=2) M(n=3) N(n=4) O(n=5)
支壳层2(2l+1)
S(l=0) P(l=1) d(l=2) f(l=3) g(l=4)
最多电 子数
(2n2)
2
2 2 2 2
6 6 6 6
10 10 10
14 14
第二章晶体的结合

两个相互平行的电偶极子的库仑势能可以求 出:
ur
1
40
q2 r
r
q2 l2 l1
q2 r l1
q2 r l2
ur
q2
40r
1 1
1 l2 l1
1 1 l1
1 1 l2
q2l1l2
1 2
N i 1
N j 1
' 4
rij
6
rij
12
N 2
N j 1
'
4
rij
6
rij
12
说明:金属晶体中,价电子不再属于个别 原子,而是为所有原子所共有,在 晶体中做共有化运动,或者说金属中 所有原子都失掉了最外层价电子成为 原子实(离子实),原子实浸没在 共有电子的电子云中,金属晶体的 结合力主要是原子实和共有化电子的 静电库仑力。
4. 范德瓦耳斯键和分子晶体
分子间的相互作用力(范德瓦耳斯力)分为三种:
配位数小,4 特点:
1)饱和性(一个原子只能形成一定数目的共价 键。)
2)方向性:原子只在特定的方向上形成共价键。 3)熔点高、硬度大、导电性差,结合能大 约为800kJ/mol。
饱和性经验公式:当原子的价电子壳层不到半满 时,所有的价电子都未配对,共价键数目与价电 子数相等。N=n(N为价电子数);当原子的价 电子壳层不满但超过半满时,形成的共价键数目n =8-N。
固体物理 第二章 结合能

固体物理第二章 23
固体物理第二章
17
固体物理第二章
18
3
典型的共价键是氢分子的共价键,两个氢原子 的价电子,围绕着两个氢原子核运动,形成 电子云。在两个氢核之间,为两个氢核所共 有。实际上,共价键的现代理论正是由氢分 子的量子理论开始的。 设想有原子A 和 B ,它们表示互为近邻的一对 原子。当它们是自由原子时,各有一个价电 子,归一化的波函数分别用 A 、 B 表示,即:
这一四体问题迄今还不能严格求解,需作近 似处理,常用的比较成功的做法是分子轨道 法 (Molecular Orbital Method) 。忽略电子 - 电 子间相互作用,且假定 : (r1 , r2 ) 1 (r ) 2 (r )
固体物理第二章 20
2 2 2 2 1 2 VA1 VA 2 VB1 VB 2 V12 2m 2m
* H dr
* H aa * A H A dr B H B dr 0
* H ab * A H B dr B H A dr 0
* dr
2 2C ( H aa H ab )
+态波函数是对称的,可填充两个自旋相反的电子, +态的能量亦低于自由氢原子1s态的能量。较多出现
固体物理第二章 3
2-1 结合力的普遍性质与结合能
研究组成晶体的原子结构和它们之间的结合力与结 合力的性质,是固体物理中最基本、最重要的问题 之一。 不同的晶体具有不同的结合力类型,但它们的结合力 在定性上具有共同的普遍性质。 在晶体中,粒子的相互作用可分为吸引作用和排斥作 用两类。当粒子间距离较远时(大于几个A),吸引作 用为主;当距离较近时 ( 小于平均粒子间距),排斥 作用为主;当距离适当时,二者相等,相互抵消, 使晶体中的粒子处于平衡状态。 首先研究处于基态的两个相同的原子由相距无穷远处 移到一起时能量和结合能变化的情形。
固体物理第二章复习

式中
B
1
6
;
A2
A
4B
'N 1
A12
j
a12 j
A6 , A12 是仅与晶体结构有关的常数。
'N 1
A6
j
a6 j
3.原子晶体、金属晶体和氢键晶体
(1)原子晶体
结构:第Ⅳ族、第Ⅴ族、第Ⅵ族、第Ⅶ族元素都可以形成
原子晶体。
结合力: 共价键 (2)金属晶体
饱和性 方向性
层一共有 8 个量子态, 最多能接纳(8- N)个电子, 形成(8- N)个共价键. 这就 是共价结合的 “饱和性”.
共价键的形成只在特定的方向上, 这些方向是配对电子波函数的对称轴方向, 在这个方向上交迭的电子云密度最大. 这就是共价结合的 “方向性”.
10. 为什么许多金属为密积结构? 金属结合中, 受到最小能量原理的约束, 要求原子实与共有电子电子云间的
(2)结合力: 范德瓦尔斯力。
(3)配位数: 通常取密堆积,配位数为12。
(4)互作用势能:
u(r )
4
12
6
r r
U ( R)
2 N
A12
R
12
A6
R
6
雷纳德-琼斯势
r1 rA a, a1 1, r2 rB 2a, a2 2, r3 rC 3a, a3 3,
2( 1 1 1 1 ) ln( 1 x ) x x2 x3 x4
第二章晶体结构结合力和结合能
较弱 无方向性键、结构密堆、低 熔点、绝缘
氢键 氢原子核与极性分子 弱 有方向性和饱和性 间的库仑引力School of materials Science and engineering Prof. Y.X. Li 第五页,编辑于星期五:十七点 四十九分。
2.3 晶体中质点的堆积
2.3.1 原子半径和离子半径 原子半径或离子半径
有效半径
离子半径 共价半径 金属半径
一种原子在不同的晶体中,与不同的元素相结合时, 其半径有可能发生变化。晶体极化、共价键的增强和配位 数的降低都可使原子或离子之间距离缩短,而使其半径减 小。
School of materials Science and engineering Prof. Y.X. Li 第十三页,编辑于星期五:十七点 四十九分。
对于1molAX型晶体,原子总数N=2N0,于是晶格
能计算如下:
EL
N0 Az1z2e2 1 1
4 0r0
n
取决于晶体 结构类型
式中:A-马德龙常数见表2.4(P24)
n-Born Index.(与离子的电子层结构有关)。
ε0-真空的介电常数,
取决于电子 ≈8.85×10-12C2.N-1m-2 层结构
School of materials Science and engineering Prof. Y.X. Li 第二十一页,编辑于星期五:十七点 四十九分。
2.3.3 内在因素对晶体结构的影响-化学组成 (1)原子或离子半径
•原子半径或离子半径是定值吗?
•原子半径或离子半径的大小与哪些因 素有关?
氢键:指氢原子同时与两个电负性很大而原子半径较
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、共价键
——亚金属(C、Si、Sn、Ge)、 聚合物和无机非金属材料。 实质:由二个或多个电负性差不大的原子间通过共用电子 对形成。 在形成共价键时,为使电子云达到最大限度的重叠,共 价键就有方向性,键的分布严格服从键的方向性。 当一个电子和另一个电子配对以后就不再和第三个电子 配对了,成键的公用电子对数目是一定的,这就是共价键 的饱和性。
电负性:原子在分子中吸引成键电子的能力。 元素的电负性大,表示原子在分子内吸引电子 的能强。 元素的电负性目前还无法直接测定 目前较为通用的是鲍林的电负性标度。 鲍林的电负性标度: 假定元素氢H的电负性=2.05 然后通过比较和计算得到其它元素的电负性(32页)。
同周期元素变化:
同周期元素,电负性从左到右加大。
共价键
Covalent Bonding
主价键
Primary Bonding
结合键 Bonding
物理键
Physcal Bonding
金属键
Metallic Bonding
范德华键
Van der Waals Bonding
次价键
Secondary Bonding
氢键
Hydrogen Bonding
电负性
考虑到核外电子运动的特殊性,求解波函数时,引入了 三个量子化参数,分别为::主量子数n,k,m
主量子数 n:
n=1 2 3 4 · · · · · · ,n 对应主壳层:K L M N •主要决定电子的能量 •电子离核的平均距离 •电子层数 •各电子层的轨道数
角量子数 l:
l=0,1,2,· · · · · · ,(n -1)等正整数,
六、各种结合键的特点比较
离子键、共价键和金属键都涉及到原子外层电子的重新 分布,这些电子在键合后不再仅仅属于原来的原子,因此, 这几种键都称为化学键。
在形成分子键和氢键时,原子的外层电子分布没有变化, 或变化极小,它们仍属于原来的原子。因此,分子键和氢 键就称为物理键。
一般说来,化学键最强,氢键和分子键较弱。
α粒子
α粒子
电子
卢瑟福提出含核原子结构模型。主要观点是:
(1)每一个原子都有一个体积极小、极密实的核;
(2)原子核占有全部正电荷和几乎全部的原子质量;
(3)原子核被一个体积很大几乎什么也没有的空间包围着; (4)原子核外的空间里极稀疏地散布着电子,其总荷数恰好 与原子核中的正电荷相等。
卢瑟福的原子结构的行星模型
电子层 量子数 原子轨道表
电子层 K L n 1 2 l 0 0 m 0 0 0 ±1 0 0 ±1 0 ±1 ±2 原子轨道符 号 1s 2s 2pz 2px ,2py 3s 3pz 3px , 3py 3dz2 3dyz, 3dxz 3dx2-y2, 3dxy 亚层中 原子轨 道数 1 1 电子层 中原子 轨道数n2 1 4
由于这一开拓性的贡献,玻尔获得了1922年诺贝尔 物理学奖。
玻尔理论的局限性:
1.它对能级的描述很能粗略,只有一个量子数。 2.更不能解释原子如何形成分子的化学健的本质。
5 .原子的量子力学模型——核外电子的运动和电 子排布规律
玻尔的原子结构模型理论也不是十分完美,对于多电子 原子的光谱线时,就只能做出近似的估计,无法定量计算。
电子云模型:
对于原子来说, 核外电子的运动状态用波函数描述。 电子的波函数满足薛定谔方程
h2 2 [ ∇ V ] ( x, y, z ) E ( x, y, z ) 2 8 m
2 2 2 2 2 x y z 2
2
ψ——电子波函数: 描述原子核外电子运动状态的一个数学函数式 E——体系的总能量 V——体系的势能 m——微粒的质量 h——普朗克常数 x、y、z——微粒的空间坐标
氟9 F 氯17 Cl 溴35 Br 碘53 I 砹85 At
氦2 He 氖10 Ne 氩18 Ar 氪36 Kr 氙54 Xe 氡86 Rn
镧 57 铈 58 镨 59 钕 60 钷 61 钐 62 铓 63 钆 64 铽 65 镝 66 钬 67 铒 68 铥 69 镱 70 镥 71 La La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu 锕 89 钍 90 镤 91 铀 92 镎 93 钚 94 镅 95 锔 96 锫 97 锎 98 锿 99 镄100 钔101 锘102 铹103 Ac Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
科学家们经过 13 年的艰苦修改、验证、论证,终于在 1925
年~1926年,在玻尔原子结构模型的基础上发展成为原子的 量子力学模型,其核心是薛定锷波动方程。
原子的量子力学模型包括:
① 玻尔所采用的量子化能级的概念,即主量子数(主层)。 ② 此外还提出其他量子数以说明电子的能量,如亚层和轨 道数。 ③ 由于电子属于微观粒子,具有波粒二象性,它在核外的 运动速度可以与光速相比,很难同时准确地测定它的速 度和位置,只能用统计的方法来描述,因而引入了“电 子云”的概念。
IA O
元素周期表
IIIA
IVA
VA
VIA
VIIA
硼5 B 铝13 Al IIB 锌30 镓31 Zn Ga 镉48 铟49 Cd In 汞80 铊81 Hg Tl
碳6 C 硅14 Si 锗32 Ge 锡50 Sn 铅82 Pb
氮7 N 磷15 P 砷33 As 锑51 Sb 铋83 Bi
氧8 O 硫16 S 硒34 Se 碲52 Te 针84 Po
1
0 1
3
1 3
M
3 2
9 5
小结
2.2 原子间的结合力
结合键:原子结合成分子或晶体的作用力。
结合键决定了物质的一系列物理、化学、力学等性质。 从原则上讲,只要能从理论上正确地分析和计算结合键, 就能预测物质的各项性质。
离子键
Ionic Bonding
化学键
Chemical Bonding
同族元素,电负性从上到下减小。
稀有气体的电负性是同周期元素中最高的。 电负性最大的元素是F,最小的元素是钫Fr。 非金属元素电负性>2.0 金属元素电负性<2.0
电负性高 电负性低 氢1 H IIA 锂3 铍4 Li Be Periodic Table of Elements 钠 11 镁 12 Na Mg IIIB IVB VB VIB VIIB VIII IB 钾19 钙 20 钪 21 钛 22 钒 23 铬24 锰25 铁26 钴27 镍28 铜29 K Ca Sc Ti V Cr Mn Fe Co Ni Cu 铷 37 锶 38 钇 39 锆 40 铌 41 钼42 锝43 钌44 铑45 钯46 银47 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag 铯55 钡 56 铪72 钽73 钨74 铼75 锇76 铱77 铂78 金79 La Cs Ba Hf Ta W Re Os Ir Pt Au 钫 87 镭88 Fr Ra Ac
第二章
原子结构和晶体的结合力
2.1 原子结构
近代科学实验证明:原子是由质子和中子组成的原子核,以 及核外的电子所构成的。 原子的体积很小,直径约为10-10m数量级,而其原子 核直径更小,仅为10-13m数量级。 原子的质量恰主要集中在原子核内。因为每个质子 和中子的质量大致为1.67X10-24g,而电子的质量约为 9.11X10-28g,仅为质子的1/1836。
以s,p,d,f· · · · · · 等表示。
•决定电子运动的角动量; •决定原子轨道的形状; •影响多电子原子中电子的能量; •表示同一电子层还可以分出几个亚层。
磁量子数 m
m=0,±1,± 2,±3· · · · · · ,±l 等正整数。 决定了各原子轨道在空间的伸展方向, 电子亚层中原子轨道的数目。
特点:饱和性、方向性 共价键晶体性质:强度高,硬度高,脆性大,熔点高, 沸点高和挥发性低。
金刚石结构
三、金属键
金属键:金属中自由电子与金属正离子之间构成的键。
实质:金属最外层电子数很少(通常s、p 价电子数少于
4),即价电子极易挣脱原子核之束缚而成为自由电子, 形成电子云。
特点:电子共有化,既无饱和性又无方向性, 容易形成低能量密堆结构。 金属键材料特点: 良好的导电性和导热性。 正的电阻温度系数。 不透明并呈现特有的金属光泽。 良好的塑性变形能力,好的强韧性。
1 近代原子论的建立者——道尔顿
化学元素均由不可再分的微粒构成, 这种微粒称为原子。 原子在一切化学变化中均保持其不 可再分性。 同一元素的原子在质量和性质上都 相同,不同元素的原子在质量和性质上 都不相同。 不同元素化合时,这些元素的原子按 简单整数比结合成化合物。
2.汤姆生的原子结构模型-葡萄干面包模型
类 型
作用力来源
键合 强弱
强
形成晶体的特点
无方向性键、高配位数、高熔 点、高强度、低膨胀系数、塑 性较差、固态不导电、熔态离 子导电
原子得、失电子后形成负、 离子键 正离子,正负离子间的库仑 引力 相邻原子价电子各处于相反 共价键 的自旋状态,原子核间的库 仑引力
子运动时所处的能量状态称为能级。电子在轨道上运动时所
具有的能量只能取某些不连续的数值 (电子能量是量子化的 )。
(3)只有当电子从某一轨道跃迁到另一轨道时,才有能量的
吸收或放出。当电子从能量较高的(E2)轨道跃迁到能量较低 的(E0)轨道时,原子就放出能量。放出的能量转变为一个辐 射能的光子,其频率可由两个轨道的能量差决定。玻尔提 出的原子结构模型,揭示了光谱线与原子结构的内在联系。
一、离子键 ——多数盐类、碱类和金属氧化物
实质:金属原子失去电子成为带正电的正离子,非金属
原子得到电子成为带负电的负离子,两个异号离子间的
