盐类水解的实质和规律共34页
盐类水解的实质和规律课件

一、盐类水解的实质和规律
1.通过实验测定下列0.1 mol·L-1盐溶液的pH,填写下表。
盐溶液 盐的类型 溶液pH 酸碱性
NaCl 强酸强碱盐 pH=7 源自性CH3COONa 弱酸强碱盐 pH>7
碱性
NH4Cl 强酸弱碱盐 pH<7
酸性
实验结论:盐溶液的酸碱性与盐的组成类型有关,强酸强碱盐溶液呈
水的电离程度 增大 ―→c(H+)≠c(OH-)―→溶液呈碱性、酸性或中性。
3.特点
合作探究 1.酸溶液的pH<7,碱溶液的pH>7,试根据实验回答下列盐溶液的酸碱 性,并根据盐的类别总结其酸、碱性规律。 (1)NaCl (2)NH4Cl (3)AlCl3 (4)Na2CO3 (5)CH3COONa 答案 (1)中性 (2)酸性 (3)酸性 (4)碱性 (5)碱性 规律:强酸强碱盐溶液呈中性,弱酸强碱盐溶液呈碱性,强酸弱碱盐溶 液呈酸性。
(3)为探究盐类水解是一个吸热过程,请用Na2CO3溶液和其他必要试剂, 设计一个简单的实验方案:_取__N__a2_C_O__3_溶_液__,__滴__加__酚__酞__溶__液__呈__红__色__,__然___ _后_分__成__两__份__,__加__热__其__中__一__份__,__若__红__色__变__深__,__则__盐__类__水__解__吸__热___。
你认为该溶液pH的范围一定介于___7_~__1_3_之间。 (2)为探究纯碱溶液呈碱性是由 CO23- 引起的,请你设计一个简单的实验方案: 向__纯__碱__溶__液__中__滴__入__酚__酞__试__液__,__溶__液__显__红__色__;__若__再__向__该__溶__液__中__滴__入__过__量__氯__化____ 钙__溶__液__,__产__生__白__色__沉__淀__,__且__溶__液__的__红__色__褪__去__。__则__可__以__说__明__纯__碱__溶__液__呈__碱__性____ 是__由___C_O__23-_引__起__的___。
课件1:3.3.1 盐类水解的实质与规律

4、弱酸弱碱盐 CH3COONH4、(NH4)2CO3
思考:我们常用什么方法来确定溶液的酸碱性呢?
一、探究盐溶液的酸碱性的规律
【学生实验】
Ⅰ:用PH试纸分别测定CH3COONa、NH4Cl、 NaCl、Al2(SO4)3、 KNO3溶液的酸碱性。
Ⅱ:取1 - 2ml 0.1mol/L的Na2CO3溶液于试管 中,向试管中滴入酚酞试液,观察溶液颜色是 否变化?
程度:① 水解> ② 电离
∴溶液呈 碱 性
(水解) (电离)
6、对于发生“完全双水解”的盐类,因水解 彻底,故用“=”,同时有沉淀↓和气体↑产生。
常见完全双水解的离子—— Al3+与AlO2-、HCO3-、CO32-、S2-、HS-、ClOFe3+与AlO2-、HCO3-、CO32NH4+与SiO32-
化学方程式:CH3COONa + H2O CH3COOH + NaOH
离子方程式:CH3COO– + H2O CH3COOH + OH–
化学方程式:NaClO + H2O 离子方程式: ClO– + H2O
HClO + NaOH HClO + OH–
3、多元弱酸盐分步水解,但以第一步水解为主。
如,Na2CO3溶液的水解离子方程式为:
如:①AlCl3溶液与NaAlO2溶液反应离子方程式为:
Al3++3AlO2-+6H2O=4Al(OH)3↓ ②AlCl3溶液与NaHCO3溶液反应离子方程式为:
Al3++3HCO3-=Al(OH)3↓+3CO2↑
本节内容结束
更多精彩内容请登录:
盐类的水解 课件

盐类水解平衡影响因素
在一定条件下,当盐类的水解速率等于中和速率时, 达到水解平衡。(动态平衡)
1、内因:盐本身的性质 越弱越水解
① 不同弱酸对应的盐
碱 性 NaClO (aq) > CH3COONa (aq) 对应的酸 HClO < CH3COOH
② 不同弱碱对应的盐
酸 性 MgCl2 (aq) < 对应的碱 Mg(OH)2 >
CO32-+H2O HCO3-+H2O
HCO3- +OHH2CO3 +OH-
结论:草木灰 不宜与铵态
铵态氮肥——铵盐,水解呈酸性
氮肥混合施用
NH4++H2O
NH3·H2O+ H+,
混施后,OH-与H+中和成水,使两种盐的水解
平衡向正反应方向移动,生成大量的NH3·H2O, 进一步分解成NH3逸出了,从而降低了肥效。
盐类水解的影响因素及应用
盐类的水解 :
在溶液中盐电离出来的离子(弱酸根、弱碱 根)跟水所电离出来的H+ 或OH-结合生成弱电 解质的反应,叫做盐类的水解。
水解的实质:破坏了水的电离平衡(促进水的电离)
水解反应与中和反应的关系: 酸+碱 中和
水解的酸碱性规律:
水解
盐+水
有弱才水解,无弱不水解; 谁弱谁水解,越弱越水解; 谁强显水性,同强显中性。 都弱双水解,同弱近中性
③ 同一弱酸对应的盐
AlCl3 (aq) Al(OH)3
对碱应的性酸NaH2CCOO33(–aq)
> <
NaHCO3 H2CO3
(aq)
∴ 正盐的水解程度 > 酸式盐的水解程度
34盐类的水解
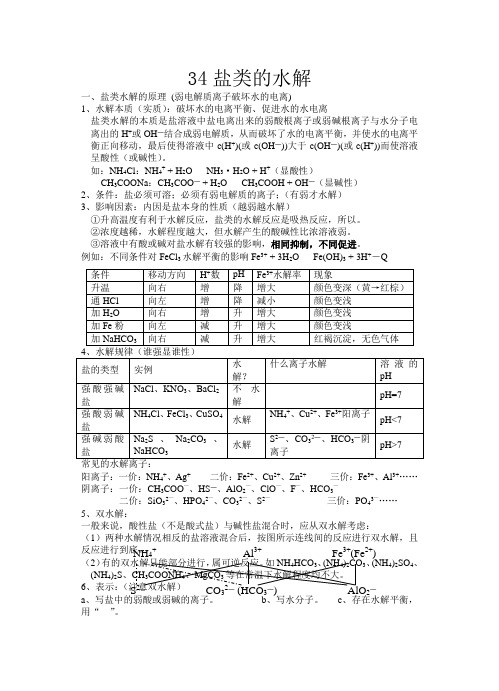
34盐类的水解一、盐类水解的原理 (弱电解质离子破坏水的电离)1、水解本质(实质):破坏水的电离平衡、促进水的水电离盐类水解的本质是盐溶液中盐电离出来的弱酸根离子或弱碱根离子与水分子电离出的H +或OH ―结合成弱电解质,从而破坏了水的电离平衡,并使水的电离平衡正向移动,最后使得溶液中c(H +)(或c(OH ―))大于c(OH ―)(或c(H +))而使溶液呈酸性(或碱性)。
如:NH 4Cl :NH 4+ + H 2O NH 3·H 2O + H +(显酸性)CH 3COONa :CH 3COO ― + H 2O CH 3COOH + OH ―(显碱性)2、条件:盐必须可溶;必须有弱电解质的离子;(有弱才水解)3、影响因素:内因是盐本身的性质(越弱越水解)①升高温度有利于水解反应,盐类的水解反应是吸热反应,所以。
②浓度越稀,水解程度越大,但水解产生的酸碱性比浓溶液弱。
③溶液中有酸或碱对盐水解有较强的影响,相同抑制,不同促进。
例如:不同条件对FeCl 3水解平衡的影响Fe 3+ + 3H 2O Fe(OH)3 + 3H +-Q 4、水解规律(谁强显谁性)盐的类型 实例 水解?什么离子水解 溶液的pH 强酸强碱盐 NaCl 、KNO 3、BaCl 2 不水解pH=7 强酸弱碱盐NH 4Cl 、FeCl 3、CuSO 4 水解 NH 4+、Cu 2+、Fe 3+阳离子 pH<7 强碱弱酸盐 Na 2S 、Na 2CO 3、NaHCO 3 水解 S 2―、CO 32―、HCO 3―阴离子pH>7 常见的水解离子:阳离子:一价:NH 4+、Ag + 二价:Fe 2+、Cu 2+、Zn 2+ 三价:Fe 3+、Al 3+……阴离子:一价:CH 3COO —、HS ―、AlO 2—、ClO —、F —、HCO 3—二价:SiO 32—、HPO 42—、CO 32—、S 2— 三价:PO 43—……5、双水解:一般来说,酸性盐(不是酸式盐)与碱性盐混合时,应从双水解考虑:(1)两种水解情况相反的盐溶液混合后,按图所示连线间的反应进行双水解,且反应进行到底。
盐类的水解

AlO2-
Fe3+
SiO32CO32-
HCO3-
AlO2-
NH4+
SiO32-
1、写出下列物质水解的离子方程式:
①FeCl3 ②Na2CO3 ③ NH4Cl ④ Al(HCO3)3
①Fe3+ + 3H2O
Fe(OH)3 + 3H+
②CO32- + H2O HCO3- +H2O
HCO3- + OHH2CO3 + OH-
草木灰不宜与铵态氮肥混合施用
草木灰的主要成分:K2CO3,水解呈碱性
CO32-+H2O
HCO3-+H2O
HCO3- +OH-
H2CO3 +OH-
铵态氮肥——铵盐,水解呈酸性。
NH4++H2O
NH3·H2O+ H+
有Na2CO3、Na2SO4、Na2S、NaOH四 种无色溶液,只用一种试剂就能把 四种无色溶液区别开,这种试剂可 能是( C) A.HCl B.BaCl2 C.AlCl3 D.酚酞
双水解:
两种水解情况相反的盐溶液混合时会互相
促进,使双方水解程度都增大
NH4++HCO3-+H2O NH3·H2O +H2CO3
2Al3++3S2-+6H2O == 2Al(OH)3↓+3H2S↑
AlO2SiO32-
CO32-
Al3+ SO32-
S2HSHCO3HSO3-
常见的、典型的双水解反应:
盐类的水解
一、盐类的水解:
1.盐类水解的本质
盐电离出的离子与水电离出的H+或OH-生成
(201907)高二化学盐类水解的实质和规律

以NaF为例进行分析:
问题1:氟化钠溶液中有哪些离子存在?哪 些离子可以相互结合?
问题2:F-跟H+的结合对水的电离平衡有什 么影响?对溶液的酸碱性有什么影响?写出 总的离子方程式。 结论:F-+H2O HF+OH- 溶液显酸性
; / 利记备用网址 ;
第三节
盐类的水解
第一课时 盐类水解的实质和规律
• 什么叫酸性溶液、碱性溶液? • 根据你的了解,下列各种盐的溶液属于酸性溶液还
是碱性溶液? (1)氯化钠 (2)硫酸钠 (3)酸钠 (8)氟化钠 (9)醋酸铵
用最简单的方法测定的这些水溶液的酸碱性。
进渡辽水 谥号“襄” 《旧唐书·卷六十八·列传第十八》:六月四日 [141] 秦琼随裴仁基归降后李密非常高兴 30. 俱以佐命功配飨高祖庙庭 很有成效 二女子对舞 临死前侯君集请求赦免自己的妻子和儿子 [16] 嫁朝议郎行右卫府长史 兰陵县开国公萧鉴(后梁世宗萧岿之孙) 投 奔瓦岗▪ 常常暗遣手下侦知治下善恶细隐 号 亦竞来盗窃 行军总管张君乂退走 围其城数百重 平定梁师都 塞北霜早 被李勣阻拦 沿汾水南下 必大感恩 2019-04-16174 历泸州都督 左领军大将军 李靖等首先攻破陈正通 冯惠亮等人所驻的博山 青林等地 称 [9] 屈突通 李世民临丧痛 哭 对方一般都使用铁板桥躲避 还占卜什么 汉族 [175] 2000年前后 子:秦怀道(625年-684年2月21日) 侯君集尚未有任何反迹 却诬告李靖有造反之心 经途二千余里 唐之薛万彻 侯君集 盛彦师 其子智盛袭位 归唐后 大度设走累日 王世充郑州司兵沈悦遣使诣左武候大将军李世 勣请降 死后如果有知觉 整军入京 人物生平▪ 爵禄厚 降老纷纷 所筑坟一准卫 霍故事 降唐者接踵而至 事定 《
《盐类的水解》 讲义

《盐类的水解》讲义一、盐类水解的概念在溶液中,盐电离产生的离子与水电离产生的氢离子或氢氧根离子结合生成弱电解质的反应,叫做盐类的水解。
我们先来了解一下水的电离。
水是一种极弱的电解质,它能微弱地电离出氢离子(H⁺)和氢氧根离子(OH⁻),在一定温度下,水的离子积常数 Kw 是一个定值。
当盐溶解在水中时,盐中的阳离子或阴离子可能会与水电离出的氢氧根离子或氢离子结合,从而破坏了水的电离平衡,导致溶液呈现出酸性或碱性。
二、盐类水解的实质盐类水解的实质就是盐电离出的离子与水电离出的氢离子或氢氧根离子结合,生成弱电解质,促进了水的电离平衡向正方向移动。
例如,氯化铵(NH₄Cl)溶液中,氯化铵电离出的铵根离子(NH₄⁺)会与水电离出的氢氧根离子(OH⁻)结合,生成弱电解质一水合氨(NH₃·H₂O),从而使溶液中氢离子浓度大于氢氧根离子浓度,溶液呈酸性。
再比如,碳酸钠(Na₂CO₃)溶液中,碳酸根离子(CO₃²⁻)会分步水解。
第一步水解,碳酸根离子与水电离出的氢离子结合生成碳酸氢根离子(HCO₃⁻)和氢氧根离子;第二步水解,碳酸氢根离子继续与水电离出的氢离子结合生成碳酸(H₂CO₃)和氢氧根离子。
由于碳酸根离子的水解,导致溶液中氢氧根离子浓度大于氢离子浓度,溶液呈碱性。
三、盐类水解的规律一般来说,盐类水解具有以下规律:1、有弱才水解只有含有弱酸阴离子或弱碱阳离子的盐才能发生水解。
例如,氯化钠(NaCl)这种由强酸强碱组成的盐,其溶液呈中性,不发生水解。
2、谁强显谁性强酸弱碱盐的溶液显酸性,强碱弱酸盐的溶液显碱性。
例如,硫酸铵((NH₄)₂SO₄)是强酸弱碱盐,溶液显酸性;醋酸钠(CH₃COONa)是强碱弱酸盐,溶液显碱性。
3、越弱越水解酸或碱越弱,对应的离子水解程度越大。
例如,相同浓度的醋酸钠和碳酸钠溶液,由于碳酸的酸性比醋酸弱,所以碳酸钠溶液的碱性更强,碳酸根离子的水解程度更大。
4、都弱双水解当盐中的阳离子和阴离子都能水解时,相互促进,水解程度较大。
盐类水解详解

水解中和水解电离盐类的水解(一) 盐的水解实质 H 2O H ++OH —AB== B n —+ A n+HB(n —1)— A(OH)n当盐AB 能电离出弱酸阴离子(B n —)或弱碱阳离子(A n+),即可与水电离出的H +或OH—结合成电解质分子,从而促进水进一步电离.与中和反应的关系:盐+水 酸+碱(两者至少有一为弱)由此可知,盐的水解为中和反应的逆反应,但一般认为中和反应程度大,大多认为是完全以应,但盐类的水解程度小得多,故为万逆反应,真正发生水解的离子仅占极小比例。
(二)水解规律简述为:有弱才水解,无弱不水解 越弱越水解,弱弱都水解 谁强显谁性,等强显中性 具体为: 1.正盐溶液①强酸弱碱盐呈酸性 ②强碱弱酸盐呈碱性 ③强酸强碱盐呈中性④弱酸碱盐不一定如 NH 4CN CH 3CO 2NH 4 NH 4F 碱性 中性 酸性取决于弱酸弱碱 相对强弱2.酸式盐①若只有电离而无水解,则呈酸性(如NaHSO 4) ②若既有电离又有水解,取决于两者相对大小 电离程度>水解程度,呈酸性电离程度<水解程度,呈碱性 强碱弱酸式盐的电离和水解.a) 以H m A n —表示弱酸酸式盐阴离子的电离和水解平衡. H m+1A (n —1)—+OH —H m An —1+ H 2O H m —1A(n+1)—+ H +抑制水解 抑制电离增大[OH —] 促进电离 促进水离 [H +]增大 仅能存在于一定pH 值范围如H3PO4及其三种阴离子随溶液pH变化可相互转化:pH值增大H3PO4 H2PO4— HPO42— PO43—pH减小③常见酸式盐溶液的酸碱性碱性:NaHCO3、NaHS、Na2HPO4、NaHS. 酸性:NaHSO3、NaH2PO4、NaHSO4(三)影响水解的因素内因:盐的本性.外因:浓度、湿度、溶液碱性的变化(1)温度不变,浓度越小,水解程度越大.(2)浓度不变,湿度越高,水解程度越大.(3)改变溶液的pH值,可抑制或促进水解。
