物理化学16章课后答案
《物理化学》课后习题答案(天津大学第四版)

青 海 民 族 学 院 ( 化 学 系
)
物 理 化 学
(第四版)
习题及答案
天津大学物理化学教研组 编 王正烈 周亚平 李松林 刘俊吉 修订
高等教育出版社
第二章 热力学第一定律
2.5 始态为25°C,200kPa的5mol某理想气体,经途径a,b两不同 途径到达相同的末态。途经a先经绝热膨胀到 -28.47°C,100 kPa,步骤的功Wa=-5.57KJ,再恒容加热到压力200 kPa的末态,步 骤的热Qa=25.42KJ。途径b为恒压加热过程。求途径b的Wb及Qb。 解:先确定系统的始、末态
同上题,先求功
同样,由于汽缸绝热,根据热力学第一定律
2.23 5 mol双原子气体从始态300 K,200 kPa,先恒温可逆膨胀到压 力为50 kPa,在绝热可逆压缩到末态压力200 kPa。求末态温度T及整 个过程的及 。 解:过程图示如下
要确定
,只需对第二步应用绝热状态方程 对双原子气体
因此 由于理想气体的U和H只是温度的函数,
g的
系统冰和水的质量分别为
2.30 蒸汽锅炉中连续不断地注入 20 °C的水,将其加热并蒸发成 180 °C,饱和蒸汽压为 1.003 MPa 的水蒸气。求生产 1 kg 水蒸气所需要 的热量。 已知:水 在 100 °C的摩尔蒸发焓 , 水的平均摩尔定压热容 ,水蒸气 的摩 尔定压热容与温度的函数关系见附录。 解:将过程看作是恒压过程( ),系统的初态和末态分 别为 和 。插入平衡相变点 ,并将蒸汽看作理想气体,则过程的焓变为 注:压力对凝聚相焓变的影响可忽略,而理想气体的焓变与压力无关 查表知 因此,
利用附录中各物质的数据求上述反应在25利用附录中各物质的数据计算上述反应在2525c若始态chg的分压均为150kpa末态cog和hg的分压均为50kpa求反应的3设立以下途径341已知化学反应中各物质的摩尔定压热容与温度间的函数关系为这反应的标准摩尔反应熵与温度的关系为试用热力学基本方程推导出该反应的标准摩尔反应吉布斯函数与温度t的函数关系式
《物理化学》教材习题参考解答

第一篇化学热力学第一章热力学基本定律.1-1 0.1kg C6H6(l)在,沸点353.35K下蒸发,已知(C6H6) =30.80 kJ mol-1。
试计算此过程Q,W,ΔU和ΔH值。
解:等温等压相变。
n/mol =100/78 , ΔH = Q = n = 39.5 kJ , W= - nRT = -3.77 kJ , ΔU =Q+W=35.7 kJ1-2 设一礼堂的体积是1000m3,室温是290K,气压为pϑ,今欲将温度升至300K,需吸收热量多少?(若将空气视为理想气体,并已知其C p,m为29.29 J K-1·mol-1。
)解:理想气体等压升温(n变)。
Q=nC p,m△T=(1000pϑ)/(8.314×290)×C p,m△T=1.2×107J1-3 2 mol单原子理想气体,由600K,1.0MPa对抗恒外压绝热膨胀到。
计算该过程的Q、W、ΔU和ΔH。
(Cp ,m=2.5 R)解:理想气体绝热不可逆膨胀Q=0 。
ΔU=W ,即nC V,m(T2-T1)= - p2 (V2-V1), 因V2= nRT2/ p2, V1= nRT1/ p1,求出T2=384K。
ΔU=W=nCV,m(T2-T1)=-5.39kJ ,ΔH=nC p,m(T2-T1)=-8.98 kJ1-4 在298.15K,6×101.3kPa压力下,1 mol单原子理想气体进行绝热膨胀,最后压力为pϑ,若为;(1)可逆膨胀(2)对抗恒外压膨胀,求上述二绝热膨胀过程的气体的最终温度;气体对外界所作的功;气体的热力学能变化及焓变。
(已知C p,m=2.5 R)。
解:(1)绝热可逆膨胀:γ=5/3 , 过程方程p11-γT1γ= p21-γT2γ, T2=145.6 K ,ΔU=W=nC V,m(T2-T1)=-1.9 kJ , ΔH=nC p,m(T2-T1)=-3.17kJ(2)对抗恒外压膨胀,利用ΔU=W ,即nC V,m(T2-T1)= - p2 (V2-V1) ,求出T2=198.8K。
普通物理学第五版第16章波动答案

n
=
u
l
=
3×108 4×10-7
=7.5×1014 Hz
l =760nm
n
=
u
l
=
3×108 7.6×10-7
=395×1014 Hz
精品课件
结束 目录
16-3 一横波沿绳子传播时的波动表式为
y = 0.05 cos(10πt 4πx )
x, y 的单位为 m, t 的单位为s。
设波沿着x 轴正向传播,弹簧中某圈的最大
位移为3.0cm,振动频率为2.5Hz,弹簧中
相邻两疏部中心的距离为24cm。当 t =0时, 在x =0处质元的位移为零并向x 轴正向运动。
试写出该波的波动表式。
精品课件
结束 目录
解:
x =0
t =0 y=0
j=
π
2
y0= 0.03 cos(2π×2.5 t π2 )
= 4.62×10-7 J 精品课件
结束 目录
16-13 一平面简谐声波的频率为500Hz,
在空气中以速度u =340m/s传播, 到达人耳 时,振幅A =l0-4 cm,试求人耳接收到声波 的平均能量密度和声强 ( 空气的密度ρ=1.29
kg/m3)。
精品课件
结束 目录
解:
w = 12ρAω2 2
(1) A =0.05m n =5Hz l =0.5m
u = ln =0.5×5=2.5m/s
(2) um = Aω=0.05×10π=0.5πm/s am = Aω2 = 0.05×(10π)2 =0.5π2 m/s2
精品课件
结束 目录
(3) x =0.2m t =1s
物理化学第2版万洪文 下 各章练习题答案

解:1/[A]-1/ [A]0=( k1+ k2) t , k1 /k2=15%/25%=0.6 , k1+ k2=0.044 mol-1dm3min-1, k1 = 1.67×10-2mol-1dm3min-1 k2 = 2.78×10-2mol-1dm3min-1
11、在1189K下,乙酸的气相分解有两条平行的反应途径: ( 1 ) CH3COOH → CH4 + CO2 k1 = 3.74 s-1 ( 2 ) CH3COOH → H2C=C=O + H2O k2 = 4.65 s-1 (1)求乙酸反应掉99%所需的时间; (2)求在此温度下乙烯酮的最大产率。 解:(1) ln([A] /[A]0)= -( k1+ k2)t , t= 0.55 s . (2) 最大产率= 4.65/(3.74+ 4.65)=0.556
9、某连串反应, 试证明:(1)若k1>>k2,则C的生成速率决定于k2; (2)若k1<<k2,则C的生成速率决定于k1
证明: t=0 a t=t x 0 y 0 z
10、在二硫化碳溶液中,以碘为催化剂,氯苯与氯发生如下平行反应:
在温度和碘的浓度一定的条下, C6H5Cl和 Cl2的起始浓度均为0.5 mol.dm-3 , 30 min 后 C6H5Cl 有 15%转变为邻- C6H4Cl2 , 而有25%转变为对- C6H4Cl2 ,求k1和 k2 。
7、某溶液含有NaOH和CH3COOC2H5 ,浓度均为1.00×10-2mol· dm-3 , 298 K时反应经 过10min有39%的CH3COOC2H5分解,而在308 K时,10分钟有55%分解,计算: (1)该反应的活化能。 (2)288K时,10分钟能分解多少? (3)293K时,若有50%的CH3COOC2H5分解需时多少? 解:(1)1/[A]-1/[A]0= k t ,k(298 K)= 6.39 mol-1· dm3 min-1 ,k(308 K)=12.22 mol-1· dm3 min-1 Ea=Rln(k1/k2)(1/T2-1/T1)= 49.4kJ· mol-1 (2)288K时,k(288K)=3.2 mol-1· dm3 min-1, t =10 min,{[A]0-[A]}/ [A]0=24.2% (3)293K时, k(293K)=4.55 mol-1· dm3 min-1, t1/2=1/( k[A]0)= 22min 8、两个二级反应1和2具有完全相同的频率因子,反应1的活化能比反应2的活化能高出 10.46kJ ·mol-1;在 373K时,若反应1的反应物初始浓度为0.1mol ·dm-3,经过60min后反应 1已完成了30%,试问在同样温度下反应2的反应物初始浓度为0.05mol ·d m-3时, 要使反应 2完成70%需要多长时间(单位min)? 解:由k=Ae-Ea/RT,A1=A2,所以k1/k2=e (Ea1-Ea2)/RT 由1/[A]-1/[A]0= k t , Ea1-Ea2=10.46×103J/mol 所以 k1= 7.14×10-2 mol-1 ·dm3 min-1 ,k2=2.04 1/(1-70%) [A]0 -1/[A]0 = k2 t2 , [A]0 = 0.05mol ·d m-3 所以 t2=22.88min
高师《物理化学》第三版习题全解

答:(1)ΔUA→B=-100+50=-50J Q=ΔUA→B-W=-50-(-80)=30J
(2)ΔUB→A=-ΔUA→B=50J Q=ΔUB→A-W=50-50=0
体系不吸热也放热
7.已知体系的状态方程式F(T,P,V)=0,由U=f(T,V)写出当压力不变时气体的内
所作功W(不)=-Q(不)=-P2(V2-V1),再经过可逆压缩回到始态,
可逆压缩
B(P2,V2,T1)———=-RTln(V1/V2)(因为可逆压缩环境消耗的功最小)
整个循环过程:
W=W(不)+W'=-P2(V2-V1)-RTln(V1/V2)=-Q
9.“因ΔH=QP,所以只有等压过程才有ΔH。”这句话是否正确?
答:不正确。H是状态函数,H=U+PV,凡是体系状态发生变化,不管经过什么过程,
体系的焓值都可能变化,即ΔH有可能不等于零。
10.因为“ΔH=QP,所以QP也具有状态函数的性质”对吗?为什么?
答:不对,ΔH=QP,只说明QP等于状态函数H的变化值ΔH,仅是数值上相等,并
QV,m=QP,m-∑νB(g)RT=-177.9×10-3-8.314×298=-180.37 KJ·mol-1
QP,m>QV,m
16.“稳定单值的焓值等于零”;“化合物摩尔生成热就是1mol该物质所具有的焓值”
对吗?为什么?
答:不对。稳定单质的焓值并不等于零。但可以说标准状态下稳定单质的规定焓值等
等于0,不一定吸热。例如,绝热容器中H2与O2燃烧,ΔHm>0,但Q=0,
不吸热。
19.“可逆过程一定是循还过程,循还过程一定是可逆过程”这种说法对吗?为什么?
答:不对。可逆过程不一定为循环过程。因为只要体系由A态在无摩擦等消耗效应存在
第16章 物理化学处理(过滤)

阀滤 流、砂滤 (4);(2)减少二只阀门,相应降低了造价 同
池
料的双阀 和检修工作量
式滤池
缺点:(1)必须设有全套冲洗设备(2)
增加形成虹吸的抽气设备
V
下向流
优点:(1)运行稳妥可靠(2)采用砂滤
(1)适用于大、
型滤 均粒砂滤 料,材料易得(3)滤床含污量大,周期长, 中型水厂
池 料,带表面 滤速高,水质好(4)具有气水反洗和水表面
管件及阀门,管廊内管件简单,施工和检修方便。但造价稍高③进水、冲洗水及清水管均采
用金属管道,排水渠单独设置。特点:通常用于小型水厂或滤池单行布置。④对于较大滤池, 为节约阀门,可以将进水和排水阀门分别用进水虹吸和排水虹吸代替,冲洗水管和清水管仍
用阀门。特点:虹吸管通水或断水以真空系统控制。 (6)设计注意事项①滤池清水管应设短管,管径一般采用 75~200mm,以便滤池翻修后排
滤池 料的四阀 宜(3)采用大阻力配水系统,单池面积可做
(2)单池面积一
式滤池 得较大;池深较浅(4)可采用降速过滤,水 般不宜大于 100m2
质较好
(3)有条件时尽
缺点:(1)阀门多(2)必须设有全套冲 量采用表面冲洗或空
洗设备
气助洗设备
双
下向
优点:(1)同普通快滤池的(1)(2)(3) 与普通快滤池相
级配和适当的孔隙率 d.能就地取材、价廉。
石英砂是使用最广泛的滤料,双层和多层滤料中,常用的还有无烟煤、石榴石、钛 铁矿、磁铁矿、金刚砂等。轻质滤料有聚苯乙烯及陶粒等。
(2)滤料性能参数 a.比表面积:单位重量或体积的滤料所具有的表面积,单位为 cm2/g 或 cm2/ cm3。 b.有效粒径与不均匀系数:粒径级配可以用滤料的有效粒径和不均匀系数表示,关系如 下:
九年级物理全册16章1-4课后习题(带答案解析)
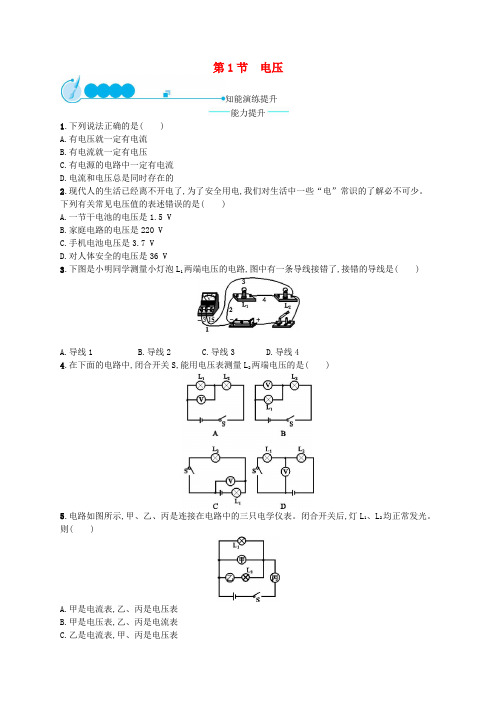
第1节电压知能演练提升能力提升1.下列说法正确的是()A.有电压就一定有电流B.有电流就一定有电压C.有电源的电路中一定有电流D.电流和电压总是同时存在的2.现代人的生活已经离不开电了,为了安全用电,我们对生活中一些“电”常识的了解必不可少。
下列有关常见电压值的表述错误的是()A.一节干电池的电压是1.5 VB.家庭电路的电压是220 VC.手机电池电压是3.7 VD.对人体安全的电压是36 V3.下图是小明同学测量小灯泡L1两端电压的电路,图中有一条导线接错了,接错的导线是()A.导线1B.导线2C.导线3D.导线44.在下面的电路中,闭合开关S,能用电压表测量L2两端电压的是()5.电路如图所示,甲、乙、丙是连接在电路中的三只电学仪表。
闭合开关后,灯L1、L2均正常发光。
则()A.甲是电流表,乙、丙是电压表B.甲是电压表,乙、丙是电流表C.乙是电流表,甲、丙是电压表D.乙是电压表,甲、丙是电流表6.关于电流表和电压表的使用,下列说法错误的是()A.使用前都应检查指针是否指零B.若有两个量程,一般都先用大量程试触C.两表都不能将两接线柱直接接到电源的两极上D.接入电路时,都应使电流从正接线柱流入,从负接线柱流出7.如图所示,电源电压不变,闭合开关S,电路各元件工作正常。
一段时间后,若其中一只电压表示数变大,则()A.另一个电压表示数变小B.其中有一盏灯亮度不变C.灯L2可能断路D.灯L2可能短路8.某同学做用电压表测电压的实验,正确连接了电路,闭合开关后,电压表的示数如图所示,由此可以看出实验中存在的问题是,使实验结果更为精确的做法是。
9.(2017·山东枣庄中考)如图所示,在烧杯中加入盐水,然后将连在电压表上的铜片和锌片插入盐水中,这样就制成了一个盐水电池。
观察电压表的接线情况和指针偏转可知:锌片是盐水电池的极,电池的电压为 V。
10.用笔画线代替导线将实物图连接起来,使电压表能测出小灯泡两端的电压。
物理化学-高盘良267-281第十六章链反应动力学

第16章链反应动力学主 要 公 式平均链长: ()l =链的传递速率链的引发或终止速率()16.6.1例 题 解 析例 16.1 791 K 乙醛气相热分解反应3CH CHO =4CH CO +在不同乙醛的初始压力Οp 下的反应初速数据如下:ΟPa p 11.29 15.52 20.11 28.37 34.26 48.40 57.79 70.931ΟPa s r -⋅6.40 10.13 1 5.86 23.99 36.26 50.25 74.25 95.44(1) 求乙醛热分解的反应级数;(2) 若乙醛热分解是按下述反应历程进行:3CH CHO 3CH ·+CHO 1k 11318kJ mol E -=⋅ 3CH ·3 CH CHO + 43CH CH CO +· 2k 1241.8kJ mol E -=⋅ 3CH CO · 3CH ·CO + 3k 1375.3kJ mol E -=⋅ 3CH ·3 CH +·26C H 4k 40E = 请利用稳态近似求该反应的速率方程,是否与(1)相一致?并求算表现活化能a E 。
(3) 实验求得表现活化能,今已知键能数据为:()1C C 356kJ mol E --=⋅,()1C H 423kJ mol E --=⋅请估算表现活化能,并与实验相对照。
解析: (1) 根据 ()3CH CHO n r kp =,可得{}{}{}ΟΟln ln ln r k n p =+将实验数据转化为ln(p 0/Pa) 9.33 9.65 9.91 10.25 10.44 10.79 10.96 11.17()1Οln Pa s r -⋅1.862.32 2.763.18 3.59 3.924.31 4.56作ln r 0-ln p 0图,由斜率可得n =1.5。
(2) 应用稳态近似时,只用各反应组分的消耗速率与生成速率,不是写元反应的反应速率。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第 16 章 电解质溶液
习题解答
K 2 SO 4 、Na 3 PO 4 溶液的离子平均浓度 b± 与 1. 试分别写出 CuSO 4 、
电解质质量摩尔浓度 b 的关系式。
1
解: CuSO 4 :
b± = (11 × 11 ) 2 b = b
1
K 2 SO 4 :
b± = (2 2 ×11 ) 3 b = 3 4b
⎛ 解: ⎜ l ⎜A ⎝ s
⎞ ⎛κ ⎞ −1 −1 ⎟ ⎟ = κ R = (0.14114 ×161.5) m = 22.79 m ⎟=⎜ G ⎠ ⎝ ⎠
⎛ l ⎞
后 答
2
4
= 69.9 × 10 −3 S ⋅ m −1
Λ m (K 2 SO 4 ) =
11. 291 K 时,在同一电导池中分别测得 0.01 mol ⋅ dm −3 KCl 溶液、 0.5 ×10 −3 mol ⋅ dm −3 K 2SO 4 溶液及用来配制溶液的蒸馏水的电阻(蒸馏水
解:(1) G KCl ' =
GKCl = (10.22 − 0.100 ) × 10 −3 S = 10.12 × 10 −3 S
GK 2SO 4 = (1.067 − 0.100) × 10−3 S = 0.967 × 10−3 S (2) κ K 2SO4 =
GK 2SO4 GKCl
−1 κ KCl = ⎜ ⎜ 10.12 × 10 −3 ⋅ 0.12227 ⎟ ⎟ S⋅ m ⎝ ⎠
1
Na 3 PO 4 : b± = (3 3 × 11 ) 4 b = 4 27b
2. 计算由 NaCl、CuSO4、LaCl3 各 0.025 mol 溶于 1 kg 水时所形成 溶液的离子强度。
=
课
1 2 2 × 0.025 × 12 + 0.025 × (− 1) + 0.025 × 2 2 + 0.025 × (− 2) 2 2 + 0.025 × 3 2 + (3 × 0.025) × (− 1) mol ⋅ kg −1
= 0.825
10. 将某电导池盛以 0.01 mol ⋅ dm −3 KCl 溶液, 在 298 K 时测得其电
−3 阻 为 161.5 Ω , 换 以 2.50 × 10−3 mol ⋅ dm K 2SO 4 溶 液 后 测 得 电 阻 为
326 Ω 。已知 298 K 0.01 mol ⋅ dm −3 KCl 溶液的电导率为 0.14114 S ⋅ m −1 ,
1 − 0.4375 × 5.40 ×10 −8 m 2 ⋅ V −1 ⋅ s −1 0.4375 = 6.94 ×10 −8 m 2 ⋅ V −1 ⋅ s −1
=
da
( )
后 答
12. 298 K 时 0.01 mol ⋅ dm −3 BaCl 2 水溶液的电导率为 0.2382 S ⋅ m −1 ,
·238·
思考题和习题解答
⎛ 0.5008 1 ⎞ n电 = ⎜ × ⎟ mol = 2.321 × 10 −3 mol ⎝ 107.87 2 ⎠
n 迁 = n 前 − n 后 + n电 = (34.23 − 35.88 + 2.321)× 10 −3 mol = 0.67 ×10 −3 mol
t Cu 2 + =
kh
da
]
−1
后 答
解: I = 1 ∑ bi z i2 2 i
w.
案 网
co
m
·236·
思考题和习题解答
⎛b a± = ⎜ ± o ⎝b
⎞ ⎟γ ± = 1.00 × 0.659 = 0.659 ⎠
2 a B = aν ± = 0.659 = 0.434
xA =
1 1 = = 0.965 1 + νbM A 1 + 2 × 1.00 × 0.0180
[
= 0.275 mol ⋅ kg
3. 已知 298 K 时 1.00 mol ⋅ kg −1 NaCl 水溶液的离子平均活度因子
γ ± = 0.659 ,溶剂渗透因子 ϕ = 0.936 ,计算该溶液的离子平均浓度、离
子平均活度、电解质活度、溶剂活度和活度因子。
ww
w.
解: b± = b = 1.00 mol ⋅ kg −1
κ
da
−1 κ K SO = ⎜ 22.79 ⋅ ⎟ S⋅ m ⎜A ⎟ ⎟G = A ⋅ R = ⎜ 326 ⎝ ⎠ s ⎝ s⎠
l
1
⎛
课
w.
1 ⎞
求 K 2 SO 4 溶液的电导率和摩尔电导率。
案 网
co
m
=
(
) (
)
·240·
思考题和习题解答
计算两溶液的电导。 (2) 已 知 291 K 时 , 0.01 mol ⋅ dm −3 KCl 溶 液 的 电 导 率 为
课后答案网,用心为你服务!
大学答案 --- 中学答案 --- 考研答案 --- 考试答案 最全最多的课后习题参考答案,尽在课后答案网()! Khdaw团队一直秉承用心为大家服务的宗旨,以关注学生的学习生活为出发点, 旨在为广大学生朋友的自主学习提供一个分享和交流的平台。 爱校园() 课后答案网() 淘答案()
n迁 0.67 × 10 −3 = = 0.29 n电 2.321 × 10 −3
t SO 2 − = 1 − t Cu 2 + = 1 − 0.29 = 0.71
4
⎯→ AgCl(s) + e − ,求 K+ 和 出银 0.6136 g。已知阳极反应为 Ag + Cl − ⎯
⎛ 0.7422 117.51 − 0.6659 ⎞ −3 n前 = ⎜ × ⎟ mol = 11.719 × 10 mol 100 − 0.7422 ⎠ ⎝ 74.55
w.
Cl − 的迁移数。 解: 按阳极区对 Cl − 作物料衡算, 并设电解前后电极区的水量不变。
案 网
co
8. 用银作电极电解 KCl 溶液。 电解前每 100 g 溶液含 KCl 0.7422 g, 电解后阳极区溶液为 117.51 g,含 KCl 0.6659 g,测得银库仑计中析
m
第 16 章 电解质溶液
ϕ aA = xA = 0.965 0.936 = 0.967
4. 设 0.001 mol ⋅ kg −1 ZnSO 4 水溶液的离子平均活度因子与离子强
解: I =
1 1 ∑ bi z i2 = 2 0.001 × 2 2 + 0.001 × (− 2)2 mol ⋅ kg −1 2 i
[
ϕ = 1+ ⎜ ⎟z + z − I
ww
w.
5. 以 0.1 A 电流电解硫酸铜溶液, 10 min 后, 在阴极上可析出多少 质量的铜?在铂阳极上又可获得多少体积的氧 O2(298 K、100kPa)? 0.1 × 10 × 60 ⎞ −4 解: n Cu = Q = ⎛ ⎜ ⎟ mol = 3.11 × 10 mol zF ⎝ 2 × 96485 ⎠
0.12227 S ⋅ m −1 ,试用(1)的结果计算 0.5 × 10 −3 mol ⋅ dm −3 K 2SO 4 溶液的电
导率。
1 = 10.22 × 10 −3 S 97.8 Ω 1 GK ' 2SO4 = = 1.067 × 10 −3 S 937 Ω 1 ' 2O = GH = 0.100 × 10 −3 S 10000Ω 若水不含杂质,则
= 0.01168 S ⋅ m −1
溶液中 Ba 2+ 的迁移数为 0.4375。试计算 Ba 2+ 和 Cl − 的电迁移率。
课
解: u Ba 2 + =
t (κ c ) t +Λ m = + αν + z + F αν + z + F
ww
w.
kh
u Cl − = t− u 2+ t + Ba
⎡ 0.4375 × 0.2382 / 0.01×10 3 ⎤ 2 −1 −1 =⎢ ⎥ m ⋅ V ⋅s 1×1× 2 × 96485 ⎣ ⎦ −8 2 −1 −1 = 5.40 ×10 m ⋅ V ⋅ s
w.
⎛ 0.967 × 10 −3
⎞
案 网
co
m
第 16 章 电解质溶液
·241·
13. 298 K 时,NH4Cl 溶液的无限稀释摩尔电导率为 14.97 ×10 −3 S ⋅ m ⋅ mol −1 ,阳离子在无限稀释时的迁移数为 0.4907。试计算无限稀
ww
w.
中因含有微量杂质如碳酸及氨, 故电导率较纯水略大)为 97.8 Ω 、937 Ω 及 10000 Ω 。 (1) 求两种溶液及蒸馏水的电导。假如蒸馏水完全不含杂质,试再
kh
69.9 × 10 −3 S ⋅ m 2 ⋅ mol −1 c 2.50 × 10 − 3 × 10 3 = 28.0 ×10 −3 S ⋅ m 2 ⋅ mol −1 =
·239·
上部放 0.0100 mol ⋅ dm −3 HCl 溶液,两溶液间有清晰的界面。当以 3.00 mA 电流通电 45 min 后,观察到界面向上移动了 2.13 cm,求氢离子的 迁移数 t H + 。 解: t
H+
=
z H + c H + VF It
1 × 0.0100 × 10 3 × 3.25 × 10 −4 × 2.13 × 10 −2 × 96485 3.00 × 10 −3 × 45 × 60
10.06 g ,电解后阳极区溶液为 54.565 g,含 CuSO4 5.726 g,测得银库
