第二章 共振论
共振论

C
C
C
4种共振杂化体,3种等价共振杂化体而稳定
共振论的应用
共振论可以解释: 分子或离子的稳定性大小 键长,偶极距 酸性,碱性 亲电或亲核反应位置 特别在杂环化学中威力巨大
共振论的不足ຫໍສະໝຸດ 和苯一样具有2个等价共振杂化体 但事实表明很不稳定
共振论意义
Pauling说:
共振论对共轭分子的计算一般 与实验相符,但比定量计算更重要 的是,应用简单的化学论证工作可 以预言可能性,除共振论外,还无 一个更简单的方法。
共振发生的必要条件:
(1)能量近似; (2)配对电子数相等; (3)构型相同
共振论要点:
1.当一个分子、离子或自由基按价键规 则写出一个以上 Lewis结构式时,则真实的 分子结构就是这些结构的共振杂化体,它不 同程度地表现出这些结构的所有性质,它们 的区别只是键或电子的分布不同,而原子排 列序不变。 2. 分子、离子或自由基之有共振者较之 没有共振的来的稳定。参加共振的结构数目 越多,则杂化体就越稳定,尤其是结构相同 的式子参加共振,得到的杂化体十分稳定。
共振论
Resonance Theory
共振论概念
1932年Pauling说:
对于许多分子能够指定单个的价键结构来 满意地说明该物质的性质。然而,对于另外 一些分子如O3却不是这样。已经发现,对于 这些分子可以用一个以上的价键结构来作出 满意地描述。这个观念在结构化学中叫共振 论。
1954年荣获诺贝尔奖
3.在各个共振结构中,能量最低而结构 相近的式子,越稳定,所占的几率最 多,对杂化体的贡献大。 4.真实分子本身的能量一定比任何一个 共振结构的能量低,这个能量差叫 共振能。
写共振式时应遵循以下原则:
1. 符合价键结构要求 CH2
共振论

共振论存在着电子离域的体系包括分子、离子、自由基,用经典的路易斯结构式不能完全、准确地表示出不能描述出其体系内电子云平均化,这个体系的真实结构和性质。
例如,1,3-丁二烯用CH2=CH-CH=CH2C-C有部分双键的性质,C=C比正常C=C键长等。
为了解决用经典的路易斯结构式表达复杂的电子离域体系的矛盾,鲍林在1931-1933年间提出了“共振论”。
共振论是用经典的结构式表达电子离域体系,是价键理论的延伸。
在有机化学中经常被使用,比较方便地解决了电子离域体系的表示,但有它的局限性。
一、共振论的基本概念对于电子离域体系的化学物种,不能用一个经典结构式表示清楚其结构,可用几个可能的经典结构式表示,真实物种是这几个可能的经典结构的叠加——共振杂化体。
表示离域体系的可能的经典结构称做极限结构或共振结构,共振结构的叠加得到共振杂化体,共振杂化体才能较确切地代表真实物种的结构。
1,3-丁二烯可用一系列共振结构表示:每个式子叫共振结构式或共振极限结构式,“<—>”双箭头符号表示共振结构之间的叠加或共振;合起来表示真实的1,3-丁二烯。
表示共振结构的叠加关系,不同于互变异构体间表示互变关系。
共振杂化体是一单一物种,只有一个结构。
极限结构式表示电子离域的极限度。
一个物种的极限结构式越多,电子离域的范围越大,体系能量越低,物种越稳定。
任何一个极限结构的能量都高于共振杂化体的能量,真实物种与最低能量的极限结构(最稳定的极限结构)的能量差称为共振能。
它是由电子离域而获得的稳定化能,与共轭能是一致的。
每个极限结构对其共振杂体的贡献是不相等的。
极限结构越稳定,对共振杂化体的贡献越大。
相同的极限结构贡献相等。
例如,1,3-丁二烯的共轭能为14kJ·mol-1,可用下列极限结构表示:CH2=CH-CH=CH2是最稳定的极限结构,对杂化体贡献最大,它与真实分子的能量差为共振能;后面几个极限结构是不稳定的,能量较高,对共振杂化体的贡献小,有时可以不考虑;和相同,对共振杂化体的贡献相等。
第二章Lewis结构与共振论

分子的静电荷=+1
(c) SO42
1 S:6-[0+ 2 ×8]=2 1 O:6-[6+ 2 ×2]=-1
O O S O O
O
所以
2
O S O O
2+
二、Lewis结构式的书写程序及优势结构 以NO2的Lewis结构为例 1、计算价电子总数 NO2=5+2×6=17 2、写出原子实符号,填入电子数
i. sp3--- CH4 (methane)
C(6e) 2p 化合价 valence shell(4e) 2s promotion sp3 hybridization excited state energy: Es < Esp3 < Ep hybrid orbital
ground state
1、真实分子的能量低于所写出的任何一个共 振式的能量,最稳定的极限结构与共子振杂 化体的能量差称为共振能 2、等价共振式对杂化体的贡献也等价 3、稳定的共振式对杂化体的贡献也大 4、共价键数目越多的共振式越稳定
5、除特例外,拥有形式电荷数量最小的结构 最稳定 6、负电荷在电负性大的原子上,正电荷在电 负性小的原子上则较稳定 7、所有的原子都有完整的价电子层,则较稳定 8、同类化合物中,共振式较多的较为稳定
H2C
C H
CH2
•
H3C
•
C H
CH2
书写规则:
1、电子动,原子核位置不动
H 2 C C CH 2 H
H 2C C H
CH 2
2、所有共振式,必须符合Lewis结构式
H3C OH
3、共振式中必须具有相等的未成对电子数
H2C C CH2 H
共振论

共振论内容补充共振论最早由美国科学家Linus Pauling (1954年Nobel 化学奖得主)提出,他在1931-1933年间发表了与之相关的7篇研究论文。
针对经典价键理论,共价键都是电子定域在两个成键原子之间的,这种键称为定域键。
若电子可流动,经典价键结构就难以正确表示它的结构状况。
电子可流动的键称为离域键,如苯。
共振论就是设法用多个价键结构来表示有离域键的分子的结构。
共振概念当一个分子、离子或游离基按价键结构规则可以写出一个以上的Lewis 结构式时,真正的结构用一个Lewis 结构表示不确切妥当,要用几个Lewis 结构表示,这些Lewis 结构称为共振结构(常常称为极限结构或参与结构)。
真正的结构是这些共振结构的共振杂化体(hybrid ),如CO 32-可写出3个结构。
O OO O OO O OO I II III共振符号真实的CO 32-结构既不是一会I ,一会II ,一会III ,也不是1/3 I ,1/3 II ,1/3 III 。
真实的CO 32-结构只有一个,用三个Lewis 结构式从三个侧面表示真正的CO 32-结构。
共振结构如何写1.必须符合Lewis结构(8电子)H C OHH H H COHHH C外层10电子2.原子位置不变(只是电子移动)H2C CCH2HCH2CH2CHH2C CH2HC正确键角扭小3.相同电子对数正确CH2CH CH2H2C CH CH2CH2CH CH2能量太高共振使分子稳定1.真正分子的能量低于各个个别共振结构。
2.共振结构对共振杂化体(真正分子)的稳定性有贡献,相同共振结构贡献一样。
3.较稳定共振结构对共振杂化体贡献大。
也就是真正结构更像较稳定结构。
各共振结构贡献的大小1.共价键数多的共振结构贡献大(稳定)CH2CH CH CH2CH2CH CH CH2大2.较稳定的价电子结构(完整八隅体)贡献大CH2O CH3CH2O CH3大3.电荷分离不稳定,电荷不分离稳定CH2CH Cl CH2CH Cl大4.负电荷在电负性大的原子上稳定CH2CH OCH2CH O大共振论在解释有离域键存在的有机反应时是很有用的。
第二章 有机化合物的结构理论
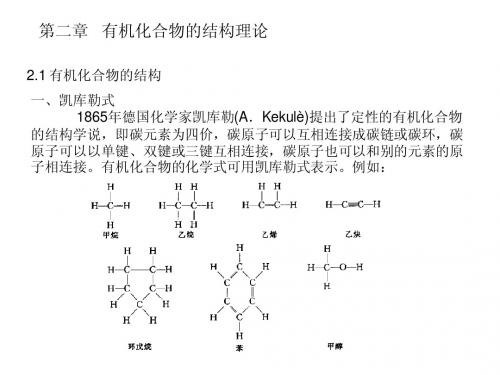
H—H键的电子云是围绕键轴对称分布的,这种类型的键叫做σ键。
2.共价键的饱和性。 如果一个未成对电子已经配对,就不能再与别的原子的未成对电 子配对。例如氯化氢分子中的氢原子和氯原子的未成对电子已互相配 对,就不能再与其它的原子形成共价键。
3.共价键的方向性。 原子轨道互相重叠程度越大,体系能量就越低,形成的共价键也 就越牢固,因而应使原子轨道最大限度地互相重叠。例如两个2px轨道 只有在x轴方向上才能最大限度地互相重叠形成σ键。两个原子的p轨 道若互相平行,则在侧面能有最大的重叠,这种类型的共价键叫做π 键,π电子云分布在两个原子键轴的平面的上方和下方。
2.异裂(heterolytic) 共价键异裂时,成键的一对电子为某一个原子或基团占有,生 成正离子和负离子。通过共价键的异裂的反应叫做离子型反应。 大多数有机反应都是离子型反应或自由基反应。此外还有协同 反应,在协同反应中,既无自由基也无离子生成,共价键的断裂 和形成是同时进行的。
2.3. 分子间的弱相互作用力 一. 分子间的弱相互作用力类型 分子中相连原子之间存在强烈的吸引力,这种吸引力叫做化学键, 它是决定分子化学性质的重要因素。在物质的聚集态中,分子之间还存在 着一种弱的吸引力,把它统称为范德华(van der Waals)引力,它是决定 物质的沸点、熔点、气化热、熔化热、溶解度、粘度、表面张力等物理化 学性质的重要因素。从本质上讲,这种吸引力是由于分子中电荷分布不均 匀[或瞬间分布不均)而出现的静电作用力。常见的有如下3种。 (1). 偶极-偶极作用力(静电力):这种作用力产生于极性分子的静电相互作 用。如氯甲烷分子中,氯原子电负性较大,氯原子一端带有部分负电荷, 而碳原子上带有部分正电荷。一个分子带负电荷的一端吸引另一个分子带 正电荷的一端,于是分子间出现正负极相吸的排列,即
第二讲共振理论有机酸碱理论优秀课件

2.布朗斯德—洛易酸碱理论
1.重要论点: 凡能给出质子的物质都是酸,凡能接受质子的都是碱(即 有电子对)
所有酸碱反应都可用下式表示:
AH + B:
A:-
酸
碱
共轭碱
+ BH+
共轭酸
3.酸碱强度的衡量
HA + H2O
H3O+ + A-
CH2 CH CH O a
+
CH2 CH CH O b
+
CH2 CH CH O c
+
CH2 CH CH O
+
CH2 CH CH O
d
e
丙烯醛的五种极限结构的稳定性顺序为 a>b>c>d>e。
(4) 键角和键长变形较大的极限结构稳定性差,对 真实分子的贡献小
(5) 原子不具有完整的价电子层且带电荷的极限结构 稳定性差,对真实分子贡献小。
• “硬”、“软”两词实指酸碱约束外层价电子的紧松。 • 硬酸(HA):受体原子体积小,有较高正电荷,外层价电
O
DMSO
+ CH3O-
H3C CH3
O H3C CH2
+ CH3OH
Acid
Base
O H3C CH3 +
Base
H2SO4 Acid
OH
H3C CH3
+
HSO4-
各类酸的Pka值
PKa
ArSO3H -6.5
CH(CN)3 -5
H3+O
-1.74
RCOOH 3.5
共振论的基本概念
共振论的基本概念★★某些分子、离子或自由基不能用某个单一的结构来解释其某种性质(能量值、键长、化学性能)时,我们就用两个或两个以上的结构式来代替通常的单一结构式,这个过程叫共振。
用共振符号双向箭头表示。
例如:甲酸根离子HCOO就不能用单一的结构式来表示。
因为在上式中有C =O双键和C-O单键两种键,那么C-O单键键长应为143pm,C=O双键键长应为120pm,而实际测得甲酸根离子中的两个碳氧键键长都是126pm,即表明甲酸根离子中没有真正的C -O和C=O。
所以只能用下面两个共振式来表示。
其意义是C-O键介于双键和单键之间的中间状态,负电荷被两个氧承担。
这些组合结构叫共振杂化体(resonance hybrid)或简称杂化体,也就是说Ⅰ和Ⅱ综合称共振杂化体,每个参与杂化的结构叫共振结构式(resonance structures)或极限结构式,也就是说Ⅰ和Ⅱ互称共振结构式。
但并不是说,甲酸根离子一会是极限结构式Ⅰ,一会是极限结构式Ⅱ,也不是说一半是Ⅰ,一半是Ⅱ,而是介于Ⅰ和Ⅱ之间,Ⅰ和Ⅱ都不能表示其真实结构,不能单独存在、独立表示,只能参与共振杂化体。
L.Pauling的学生芝加哥大学的G.W.Wheland教授所作的生物杂化体的比喻是有启发性的。
如把骡子看作是马和驴杂交后生下的动物,是生物杂化体。
这并不是说骡子是几分之几的马和几分之几的驴,也不能说骡子有时候是马,有时候是驴,只能说骡子是与马和驴都有关系的动物。
因而可用两种熟知的动物马和驴来很好地说明骡子。
加利福尼亚工艺学院的J.D.Roberts教授的比喻就更恰当了,在中世纪,欧洲有一个旅行者从印度回来,他把犀牛描绘成龙和独角兽的生物杂化体,用两种熟知的、但完全是想像中的动物来很好地描绘一种真实的动物。
再如:1,3-丁二烯CH=CH—CH=CH,分子中C=C双键的键长不是134pm,而是137pm,C-C单键的键长不是154pm,而是148pm,说明分子中不存在纯粹的单双键,所以不能用一个结构式表示,而应该用共振杂化体表示。
共振论的基本概念
共振论的基本概念★★某些分子、离子或自由基不能用某个单一的结构来解释其某种性质(能量值、键长、化学性能)时,我们就用两个或两个以上的结构式来代替通常的单一结构式,这个过程叫共振。
用共振符号双向箭头表示。
例如:甲酸根离子HCOO就不能用单一的结构式来表示。
因为在上式中有C =O双键和C-O单键两种键,那么C-O单键键长应为143pm,C=O双键键长应为120pm,而实际测得甲酸根离子中的两个碳氧键键长都是126pm,即表明甲酸根离子中没有真正的C -O和C=O。
所以只能用下面两个共振式来表示。
其意义是C-O键介于双键和单键之间的中间状态,负电荷被两个氧承担。
这些组合结构叫共振杂化体(resonance hybrid)或简称杂化体,也就是说Ⅰ和Ⅱ综合称共振杂化体,每个参与杂化的结构叫共振结构式(resonance structures)或极限结构式,也就是说Ⅰ和Ⅱ互称共振结构式。
但并不是说,甲酸根离子一会是极限结构式Ⅰ,一会是极限结构式Ⅱ,也不是说一半是Ⅰ,一半是Ⅱ,而是介于Ⅰ和Ⅱ之间,Ⅰ和Ⅱ都不能表示其真实结构,不能单独存在、独立表示,只能参与共振杂化体。
L.Pauling的学生芝加哥大学的G.W.Wheland教授所作的生物杂化体的比喻是有启发性的。
如把骡子看作是马和驴杂交后生下的动物,是生物杂化体。
这并不是说骡子是几分之几的马和几分之几的驴,也不能说骡子有时候是马,有时候是驴,只能说骡子是与马和驴都有关系的动物。
因而可用两种熟知的动物马和驴来很好地说明骡子。
加利福尼亚工艺学院的J.D.Roberts教授的比喻就更恰当了,在中世纪,欧洲有一个旅行者从印度回来,他把犀牛描绘成龙和独角兽的生物杂化体,用两种熟知的、但完全是想像中的动物来很好地描绘一种真实的动物。
再如:1,3-丁二烯CH=CH—CH=CH,分子中C=C双键的键长不是134pm,而是137pm,C-C单键的键长不是154pm,而是148pm,说明分子中不存在纯粹的单双键,所以不能用一个结构式表示,而应该用共振杂化体表示。
无机化学教学课件7.0 共振论-讲授
CH=CH2
CH-CH2
-
È ¨ Î ¶ ¡
CH2-CH
+
+ CH-CH2 中C 外层电子只有6个。
4 共振杂化体的各结构式贡献的大小
------不同极限结构对共振杂化体的贡献大小不同
各个极限结构式对真实分子结构 贡献的大小与其的稳定性成正比
(a) 满足八隅体的共振式比不满足的共振式稳定,对杂化 体贡献大。
CH
O
贡献极小,忽略
(d) 键长、键角变化大的极限结构对杂化体的贡献小。
D ew ar 苯 (1 ) (2 ) (3 ) (4 ) (5 )
苯的共振式
(1)、(2)的贡献大,(3)、(4)、(5)贡献小
5 共振论的应用
①解释结构与性质间的关系
例1:1,3-丁二烯分子中的键长平均化的趋势是由于存在 下列共振:
③ 同一化合物的所有的极限结构式中,配对的或 不配对的电子数目应保持一致。
3共振杂化体的稳定性的判断
共振杂化体比任何一个共振式都稳定,其稳定性 的大小与共振式的结构有关 ① 具有相同稳定性的共振式参与形成的共振 杂化体往往特别稳定. ② 越是稳定的共振式对共振杂化体的贡献越 大,与共振杂化体结构越接近,参与形成的共 振杂化体越稳定. ③ 共振式越多,参与形成的共振杂化体越稳定.
14
H 2C
CH
CH2
14
共振式之间只是电 子排列不同 共振杂化体不是共 振式混合物 共振杂化体也不是 互变平衡体系
共振式的写法
---使原子核的相对位置和电子对的数目保持不 变而改变电子的排布,就能写出不同的价键结 构共振式:
CH2-CH=CH2
+
CH2=CH-CH2
第二章 共振论
OH E
OH
E H
OH
E H
OH
E H
OH E
OH
OH
OH
OH
EH
EH
EH
EH
共振论简介
例2 硝基苯进行亲电取代
N20 E
N20
E H
邻、对位取代中间体各 有一个极限式稳定性差。
N20
E H
N20
E H
N20 E
N2 0 E
N20
E H
N2 0
N20
E H
N2 0
N20
E H
N2 0
EH
EH
EH
实例3. 1, 3, 5-己三烯与1 mol Br2反应可能有四种产物,实 际上没有3,4-二溴产物。为什么?
eg.C6H6 P1,2= 1 + 1/2 = 1.5 P2,3 = 1 + 1/2 = 1.5 P1,2 = P2,3 键长相等,为正六边形结构。
共振论简介
eg. C10H8 P1,2= 1 + 2/3 = 1.67 P3,4= 1 + 2/3 = 1.67
P2,3 = 1 + 1/3 = 1.33
+
E
E
H
H
+
β-取代中间体有
E
H
一个特别稳定结构
+
共振论简介
环戊二烯负离子 4n + 2
环庚三烯正离子 4n + 2
亲核反应主要发生在七元环,主产物是4 ,6,8位取代产物;亲电反应主要发生在五 元环,主产物是1,3位取代产物。
共振论简介
6.判断反应速度
-Br-
OH-
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1)质子越易离去,酸性越强;
(2)共轭碱越稳定,酸性越强。
共 振 论 简 介
• 实例1.试用共振论解释苯酚的酸性强于环己醇。
OH +
-
OOH + H2O
O
-
O -
O
-
O
苯酚的酚羟基离去一个质子后,得到酚氧负离子,后 者因共振而稳定。 一个带电体系,电荷愈分散,体系愈稳定。而环己醇的共 轭碱没有类似的共振结构存在,稳定性较差。
圆满地表示它的结构。真实的结构是这些共振结构 式的杂化体。这些共振结构式仅仅是纸面上的非真
实结构。
共 振 论 简 介
解决了苯环结构的四个问题
共 振 论 简 介
O O C O O
O C O O
O C O
碳酸根的共振结构
共 振 论 简 介
§2共振论的书写方式
1. 在写共振式时只允许电子的移动,原子 核的位置不能变。
CH2 CH2
CH2
共 振 论 简 介
2.对键长的判断
Pi = 1 + ND/SC ND - 双键出现次数 SJ - 合理共振式数目 eg.C6H6 P1,2= 1 + 1/2 = 1.5 P1,2 = P2,3 P2,3 = 1 + 1/2 = 1.5 键长相等,为正六边形结构。
1 2
共 振 论 简 介
Br
Br
共 振 论 简 介
5.多环芳烃亲电取代反应的定位 只有用共振论来预测。
α位取代的中间体有两个特别稳定的结构 (带完整苯环),反应速度快,成为主要产 物。β位取代的中间体只有一个特别稳定的 结构,反应速度慢,是次要产物。
共 振 论 简 介
H
E
H
E
H
E
+
+ +
H E H E
α-取代中间体有 两个特别稳定结构
共 振 论 简 介
§4 共振论的应用
1.定性判断分子稳定性 依据:能写出的共振式越多,真实分子越稳定。
分子 离域能
共振结构
苯 2β 2
薁
3.36β 2
萘 3.683β 3
联苯 4.383β 4
蒽 5.316β 4
菲 5.444β 5
蒽
菲
蒽
共 振 论 简 介
稳定性
PhCH2+ >
CH2
RCH2+
-BrOHCH2=CHCH2Br —→ CH2=CHCH2+ —→ CH2=CHCH2OH
稳定性高反应快
-BrOHCH3CH2CH2Br —→ CH3CH2CH2+ —→ CH3CH2CH2OH
稳定性差反应慢
共 振 论 简 介
eg. C10H8
P1,2= 1 + 2/3 = 1.67 P3,4= 1 + 2/3 = 1.67 1,2键比2,3键长,萘是拉长的六边形结构。
1 2 3 4
P2,3 = 1 + 1/3 = 1.33
共 振 论 简 介
3.判断酸碱性的强弱 Ka XH ―→ X- + H+
判断化合物酸碱性大小的一般方法是:
H
E
H
E
H
共 振 论 简 介
例2 硝基苯进行亲电取代
N02 E N02 E H
邻、对位取代中间体各 有一个极限式稳定性差。
N02 E H N02 E H
N02 E
N02 E H
N02 E H
N02
N02 E H
N02
N02 E E
N02
H
E
H
E
H
实例3. 1, 3, 5-己三烯与1 mol Br2反应可能有四种产物,实
性。
共 振 论 简 介
3.较稳定的结构式对杂化体的贡献较大。
稳定
稳定
不稳定
不稳定
不稳定
共 振 论 简 介
4.共价键数目越多的共振式越稳定。
CH2=CHCH=CH2
稳定
CH2
CHCH=CH2
不稳定
共 振 论 简 介
5.共振式中如果所有的原子都有完整的 价电子层则是非常稳定的。
CH2 0
CH3
CH2=O
CH2 CH2=CHCH2
共振
CH2
CH2CH=CH2
非共振
CH
O H
CH3CH=C
OH H
结构互变
CH3CH2 C
共 振 论 简 介
2.所有共振式必须符合lewis结构式,即
符合价键理论。
CH3C
O NH2
NH2 O CH3C
CH3=C
O NH2
O NH2
CH3C
O NH2
OH
CH3C
CH2=C
第二章
共振论 简介
共 振 论 简 介
共振论也是一种有机结构理论。该理论 简单、直观,能解决共轭体系的结构与性能 问题,结果与分子轨道理论HMO法的计算结 果相似。过去因为政治的原因而被打压。现 在仍然在发展。
唯心论?反马克思理论?
共 振 论 简 介
• 苯环结构的问题,传统理论与现实严重不符
价键理论 有单双键之分,键长不 同,应为不规则形状。 实验结果 正六角无单双键之分, 键长完全一致。
+
+ +
E H
+
E H
+
E H
E H
E
+
+
H
β-取代中间体有 一个特别稳定结构
共 振 论 简 介
环戊二烯负离子 4n + 2
环庚三烯正离子 4n + 2
亲核反应主要发生在七元环,主产物是4 ,6,8位取代产物;亲电反应主要发生在五 元环,主产物是1,3位取代产物。
共 振 论 简 介
6.判断反应速度
1.54 A 1.34 A
1.39 A 1.39 A
共 振 论 简 介
理论
含有三个双键,应该稳定性比较差; △H = 3×119.3= 357.9 kJ/mol 实际 稳定性很好,反应中一般不开环。 △H = 208 J/mol
共 振 论 简 介
理论:应该主要发生加成反应
Br2 Br Br
实际:主要发生取代反应
Br2 Br
共 振 论 简 介
理论:邻二取代产物应该有两个
Br Br
实际:邻二取代产物只有一个
介
用传统的价键理论不能解释……
共 振 论 简 介
§1
共振论的主要内容 Solomen的共振规则 1.当一个分子、离子或游离基按价键理论可以写成
一个以上 lewis 结构式时,则任何一个结构都不能
CH2CHCH2
共 振 论 简 介
§3、极限式对共振杂化体的贡献 1.真实分子的能量低于所写出的任何一
个共振式的能量。能写出的共振式越多,真
实分子越稳定。
分子
离域能
共振结构
苯
2β 2
薁
3.36β 2
萘
3.683β 3
联苯
4.383β 4
蒽
5.316β 4
菲
5.444β 5
共 振 论 简 介
2.等价的共振式对杂化体的贡献是相等的 。由等价共振式所组成的体系具有巨大的稳定
稳定
CH3
不稳定
共 振 论 简 介
5.电荷分离的共振结构式稳定性降低。
O CH3 C CH3 CH3
O C CH3
稳定
不稳定
共 振 论 简 介
6.在共振式中负电荷处在电负性较强的原
子上的式子要比处在电负性较弱原子上的式 子来得稳定。
CH2
C
=O
CH2 = C
稳定
O
不稳定
共 振 论 简 介
总结:真伪共振结构式的判断—— ① 符合价键理论 ② 原子核位置不变 ③ 能量合理
NH2
共 振 论 简 介
2.所有共振式必须符合lewis结构式,即
符合价键理论。
CH3C
√
O NH2
NH2 O CH3C
√
CH3=C
×
O NH2
O NH2
CH3C
√
O NH2
OH
CH3C
×
CH2=C
×
NH2
共 振 论 简 介
3.所有共振式中必须有相等的未成对电子数。
CH2=CHCH2
CH2CH=CH2
共 振 论 简 介
碱性
甲胺
Ka=2.3×10-11
>
苯胺
Ka=2.6×10-5
酸性
O2NC6H4OH > C6H50H > CH3OH
pKa = 7.15
pKa = 9.94
pKa = 19
共 振 论 简 介
4. 芳环上亲电取代反应的定位
取代反应是一个竞争过程,可以从中间体稳定
性判断反应的方向。
对于第一类定位基,邻对位取代的中间体共振 结构多,稳定性高,邻对位产物占优。
共 振 论 简 介
例1 苯酚进行亲电取代
OH E OH E H OH E H
邻、对位取代中间体 极限式更多,稳定性好。
OH E H OH E H
OH E
OH E H
OH E H
OH OH
OH E H
OH
OH E E
OH
H
E
际上没有3,4-二溴产物。为什么?
Br Br2 Br
(1,2-addition)
Br + Br
(1,4-addition)
Br + Br
