烃化反应
合集下载
第四章 烃化反应

H2C N N
+
ROH
H3C N N OR
N2
CH3OR
R = Ar 或 R' C 酸 O 酚
OMe OMe OH OMe OH OH
过量CH2N2
2 mol CH2N2
COOMe
COOMe
COOH
什么情况下为过量? 1 mol CH2N2
OH OH
羧酸比酚更易于反应
COOMe
DCC催化酚醇偶联 催化酚醇偶联
b
R H
OH
H H Nu
过渡态时 C- O断 裂 少 - 断
位阻小
H2SO4
Ph O
* CH2OH Ph 2h
OMe
+ +
Ph
* CH2OMe
OH
+
MeOH CH3ONa 2h
Ph
90% * CH2OH
OMe
10% * CH2OMe
OH
Ph
25%
75%
由于产物中含羟基,如果环氧乙烷过量,就可形成聚醚, 由于产物中含羟基,如果环氧乙烷过量,就可形成聚醚,故 甲醇必须过量
多卤化物与醇钠反应,得到多醚化产物: 多卤化物与醇钠反应,得到多醚化产物:
CHCl3
+ 3 RONa CCl3NO2 + 4 RONa
CH(OR)3 C(OR)4
原酸酯 四烷氧基甲烷
Cl
EtOH/NaOH
NO2
OEt
(95.6%) 转化率70%
NO2
4.1.1.2 芳磺酸酯作烃化剂
芳磺酸酯的应用比硫酸酯(有毒 广 是很好的离去基团。 芳磺酸酯的应用比硫酸酯 有毒)广,且OTs是很好的离去基团。 有毒 是很好的离去基团
第二章 烃化反应

(H3C)3 CX
欲制备:
B-
(H3C)3 C+
CH3
H3C C
O
H3C A B
CH3 C CH2 CH3
C2H5
A: (CH3)3CX+C2H5OH
B: (CH3)3COH + C2H5X
一 、醇的O-烃化
1 卤代烷为烃化剂 2 磺酸酯作烃化剂 3 环氧乙烷类作烃化剂 4 烯烃作为烃化剂 5 醇作为烃化剂 6 其它烃化剂
1.卤代烃为烃化剂 (1)反应通式
ArOH RX OH Ar O R X H2O
(3)应用
① 芳香脂肪醚的制备 镇痛药邻乙氧基苯甲酰胺的合成
CONH2 OH
EtBr/NaOH 80~100
CONH2 (75%)
OEt
镇痛药苄达明的合成
O Na
N N
Cl(CH2)3N(CH3)2/Xyl 125~128 ,7h
温-80。
(m、n、p均约为20)
一 、醇的O-烃化
1 卤代烷为烃化剂 2 磺酸酯作烃化剂 3 环氧乙烷类作烃化剂 4 烯烃作为烃化剂 5 醇作为烃化剂 6 其它烃化剂
4. 烯烃为烃化剂
醇可与烯烃双键进行加成反应生成醚, 但对烯烃双键旁边没有吸电子基团存在时,反应
不易进行。 只有当双键的位有羰基、氰基、酯基、羧基等存
② 酚的O-烃化反应
由于酚的酸性比醇强,所以反应更容易 进行,需要的碱相对醇的反应也较弱。
反应通常是通过SN2机理完成
2.碳负离子的亲核取代反应
碳负离子带有负电荷,具有很强的碱性 和亲核能力,可以和卤代烃等烃化试剂 发生取代反应,延长碳链。
其中碳负离子可以是炔基负离子,格氏 试剂中的烷基负离子及活泼亚甲基在碱 作用形成次甲基负离子。
《烃化反应》课件

碳正离子的形成是烃化反应的关键步骤,其稳定性直接影响反应速率和 产物构型。在形成碳正离子的过程中,取代基的影响较大,取代基的电
子效应和空间效应均可影响碳正离子的稳定性。
亲核取代过程是放热反应,其速率主要受亲核试剂的活性影响。在亲核 取代过程中,溶剂效应、温度、压力等因素也会影响反应速率和产物构 型。
烃化反应的影响因素
底物的影响
底物的结构和取代基的性质对烃化反应的影响较 大。在底物分子中,未取代的碳-氢键的数目和取 代基的性质均可影响碳正离子的形成和稳定性。
溶剂的影响
溶剂的极性和酸碱性对烃化反应的影响较大。在 极性溶剂中,反应物的溶解度和反应速率均会增 加。此外,酸碱性溶剂可影响碳正离子的稳定性 ,进而影响反应速率和产物构型。
烃化反应的挑战与机遇
挑战
如何实现绿色低碳发展、提高反 应效率和选择性、降低能耗和资 源消耗等是烃化反应面临的挑战 。
机遇
随着科技的不断进步和社会需求 的增加,烃化反应在化工、医药 、新能源等领域的应用前景广阔 ,具有很大的发展机遇。
烃化反应的前沿研究动态
新催化剂研究
针对烃化反应的催化剂进行创新研究, 开发高效、环保、低成本的催化剂体系
氨基烃化
在氨氮上添加烃基,生成胺类 化合物。
烃化反应的重要性
01 02
在有机合成中的重要性
烃化反应是有机合成中的重要反应之一,可以用于合成高分子材料、药 物、香料等。通过烃化反应,可以改变有机物的官能团和结构,生成新 的化合物。
在工业生产中的重要性
烃化反应在工业生产中具有广泛的应用,如生产塑料、合成橡胶、农药 、染料等。通过烃化反应,可以生产出具有特定性能和用途的化学品。
烃化反应的未来发展方向
绿色低碳
子效应和空间效应均可影响碳正离子的稳定性。
亲核取代过程是放热反应,其速率主要受亲核试剂的活性影响。在亲核 取代过程中,溶剂效应、温度、压力等因素也会影响反应速率和产物构 型。
烃化反应的影响因素
底物的影响
底物的结构和取代基的性质对烃化反应的影响较 大。在底物分子中,未取代的碳-氢键的数目和取 代基的性质均可影响碳正离子的形成和稳定性。
溶剂的影响
溶剂的极性和酸碱性对烃化反应的影响较大。在 极性溶剂中,反应物的溶解度和反应速率均会增 加。此外,酸碱性溶剂可影响碳正离子的稳定性 ,进而影响反应速率和产物构型。
烃化反应的挑战与机遇
挑战
如何实现绿色低碳发展、提高反 应效率和选择性、降低能耗和资 源消耗等是烃化反应面临的挑战 。
机遇
随着科技的不断进步和社会需求 的增加,烃化反应在化工、医药 、新能源等领域的应用前景广阔 ,具有很大的发展机遇。
烃化反应的前沿研究动态
新催化剂研究
针对烃化反应的催化剂进行创新研究, 开发高效、环保、低成本的催化剂体系
氨基烃化
在氨氮上添加烃基,生成胺类 化合物。
烃化反应的重要性
01 02
在有机合成中的重要性
烃化反应是有机合成中的重要反应之一,可以用于合成高分子材料、药 物、香料等。通过烃化反应,可以改变有机物的官能团和结构,生成新 的化合物。
在工业生产中的重要性
烃化反应在工业生产中具有广泛的应用,如生产塑料、合成橡胶、农药 、染料等。通过烃化反应,可以生产出具有特定性能和用途的化学品。
烃化反应的未来发展方向
绿色低碳
第五章烃化反应
丙二酸酯、丙二腈、氰乙酸酯、乙酰乙酸乙酯、苄腈等
Eg. CH2(COOEt)2
Cl
(EtOOC)2HC
EtONa
(61%)
主要影响因素 a.催化剂 常用RONa b.溶剂 以RONa为催化剂时,多选用醇类作溶剂。 c.被烃化物的结构 当活泼亚甲基上有两个活性H时,若有足够量的碱 和烃化剂存在,可发生双烃化反应。
O
C OEt H2C
C OEt O
(CH3)2CHCH2CH2Br EtONa, EtOH
O
C OEt
CH (H3C)2HCH2CH2C C OEt
O
O
CH3CH2Br EtONa, EtOH
C2H5
C OEt
C (H3C)2HCH2CH2C C OEt
O
三、硫酸酯和芳磺酸酯类烃化剂
(CH3)2SO4 , (C2H5)2SO4 ,
⑵ 活泼亚甲基化合物的C-烃化
活性亚甲基:亚甲基上连有吸电子基团时,其上氢原子的
活性增大。 X
B:-
H2C
+R
Y
X
X R HC Y
吸e基使亚甲基活性增大的能力按大小次序排列:
X H2C Y
X, Y为吸电子基
O
-NO2 > -CR> RSO2-> -CN> -COOR> Ph
常见的活性亚甲基的化合物:β-二酮、β-羰基酸酯、
OHO N H
(CH3)2SO4,NaOH
△
O
O OCH3
(酚羟基形成氢链
N
O 用RX难烃化)
CH3
抗肿瘤药阿克罗宁(Acronine)
⑵ 氮原子上的烃化反应
亲核活性 氨基氮 > 羟基氧 , 用(CH3)2SO4更易烃化. Eg.
烃化反应

ph CH ph OH + ClCH2CH2NMeHCl
NaOH/二甲苯 △
ph CH ph OCH2CH2NMe2
苯海拉明(Diphenydramine)
返回本节
(2)酚结构对烃化反应的影响
酚酸性比醇强,在碱性条件下,很容易得到高收率的酚醚。
ArOH RX
OH
Ar
O R
X
H2O
如镇痛药邻乙氧基苯甲酰胺(Ethenzamide)的合成。
返回本节
(2)卤代烃的选择
a. 由于Williamson合成是在强碱条件下进行的,所以 一般不用叔卤烷作为烃化试剂,因为叔卤烷在碱性条 件下易发生消除,生成烯烃。 b. 如果卤原子相同,则伯卤烷的反应最好,仲卤烷次 之。 c. 氯苄和溴苄的活性较大,易于进行烃化反应; d. 氯苯和溴苯由于卤原子与芳环存在p-π共轭,活性 很差,烃化反应较难进行。 e. 芳基-脂肪混合醚的制备 制备芳基-脂肪混合醚(Ar-O-R)时,一般应选用酚类 与脂肪族的卤代烃反应。
返回本节
(2)酚的氧烃化
① 由于酚的烃化比醇容易,所以常用的碱除 了氢氧化钠等强碱外,还可以用碳酸钠(钾) 等弱碱。 ② 反应溶剂可用水、醇类、丙酮、DMF、 DMSO、苯或二甲苯等。
返回ArSO2OR)和硫酸酯烃化剂
也是常用烃化剂,其反应机理与卤代烃的烃化反应 相同。由于芳磺酸酯基和硫酸酯基比卤原子易离去, 所以,其活性比卤代烃大,是一类强烃化剂。因此, 使用芳磺酸酯和硫酸酯时,其反应条件较卤代烃温 和。 芳磺酸酯由芳磺酰氯与相应的醇在低温下反应制得。 芳磺酸酯中应用最多的是对甲苯磺酸酯(TsOR), 常用于引入分子量较大的烃基。 某些难以烃化的羟基(如螯合酚的烃化),可用芳 磺酸酯进行烃化。
NaOH/二甲苯 △
ph CH ph OCH2CH2NMe2
苯海拉明(Diphenydramine)
返回本节
(2)酚结构对烃化反应的影响
酚酸性比醇强,在碱性条件下,很容易得到高收率的酚醚。
ArOH RX
OH
Ar
O R
X
H2O
如镇痛药邻乙氧基苯甲酰胺(Ethenzamide)的合成。
返回本节
(2)卤代烃的选择
a. 由于Williamson合成是在强碱条件下进行的,所以 一般不用叔卤烷作为烃化试剂,因为叔卤烷在碱性条 件下易发生消除,生成烯烃。 b. 如果卤原子相同,则伯卤烷的反应最好,仲卤烷次 之。 c. 氯苄和溴苄的活性较大,易于进行烃化反应; d. 氯苯和溴苯由于卤原子与芳环存在p-π共轭,活性 很差,烃化反应较难进行。 e. 芳基-脂肪混合醚的制备 制备芳基-脂肪混合醚(Ar-O-R)时,一般应选用酚类 与脂肪族的卤代烃反应。
返回本节
(2)酚的氧烃化
① 由于酚的烃化比醇容易,所以常用的碱除 了氢氧化钠等强碱外,还可以用碳酸钠(钾) 等弱碱。 ② 反应溶剂可用水、醇类、丙酮、DMF、 DMSO、苯或二甲苯等。
返回ArSO2OR)和硫酸酯烃化剂
也是常用烃化剂,其反应机理与卤代烃的烃化反应 相同。由于芳磺酸酯基和硫酸酯基比卤原子易离去, 所以,其活性比卤代烃大,是一类强烃化剂。因此, 使用芳磺酸酯和硫酸酯时,其反应条件较卤代烃温 和。 芳磺酸酯由芳磺酰氯与相应的醇在低温下反应制得。 芳磺酸酯中应用最多的是对甲苯磺酸酯(TsOR), 常用于引入分子量较大的烃基。 某些难以烃化的羟基(如螯合酚的烃化),可用芳 磺酸酯进行烃化。
烃化反应

普鲁卡因
学习重点
氧原子上的烃化反应历程、烃化剂种类、特点及应用 范围
氮原子上的烃化反应历程、烃化剂种类、特点及应用 范围
伯胺的制备方法 芳烃的C-烃化(F-C反应)历程、特点及影响因素 烯丙位、苄位、活性亚甲基化合物的C-烃化的反应历
程及影响因素
一 醇的O-烃化
1 卤代烷为烃化剂 2 磺酸酯 3 环氧乙烷类作烃化剂 4 烯烃作为烃化剂 5 醇作为烃化剂 6 其它烃化剂
ii)当X相同时
卤代丙烯, 卤苄 > 卤代烷 > 卤芳烃ArX
Cl
OEt
NaOH
+ EtOH
非那西丁中间体
NO 2
NO 2
当卤代烃为叔卤代烃时,不能在强碱下反应,
易消除HX,可在中性或弱碱性下反应。
CH 3
B
CH3 C +
CH 3
CH 2
CH3-C
CH 3
影响因素 b 醇的影响
苯海拉明合成可采用的两种方法。可以看到,由于醇羟基氢原子的活性不 同,进行烃化反应时所需的条件也不同。前一反应醇的活性低,要先制成 醇钠;而二苯甲醇中,由于苯基的吸电子效应,羟基中氢原子的活性增大 ,在反应中加入氢氧化钠作除酸剂即可。显然后一反应优于前一反应,因 此苯海拉明的合成采用了后一种方式
4%
3 叔胺的制备
1) 仲胺与卤代烃或α,β不饱和烃作用
(n-Pr)2NH+H2C=CHCN
(n-Pr)2NCH2CH2CN
2) 仲胺+1mol醛或酮还原烃化 伯胺+2mol醛或酮还原烃化
O
C
-CN -COOR' -COOH
O NaOH
H3C
第二章 烃化反应

6
苄基卤化物,烯丙基卤化物活性较大,只要在 较弱的碱碳酸钾催化下与酚反应即得苄醚或烯 丙醚:
OH
K CO , KI 2 3 K K CO CO ,, KI KI K CO , KI 2 2 3 3 2 3 + ClCH CH=CH + 2CH=CH 2 2CH=CH + ClCH ClCH 2 Me CO 2 2 2 Me2CO Me Me CO CO 2 2 2 OH OH OH OH
NO 22 NO NO 2
OH OH OH OH
NO2
NO2
OCH3 OCH3OH OCH 3 OH NaOH OH NaOH NaOH
OCH3 OCH3ONa OCH 3 ONa ClCH2CHOHCH2OH ONa ClCH2CHOHCH CHOHCH2OH OH ClCH
2 2
OCH3 OCH OCH3 OCH2CHCH2OH 3 OCH 2OH OCH22CHCH CHCH OH 2OH OH OH 6 6
伯卤代烃:SN2机理 苄卤和烯丙卤:SN1或SN2的反应活性都很高; 不同卤素对反应活性有影响: R-I > R-Br > R-Cl。 亲核试剂对反应活性有影响,强亲核试剂对SN2反 应有利,但强碱对于易按SN1机理反应的叔卤烷影 响不大,却可引起它发生消除反应生成烯烃。
叔卤代烃作烷基化试剂:会发生消除反应,得不 到相应的醚; 要合成叔烷基混合醚时,需用叔醇与相应的卤代 烷进行反应;
OH + + R'X R-OH R'X
OH OH
R-O-R' R-O-R'
该反应为亲核取代反应(SN) 根据烃基的结构,可按SN1或SN2机理进行。
烃化反应

烃化反应 31/60
1、伯胺的制备
1)“过量的氨” 法 加入铵盐,有利于反应的进行
O2N Cl NO2 NH3/AcONH4 O2N NH2 NO2
烃化反应 32/60
2) Gabriel合成法-“邻苯二甲酰亚胺”
O NH O KOH/ EtOH O NK O RX/DMF (SN2) O O N R NH2NH2 HCl/H2O RNH2 + CO2H RNH2 + O NH NH O CO2H
ROH H3C SO2R
H3C
SO2Cl
CH2OH HC OH CH2OH
HCl/Me2CO
CH2OH HC O CH2O
CH2OC18H37 HCl/EtOH C18H37OTs/KOH/Tol HC O 2h CH2O
CH2OC18H37 HC OH CH2OH
烃化反应 10/60
3、环氧乙烷: 碱催化:SN2
R O R'O R O OR' H R C O OR' R'OH OR' H R C + R'O OH
酸催化:SN2---SN1
R O H R O H R O R'OH HO R' R O H
HO R' R OH
_
H R
OR' OH
烃化反应 11/60
实例:
H2SO4 H Ph C CH2 + MeOH O CH3ONa
烃化反应
Alkylation
定义
有机分子中的氢原子被烃基取代的反应 引入方式:取代或加成 反应机理:亲核取代、亲电取代等
烃化反应 2/60
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
OMe HO O MeI/NaOH MeO O OMe
O
H
O
O
H
O
4 O-烃化和C-烃化
溶剂对烃化位置有较大的影响,酚类在DMSO、DMF、 醚类、醇类中烃化,主要的酚醚。 在水、酚或三氟乙醇中,主要的碳烃化产物。
LOGO
三、醇、酚羟基的保护
保护:当一个化合物有不止一个官能团,想在官能团A处 进行转换反应,又不希望影响分子中其他的官能团B、C, 这时常先使官能团B、C与某些试剂反应,生成其衍生物, 待达到目的之后再恢复为原来的官能团,此衍生物在下一 步官能团A的转换时是稳定的。此时引入的基团叫保护基。 理想保护基的要求: 1)引入保护基的试剂应易得、稳定及无毒; 2)保护基不带有或不引入手性中心; 3)保护基在整个过程中是稳定的; 4)保护基的引入及脱去,收率是定量的; 5)脱保护后,保护基部分与产物容易分离。
LOGO
ArOMe + BBr3 ArOBBr2 + 3H2O
Ar O Me Br2B Br
ArOBBr2 + MeBr
ArOH +H3BO3 + 2HBr
此外三溴化铝及三氯化铝的脱甲醚活性与三卤化硼相 类同。 还有两种较缓和的脱甲基条件:一是加入甲磺酸及蛋 氨酸,室温放置;二是用碘代三甲基硅烷在室温下反应。
LOGO
第二章 烃化反应
本章所要掌握的重点和难点内容如下: 1.Williamson醚合成法; 2.醇酚羟基和氨基的保护(烃化法); 3.伯、仲、叔胺的制备; 4.碳烃化反应中的Frieldel-Crafts反应,烯丙位、苄 位和羰基化合物 α-位的碳-烃化有机金属化合物 在碳烃化中的应用。
LOGO
LOGO
第一节
醇的O-烃化 酚的O-烃化
氧原子上的 烃化反应
醇、酚羟基的保护
LOGO
一、醇的O-烃化
简单醚的合成常采用醇脱水的方法制备。本节着重讨论 醇与烃化剂反应制备混合醚的方法。 1 卤代烃为烃化剂 Williamson醚合成:醇在碱(Na、NaOH、KOH等)存在 下与卤代烃反应生成醚
4.汴醚 保护基
例如:抗肿瘤药阿糖胞苷的合成路线之一,就是用苄基 保护糖羟基。
OMe O RO RO Cl,H OR + MeO N N CH2Cl2 RO RO NH2 N O O RO RO OR N HO HO OH H2/PdCl2 O O N N NH2 OR O O N OMe N NH3/MeOH
MEM在作保护基与醇反应时,一般用三乙胺,若底物 为酸敏感物质则用季胺盐Et3NMEMCl。
H
Et3 NMEMCl / MeCN MeO 2 C H
MeO 2 C
HO
MEMO
LOGO
四氢吡喃醚(THP)保护基,
适用范围:是最常用的醇羟基保护方法之一,但在酚中应用 较少。广泛应用于炔醇、甾类及核苷酸的合成。
3.烯丙醚 保护基
适用范围:受限;寡糖合成中应用较多。 脱保护基:需要在强碱性条件。 但是现用过渡金属试剂Rh(I)、Ir(I)、Pd(0)可在缓 和条件下选择性脱去烯丙基,而不影响分子中存在 的其它烷基醚、芳醚、酯及许多常见官能团。
LOGO
苄醚保护基
适用范围:苄基广泛用于保护糖环及氨基酸中的 醇羟基,也是酚常用的保护基; 脱保护基:用氢解的方式除去,常用10%Pd-C, Raney-Ni,Rh-Al2O3作催化剂。
CH2C6H5 N Cl(CH2)3N(CH3)2 N ONa
CH2C6H5 N N O(CH2)3N(CH3)2
LOGO
b 硫酸二甲酯可以将水溶性酚的碱金属盐甲基化。
MeO HO CHO Me2SO4/NaOH MeO MeO CHO
c 重氮甲烷与酚反应较慢,反应一般在乙醚、甲醇、 氯仿等溶液中进行。可以用三氟化硼或氟硼酸催化 d 除此之外酚与醇也可以用DCC缩合法、烷氧辚盐 R3P+OR’X-、进行O-烃化; 与异丁烯、氯甲醚反应进行O-烃化
H2SO4, 加热, 5h CH3ONa,加热,6h
90% 25%
10%…..SN1 75%…..SN2
LOGO
4 烯烃为烃化剂 只有当双键的 α 位有羰基、氰基、酯基、羧基等吸电子 基存在时,才较易发生烃化反应。 5 其他烃化剂 三氟甲磺酸酯及氟硼酸三烷基羊盐是高活性的烃化剂, 他们较不稳定,可醚化有位阻的醇。并且可以避免消旋 化的发生。
LOGO
1 甲醚 保护基
适用范围: 用甲醚基保护醇羟基很较少应用; 但甲醚基是酚羟基最常用的保护基,制备简单, 对一般的酸碱、亲核试剂、氧化剂和还原剂是稳定的, 也就是说脱甲基需要剧烈的条件。
脱保护基的方法有: 1)用卤氢酸回流保护基,适合分子中没有其他敏感基团。 2)另外还可以用强烈条件,如与吡啶盐酸盐熔融(易引 起立体构型的改变)。或利用喹啉作溶剂,加吡啶盐酸盐回 流。 3) 用三溴化硼脱甲基,优点:条件缓和,在室温或低温 下,惰性试剂中。缺点:保护有限制,会引起聚合。适用 范围:选择性的对羰基邻位的甲氧基脱保护,对间位甲氧 基无影响。
LOGO
2.叔丁醚 保护基
适用范围:叔丁醚保护用的较少,用于多肽合成中峈 氨酸酚羟基及甾类化合物合成时醇羟基的保护。 脱保护基:叔丁醚对强碱及催化氢化稳定,但对酸敏 感。所以脱除要用中强度的酸,如:HCOOH、 CF3COOH、HBr-HOAc、HCl-dioxane或Lewis酸
LOGO
二、酚的O-烃化
1 烃化剂 a 卤代烃与酚在碱存在下,很容易得到较高收率的酚 醚,一般加NaOH即可形成芳氧负离子。可用水、醇类、 丙酮、DMF、DMSO、苯或二甲苯做溶剂。
如:镇痛药邻乙氧基苯甲酰胺及苄达明(benzydamine) 的合成
CONH2 OH EtBr/NaOH CONH2 OEt
+ R'OH
ROR' H
ROR' + H
LOGO
抗组胺药苯海拉明的合成可以采用Williamson醚合成:
孰优孰劣?
后一种反应活性强
LOGO
后对Williamson醚合成法进行改进,用醇铊与卤代烃在 乙氰中反应,收率较佳。
环烷衍生物在酸催化下进行的是SN1。
H H3C C CH2 O H+ H H3C C CH2 O H H HOR -HCH3CHCH2 OROH
LOGO
例如:苯基环氧乙烷分别在酸和碱的催化下反应;
O Ph
OMe + MeOH PhCHCH2OH
OH + PhCHCH2OMe
LOGO
卤代醇在碱性条件下可发生分子内的Williamson醚合 成,得到环氧乙烷、环氧丙烷及高环醚类化合物。
OH X NaOH O X O
芳香卤化物如卤素的邻对位有吸电子基团存在时,也可 作烃化剂,生成芳基烷基混合醚。
Cl EtOH/NaOH OEt
非那西丁中间体
ROH + B R'X + OR RO + HB R'OR + X
LOGO
反应历程可以为SN1也可以为SN2,历程如下:一般伯卤 代烃为SN2 ,叔卤代烃为SN1。 SN2
RO + H2 R' C X R' OR C X H H ROCH2R' + X
SN1
(1) R X
slow
R + X
(2) R
此时由于存在分子内氢键,使反应难以发生,解决办 法是用NaH或ROLi将酚转变成钠或锂盐,然后用卤代烃烃 化。 OMe OMe
HO O MeI/NaOH MeO O
O
H
O
O
H
O
LOGO
3 多元酚的选择性烃化
多元酚在强烈的条件下完全烃化,也可以采用适宜 条件进行选择性烃化。 黄酮类化合物一般可以利用螯合选择性烃化。
LOGO
醇、酚羟基的保护:
1. 形成醚 (与RX、RCOOR’等反应) 2. 形成缩醛或缩酮(与干燥的醛酮反应) 3. 形成酯(与酰化试剂如羧酸、酰氯、酸酐反应) 本节讨论由醇、酚经烃化所得醚类为保护基,介绍保 护基在合成中的应用及脱保护法
LOGO
ArOCH2OCH3 MOM
MeOCH2CH2OCH2OR MEM
O
OR
THP
MEM :1976年Corey等发现,适用范围广,可代替MOM (在制备时需要用致癌物氯甲醚)。
其制备如下: MeOCH2CH2OH
(CH2O)3/HCl
MeOCH2CH2OCH2Cl
ROH EtOTl C6H6 ROTl R'X CH3CN ROR'
例如:
COOEt H OH HO H COOEt ROTl COOEt COOEt H OTl R'I/CH3CN H OR' TlO H R'O H COOEt COOEt
若想得到立体专一的甲醚类化合物,可以用氢化钠代替 金属钠制成醇钠。
LOGO
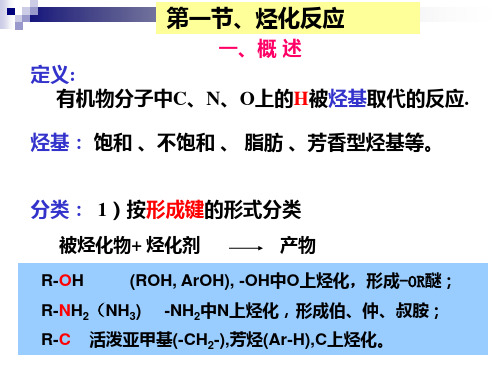
常见的被烃化物有: a 醇(ROH),酚(ArOH)等,烃化发生在羟基上; b 胺类,在氨基氮上引入烃基; c 活性亚甲基、芳烃等,在碳原子上引入烃基。 反应难易决定于被烃化物的结构,也决定于烃化物结 构及离去基团的性质,和溶剂的影响,有时也受催化剂 影响。 常用的烃化剂有:卤代烃及硫酸酯类。此外芳磺酸酯、 醇类、醚类、烯烃类及甲醛、甲酸、重氮甲烷等均可应 用。
第一节
氧原子上的烃化反应
第二节
氮原子上的烃化反应
第三节
碳原子上的烃化反应
LOGO
烃基引入方式
O
H
O
O
H
O
4 O-烃化和C-烃化
溶剂对烃化位置有较大的影响,酚类在DMSO、DMF、 醚类、醇类中烃化,主要的酚醚。 在水、酚或三氟乙醇中,主要的碳烃化产物。
LOGO
三、醇、酚羟基的保护
保护:当一个化合物有不止一个官能团,想在官能团A处 进行转换反应,又不希望影响分子中其他的官能团B、C, 这时常先使官能团B、C与某些试剂反应,生成其衍生物, 待达到目的之后再恢复为原来的官能团,此衍生物在下一 步官能团A的转换时是稳定的。此时引入的基团叫保护基。 理想保护基的要求: 1)引入保护基的试剂应易得、稳定及无毒; 2)保护基不带有或不引入手性中心; 3)保护基在整个过程中是稳定的; 4)保护基的引入及脱去,收率是定量的; 5)脱保护后,保护基部分与产物容易分离。
LOGO
ArOMe + BBr3 ArOBBr2 + 3H2O
Ar O Me Br2B Br
ArOBBr2 + MeBr
ArOH +H3BO3 + 2HBr
此外三溴化铝及三氯化铝的脱甲醚活性与三卤化硼相 类同。 还有两种较缓和的脱甲基条件:一是加入甲磺酸及蛋 氨酸,室温放置;二是用碘代三甲基硅烷在室温下反应。
LOGO
第二章 烃化反应
本章所要掌握的重点和难点内容如下: 1.Williamson醚合成法; 2.醇酚羟基和氨基的保护(烃化法); 3.伯、仲、叔胺的制备; 4.碳烃化反应中的Frieldel-Crafts反应,烯丙位、苄 位和羰基化合物 α-位的碳-烃化有机金属化合物 在碳烃化中的应用。
LOGO
LOGO
第一节
醇的O-烃化 酚的O-烃化
氧原子上的 烃化反应
醇、酚羟基的保护
LOGO
一、醇的O-烃化
简单醚的合成常采用醇脱水的方法制备。本节着重讨论 醇与烃化剂反应制备混合醚的方法。 1 卤代烃为烃化剂 Williamson醚合成:醇在碱(Na、NaOH、KOH等)存在 下与卤代烃反应生成醚
4.汴醚 保护基
例如:抗肿瘤药阿糖胞苷的合成路线之一,就是用苄基 保护糖羟基。
OMe O RO RO Cl,H OR + MeO N N CH2Cl2 RO RO NH2 N O O RO RO OR N HO HO OH H2/PdCl2 O O N N NH2 OR O O N OMe N NH3/MeOH
MEM在作保护基与醇反应时,一般用三乙胺,若底物 为酸敏感物质则用季胺盐Et3NMEMCl。
H
Et3 NMEMCl / MeCN MeO 2 C H
MeO 2 C
HO
MEMO
LOGO
四氢吡喃醚(THP)保护基,
适用范围:是最常用的醇羟基保护方法之一,但在酚中应用 较少。广泛应用于炔醇、甾类及核苷酸的合成。
3.烯丙醚 保护基
适用范围:受限;寡糖合成中应用较多。 脱保护基:需要在强碱性条件。 但是现用过渡金属试剂Rh(I)、Ir(I)、Pd(0)可在缓 和条件下选择性脱去烯丙基,而不影响分子中存在 的其它烷基醚、芳醚、酯及许多常见官能团。
LOGO
苄醚保护基
适用范围:苄基广泛用于保护糖环及氨基酸中的 醇羟基,也是酚常用的保护基; 脱保护基:用氢解的方式除去,常用10%Pd-C, Raney-Ni,Rh-Al2O3作催化剂。
CH2C6H5 N Cl(CH2)3N(CH3)2 N ONa
CH2C6H5 N N O(CH2)3N(CH3)2
LOGO
b 硫酸二甲酯可以将水溶性酚的碱金属盐甲基化。
MeO HO CHO Me2SO4/NaOH MeO MeO CHO
c 重氮甲烷与酚反应较慢,反应一般在乙醚、甲醇、 氯仿等溶液中进行。可以用三氟化硼或氟硼酸催化 d 除此之外酚与醇也可以用DCC缩合法、烷氧辚盐 R3P+OR’X-、进行O-烃化; 与异丁烯、氯甲醚反应进行O-烃化
H2SO4, 加热, 5h CH3ONa,加热,6h
90% 25%
10%…..SN1 75%…..SN2
LOGO
4 烯烃为烃化剂 只有当双键的 α 位有羰基、氰基、酯基、羧基等吸电子 基存在时,才较易发生烃化反应。 5 其他烃化剂 三氟甲磺酸酯及氟硼酸三烷基羊盐是高活性的烃化剂, 他们较不稳定,可醚化有位阻的醇。并且可以避免消旋 化的发生。
LOGO
1 甲醚 保护基
适用范围: 用甲醚基保护醇羟基很较少应用; 但甲醚基是酚羟基最常用的保护基,制备简单, 对一般的酸碱、亲核试剂、氧化剂和还原剂是稳定的, 也就是说脱甲基需要剧烈的条件。
脱保护基的方法有: 1)用卤氢酸回流保护基,适合分子中没有其他敏感基团。 2)另外还可以用强烈条件,如与吡啶盐酸盐熔融(易引 起立体构型的改变)。或利用喹啉作溶剂,加吡啶盐酸盐回 流。 3) 用三溴化硼脱甲基,优点:条件缓和,在室温或低温 下,惰性试剂中。缺点:保护有限制,会引起聚合。适用 范围:选择性的对羰基邻位的甲氧基脱保护,对间位甲氧 基无影响。
LOGO
2.叔丁醚 保护基
适用范围:叔丁醚保护用的较少,用于多肽合成中峈 氨酸酚羟基及甾类化合物合成时醇羟基的保护。 脱保护基:叔丁醚对强碱及催化氢化稳定,但对酸敏 感。所以脱除要用中强度的酸,如:HCOOH、 CF3COOH、HBr-HOAc、HCl-dioxane或Lewis酸
LOGO
二、酚的O-烃化
1 烃化剂 a 卤代烃与酚在碱存在下,很容易得到较高收率的酚 醚,一般加NaOH即可形成芳氧负离子。可用水、醇类、 丙酮、DMF、DMSO、苯或二甲苯做溶剂。
如:镇痛药邻乙氧基苯甲酰胺及苄达明(benzydamine) 的合成
CONH2 OH EtBr/NaOH CONH2 OEt
+ R'OH
ROR' H
ROR' + H
LOGO
抗组胺药苯海拉明的合成可以采用Williamson醚合成:
孰优孰劣?
后一种反应活性强
LOGO
后对Williamson醚合成法进行改进,用醇铊与卤代烃在 乙氰中反应,收率较佳。
环烷衍生物在酸催化下进行的是SN1。
H H3C C CH2 O H+ H H3C C CH2 O H H HOR -HCH3CHCH2 OROH
LOGO
例如:苯基环氧乙烷分别在酸和碱的催化下反应;
O Ph
OMe + MeOH PhCHCH2OH
OH + PhCHCH2OMe
LOGO
卤代醇在碱性条件下可发生分子内的Williamson醚合 成,得到环氧乙烷、环氧丙烷及高环醚类化合物。
OH X NaOH O X O
芳香卤化物如卤素的邻对位有吸电子基团存在时,也可 作烃化剂,生成芳基烷基混合醚。
Cl EtOH/NaOH OEt
非那西丁中间体
ROH + B R'X + OR RO + HB R'OR + X
LOGO
反应历程可以为SN1也可以为SN2,历程如下:一般伯卤 代烃为SN2 ,叔卤代烃为SN1。 SN2
RO + H2 R' C X R' OR C X H H ROCH2R' + X
SN1
(1) R X
slow
R + X
(2) R
此时由于存在分子内氢键,使反应难以发生,解决办 法是用NaH或ROLi将酚转变成钠或锂盐,然后用卤代烃烃 化。 OMe OMe
HO O MeI/NaOH MeO O
O
H
O
O
H
O
LOGO
3 多元酚的选择性烃化
多元酚在强烈的条件下完全烃化,也可以采用适宜 条件进行选择性烃化。 黄酮类化合物一般可以利用螯合选择性烃化。
LOGO
醇、酚羟基的保护:
1. 形成醚 (与RX、RCOOR’等反应) 2. 形成缩醛或缩酮(与干燥的醛酮反应) 3. 形成酯(与酰化试剂如羧酸、酰氯、酸酐反应) 本节讨论由醇、酚经烃化所得醚类为保护基,介绍保 护基在合成中的应用及脱保护法
LOGO
ArOCH2OCH3 MOM
MeOCH2CH2OCH2OR MEM
O
OR
THP
MEM :1976年Corey等发现,适用范围广,可代替MOM (在制备时需要用致癌物氯甲醚)。
其制备如下: MeOCH2CH2OH
(CH2O)3/HCl
MeOCH2CH2OCH2Cl
ROH EtOTl C6H6 ROTl R'X CH3CN ROR'
例如:
COOEt H OH HO H COOEt ROTl COOEt COOEt H OTl R'I/CH3CN H OR' TlO H R'O H COOEt COOEt
若想得到立体专一的甲醚类化合物,可以用氢化钠代替 金属钠制成醇钠。
LOGO
常见的被烃化物有: a 醇(ROH),酚(ArOH)等,烃化发生在羟基上; b 胺类,在氨基氮上引入烃基; c 活性亚甲基、芳烃等,在碳原子上引入烃基。 反应难易决定于被烃化物的结构,也决定于烃化物结 构及离去基团的性质,和溶剂的影响,有时也受催化剂 影响。 常用的烃化剂有:卤代烃及硫酸酯类。此外芳磺酸酯、 醇类、醚类、烯烃类及甲醛、甲酸、重氮甲烷等均可应 用。
第一节
氧原子上的烃化反应
第二节
氮原子上的烃化反应
第三节
碳原子上的烃化反应
LOGO
烃基引入方式
