高一化学必修1第二章第三节氧化还原反应PPT
合集下载
高一化学必修1 第二章氧化还原反应 ppt

第二章 化学物质及其变化
第三节 氧化还原反应
思考与交流 思考与交流
在我们生活的大气圈中,最具反应活性的物质是什 么?它能与哪些物质发生反应?
C + O2 == CO2 S + O2 == SO2 CH4 + 2O2 == CO2 + 2H2O
点燃 点燃
点燃
氧化反应
观察我们周围的物质,有哪些是被氧化的产物?
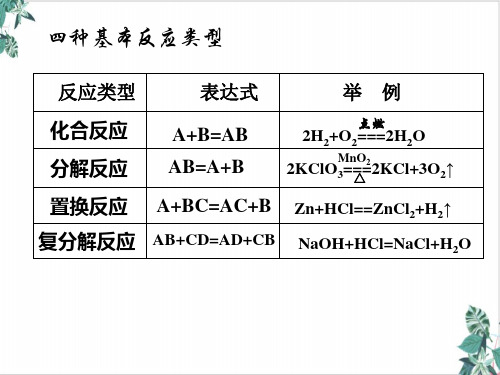
复分解反应 离子反应 非离子反应 氧化还原反应 按反应中是否 有电子转移分 非氧化还原反应
学与问
1、有人说置换反应、有单质参与的化合反应和有单 、有人说置换反应、 质生成的分解反应全部都属于氧化还原反应。 质生成的分解反应全部都属于氧化还原反应。你认为 这个说法正确吗?请说明你的理由。 这个说法正确吗?请说明你的理由。 2、尝试列举具体的化学反应画出化合反应、分解反 、尝试列举具体的化学反应画出化合反应、 置换反应与氧化还原反应的交叉分类示意图。 应、置换反应与氧化还原反应的交叉分类示意图。
用双线桥表示下列氧化还原反应:
Fe2O3 + 3CO == 2Fe + 3CO2 CuO + H2 == Cu + H2O 2NaBr + Cl2 == Br2 + 2NaCl CH4 + 2O2 == CO2 + 2H2O
化合反应 按反应物和生成物 的种类和类别分 化 学 反 应 按反应中是否 有离子参加分 分解反应 置换反应
化合价升高、被氧化、失去 × 化合价升高、被氧化、失去2×e-
思考与交流
下列化学反应属于氧化还原反应的有 1、CaCO3+2HCl=CaCl2+CO2↑+H2O 、 2、CaO+H2O=Ca(OH)2 、 3、C+O2=CO2 、 4、CaCO3=CaO+CO2↑ 、 5、2KClO3=2KCl+3O2↑ 、 6、NaOH+HCl=NaCl+H2O 、 7、BaCl2+K2SO4=BaSO4↓+2KCl 、 8、MnO2+4HCl=MnCl2+Cl2↑+2H2O 、 9、2H2S+SO2=3S+2H2O 、 10、H2S+Cu2+=CuS↓+2H+ 、 ,
第三节 氧化还原反应
思考与交流 思考与交流
在我们生活的大气圈中,最具反应活性的物质是什 么?它能与哪些物质发生反应?
C + O2 == CO2 S + O2 == SO2 CH4 + 2O2 == CO2 + 2H2O
点燃 点燃
点燃
氧化反应
观察我们周围的物质,有哪些是被氧化的产物?
复分解反应 离子反应 非离子反应 氧化还原反应 按反应中是否 有电子转移分 非氧化还原反应
学与问
1、有人说置换反应、有单质参与的化合反应和有单 、有人说置换反应、 质生成的分解反应全部都属于氧化还原反应。 质生成的分解反应全部都属于氧化还原反应。你认为 这个说法正确吗?请说明你的理由。 这个说法正确吗?请说明你的理由。 2、尝试列举具体的化学反应画出化合反应、分解反 、尝试列举具体的化学反应画出化合反应、 置换反应与氧化还原反应的交叉分类示意图。 应、置换反应与氧化还原反应的交叉分类示意图。
用双线桥表示下列氧化还原反应:
Fe2O3 + 3CO == 2Fe + 3CO2 CuO + H2 == Cu + H2O 2NaBr + Cl2 == Br2 + 2NaCl CH4 + 2O2 == CO2 + 2H2O
化合反应 按反应物和生成物 的种类和类别分 化 学 反 应 按反应中是否 有离子参加分 分解反应 置换反应
化合价升高、被氧化、失去 × 化合价升高、被氧化、失去2×e-
思考与交流
下列化学反应属于氧化还原反应的有 1、CaCO3+2HCl=CaCl2+CO2↑+H2O 、 2、CaO+H2O=Ca(OH)2 、 3、C+O2=CO2 、 4、CaCO3=CaO+CO2↑ 、 5、2KClO3=2KCl+3O2↑ 、 6、NaOH+HCl=NaCl+H2O 、 7、BaCl2+K2SO4=BaSO4↓+2KCl 、 8、MnO2+4HCl=MnCl2+Cl2↑+2H2O 、 9、2H2S+SO2=3S+2H2O 、 10、H2S+Cu2+=CuS↓+2H+ 、 ,
人教版高一化学课件-氧化还原反应(共18张PPT)

一、氧化還原反應
化合價變化本質原因的分析:以NaCl為例
Na
+11
Na+
+11
+17
Cl
化合價升高,失去電子
2Na + Cl2 == 2NaCl
化合價降低,得到電子
+17
Cl-
Na+ Cl-
化合價的升降——電子的得失
一、氧化還原反應
化以合HC價l為變例化本質原因的分析:H0 2
+
0
Cl2
=
+1-1
非氧化還原反應
置換反應
化合反應化學反應分解反應 氧化還原反應
複分解反應
一、氧化還原反應
分層訓練1:必做題
1、下列反應屬於氧化還原反應的是( BC )
A. CuO+2HCl=CuCl2+H2O B. 2Na2O2+2H2O=4NaOH+O2↑ C. Zn+CuSO4=ZnSO4+Cu
D. Ca(OH)2+CO2=CaCO3↓ + H2O
化合
CaO + H2O === Ca(OH) 2 反應
高溫
CaCO3===CaO+CO2 ↑
分解反應
2KClO3==△=2KCl+3O2 ↑
Fe+CuSO4 == Cu+FeSO4 置換反應
NaOH+HCl==NaCl+H2O 複分解反應
一、氧化還原反應
結論3:氧化還原反應與四種基本反應類型 的關係
屬於哪種基本反應類型?
讓我 想一想?
一、氧化還原反應
思考與交流1:
1.請舉幾個氧化反應和還原反應的實例,指 出這類化學反應的分類標準是什麼?
高中化学必修一第二章第三节氧化还原反应 (共51张PPT)

生活中的氧化还原反应
●学习目标
• 1.从化合价升降、电子得失(或偏移)的 角度理解氧化还原反应。 • 2.了解氧化反应、还原反应的概念。 • 3.初步掌握根据化合价的变化分析及判断 氧化还原反应的方法 • 4.培养由现象到本质的科学探究意识。
●阅读自学 阅读教材35-37页并完成学法大视野24-25页的填空 一 从得失氧的角度分析氧化还原反应
还原反应:物质所含元素化合价降低的反应
2)从电子的得失或偏移(本质)角度分析
氧化反应:元素的原子失去或是偏离电子的反应 还原反应:元素的原子得到或是偏向电子的反应
●巩固练习
从氧化还原反应和四种基本反应类型的角度将下列方程式进行分类
化学反应
反应类型
是否氧化还原
(1)Zn + H2SO4== ZnSO4 + H2↑ (2)3C+2Fe2O3 4Fe+3CO2↑ (3)CaCO3==CaO+CO2↑ 2KCl + 3O2↑ (4)2KClO3 (5)CaO + H2O==Ca(OH)2 (6)4P+5O2 2 P2O5 (7) Na2SO4 + BaCl2=BaSO4↓+2NaCl (8) NaOH + HCl = NaCl + H2O
●精讲倾学
氧化还原反应与四种基本反应类型
是 不是 是 不是 是 是
不是 不是
●精讲倾学 氧化还原反应与四种基本反应类型
非氧化还原反应
化合反应
分解反应 化学反应 氧化还原反应
复分解反应
置换反应
练习:学法大视野P25,体验2
小结
氧化还原反应
1)从化合价的升降(特征)角度分析
氧化反应:物质所含元素化合价升高的反应
●学习目标
• 1.从化合价升降、电子得失(或偏移)的 角度理解氧化还原反应。 • 2.了解氧化反应、还原反应的概念。 • 3.初步掌握根据化合价的变化分析及判断 氧化还原反应的方法 • 4.培养由现象到本质的科学探究意识。
●阅读自学 阅读教材35-37页并完成学法大视野24-25页的填空 一 从得失氧的角度分析氧化还原反应
还原反应:物质所含元素化合价降低的反应
2)从电子的得失或偏移(本质)角度分析
氧化反应:元素的原子失去或是偏离电子的反应 还原反应:元素的原子得到或是偏向电子的反应
●巩固练习
从氧化还原反应和四种基本反应类型的角度将下列方程式进行分类
化学反应
反应类型
是否氧化还原
(1)Zn + H2SO4== ZnSO4 + H2↑ (2)3C+2Fe2O3 4Fe+3CO2↑ (3)CaCO3==CaO+CO2↑ 2KCl + 3O2↑ (4)2KClO3 (5)CaO + H2O==Ca(OH)2 (6)4P+5O2 2 P2O5 (7) Na2SO4 + BaCl2=BaSO4↓+2NaCl (8) NaOH + HCl = NaCl + H2O
●精讲倾学
氧化还原反应与四种基本反应类型
是 不是 是 不是 是 是
不是 不是
●精讲倾学 氧化还原反应与四种基本反应类型
非氧化还原反应
化合反应
分解反应 化学反应 氧化还原反应
复分解反应
置换反应
练习:学法大视野P25,体验2
小结
氧化还原反应
1)从化合价的升降(特征)角度分析
氧化反应:物质所含元素化合价升高的反应
人教版高一化学必修一氧化还原反应ppt课件

18
反应得到氧化产物
反应物所含的元素:化合价降低→得e-→ 发生还原反应 →是氧化剂→表现氧化性→
反应得到还原产物
12
下列反应中,哪些是氧化剂? 哪些是还原剂?
Cu + Cl2 == CuCl2 还原剂 氧化剂
Zn + H2SO4 == ZnSO4 + H2↑ 还原剂 氧化剂
CaCO3+ 2HCl == CaCl2+H2O+CO2↑
普通高中课程标准实验教科书 化学1(必修)
第二章 第三节 氧化还原反应
第一课时 氧化还原反应基本概念
1
旧知回顾
初中阶段,我们知道:
点燃
2Mg + O2 = 2MgO
氧化反应
△ CuO + H2 = Cu + H2O
还原反应
点燃
H2 + Cl2 = 2HCl
得氧、失氧
2
思考与交流
氧化反应和还原反应是独立进行的吗? CuO + H2 =△ Cu + H2O
非氧化还原反应
Cl2 + H2O== HCl + HClO
既是氧化剂又是还原剂 13
〖思考〗
下列几个反应属于基本反应类型中的那一种?
化合价 Cu+Cl2 =△== CuCl2
有变化
化合反应
CaO + H2O === Ca(OH) 2
CaCO3=高=温=CaO+CO2 ↑
△
2KClO3===2KCl+3O2 ↑
2Na + Cl2 == 2NaCl
氧化还原反应:
有元素化合价变化的化学反应 4
〖小结〗
化 氧化还原反应
学
反应得到氧化产物
反应物所含的元素:化合价降低→得e-→ 发生还原反应 →是氧化剂→表现氧化性→
反应得到还原产物
12
下列反应中,哪些是氧化剂? 哪些是还原剂?
Cu + Cl2 == CuCl2 还原剂 氧化剂
Zn + H2SO4 == ZnSO4 + H2↑ 还原剂 氧化剂
CaCO3+ 2HCl == CaCl2+H2O+CO2↑
普通高中课程标准实验教科书 化学1(必修)
第二章 第三节 氧化还原反应
第一课时 氧化还原反应基本概念
1
旧知回顾
初中阶段,我们知道:
点燃
2Mg + O2 = 2MgO
氧化反应
△ CuO + H2 = Cu + H2O
还原反应
点燃
H2 + Cl2 = 2HCl
得氧、失氧
2
思考与交流
氧化反应和还原反应是独立进行的吗? CuO + H2 =△ Cu + H2O
非氧化还原反应
Cl2 + H2O== HCl + HClO
既是氧化剂又是还原剂 13
〖思考〗
下列几个反应属于基本反应类型中的那一种?
化合价 Cu+Cl2 =△== CuCl2
有变化
化合反应
CaO + H2O === Ca(OH) 2
CaCO3=高=温=CaO+CO2 ↑
△
2KClO3===2KCl+3O2 ↑
2Na + Cl2 == 2NaCl
氧化还原反应:
有元素化合价变化的化学反应 4
〖小结〗
化 氧化还原反应
学
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
高中化学人教版必修一第二章第三节《氧化还原反应》ppt课件 (共50张PPT)

•上述反应中,哪些反应属于氧化 还原反应? •基本反应类型与氧化还原反应有 什么关系?
请同学通过图示来表示出氧化还原 反应与四种基本反应类型的关系:
分解 反应 化合 反应
氧化还原反应
置换 反应
复分解 反应
非氧化还原反应
氧化还原反应与四种基本反应类型的关 系可表示为:
氧化还原反应
复分解反应
【讨论】【交流ຫໍສະໝຸດ 论】在下列几个氧化还原反应中, H2O所起的作用一样吗?
既不是氧化剂 ⑴Cl2+H2O==HCl+HClO 也不是还原剂 ⑵2F2+2H2O==4HF+O2↑ 还原剂 ⑶2Na+2H2O==2NaOH+H2↑ 氧化剂 既是氧化剂 电解 ⑷2H2O == 2H2↑+O2↑ 也是还原剂
【知识拓展】
【练习】
1、下列变化中,需加入氧化剂才能实 现的是( BC ) A、HCl→ H2 B、CO → CO2 C、SO2 → SO3 D、FeCl3 → FeCl2
【练习】
2、下列变化中,加入还原剂才能实现 的是( AB ) A、Ag+ → Ag B、CuO → Cu C、FeO →Fe2O3 D、NO → NO2
特征
化合价 升高
化合价 降低
反应
氧化 反应
还原 反应 氧化 还原 反应
二、氧化剂和还原剂
氧化剂:定义:得到电子(或电子对偏向)的物质。
表现:在反应时所含元素化合价降低
还原剂:定义:失去电子(或电子对偏离)的物质。
表现:在反应时所含元素化合价升高
氧化性: 得电子的能力( 氧化剂的性质 ) 还原性: 失电子的能力( 还原剂的性质 )
【练习】
3、判断下列说法正确的是( A ) A、金属在化学反应中只做还原剂 B、非金属在化学反应中只做氧化剂 C、被氧化的是氧化剂,被还原的是 还原剂 D、失电子的反应是氧化反应,失电子 的物质是氧化剂
请同学通过图示来表示出氧化还原 反应与四种基本反应类型的关系:
分解 反应 化合 反应
氧化还原反应
置换 反应
复分解 反应
非氧化还原反应
氧化还原反应与四种基本反应类型的关 系可表示为:
氧化还原反应
复分解反应
【讨论】【交流ຫໍສະໝຸດ 论】在下列几个氧化还原反应中, H2O所起的作用一样吗?
既不是氧化剂 ⑴Cl2+H2O==HCl+HClO 也不是还原剂 ⑵2F2+2H2O==4HF+O2↑ 还原剂 ⑶2Na+2H2O==2NaOH+H2↑ 氧化剂 既是氧化剂 电解 ⑷2H2O == 2H2↑+O2↑ 也是还原剂
【知识拓展】
【练习】
1、下列变化中,需加入氧化剂才能实 现的是( BC ) A、HCl→ H2 B、CO → CO2 C、SO2 → SO3 D、FeCl3 → FeCl2
【练习】
2、下列变化中,加入还原剂才能实现 的是( AB ) A、Ag+ → Ag B、CuO → Cu C、FeO →Fe2O3 D、NO → NO2
特征
化合价 升高
化合价 降低
反应
氧化 反应
还原 反应 氧化 还原 反应
二、氧化剂和还原剂
氧化剂:定义:得到电子(或电子对偏向)的物质。
表现:在反应时所含元素化合价降低
还原剂:定义:失去电子(或电子对偏离)的物质。
表现:在反应时所含元素化合价升高
氧化性: 得电子的能力( 氧化剂的性质 ) 还原性: 失电子的能力( 还原剂的性质 )
【练习】
3、判断下列说法正确的是( A ) A、金属在化学反应中只做还原剂 B、非金属在化学反应中只做氧化剂 C、被氧化的是氧化剂,被还原的是 还原剂 D、失电子的反应是氧化反应,失电子 的物质是氧化剂
人教版高一化学课件-氧化还原反应(共16张PPT)

二、氧化劑和還原劑
〖遷移·應用〗
常見的氧化劑和還原劑有哪些?
常見氧化劑:O2 、Cl2、濃硫酸、 HNO3、 KMnO4、FeCl3等
常見還原劑:Na、Mg、Al、Zn、Fe、H2、 C、CO等
二、氧化劑和還原劑
〖 思考油漆,這樣做的目的是 什麼? 2、一些容易變質食品常採用真空包裝或往包裝 袋中裝入一小包鐵粉,這樣做的目的又是為啥?
B. NaCl → NaNO3 D. CuO → CuSO4
2、下列反應中,SO2作還原劑的是( C )
A.2H2S+SO2=3S↓+2H2O B.SO2+2Mg=2MgO+S C.Cl2+SO2+2H2O=H2SO4+2HCl D.SO2+2NaOH=Na2SO3+H2O
二、氧化劑和還原劑
【分層訓練】選做題 3、在K2Cr2O7 + 14 HCl == 2KCl + 2CrCl3
+ 3Cl2↑ + 7H2O反應中, C元r 素得電子, 化合價 降低 , K2Cr2O7是氧化劑; Cl元素失電子,化合價升高, HCl 是還原
劑; HCl 被氧化,K2Cr2O7被還原。
二、氧化劑和還原劑
氧化還原反應對立統 〖概括·整合〗 一關係的兩根推斷線
實質 元素(判斷依據) 反應過程 反應物 反應物性質 失e- → 化合價升高 → 氧化反應 → 還原劑 → 還原性 得e- → 化合價降低 → 還原反應 → 氧化劑 → 氧化性
非氧化還原反應
Cl2 + H2O== HCl + HClO 既是氧化劑又是還原劑
二、氧化劑和還原劑
〖交流·探究〗 從電子轉移的觀點說明氧化 劑、還原劑的實質是什麼?
化学人教版高中必修1高一化学《氧化还原反应》课件-PPT

还原剂:反应中失电子的物质,表现还原性,具 有还原能力,起还原作用。
2、氧化产物:还原剂失电子被氧化对应生成物 还原产物:氧化剂得电子被还原对应生成物 氧化剂(有氧化性)--→还原产物 还原剂(有还原性)--→氧化产物
一、常见的氧化剂和还原剂
1.常见氧化剂
(1)部分非金属单质:如 、Cl2 等O。2
CaCO3 高温 CaO+CO2
(否)
2KClMO△n3O2 2KCl+3O2
(是)
CaO+H2O Ca(OH) 2
(否)
C+O2 点燃 CO2
(是)
CuO+H△2
Cu+H2O
(是)
3C+Fe2O3 高温 2Fe+3CO2
(是)
HCl+NaOH NaCl+H2O
(否)
2HCl+CaCO3 CaCl2+H2O+CO2(否)
(2)含有高价态元素的化合物:如
HNO3、 KMnO、4 FeC等l3。
H2、SO4
2.常见还原剂 (1)活泼的金属单质,如 (2)某些非金属单质,如
Al Zn Fe
、H2 、C 等。 、 C等O。 SO2
(3)某些非金属氧化物,如 、 等。
要点一 氧化性、还原性强弱的判断
1.根据氧化还原反应方程式进行判断 在同一反应中 氧化性:氧化剂>氧化产物;还原性:还原剂>还 原产物; 如:Fe+H2SO4===FeSO4+H2↑ 氧化性:H2SO4>FeSO4,还原性:Fe>H2
四 “双线桥”法
Mg + Cl2 = MgCl2
步骤:
1.标出变价元素的化合价
2、氧化产物:还原剂失电子被氧化对应生成物 还原产物:氧化剂得电子被还原对应生成物 氧化剂(有氧化性)--→还原产物 还原剂(有还原性)--→氧化产物
一、常见的氧化剂和还原剂
1.常见氧化剂
(1)部分非金属单质:如 、Cl2 等O。2
CaCO3 高温 CaO+CO2
(否)
2KClMO△n3O2 2KCl+3O2
(是)
CaO+H2O Ca(OH) 2
(否)
C+O2 点燃 CO2
(是)
CuO+H△2
Cu+H2O
(是)
3C+Fe2O3 高温 2Fe+3CO2
(是)
HCl+NaOH NaCl+H2O
(否)
2HCl+CaCO3 CaCl2+H2O+CO2(否)
(2)含有高价态元素的化合物:如
HNO3、 KMnO、4 FeC等l3。
H2、SO4
2.常见还原剂 (1)活泼的金属单质,如 (2)某些非金属单质,如
Al Zn Fe
、H2 、C 等。 、 C等O。 SO2
(3)某些非金属氧化物,如 、 等。
要点一 氧化性、还原性强弱的判断
1.根据氧化还原反应方程式进行判断 在同一反应中 氧化性:氧化剂>氧化产物;还原性:还原剂>还 原产物; 如:Fe+H2SO4===FeSO4+H2↑ 氧化性:H2SO4>FeSO4,还原性:Fe>H2
四 “双线桥”法
Mg + Cl2 = MgCl2
步骤:
1.标出变价元素的化合价
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化剂 还原剂 还原产物 氧化产物
Fe + 2H+ == Fe2+
还原剂
+
H2
氧化剂 氧化产物 还原产物
小结: 降 、 得 、 还 、 还 、 氧 、 还
氧化还原 升 、 失 、 氧 、 氧 、 还 、 氧
氧化还原反应的一般公式:
得电子,化合价降低,被还原 氧化剂 + 还原剂 === 还原产物 + 氧化产物 (弱还原性) (弱氧化性)
例2、下列反应中属于氧化还原
反应的是( C D E
)
A、CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
B、Na2O + H2O = 2NaOH
C、2KMnO4 = K2MnO4 + MnO2 + O2↑
D、MnO2 + 4HCl
E、3Fe + 2O2
MnCl2 + 2H2O + Cl2↑
小结:
氧化还原反应中, 化合价有升必有降 且化合价升高总数==化合价降低总数
练习题
1.下列不属于氧化还原反应的是( D ) A. 2Mg+CO2=2MgO+C B. 2KMnO4=K2MnO4 + MnO2 + O2↑ C. Zn +2HCl = ZnCl2 + H2↑
D. NaOH+HCl=NaCl+H2O
1. CuO + H2
氧化剂 还原剂
Cu + H2O
Cu2+ 2Ho
2. Zn + 2HCl==ZnCl2 + H2
还原剂 氧化剂 Zn 2H+
Cuo 还原反应 2H+1 氧化反应
3. CuSO4 + Fe== Cu + FeSO4
Zn2+ 氧化反应 2H 还原反应
2+ 氧化反应 Fe Fe 氧化剂 还原剂 Cu2+ Cu 还原反应 4.MnO2 + 4HCl MnCl2 + 2H2O + Cl2↑ 2Cl 2Clo 氧化反应 氧化剂 还原剂 Mn4+ Mn2+ 还原反应
0 0
H
Cl
H2 + Cl2
H Cl
=== 2 H Cl
点燃
+1-1
电子对偏向,化合价降低,被还原
化合价升降的原因: 共用电子对的偏移
3、从电子转移的角度定义氧化还原反应
失去电子(或电子对偏离)的反应是氧化反应 得到电子(或电子对偏向)的反应是还原反应
有电子转移(得失或共用电子对偏 移)的反应是氧化还原反应
从电子转移角度分析 有电子转移(电子得失或共用电子对偏移) 的化学反应是氧化还原反应。 说明:氧化还原反应的本质是电子转移。
例1、下列叙述正确的是( BD
)
A、在氧化还原反应中,失去电子的物质, 所含元素化合价降低 B、凡是有元素化合价升降的化学反应都 是氧化还原反应 C、在氧化还原反应中一定所有的元素化 合价都发生变化 D、氧化还原反应的本质是电子的转移 (得失或偏移)
还原剂被氧化,得 氧化产物。氧化产 物有弱氧化性
氧化产物的特征:含有化合价升高的元素 还原产物的特征:含有化合价降低的元素
例:指出下列反应中的氧化剂和还原剂, 氧化产物和还原产物 MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O
氧化剂 还原剂 还原产物 氧化产物
CuSO4 + Fe == Cu + FeSO4
化合反应
氧化还原反应
分解反应
非氧化还原反应
复分解反应
小结:氧化还原反应
从得氧失氧角度分析 一种物质得到氧被氧化,同时另一种物质 失去氧被还原的化学反应是氧化还原反应。 从化合价升降角度分析 有元素化合价升降的化学反应是氧化还原 反应说明:元素化合价升降是氧化还原反应 的表观特征,可作为氧化还原反应的判断依据。
在氧化还原反应中一种物质被氧化肯定有 另一种物质被还原,这句话对吗?
2Mg 2MgO 2Mg+ +O2 O= = 2MgO
2
2KClO3 = 2KCl + 3O2↑
氧化剂 、还原剂 可以为同一物质, 同样氧化产物、还原产物也可以为同 一物质
[练习] 判断下列化学反应是否为氧化还原反应, 从四种基本反应类型来分析,应属于哪种反应类型 1、Fe+CuCl2=FeCl2+Cu 氧化还原反应
任课教师:陈玉书
讨论1: 请看课本P35思考与交流。从得失氧的角 度分析下列几个化学反应,并指出哪种物质发生 了氧化反应,哪种物质发生了还原反应?
Fe2O3 + 3CO === 2Fe + 3CO2 ↑ 2CuO+C === 2Cu+CO2
高温
CuO+H2 == Cu+H2O↑
高温
高温
1. 从得失氧的角度定义氧化还原反应
4. 4NH3+5O2=4NO+6H2O
5. 3Cl2+6KOH=5KCl+KClO3+3H2O
氧化还原反应与四种基本反应的关系
交 叉 分 类 图 (1)
化合反应 置换反应
复分解反应
分解反应
氧化还原反应
非氧化还原反应
交 叉 分 类 图 (2) 四种基本反应类型与氧化还原反应的关系
置换反应
交叉分类图(3)
所以是氧化还原反应。
从电子得失角度分析
失去e-
NaCl 的形成过程
Cl
Na
失电子,化合价升高,被氧化
失去e-后 得到e-后
Na+
[ Cl ]-
2Na+Cl2 == 2Na Cl
0
0
+1 -1
得电子,化合价降低,被还原
Na+
Cl -
化合价升降的原因: 电子的得失
HCl 的形成过程
电子对偏离,化合价升高,被氧化
氧化还原反应的实质:电子转移
1、氧化还原反应中:
失电子总数=化合价升高总数 得电子总数=化合价降低总数 得失电子守恒(本质) 化合价升降守恒(特征)
2、得失电子数目的计算方法: (高价低价)系数下标
小 结
练习题:计算下列各反应中得电子或失 电子总数 1. 2FeCl2+ Cl2 = 2FeCl3 2. 2KClO3=2KCl+ 3O2↑ 3. 2KMnO4=K2MnO4 + MnO2 + O2↑
物质得到氧的反应 叫氧化反应. _________________ _________________ 物质失去氧的反应 叫还原反应. ________________ 叫氧化还原反应. 有氧得失的反应
讨论3:氧化反应和还原反应能否分开进行?
氧化反应和还原反应是兼于一体的,两者同时存 在,同时发生,不可截然分开。
思考:怎样判断一个反应是否为氧化还原反应 依据
有化合价升降的反应:属于氧化还原反应 无化合价升降的反应:属于非氧化还原反应
[练习1] 判断下列化学反应哪些是氧化还原 反应? 1、 CaCO3 == CaO +CO2 2、 2FeCl2 + Cl2 = 2FeCl3 3、 2CuO+H2==Cu+H2O 4、CaCO3+H2O+CO2==Ca(HCO3)2 5、2CO + O2 ==2CO2 6、2Fe(OH)3 == Fe2O3 +3H2O 7、NaCl+AgNO3=AgCl↓+NaNO3
2、下列属于氧化还原反应的是(ACE ) A、C+CO2=2CO C、2KClO3=2KCl+ 3O2↑ D、CaCO3=CaO+CO2↑ E、2Na +2H2O = 2NaOH + H2↑ F、BaCl2+Na2SO4=2NaCl+BaSO4↓ B、CaO+H2O=Ca(OH)2
问题:下列反应是否属于氧化还原反应? 2Na+Cl2 2NaCl 结论: 点燃 2H2+Cl2 === 2HCl 因为有化合价升降, 可见,从化合价升降角度不但可以分析 有得氧失氧的化学反应,也可以分析没 有得氧失氧的化学反应,扩大了概念的 适用范围。
(强氧化性) (强还原性)
失电子,化合价升高,被氧化
反 应 物
氧化剂
(强氧化性)
被还原
得电子(化合价降低)
还原剂
(强还原性)
被氧化
失电子(化合价升高)
生 (弱还原性) 成 氧化产物 物
(弱氧化性)
还原产物
练习 分析下列变化
1、Fe→FeCl3,需要加 氧化 剂,如:Cl2 2、CuO→Cu,需要加 还原 剂,如:H2
还原性、酸性 (3)反应中HCl表现___________ ____.
(二)歧化反应
同种物质中同种价态的同种元素一部分被氧 化、另一部分被还原的反应称为歧化反应(这 里的“三同”缺一不可) [例题] Cl2+2NaOH=NaCl+NaClO+H2O 1:1 氧化剂与还原剂的物质的量之比:______ [练习]3S+6NaOH == 2Na2S+Na2SO3+3H2O 2:1 氧化剂与还原剂的物质的量之比:_____ 被氧化的物质与被还原的物质的物质的量之比: _____ 1:2
2、CaCO3+2HCl=CaCl2+H2O+CO2↑ 复分解反应
3、NaCl+AgNO3=AgCl↓+NaNO3
复分解反应
4、Na2O+H2O=2NaOH
5、2Mg+O2=2MgO
化合反应
氧化还原反应 氧化还原反应
6、2AgNO3=2Ag+2NO2↑+O2↑ 7、2Na+2H2O=2NaOH+H2↑ 8、NH4HCO3==NH3↑+CO2↑+H2O
Fe + 2H+ == Fe2+
还原剂
+
H2
氧化剂 氧化产物 还原产物
小结: 降 、 得 、 还 、 还 、 氧 、 还
氧化还原 升 、 失 、 氧 、 氧 、 还 、 氧
氧化还原反应的一般公式:
得电子,化合价降低,被还原 氧化剂 + 还原剂 === 还原产物 + 氧化产物 (弱还原性) (弱氧化性)
例2、下列反应中属于氧化还原
反应的是( C D E
)
A、CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
B、Na2O + H2O = 2NaOH
C、2KMnO4 = K2MnO4 + MnO2 + O2↑
D、MnO2 + 4HCl
E、3Fe + 2O2
MnCl2 + 2H2O + Cl2↑
小结:
氧化还原反应中, 化合价有升必有降 且化合价升高总数==化合价降低总数
练习题
1.下列不属于氧化还原反应的是( D ) A. 2Mg+CO2=2MgO+C B. 2KMnO4=K2MnO4 + MnO2 + O2↑ C. Zn +2HCl = ZnCl2 + H2↑
D. NaOH+HCl=NaCl+H2O
1. CuO + H2
氧化剂 还原剂
Cu + H2O
Cu2+ 2Ho
2. Zn + 2HCl==ZnCl2 + H2
还原剂 氧化剂 Zn 2H+
Cuo 还原反应 2H+1 氧化反应
3. CuSO4 + Fe== Cu + FeSO4
Zn2+ 氧化反应 2H 还原反应
2+ 氧化反应 Fe Fe 氧化剂 还原剂 Cu2+ Cu 还原反应 4.MnO2 + 4HCl MnCl2 + 2H2O + Cl2↑ 2Cl 2Clo 氧化反应 氧化剂 还原剂 Mn4+ Mn2+ 还原反应
0 0
H
Cl
H2 + Cl2
H Cl
=== 2 H Cl
点燃
+1-1
电子对偏向,化合价降低,被还原
化合价升降的原因: 共用电子对的偏移
3、从电子转移的角度定义氧化还原反应
失去电子(或电子对偏离)的反应是氧化反应 得到电子(或电子对偏向)的反应是还原反应
有电子转移(得失或共用电子对偏 移)的反应是氧化还原反应
从电子转移角度分析 有电子转移(电子得失或共用电子对偏移) 的化学反应是氧化还原反应。 说明:氧化还原反应的本质是电子转移。
例1、下列叙述正确的是( BD
)
A、在氧化还原反应中,失去电子的物质, 所含元素化合价降低 B、凡是有元素化合价升降的化学反应都 是氧化还原反应 C、在氧化还原反应中一定所有的元素化 合价都发生变化 D、氧化还原反应的本质是电子的转移 (得失或偏移)
还原剂被氧化,得 氧化产物。氧化产 物有弱氧化性
氧化产物的特征:含有化合价升高的元素 还原产物的特征:含有化合价降低的元素
例:指出下列反应中的氧化剂和还原剂, 氧化产物和还原产物 MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O
氧化剂 还原剂 还原产物 氧化产物
CuSO4 + Fe == Cu + FeSO4
化合反应
氧化还原反应
分解反应
非氧化还原反应
复分解反应
小结:氧化还原反应
从得氧失氧角度分析 一种物质得到氧被氧化,同时另一种物质 失去氧被还原的化学反应是氧化还原反应。 从化合价升降角度分析 有元素化合价升降的化学反应是氧化还原 反应说明:元素化合价升降是氧化还原反应 的表观特征,可作为氧化还原反应的判断依据。
在氧化还原反应中一种物质被氧化肯定有 另一种物质被还原,这句话对吗?
2Mg 2MgO 2Mg+ +O2 O= = 2MgO
2
2KClO3 = 2KCl + 3O2↑
氧化剂 、还原剂 可以为同一物质, 同样氧化产物、还原产物也可以为同 一物质
[练习] 判断下列化学反应是否为氧化还原反应, 从四种基本反应类型来分析,应属于哪种反应类型 1、Fe+CuCl2=FeCl2+Cu 氧化还原反应
任课教师:陈玉书
讨论1: 请看课本P35思考与交流。从得失氧的角 度分析下列几个化学反应,并指出哪种物质发生 了氧化反应,哪种物质发生了还原反应?
Fe2O3 + 3CO === 2Fe + 3CO2 ↑ 2CuO+C === 2Cu+CO2
高温
CuO+H2 == Cu+H2O↑
高温
高温
1. 从得失氧的角度定义氧化还原反应
4. 4NH3+5O2=4NO+6H2O
5. 3Cl2+6KOH=5KCl+KClO3+3H2O
氧化还原反应与四种基本反应的关系
交 叉 分 类 图 (1)
化合反应 置换反应
复分解反应
分解反应
氧化还原反应
非氧化还原反应
交 叉 分 类 图 (2) 四种基本反应类型与氧化还原反应的关系
置换反应
交叉分类图(3)
所以是氧化还原反应。
从电子得失角度分析
失去e-
NaCl 的形成过程
Cl
Na
失电子,化合价升高,被氧化
失去e-后 得到e-后
Na+
[ Cl ]-
2Na+Cl2 == 2Na Cl
0
0
+1 -1
得电子,化合价降低,被还原
Na+
Cl -
化合价升降的原因: 电子的得失
HCl 的形成过程
电子对偏离,化合价升高,被氧化
氧化还原反应的实质:电子转移
1、氧化还原反应中:
失电子总数=化合价升高总数 得电子总数=化合价降低总数 得失电子守恒(本质) 化合价升降守恒(特征)
2、得失电子数目的计算方法: (高价低价)系数下标
小 结
练习题:计算下列各反应中得电子或失 电子总数 1. 2FeCl2+ Cl2 = 2FeCl3 2. 2KClO3=2KCl+ 3O2↑ 3. 2KMnO4=K2MnO4 + MnO2 + O2↑
物质得到氧的反应 叫氧化反应. _________________ _________________ 物质失去氧的反应 叫还原反应. ________________ 叫氧化还原反应. 有氧得失的反应
讨论3:氧化反应和还原反应能否分开进行?
氧化反应和还原反应是兼于一体的,两者同时存 在,同时发生,不可截然分开。
思考:怎样判断一个反应是否为氧化还原反应 依据
有化合价升降的反应:属于氧化还原反应 无化合价升降的反应:属于非氧化还原反应
[练习1] 判断下列化学反应哪些是氧化还原 反应? 1、 CaCO3 == CaO +CO2 2、 2FeCl2 + Cl2 = 2FeCl3 3、 2CuO+H2==Cu+H2O 4、CaCO3+H2O+CO2==Ca(HCO3)2 5、2CO + O2 ==2CO2 6、2Fe(OH)3 == Fe2O3 +3H2O 7、NaCl+AgNO3=AgCl↓+NaNO3
2、下列属于氧化还原反应的是(ACE ) A、C+CO2=2CO C、2KClO3=2KCl+ 3O2↑ D、CaCO3=CaO+CO2↑ E、2Na +2H2O = 2NaOH + H2↑ F、BaCl2+Na2SO4=2NaCl+BaSO4↓ B、CaO+H2O=Ca(OH)2
问题:下列反应是否属于氧化还原反应? 2Na+Cl2 2NaCl 结论: 点燃 2H2+Cl2 === 2HCl 因为有化合价升降, 可见,从化合价升降角度不但可以分析 有得氧失氧的化学反应,也可以分析没 有得氧失氧的化学反应,扩大了概念的 适用范围。
(强氧化性) (强还原性)
失电子,化合价升高,被氧化
反 应 物
氧化剂
(强氧化性)
被还原
得电子(化合价降低)
还原剂
(强还原性)
被氧化
失电子(化合价升高)
生 (弱还原性) 成 氧化产物 物
(弱氧化性)
还原产物
练习 分析下列变化
1、Fe→FeCl3,需要加 氧化 剂,如:Cl2 2、CuO→Cu,需要加 还原 剂,如:H2
还原性、酸性 (3)反应中HCl表现___________ ____.
(二)歧化反应
同种物质中同种价态的同种元素一部分被氧 化、另一部分被还原的反应称为歧化反应(这 里的“三同”缺一不可) [例题] Cl2+2NaOH=NaCl+NaClO+H2O 1:1 氧化剂与还原剂的物质的量之比:______ [练习]3S+6NaOH == 2Na2S+Na2SO3+3H2O 2:1 氧化剂与还原剂的物质的量之比:_____ 被氧化的物质与被还原的物质的物质的量之比: _____ 1:2
2、CaCO3+2HCl=CaCl2+H2O+CO2↑ 复分解反应
3、NaCl+AgNO3=AgCl↓+NaNO3
复分解反应
4、Na2O+H2O=2NaOH
5、2Mg+O2=2MgO
化合反应
氧化还原反应 氧化还原反应
6、2AgNO3=2Ag+2NO2↑+O2↑ 7、2Na+2H2O=2NaOH+H2↑ 8、NH4HCO3==NH3↑+CO2↑+H2O
