理想气体的等温过程和绝热过程.ppt
合集下载
等温和绝热过程讲解

pV
积分 ln p ln V C'
ln pV C'
pV const1
V 1T const2
p 1T const3
——理想气体准静态绝热过程的过程方程
3.过程曲线 将绝热线与等温线比较
P
绝热
等温过程
pV C
全微分 pdV Vdp 0
等温线斜率 dp p
CV ,m
iR 2
等压 过程
V C T
P
等温 过程
pV C
P
绝热
P
pV C
过程
CV ,mT
V
p(V2 V1)
或RT
C p,mT
C p,m
i
2 2
R
0
RT ln V2 RT ln V2
ห้องสมุดไป่ตู้
V
V1
V1
CV ,mT -CV ,mT 0
0
V
(二)、非静态绝热过程
即
CV ,m R pdV CV ,mVdp
pdV vCV ,mdT ……(1)
由
pV vRT
得
pdV Vdp vRdT ……(2)
由(1)、(2)得
pdV Vdp R pdV CV ,m
即
C p,m pdV CV ,mVdp
则 Vdp Cp,m pdV 0 CV ,m
绝热线
减小和温度的降低共同
产生。因此绝热过程中
压强的变化快于等温过 程。
o
V1
2 V2 V
4.内能增量
E CV ,mT
5.对外作功
W E CV ,mT
积分 ln p ln V C'
ln pV C'
pV const1
V 1T const2
p 1T const3
——理想气体准静态绝热过程的过程方程
3.过程曲线 将绝热线与等温线比较
P
绝热
等温过程
pV C
全微分 pdV Vdp 0
等温线斜率 dp p
CV ,m
iR 2
等压 过程
V C T
P
等温 过程
pV C
P
绝热
P
pV C
过程
CV ,mT
V
p(V2 V1)
或RT
C p,mT
C p,m
i
2 2
R
0
RT ln V2 RT ln V2
ห้องสมุดไป่ตู้
V
V1
V1
CV ,mT -CV ,mT 0
0
V
(二)、非静态绝热过程
即
CV ,m R pdV CV ,mVdp
pdV vCV ,mdT ……(1)
由
pV vRT
得
pdV Vdp vRdT ……(2)
由(1)、(2)得
pdV Vdp R pdV CV ,m
即
C p,m pdV CV ,mVdp
则 Vdp Cp,m pdV 0 CV ,m
绝热线
减小和温度的降低共同
产生。因此绝热过程中
压强的变化快于等温过 程。
o
V1
2 V2 V
4.内能增量
E CV ,mT
5.对外作功
W E CV ,mT
7.4.2理想气体的绝热过程

O V1 V2 V
pV C1 TV 1 C2 p 1T C3
热力学基础
*绝热方程的推导:
dW dE pdV
根据理想气体状态方程 pV
m
mM
CV ,mdT
pdV CV ,m
RT 两边微分:
m M
dT
M
pdV Vdp m RdT RpdV
M
CV ,m
(C p,m CV ,m ) pdV CV ,m
CV ,m ( pdV Vdp) (CV ,m Cp,m ) pdV
CV ,mVdp C p,m pdV 0
Cp,m:ln p ln V C
V--- n---P
(2)从A点经绝热膨胀过程
V--- n---P
且因绝热对外做功
E--- T--- P P’2 < P2
热力学基础
数学方法:
绝热方程: pV γ C1
V γdp γ pV γ1dV 0
Vdp pdV 0
dp γ pA
dV
VA
等温方程: pV C2
Vdp pdV 0
dp pA dV VA
热力学基础
解: 已知 m=8×10-3kg i=5 M=32×10-3kg/mol
V1=0.41×10-3m3 T1=273+27=300 k V2=4.1×10-3m3
(1)绝热膨胀 由绝热方程 T1V1 1 T2V2 1
WQ
m M
CV ,m (T1
T2 )
941 J
T2 T1
300
VV1121.411K
7.3 等体....过程

dQT dW PdV
可见等温过程中,系统吸收得热量全部用来对外作功
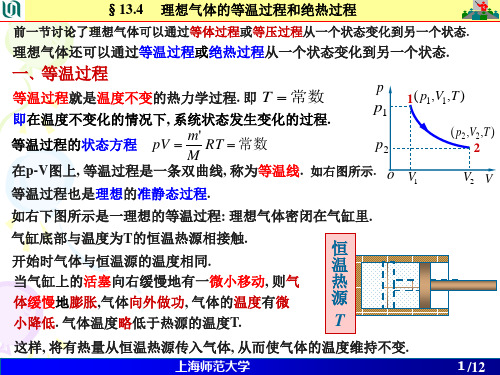
由物态方程 PV RT 可知,在P-V图上等温线是一条双曲 线。 P
M
P1
T PdV
等温线
P2 o
V V1
dV
V2
等温过程系统对外作的功,等于等温曲线下的面积。对于体 积由V1改变为V2的等温过程,气体所作的功为:
QT WT PdV
2、等体摩尔热容: 设1mol理想气体,在等体过程中吸热为dQV 温度升高dT,则气体的等体摩尔热容定义为: dQV CV dT
等体摩尔热容的单位为:J· -1· -1。 mol K
,气体
所以:
dQV CV dT
对质量为M、等体摩尔热容为CV, 的理想气体,在等体 过程中,其温度由T1改变为T2,所吸收的热量为:
dQ CP dT
dQP
QP M
M
CP dT
M
T2
T1
CPБайду номын сангаасdT
CP (T2 T1 )
表7.1 几种气体摩尔热容的实验值(在1.013X105Pa、25oC时)
气体
单原子气体 氦(He) 氖(Ne) 氩(Ar) 双原子分子 氢(H2) 氮(N2) 氧(O2) 一氧化碳(CO) 多原子分子 二氧化碳(CO2) 一氧化氮(N2O) 硫化氢(H2S) 水蒸气
Mμ
4.003X10-3 20.18X10-3 39.95X10-3 2.016X10-3 28.01X10-3 32.00X10-3 28.01X10-3 44.01X10-3 40.01X10-3 34.08X10-3 18.02X10-3
7.3 等体....过程

M CV PdV CV VdP RCV dT RPdV CP PdV CV PdV 又: R = CP - CV
PdV VdP
M
RdT
CP = CV
CVVdP CP PdV
CV PdV CV VdP
M
RCV dT
RPdV
CP PdV CV PdV
QV CV
M
(T2 T1 )
定体摩尔热容CV,可以由理论计算得出, 也可以由实验测出。下页表中给出几 种气体的CV,的实验值。
表 几种气体摩尔热容的实验值(在1.013X105Pa、25oC时)
气体
单原子气体 氦(He) 氖(Ne) 氩(Ar) 双原子分子 氢(H2) 氮(N2) 氧(O2) 一氧化碳(CO)
CV (T2 T1 )
5、比热容(比热)
前面给出的摩尔热容是针对理想气体而言的,对于液体、固 体等构成的系统,当在某一微小过程中吸热dQ,温度升高dT, 则定义: dQ C 为系统在该过程中的热容, C=
dT
单位J· K-1。
由于系统的热容 C 与系统的质量有关,故把单位质量的热 容称为比热容(简称比热)c,其单位为J· -1 · -1。 K kg 热容C 与比热容(简称比热)c 的关系为:
pdV
V1
绝热膨胀过程中,系统对外作的功,是靠内能减少实现的, 故温度降低;绝热压缩过程中,外界对气体作功全用于增加气 体内能,故温度上升。
dV
V2
V
下面我们来推导绝热方程: M dE CV dT 0 dE dWa
dWa PdV M 0= CV dT PdV
PV M RT
第4节理想气体绝热过程

绝热膨胀过程,V , n , T , P
1
方法 1、 Q 0
E
i 2
R(T2
T1 )
=
i 2
(P2V2
P1V1 )
A E
=
i 2
R(T2
T1 )
,
=
i 2
(P1V1
P2V2
)
方法 2、 Q 0
P (P1,V1,T1 ) (P2 ,V2 ,T2 )
RT2
ln
Байду номын сангаас
Vc Vd
A
Q放 Q吸
RT1
ln
Vb Va
RT2
ln
Vc Vd
w T2 T1 T2
c(Vc ,T2 ) V
4
T1 固定, T2 , w
如
T1
300K
, T2
270K
,
w
270 300 270
9
T2
250K
,
w
250 300 250
5
T2
100K
Q放 A
致冷系数: w Q吸 = Q吸
Q吸
A Q放 Q吸
注意:分子上的 Q吸 只计算从低温冷库吸取的热量 分母上的 Q吸 要计算全部吸热 0 1,w 0
3
三、 卡诺循环:准静态循环,理想气体,两个等温+两个绝热过程
T1 T2
P a(Va ,T1 ) Q吸
Q吸
b(Vb ,T1 )
Q吸 d
ab : TaVa 1 TbVb 1
工程热力学第四章理想气体热力过程

详细描述
03
CHAPTER
等容过程
等容过程是指气体在变化的整个过程中,其容积保持不变的过程。
定义
特点
适用场景
气体在等容过程中,气体温度和压力会发生变化,但容积保持不变。
等容过程常用于高压、高温或低温等极端条件下的气体处理。
03
02
01
等容过程定义
在等容过程中,气体吸收的热量等于气体所做的功和气体温度升高所吸收的热量之和。
多变过程的具体形式取决于气体所经历的压力和温度的变化规律。
多变过程定义热力学第一定律 Nhomakorabea热力学第二定律
理想气体状态方程
热效率
多变过程的热力学计算
01
02
03
04
能量守恒定律,用于计算多变过程中气体吸收或释放的热量。
熵增原理,用于分析多变过程中气体熵的变化。
描述气体压力、体积和温度之间的关系,可用于多变过程的计算。
衡量多变过程能量转换效率的指标,通过比较输入和输出的热量来计算。
提高热效率的方法
优化多变过程参数,如压力和温度的变化规律,以减少不可逆损失和提高能量转换效率。
热效率与熵增的关系
根据熵增原理,不可逆过程会导致熵的增加,从而降低热效率。因此,减少不可逆损失是提高多变过程热效率的关键。
热效率计算公式
$eta = frac{Q_{out}}{Q_{in}}$,其中$Q_{out}$为输出热量,$Q_{in}$为输入热量。
计算公式
通过优化气体的初态和终态,以及选择合适的加热和冷却方式,可以提高等容过程的热效率。同时,也可以通过改进设备结构和操作方式来提高热效率。
提高热效率的方法
等容过程的热效率
04
CHAPTER
03
CHAPTER
等容过程
等容过程是指气体在变化的整个过程中,其容积保持不变的过程。
定义
特点
适用场景
气体在等容过程中,气体温度和压力会发生变化,但容积保持不变。
等容过程常用于高压、高温或低温等极端条件下的气体处理。
03
02
01
等容过程定义
在等容过程中,气体吸收的热量等于气体所做的功和气体温度升高所吸收的热量之和。
多变过程的具体形式取决于气体所经历的压力和温度的变化规律。
多变过程定义热力学第一定律 Nhomakorabea热力学第二定律
理想气体状态方程
热效率
多变过程的热力学计算
01
02
03
04
能量守恒定律,用于计算多变过程中气体吸收或释放的热量。
熵增原理,用于分析多变过程中气体熵的变化。
描述气体压力、体积和温度之间的关系,可用于多变过程的计算。
衡量多变过程能量转换效率的指标,通过比较输入和输出的热量来计算。
提高热效率的方法
优化多变过程参数,如压力和温度的变化规律,以减少不可逆损失和提高能量转换效率。
热效率与熵增的关系
根据熵增原理,不可逆过程会导致熵的增加,从而降低热效率。因此,减少不可逆损失是提高多变过程热效率的关键。
热效率计算公式
$eta = frac{Q_{out}}{Q_{in}}$,其中$Q_{out}$为输出热量,$Q_{in}$为输入热量。
计算公式
通过优化气体的初态和终态,以及选择合适的加热和冷却方式,可以提高等容过程的热效率。同时,也可以通过改进设备结构和操作方式来提高热效率。
提高热效率的方法
等容过程的热效率
04
CHAPTER
大学物理第 13 章 第 2 次课 -- 理想气体的等温过程和绝热过程..
p1
2'
T C
V2 V2' V1 10
T1 1
V1 V
负号表示外界对气体做功. 2)绝热过程做的功
o
氢气为双原子气体, 表查13-1得 =1.41, CV,m= 20.44 J· mol-1· K-1 . 由绝热过程方程 由此可得,
TV
1
常数c'
得
T1V1
1
T2V2
1
上海师范大学
3 /12
§13.4
理想气体的等温过程和绝热过程
二、绝热过程
绝热过程: 理想气体状态发生变化的过程中, 气体与外界没有热量传递. 绝热过程是一种理想过程, 实际的过程不可能是真正的绝热过程. 但在状态的变化过程中, 如果系统与外界的热传递很小, 以致可以忽略, 则这
种过程可以近似地视为绝热过程. 如汽车发动机气缸中气体的膨胀就可以近 p ( p1 ,V1 , T1 ) 似地看成是绝热过程.
6 /12
上海师范大学
将
Cp,m R CV ,m , C p,m / CV ,m 代入上式, 简得
C p ,m dV dp CV, m V p
§13.4 理想气体的等温过程和绝热过程 (CV ,m R) dV dp CV, m V p
dV dp 0 V p
上海师范大学
(14)
5 /12
§13.4 2. 绝热过程的物态方程 理想气体的物态方程:
理想气体的等温过程和绝热过程
pV RT
V R 常数 等压过程: T p
p R 常数 等体过程: T V 等温过程: pV 常数
绝热过程中, 状态参量p,V,T都发生变化, 能否写出两个量之间的变化关系? 对理想气体的物态方程
大学热学第十二讲 绝热过程PPT课件

p1V1
Aa
U2
U1CV,m(T2T1)
R 1
(T2
T1)
C p,m CV ,m R C p,m CV ,m
CV ,m
R
1
C p,m
1
R
四. 绝热过程 1.特点:
Q =0 pV = C
2.图示: 3.TFL: AU
4. 理想气体准静态绝热过程方程 5.理想气体绝热过程中的功
6. 理想气体的绝热过程的热容量
凹函数
P’’>0
p0
(2) -1次和-次双曲函数的关系
V0
仅有一个交点(V0,p0)!
(2) 等温线和绝热线的关系 仅有一个交点(V0 ,p0)!
从物理上看: 由交点V0继续压缩气体,体积变化 V
p ?
等温过程:Vn,T p
p
绝热过程: Vn,T p
p S p
T
V v0
绝热过程曲线变化速 度更快,更陡峭!
说明绝热线 要比等温线 陡。
p V
T
p V
p V
T
p V
p V
s
p
V
4.理想气体准静态绝热过程方程
思考题: . 理想气体的自由膨胀过程: 初末态温度不变,是一个等温过程,又来不及与 外界交换热量,是一个绝热过程,则:
pV C1 pV C2
该热力学过程的方程?
四. 绝热过程
V2 V1
V1 dV
p1V1
1
V21
V11
p1 V1 1V11V21V11
p1V1
1
V1 V2
1
1
Aa
p1V1
1VV12Fra bibliotek1 1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
W2
o V1
V2 V
第十三章 热力学基础
5
物理学
13-4 理想气体的等温过程和绝热过程
第五版
若已知 p1,V1, p2 ,V2 及
由 pV RT可得
W
CV
,m
(
p1V1 R
p2V2 ) R
CV ,m C p,m CV ,m
(
p1V1
p2V2 )
W p1V1 p2V2
1
第十三章 热力学基础
解:
p2
p1
(V1 V2
)
7
155
9.52 atm
T2
T1
(V1 V2
) 1
7 1
300 5 5
571K
例3、质量为 2.810-3 kg ,压强为 1 atm ,温度为27 ℃ 的氮气,先等容增压,压强升至3 atm ;再等温膨 胀,压强降至 1 atm ;然后等压压缩,体积压缩一半。 试求氮气在全部过程中的内能变化、所做的功和吸 收的热量,并画出 P-V 图。
解: P1 1atm
P(atm)
T1 300 K
3
V1
m M
RT1 P1
2.46 103 m3
2
1 V
V1 V4 V3
V2 2.46103 m3 P2 3 atm
T2
P2 P1
T1
900
K
T3 900 K , P3 1atm
P4 P3 1atm ,
V3
P2V2 P3
7.38103 m3
第五版
QT
W
V2 pdV
V1
p RT
V
QT
W
V2
V1
RTdV V
RT ln V2
V1
RT ln p1
p2
第十三章 热力学基础
2
物理学
13-4 理想气体的等温过程和绝热过程
第五版
等温膨胀
p
p1
1 ( p1,V1,T )
p2
( p2,V2,T )
W
2
o V1
V2 V
QT
E
W
等温压缩
p
p1
1 ( p1,V1,T )
p2
( p2,V2,T )
W
2
o V1
V2 V
QT E
W
第十三章 热力学基础
3
物理学
13-4 理想气体的等温过程和绝热过程
第五版
二 绝热过程
p
p1
与外界无热量交换的过程
1( p1,V1,T1)
特征 dQ 0
由热力学 dW dE 0
第一定律 dW dE
p2
( p2,V2,T2 )
2
o V1 dV V2 V
m M
5 2 R(T4
T3) 936 J
Q3 W3 E3 1310 J
P(atm)
3
W W1 W2 W3 449 J Q Q1 Q2 Q3 761J 2
1
E Q W 312 J
V V1 V4 V3
过程 过程特点 过程方程 热一律
内能增量
T1 T2
T 0 E 0
P
2
等温线
未知线o V2源自1 V1 V由热力学第一定律
Q W 0 放热
例2:一定量氮气,其初始温度为300K,压强为1atm。将
其绝热压缩,使其体积变为初始体积的 1 5 。试求压缩
后的压强和温度
分析: p、v 的关系
p1V1 p2V2
T、 v 的关系
T2V2 1 T1V1 1
P
由
V C T
o
V2
V1
V
V T V 0 T 0 E 0
由热力学第一定律
Q E W 0 放热
3.绝热膨胀过程
Q 0
V 0 , W 0
由热力学第一定律
P 1
P1
0 E W
E W 0
T 0
P2 o V1
2 V2 V
4.未知过程与等温线 有两个交点
V 0 , W 0
由于1、2点在等温上,
物理学
13-4 理想气体的等温过程和绝热过程
第五版
一 等温过程
特征 T 常量
p
p1
1 ( p1,V1,T )
过程方程 pV 常量 p2
( p2,V2,T )
2
dE 0
o V1 dV V2 V
由热力学第一定律
恒
温
dQT dW pdV
热 源
T
第十三章 热力学基础
1
物理学
13-4 理想气体的等温过程和绝热过程
1.等体降压过程;
2.等压压缩过程;
3.绝热膨胀过程;
4.未知过程与等温线有两个交点。
P
解: 1.等体降压过程
曲线下面积为 0
P1
1
W 0
由 P C T
P2
2
o
V
V
P T P T 0 E 0
由热力学第一定律 Q E 0 放热过程
2.等压压缩过程
P
体积收缩,曲线下面
积为负值。
21
V 0 , W 0
10
物理学
13-4 理想气体的等温过程和绝热过程
第五版
等温过程曲线的斜率
pV 常量
pdV Vdp 0
(
dp dV
)T
pA VA
p
T 常量
Q0
pA papT A C
B
o VA V VB V
绝热线的斜率大于等温线的斜率.
第十三章 热力学基础
11
例1:讨论下列几个过程温度变化、内能增量、功、
热量的正负。
dE CV ,mdT
绝热的汽缸壁和活塞
第十三章 热力学基础
4
物理学
13-4 理想气体的等温过程和绝热过程
第五版
W V2 pdV V1
T2 T1
CV
,m
dT
CV ,m( T2 T1 )
p
p1
1( p1,V1,T1)
由热力学第一定律有
W E W CV ,m( T1 T2 )
p2
( p2,V2,T2 )
p2
( p2,V2,T2 )
W2
o V1
V2 V
p1
o V2
( p1,V1,T1)
W1 V1 V
E1
W
E2
E2
E1
W
第十三章 热力学基础
9
物理学
13-4 理想气体的等温过程和绝热过程
第五版
三 绝热线和等温线
绝热过程曲线的斜率
pV 常量
pV 1dV V dp 0
( dp dV
)a
pA VA
第十三章 热力学基础
V4
V3 2
3.69 103
m3
T4
V4 V3
T3
450
K
等容过程:
W1 0
Q1
E1
m M
5 2
R(T2
T1)
1248 J
等温过程: E2 0
Q2 W2
m M
RT2
ln
V3 V2
823 J
P(atm) 3
2
1 V
V1 V4 V3
等压过程:
W3 P3(V4 V3) 374 J
E3
6
物理学
13-4 理想气体的等温过程和绝热过程
第五版
绝热过程方程的推导
dQ 0, dW dE
pdV CV ,mdT
pV RT
RT V
dV
CV ,mdT
p
p1
1( p1,V1,T1) Q0
p2
o V1
( p2,V2,T2 ) 2
V2 V
第十三章 热力学基础
7
物理学
13-4 理想气体的等温过程和绝热过程
第五版
分离变量得 dV CV ,m dT
V
RT
dV V
1 dT 1 T
V 1T 常量
绝 V 1T 常量
热 方
pV
常量
程 p 1T 常量
第十三章 热力学基础
8
物理学
13-4 理想气体的等温过程和绝热过程
第五版
绝热膨胀
p
p1
1( p1,V1,T1)
绝热压缩
p
p2
2( p2,V2,T2)
o V1
V2 V
第十三章 热力学基础
5
物理学
13-4 理想气体的等温过程和绝热过程
第五版
若已知 p1,V1, p2 ,V2 及
由 pV RT可得
W
CV
,m
(
p1V1 R
p2V2 ) R
CV ,m C p,m CV ,m
(
p1V1
p2V2 )
W p1V1 p2V2
1
第十三章 热力学基础
解:
p2
p1
(V1 V2
)
7
155
9.52 atm
T2
T1
(V1 V2
) 1
7 1
300 5 5
571K
例3、质量为 2.810-3 kg ,压强为 1 atm ,温度为27 ℃ 的氮气,先等容增压,压强升至3 atm ;再等温膨 胀,压强降至 1 atm ;然后等压压缩,体积压缩一半。 试求氮气在全部过程中的内能变化、所做的功和吸 收的热量,并画出 P-V 图。
解: P1 1atm
P(atm)
T1 300 K
3
V1
m M
RT1 P1
2.46 103 m3
2
1 V
V1 V4 V3
V2 2.46103 m3 P2 3 atm
T2
P2 P1
T1
900
K
T3 900 K , P3 1atm
P4 P3 1atm ,
V3
P2V2 P3
7.38103 m3
第五版
QT
W
V2 pdV
V1
p RT
V
QT
W
V2
V1
RTdV V
RT ln V2
V1
RT ln p1
p2
第十三章 热力学基础
2
物理学
13-4 理想气体的等温过程和绝热过程
第五版
等温膨胀
p
p1
1 ( p1,V1,T )
p2
( p2,V2,T )
W
2
o V1
V2 V
QT
E
W
等温压缩
p
p1
1 ( p1,V1,T )
p2
( p2,V2,T )
W
2
o V1
V2 V
QT E
W
第十三章 热力学基础
3
物理学
13-4 理想气体的等温过程和绝热过程
第五版
二 绝热过程
p
p1
与外界无热量交换的过程
1( p1,V1,T1)
特征 dQ 0
由热力学 dW dE 0
第一定律 dW dE
p2
( p2,V2,T2 )
2
o V1 dV V2 V
m M
5 2 R(T4
T3) 936 J
Q3 W3 E3 1310 J
P(atm)
3
W W1 W2 W3 449 J Q Q1 Q2 Q3 761J 2
1
E Q W 312 J
V V1 V4 V3
过程 过程特点 过程方程 热一律
内能增量
T1 T2
T 0 E 0
P
2
等温线
未知线o V2源自1 V1 V由热力学第一定律
Q W 0 放热
例2:一定量氮气,其初始温度为300K,压强为1atm。将
其绝热压缩,使其体积变为初始体积的 1 5 。试求压缩
后的压强和温度
分析: p、v 的关系
p1V1 p2V2
T、 v 的关系
T2V2 1 T1V1 1
P
由
V C T
o
V2
V1
V
V T V 0 T 0 E 0
由热力学第一定律
Q E W 0 放热
3.绝热膨胀过程
Q 0
V 0 , W 0
由热力学第一定律
P 1
P1
0 E W
E W 0
T 0
P2 o V1
2 V2 V
4.未知过程与等温线 有两个交点
V 0 , W 0
由于1、2点在等温上,
物理学
13-4 理想气体的等温过程和绝热过程
第五版
一 等温过程
特征 T 常量
p
p1
1 ( p1,V1,T )
过程方程 pV 常量 p2
( p2,V2,T )
2
dE 0
o V1 dV V2 V
由热力学第一定律
恒
温
dQT dW pdV
热 源
T
第十三章 热力学基础
1
物理学
13-4 理想气体的等温过程和绝热过程
1.等体降压过程;
2.等压压缩过程;
3.绝热膨胀过程;
4.未知过程与等温线有两个交点。
P
解: 1.等体降压过程
曲线下面积为 0
P1
1
W 0
由 P C T
P2
2
o
V
V
P T P T 0 E 0
由热力学第一定律 Q E 0 放热过程
2.等压压缩过程
P
体积收缩,曲线下面
积为负值。
21
V 0 , W 0
10
物理学
13-4 理想气体的等温过程和绝热过程
第五版
等温过程曲线的斜率
pV 常量
pdV Vdp 0
(
dp dV
)T
pA VA
p
T 常量
Q0
pA papT A C
B
o VA V VB V
绝热线的斜率大于等温线的斜率.
第十三章 热力学基础
11
例1:讨论下列几个过程温度变化、内能增量、功、
热量的正负。
dE CV ,mdT
绝热的汽缸壁和活塞
第十三章 热力学基础
4
物理学
13-4 理想气体的等温过程和绝热过程
第五版
W V2 pdV V1
T2 T1
CV
,m
dT
CV ,m( T2 T1 )
p
p1
1( p1,V1,T1)
由热力学第一定律有
W E W CV ,m( T1 T2 )
p2
( p2,V2,T2 )
p2
( p2,V2,T2 )
W2
o V1
V2 V
p1
o V2
( p1,V1,T1)
W1 V1 V
E1
W
E2
E2
E1
W
第十三章 热力学基础
9
物理学
13-4 理想气体的等温过程和绝热过程
第五版
三 绝热线和等温线
绝热过程曲线的斜率
pV 常量
pV 1dV V dp 0
( dp dV
)a
pA VA
第十三章 热力学基础
V4
V3 2
3.69 103
m3
T4
V4 V3
T3
450
K
等容过程:
W1 0
Q1
E1
m M
5 2
R(T2
T1)
1248 J
等温过程: E2 0
Q2 W2
m M
RT2
ln
V3 V2
823 J
P(atm) 3
2
1 V
V1 V4 V3
等压过程:
W3 P3(V4 V3) 374 J
E3
6
物理学
13-4 理想气体的等温过程和绝热过程
第五版
绝热过程方程的推导
dQ 0, dW dE
pdV CV ,mdT
pV RT
RT V
dV
CV ,mdT
p
p1
1( p1,V1,T1) Q0
p2
o V1
( p2,V2,T2 ) 2
V2 V
第十三章 热力学基础
7
物理学
13-4 理想气体的等温过程和绝热过程
第五版
分离变量得 dV CV ,m dT
V
RT
dV V
1 dT 1 T
V 1T 常量
绝 V 1T 常量
热 方
pV
常量
程 p 1T 常量
第十三章 热力学基础
8
物理学
13-4 理想气体的等温过程和绝热过程
第五版
绝热膨胀
p
p1
1( p1,V1,T1)
绝热压缩
p
p2
2( p2,V2,T2)
