有机化学复习-羧酸及其衍生物
有机化学--羧酸及其衍生物

POCl3
HCl↑
O R C OH
SOCl2
O R C Cl
SO2↑
低、高沸点 ↑ HCl 的酰氯制备 都适合
② 酸酐的生成
羧酸在脱水剂如五氧化二磷的存在下,加热。两分子羧 酸失去一分子水而形成酸酐。
R-C OH R-C OH O R-C O R-C + H2O
P2O5
△
(产率较低)
O
分子量较大的羧酸在乙酐(作脱水剂)存在下,失水生 成酸酐。反应平衡中发生了酸和酸酐的交换。 O O CH3-C 2R-C-OH + O CH3-C O
任何使酸根负离子稳定的因素都将增加其酸性,羧酸根负离 子愈稳定,愈容易生成,酸性就愈强。
(1)电子效应的影响
诱导效应:X—COOH
-I使酸性增强, +I使酸性减弱
X= F Cl Br I CHO 3.53 NO2 1.68
+N(CH ) 3 3
pKa 2.66 2.86 2.90 3.18
1.83
O CH3CH2 C
丙酰基
O C
苯甲酰基
CH3 CH3 CH3CH-CHCH2COOH CH3CH-CHCH21 COOH 4 3 2 CH2CH3 CH
5 6 3
CH3-C =CH-COOH CH3 3-甲基-2-丁烯酸
γ β α
4
3
2
1
3,4-二甲基戊酸 CH2-COOH CH2-COOH 丁二酸
羧酸铵盐 腈的水解为其逆反应:
酰胺
腈
O C OH + HNH-
O C NHN-苯基苯甲酰胺
+ H2 O
扑热息痛
3、羧基的还原 (LiAlH4)
有机化学:12 羧酸及羧酸衍生物

C
+
O C O
H
(二)羧基上羟基的取代反应
O 酰卤 O 酸酐 O O 酯 O 酰胺 R C X R C O C R R C O R R C NH2(R)
1.成酯反应
O R C OH + H OR' H
+
O R C OR' + H2O
称酯化反应 反应特点:用酸做催化剂,反应可逆,速率慢
1.成酯反应
(1)诱导效应
HCOOH > CH3COOH > CH3CH2COOH
pKa 3.77 4.76 4.88
(一)酸性
如:卤素的位置——越靠近羧基影响越大
CH3CH2CHCOOH Cl
CH3CHCH2COOH CH2CH2CH2COOH Cl Cl
pKa
2.86
4.41
4.70
卤素的数目——越多,酸性越强
RCH2COOH + RCHCOX
X RCHCOOH
X X 该反应称为赫尔-佛尔哈德-泽林斯基(Hell-VolhardZelinsky)反应。 α-位如果还有H,可以进一步发生卤代反应,直至 所有α-H全部反应完。
问:
COOH CH3COOH 1 COOH 2 H2C COOH COOH 3
CH3COOH+SOCl2
pKa
4.20
3.83
4.09
4.10
2.电子效应的影响
邻位取代:
C和 I 都发挥作用,还有空间效应,情况复杂。
除氨基外,-X、-CH3、-OH、NO2酸性都比间 位或对位取代的强。邻位有取代时,羧基与 苯环不共平面,苯环电子云向羧基偏移少。
有机化学-羧酸及其衍生物

O CH3OC
O
H+
COCH3 + 2HOCH2CH2OH -2CH3OH
酯交换
O
O
O HOCH2CH2 OC
O
CH3OC
COCH3
COCH2CH2OH
HOCH2CH2OH
酯交换
O
O
C
C OCH2CH2O n n=80100
( 涤纶 )
16
4、酰胺的反应
酰胺的反应活性更小,需在酸或碱催化下长时间
加热回流才能水解
O
或 其它试剂
R CH
醛
水解反应 醇解反应 胺解反应
还原反应
11
1、酰氯的取代反应
H—OH O
R—C—Cl + H—OR'
H—NH2
O
R—C—OH O
HCl 水解
R—C—OR' + HCl 醇解
O
R—C—NH2 NH4Cl 氨解
(酰氯活性大是个优良的酰基化试剂)
O CH3CCl + CH3CH2CH2OH
RCH2
O CX
O
O
RCH2 C O C R
O RCH2 C OR'CH C
H
有弱酸性
可加成至 饱和
L
可被亲核 试剂取代
L: 离去基团 (Leaving group)
9
一、羧酸衍生物的取代反应
这类反应是羧酸衍生物与羧酸、以及羧酸衍生物 之间的相互转化。
O RCL
HOH
R C OH
RCOOH
OO
O
RC O C R HOR'
R C OR' RCOOH
有机化学第十三章 羧酸及其衍生物
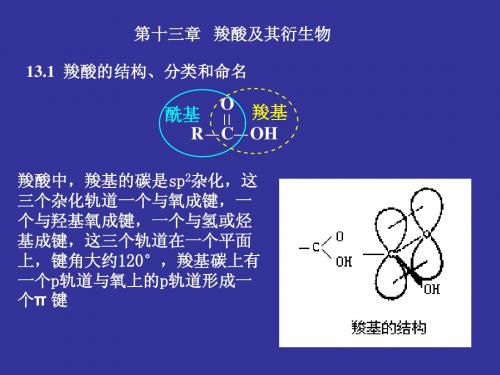
2) 与羰基相连的基团(Y) 空间体积; 3) 与羰基相连的基团(Y)
离去能力; 4) 反应物稳定化程度。
离去基团的离去能力: X- > RCOO- > RO > H2N
O R C Y
OR C Y+
羧酸衍生物亲核取代反应活性顺序:
O O O O > RCNH2 ~ ~ RCN
RCX > RCOCR >
RCH2Cl3 + H2O RCH2CN + H2O RCH2COOR' + H2O ......
RCH2COOH
13.3 羧酸的物理性质(P309) 13.4 羧酸的化学性质(P311) 1、酸性和成盐
sp
2
自学
R C
O OH R C
O
O OH
O C O
R C O-
两个碳氧键键长不同
四电子三中心的分子轨道 两个碳氧键键长等同。
O HO HC HOH2C OH
O
CH3
OH
Erythromycin A (红霉素) A
Vitamin C
• 酰胺
CH3 O O HCN-CH3 CH3
N,3-二甲基戊酰胺 N,N-二甲基甲酰胺
COOH
CH3CH2CHCH2CNHCH3
NHCOCH3
4-乙酰氨基-1萘羧酸
氮原子上有取代基, 在取代基名称前加N标出。
O NH R O R-C-NH N O S CH3 CH3 COOH
R=C6H5CH2(penicillin G)
γ -内酰胺
青霉素 ( penicillin )
物理性质(自学)
13.9 羧酸衍生物的物理性质
有机化学第10章羧酸及其衍生物
. 6H O 2
Ⅱ羧酸衍生物
羧酸分子中的羧基被不同基团取代的产物—羧酸的衍生物。 一、命名
酰氯和酰胺的命名相同,以它所含酰基命名
O O C CH 3 C Cl Cl CH3 C NH2 C NH2 O O
O H C N
CH3
O C H 3 C N H C H 2C H 3
CH3
N,N‘—二甲基甲酰胺(DMF)
O H2 R
'
+
-H R
+
O R C OR
'
H
(4)酰胺的形成
先得到铵盐,将铵盐加热,首先失去一分子水,生成酰胺,继续加热失水成腈。
O R C OH O O ONH
4
+
NH3
R
C
-H 2 O
R
C
NH2
-H 2 O
R
C
N
正好是腈水解的逆反应。 芳香、二元羧酸同样具有上述反应,可生成单酰氯、单酯也可生成二酰氯二酯。
2-丁烯酸
二元羧酸、 选取含有两个羧基的最长碳链,叫某二酸。
COOH H 3 CH 2 C H C HOOCCH COOH
2 CH 2 CH 2 CH 2 COOH
乙基丙二酸
HOOCCH=CHCOOH
已二酸
丁烯二酸 芳香酸:把芳环作为取代基
COOH COOH CH=CH-COOH HOOCH
2C
邻苯二甲酸
三、化学性质 1、酸性 RCOOH可看作 HOH中的H被酰基
R O C
取代的产物。
由于羰基的π 键与羟基氧原子上未共用电子对形成P-π 共轭体系,—OH氧上电子密度因向羰基转移而有所降低,使得—OH中氢氧间电 子密度降低,键强度减弱,以致—OH中的氢以质子形成离解,所以酸性比弱酸 和水强得多。但与强酸相比,羧酸只属于弱酸。
有机化学复习考试题及答案第十三章羧酸及其衍生物
13.5.3 丙烯酸 • 丙烯酸的制备
丙烯气相氧化
CH2=CH—CH3
O2,MoO3
280~360℃, 0.2~0.3MPa
CH2=CH—COOH
• 丙烯酸具有羧酸和烯烃双重性质。双键易发生氧化和 聚合反应。控制聚合反应程度,可得不同用途的聚合 物。工业上用作分散剂、涂料、粘合剂。
13.6 二元羧酸(自学 )
(2) 羧酸的命名 •俗名——根据天然来源
•系统命名法
(1)选择含有羧基的最长碳链为主链(母体);
(2)碳链编号时,从羧基的碳原子开始;
(3)酸前要冠以官能团位置的数字(编号最小);
(4)其它同烷烃的命名规则
俗名
系统名
O CCC C C C
OH
6 5432 1
例如:
CH2=CH-COOH C H3C -H = C HC -O O H
苯甲酸(安息香酸)
C H3
对甲苯甲酸
• 多元芳香族羧酸的命名 • 用“羧酸”或“甲酸”作字尾,其它作为取代基
COOH
COOH
COOH
COOH
对苯二羧酸
环己烷羧酸
(对苯二甲酸,1,4-苯二甲酸)(环己烷甲酸)
-萘羧酸 -萘甲酸;1- 萘甲酸
13.2 羧酸的制法 13.2.1 从伯醇或醛制备羧酸
• 不饱和醇或醛须用弱氧化剂制备
6MPa, 150~250℃
3. 烯烃制备羧酸——双键断裂
RCH=CHR’ + 4[O] K2Cr2O7+H2SO4 R’COOH
4. 环状烯烃制备——二元羧酸
RCOOH +
+ 4[O]
5. 丙烯酸的制备
CH2CH2COOH CH2CH2COOH
有机化学羧酸及其衍生物
Organic Chemistry
Ⅰ羧酸
一、羧酸、羧基的结构 1)羧酸:
H
C O
OH
R
C O
OH
Ar C O
OH
Organic Chemistry
Chapter 9 羧酸及其衍生物
2)羧基的结构:
C O
R
Organic Chemistry
OH
O
..
R C O H
形式上看,羧基由羰基和羟基组成。羟基氧原子的未共用电子对所 占据的 p轨道和羰基的 π键形成 p-π共轭。羟基氧上电子云密度有所 降低,羰基碳上电子云密度有所升高。因此,羧酸中羰基对亲核试 剂的活性降低,不利于HCN等亲核试剂反应。 Organic Chemistry
对于含不饱和键的不饱和羧酸则取包括羧基和不饱和键的最长碳链为主链称某烯酸并注明不饱和键的位置命名含脂碳环羧酸和芳香羧酸时则把脂碳环和芳环当作取代基choh3乙基己酸3丙基4戊烯酸coohchcoohchcoohcoohcooh乙基丙二酸邻苯二甲酸环戊基甲酸四物理性质羧酸的沸点比相近分子质量的其它有机物要高
3—丙基—4—戊烯酸
COOH
COOH
乙基丙二酸
环戊基甲酸
邻苯二甲酸
Organic Chemistry
Chapter 9 羧酸及其衍生物
四、物理性质
羧酸的沸点比相近分子质量的其它有机物要高: 乙 丙 酸(60):117.9℃ 醛(58): 48.8℃ 8 ℃
Organic Chemistry
正丙醇(60): 97.4℃ 甲乙醚(60):
味道 沸点
酰氯和酸酐都对粘膜有刺激性,酯有香味。 酰氯、酸酐和酯由于不能形成氢键,熔沸点与分子量相近
2024届高考化学一轮复习教案(人教版)第十一单元 有机化学 第5讲

第5讲羧酸羧酸衍生物复习目标1.掌握羧酸、羧酸衍生物的典型代表物的结构、性质与相互转化。
2.掌握羧酸及其衍生物与其他有机物的相互转化。
3.了解有机分子中官能团之间的相互影响。
一、羧酸1.概念:由01烃基(或氢原子)与02羧基相连构成的有机化合物,官能团为03—COOH ,饱和一元羧酸的通式为04C n H 2n O 2(n≥1)。
2.分类羧,酸HCOOH )、乙酸、硬脂酸HOOC—COOH )3.羧酸的化学性质羧酸的化学性质主要取决于羧基,反应时的主要断键位置如图:(1)酸的通性(以乙酸为例):乙酸是一种弱酸,其酸性比碳酸01强,在水溶液里的电离方程式为02CH 3COOH CH 3COO -+H +。
可以与Na 、NaOH 、Na 2CO 3、NaHCO 3等反应。
(2)酯化反应:酸脱03羟基,醇脱04氢。
如CH 3COOH +C 2H 185OH浓H 2SO 4△05CH 3CO 18OCH 2CH 3+H 2O 。
4.几种重要的羧酸(1)甲酸:俗名蚁酸,是最简单的饱和一元羧酸。
结构:既有01羧基,又有02醛基,具有羧酸与醛的性质。
△(NH4)2CO3+2Ag↓+2NH3+H2O。
银镜反应:HCOOH+2[Ag(NH3)2]OH――→(2)乙酸:CH3COOH,有强烈刺激性气味的无色液体,低于16.6℃凝结成固体,又称03冰醋酸,04易溶于水和乙醇。
(3)乙二酸:,俗名05草酸,属于还原性酸,可用来洗去钢笔水的墨迹。
(4)苯甲酸:,属于芳香酸,可作防腐剂。
二、羧酸衍生物1.酯(1)结构:羧酸酯的官能团为01(酯基),可表示为,饱和一元羧酸与饱和一元醇所生成酯的通式为02C n H2n O2(n≥2)。
(2)物理性质(3)化学性质酯的水解反应原理06。
07。
无机酸只起08催化作用,碱除起09催化作用外,还能中和水解生成的酸,使水解程度增大。
2.油脂(1)油脂的组成油脂的主要成分是一分子01甘油与三分子02高级脂肪酸脱水形成的酯。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O
OOHH
OHOH
3)Reformatsky反应
-卤代酸酯在锌粉作用下和醛、酮反应,所得加成产物 经水解得-羟基酸。
O
O
O
R CH
Zn C OEt
R
CH C
R'' OEt
C R'
Br
ZnBr
OZnBr
O
H2O
R'' C CH C OEt
R' R
OH R'' C CH
R' R
O C OEt
H2O, H+
4.3.成酰胺反应
O R C OH
O NH3
-H2O
R C ONH4 100oC
O R C NH2
R'NH2 R
O C
-H2O
ONH3R 180~190oC R
O C NHR
4.4 生成酯(酯化反应)
O
R C OH + R′OH
H+
R
1)酯化反应特点 ➢反应很慢 (H+ 催化,加热)
O
C OR′ + H2O
➢叔醇酯化按此机理成酯(R+ 稳定,较易生成)
5 脱羧反应
1)羧酸-碳上有强吸电子基时,受热易发生脱羧
△ Y CH2COOH
Y CH3 + CO2
O
2)Hunsdiecker 反应
Y : COOH ,R C , CN, NO2 , X, Ar, C C
OO
AAggNNOO33
OO
RR CC OOHH
产物单一 有合成意义
(3)Dieckmann 缩合(分子内酯缩合)
羧酸及其衍生物
1. 物理性质
一.羧酸
1. 物态 2. 沸点高——氢键 3. 熔点高——氢键 4. 高级脂肪酸具有润滑性
2. 光谱性质
• IR:—OH 3000 ~ 2500 cm-1(宽) 注意与醇羟基比较
C=O 1725 ~ 1700 cm-1 (与醛酮相近)
• HNMR:O—H δ 10~12 α—H δ 2.2~2.5
或
Nu
Nu
O
H
OH 亲核加成
OH
RCL
RCL
RC L
消除
OH HNu
R C Nu
H
Nu
O
H
+
R C Nu
LH
OH R C LH
Nu
3) 羧酸衍生物的水解
O RC X
H2O
HX
易
O
O
H2O
R C O CR
H or OH
O R C OR'
H2O H or OH
O R C NH2(R)
H2O H or OH
OH R'' C CH
R' R
O C OH
(4) 性质
1)受热脱水反应
-羟基酸
R R CCHOCCHOOOHOHOHH++HHHHOOOOOOCCCCHH
ΔΔ RR
RR OO
OO OO
+ +2H22HO2O OO RR 分子间脱水酯化成交酯
-羟基酸 RCRHCCHHC2HC2OCOOHOH ΔΔ RRCCHH CCHHCCOOOOHH ++HH2O2O
RR CC OOAAgg
KKOOHH
Br2
R Br + CO2
3)自由基脱羧反应
4)柯尔柏反应
电解
自由基反应引发剂
阳极
阴极
6 -氢的卤代
OO
XX2,2P, P
RRHHCC CC OOHH
HH
XX==BBr,rC, Cl l
O RHC C OH
X
O
Cl2
H3C C OH hv
7 还原反应
O Cl-H2C C OH
己二酸、 庚二酸受 热脱水和 脱羧
其它二酸 受热发生分子间脱水成高聚物(聚酐)
(3) 酯化反应
COOH CH2OH
+
H
COOH CH2OH
OO + 2 H2O
环
OO
酯
n HOOC
H
COOH + n HOH2C CH2OH
O
O
HO C
10 羟基酸
C OCH2CH2O H + (2n-1)H2O
聚酯
n
Na C2H5OH
Na, N2 乙醚 or 甲苯
RCH2OH + R'OH
伯醇
O RC
OH CR H
-羟基酮
acyloin 缩合(酮醇缩合)
➢ acyloin 缩合在合成上的应用举例
CO2R (CH2)n
CO2R
Na 二甲苯
H2O
(CH2)n
CO CHOH
4. 羧酸衍生物的-位的反应
1)酸酐-位的反应——Perkin反应
羰基:可加成至饱和
O
L:可被亲核试剂取代
RCH C L
H
离去基团 (Leaving group)
-H:有弱酸性
1. 酰基上的亲核取代
1)通式
O
Nu
R CL
or HNu
O R C Nu + L or HL
2) 酰基上的亲核取代的机理 (加成—消除)
O
亲核加成
O
消除
O
RCL
RC L
R C Nu + L
O
H2, Pd-BaSO4, 硫-喹啉
O
R C Cl Rosenmund 还原
R CH
(ii) 酯还原至醇(工业化)
使Pd催化剂活性减 弱(催化剂中毒)
O
H2, CuO CuCrO4
R C OR'
RCH2OH + R'OH 油脂氢化得高级脂肪醇
3)酯的金属钠还原
O R C OR'
O 2 R C OR'
OHOH
分子内脱水成不饱和酸
-羟基酸
ΔΔ
RCHRCHC2CHH2C2CHO2COOHOH
RR
OO ++HH2O2O
OHOH
OO
分子内脱水酯化成-丁内酯
-羟基酸
O
RCHCH2CH2CH2COOH
O + H2O
OH
R 分子内脱水酯化成 -戊内酯
2)氧化反应 RRCCHCOOH [ O ] RCCOOH
➢反应可逆 (加大某反应物用量或除去水使酯产率提高)
2) 酯化反应机理
(i) 酰基上的亲核取代(酰氧断裂) ➢ H+先与羰基氧结合—亲核加成—消除(酰氧断裂)
➢ 伯醇、仲醇酯化按此机理成酯
➢ 烃基R和R’的体积越大,酯化反应速度越慢 (ii) 烷基碳正离子中间体(烷氧断裂)
➢ H+先与醇羟基氧结合—碳正离子(烷氧断裂)
O R C OH
HO
O C
R递
or
+
减
O
HOR'
R CO
较易 催化
NH3(R)
催化 加热
4)羧酸衍生物的醇解反应
O
R'OH
O
R
C Cl Et3N or Py
R
C
OR' + HCl (碱吸收)
Et3NHCl or N HCl
OO
R'OH
R COCR
O
O
R C OR' + R C OH
O
H or R"O
(1) 制法
1)卤代酸水解
RRCCHH2C2COOOOHH BBrr22,, P
2)氰醇水解
RRCCHHCCOOOOHH1H)H2O2O, O, HO-H-RCRHCCHOCOOHOH
BBrr
2) H+ OHOH
R C HH HHCCNN RR CCHH CCNNH2HO2O, H,+H+ R R CHCHCOCOOHOH
(卤原子)
O
O
R C O C R (酰氧基)
O R C OR'
(烷氧基)
O R C NH2(R)
(氨基)
酰卤
酸酐 酯 酰胺
酰基-负性基
羧酸衍生物
4.1.成酰卤反应
O
R C OH + PCl3
(相 对 分子质量 小)
O
R C Cl + H3PO3
(蒸 出)
O
R C OH + PCl5
(相 对 分子质量 大)
CCHH33CCCCHH33 ++ CCOO22
OO CCHH33CCCCHHCCOOOOHH
ΔΔ
C6H5
OO CCHH33CCCCHH22CC66HH55 ++ CCOO22
二.羧酸衍生物的化学性质
性质分析
O
RCH2 C X
O
O
RCH2 C O C R
O RCH2 C OR'
O RCH2 C NH2(R)
RCH2COONa
Ph CHO + (RCH2CO)2O
Ph CH
COOH C
R
CH3COONa
Ph CHO + (CH3CO)2O
2)酯的-位的反应HCOOHCC NhomakorabeaPh
H
(1)Claisen 缩合(两个相同酯之间的缩合)
O
O
OO
