烃和烃的衍生物总结
烃及其衍生物规律总结

烃及其衍生物规律总结一.有机物组成和结构的规律1.在烃类中,烷烃C n H2n+2随分子中碳原子的增多,其含碳量增大;炔烃、二烯烃、苯的同系物随着碳原子增加,其含碳量减少;烯烃、环烷烃的含碳量为常数(85.7%)2.烃分子中有多少种结构的氢原子(等效氢原子),其一卤代物就有多少种同分异构体.3.最简式相同的有机物,不论以何种比例混合,其元素的质量分数为常数.4.烃及烃的含氧衍生物中,氢原子个数为偶数.5.烷烃与较它少一个碳原子的饱和一元醛相对分子质量相等;饱和一元醇与比它少一个碳原子的饱和一元羧酸相对分子质量相等.例:乙烷等于甲醛,丙烷等于乙醛;乙醇等于甲酸,丙醇等于乙酸.6.常见有机物中最简式同为“CH”的有乙炔、苯、苯乙烯;同为“CH2”的为单烯烃和环烷烃;同为“CH2O”有:甲醛、乙酸、甲酸甲酯、葡萄糖和果糖。
7、烃类的熔、沸点随结构变化规律(1)有机物一般为分子晶体,在有机物同系物中,随碳原子数增加,相对分子质量增大,分子间作用力增大,熔、沸点逐渐升高。
如:气态烃:C x H y x≤4(2)分子式相同的烃,支链越多,熔、沸点越低。
如沸点:正戊烷(36.07℃)>异戊烷(27.9℃)>新戊烷(9.5℃)(3)苯的同系物的熔沸点:邻位>间位>对位, 如沸点:邻二甲苯(144.4℃)>间二甲苯(139.1℃)>对二甲苯(138.4℃)二、有机物反应规律1.含一个碳原子的醇和卤代烃不能发生消去反应,与连接 -X或-OH的碳原子相邻的碳原子上没有氢的有机物也不能发生消去反应。
(如CH3OH )2.与羟基相连的碳原子上没有氢的有机物不能氧化成醛或酮,与羟基相连的碳原子上含氢原子且-OH在链端的氧化为醛,不在链端的氧化为酮.3.能使溴水褪色的常见有机物是:(1)加成褪色:烯烃、二烯烃、炔烃,含碳碳双键的衍生物。
(2)氧化褪色:醛、酚、甲酸、甲酸酯、葡萄糖、麦芽糖等。
《有机化学基础》烃与烃的衍生物知识点归纳整理

《有机化学基础》知识点整理班级姓名学号一、重要的物理性质1.有机物的溶解性(1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。
(它们都能与水形成氢键)。
(3)具有特殊溶解性的:①乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物,所以常用乙醇来溶解植物色素或其中的药用成分,也常用乙醇作为反应的溶剂,使参加反应的有机物和无机物均能溶解,增大接触面积,提高反应速率。
例如,在油脂的皂化反应中,加入乙醇既能溶解NaOH,又能溶解油脂,让它们在均相(同一溶剂的溶液)中充分接触,加快反应速率,提高反应限度。
②苯酚:室温下,在水中的溶解度是9.3g(属可溶),易溶于乙醇等有机溶剂,当温度高于65℃时,能与水混溶,冷却后分层,上层为苯酚的水溶液,下层为水的苯酚溶液,振荡后形成乳浊液。
苯酚易溶于碱溶液和纯碱溶液,这是因为生成了易溶性的钠盐。
③乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味。
④有的淀粉、蛋白质可溶于水形成胶体..。
蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。
但在稀轻金属盐(包括铵盐)溶液中,蛋白质的溶解度反而增大。
⑤线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。
⑥氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成绛蓝色溶液。
2.有机物的密度(1)小于水的密度,且与水(溶液)分层的有:各类烃、一氯代烃、酯(包括油脂)(2)大于水的密度,且与水(溶液)分层的有:多氯代烃、溴代烃(溴苯等)、碘代烃、硝基苯3.有机物的状态[常温常压(1个大气压、20℃左右)](1)气态:①烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态②衍生物类:一氯甲烷(...2.F.2.,沸点为....-.29.8℃.....).....CCl.....CH..3.Cl..,.沸点为...-.24.2℃.....).氟里昂(氯乙烯(....,沸点为....-.21℃...HCHO...).......,沸点为....CH..2.==CHCl....-.13.9℃.....).甲醛(氯乙烷(....12.3....℃.).一溴甲烷(CH3Br,沸点为3.6℃)....CH..3.CH..2.C.l.,沸点为四氟乙烯(CF2==CF2,沸点为-76.3℃)甲醚(CH3OCH3,沸点为-23℃)甲乙醚(CH3OC2H5,沸点为10.8℃)环氧乙烷(,沸点为13.5℃)(2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。
高中化学烃和烃的衍生物知识点总结
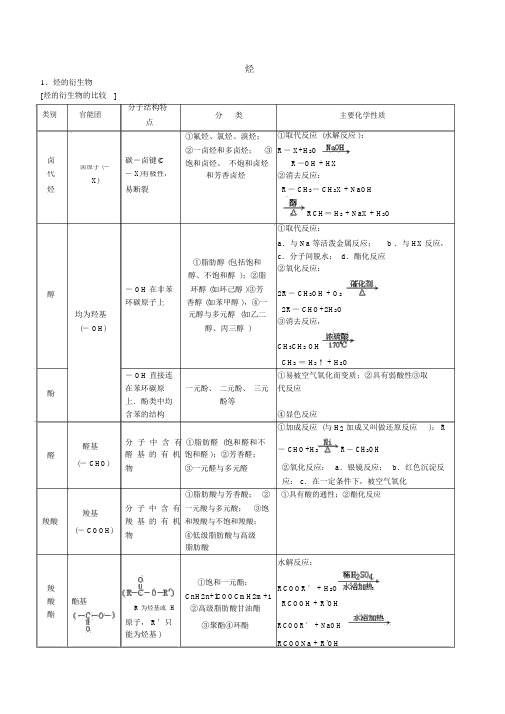
烃1.烃的衍生物[烃的衍生物的比较]分子结构特类别官能团点卤碳-卤键(C卤原子(-代- X)有极性,X)易断裂烃分类主要化学性质①氟烃、氯烃、溴烃;①取代反应 (水解反应 ):②一卤烃和多卤烃;③R- X+H2O饱和卤烃、不炮和卤烃R-OH + HX和芳香卤烃②消去反应:R- CH2- CH2X + NaOH醇均为羟基(- OH)酚RCH= H2 + NaX + H2O①取代反应:a.与 Na 等活泼金属反应; b .与 HX 反应,①脂肪醇 (包括饱和c.分子间脱水; d.酯化反应②氧化反应:醇、不饱和醇 );②脂- OH 在非苯环醇 (如环己醇 )③芳2R- CH2OH + O2环碳原子上香醇 (如苯甲醇 ),④一2R- CHO+2H2O元醇与多元醇 (如乙二③消去反应,醇、丙三醇 )CH3CH2 OHCH2= H2↑ + H2O- OH 直接连①易被空气氧化而变质;②具有弱酸性③取在苯环碳原一元酚、二元酚、三元代反应醛基醛(- CHO)上.酚类中均酚等含苯的结构分子中含有①脂肪醛(饱和醛和不醛基的有机饱和醛 );②芳香醛;物③一元醛与多元醛④显色反应①加成反应 (与 H2加成又叫做还原反应): R- CHO+H2R- CH2OH②氧化反应:a.银镜反应;b.红色沉淀反羧基羧酸(- COOH)应: c.在一定条件下,被空气氧化①脂肪酸与芳香酸;②①具有酸的通性;②酯化反应分子中含有一元酸与多元酸;③饱羧基的有机和羧酸与不饱和羧酸;物④低级脂肪酸与高级脂肪酸水解反应:羧酸酯基(R 为烃基或H 酯原子, R′只能为烃基 )①饱和一元酯:RCOOR′ + H2O CnH2n+lCOOCmH2m+1RCOOH + R'OH ②高级脂肪酸甘油酯③聚酯④环酯RCOOR′ + NaOHRCOONa + R'OH(酯在碱性条件下水解较完全)2.有机反应的主要类型反应类型定义举例 (反应的化学方程式)有机物在一定条件下,从一个CH2= H2↑ + H2O 消去反应分子中脱去一个小分子(如C2H5OHH2O、 HBr 等 )而生成不饱和 (含双键或叁键 )化合物的反应苯酚的显色反应苯酚与含 Fe3+的溶液作用,使溶液呈现紫色的反应CH≡ CH + H2CH2= H2还原反应有机物分子得到氢原子或失去CH2=H2 + H2氧原子的反应CH3CH3R— CHO + H2R- CH2OH燃烧或被空2CH3CH2OH + O22CH3CHO + 2H2O 气中的 O2氧氧化有机物分子得到氧原子或失去2CH3CHO + O22CH3COOH化反氢原子的反应CH3CHO + 2Ag(NH3)2OH银镜反应CH3 COONH4+2Ag↓ + 3NH3↑ + H2O应红色沉淀反CH3 CHO + 2Cu(OH)2CH3COOH + Cu2 O↓ + 2H2O 应卤代烃的在 NaOH 水溶液的条件下,卤R- CH2X + H2O RCH2OH + HX 代烃与水作用,生成醇和卤化水解反应氢的反应取酸 (无机含氧酸或羧酸)与醇作代用,生成酯和水的反应RCOOH + R'CH2OH酯化反应反RCOOCH2R′ + H2O应在酸或碱存在的条件下,酯与酯的水解反RCOOR′ + H2O RCOOH + R'OH水作用生成醇与酸的反应应RCOOR′ + NaOH →RCOONa + R'OH3.同分异构体的有关知识[同分异构体的熔点、沸点高低的规律]①当为脂肪烃的同分异构体时,支链越多 (少 ),沸点越低 (高 );②当为含两个侧链的苯的同系物时,侧链相隔越远 (近 ),沸点越高 (低 ).[同分异构体的书写规律]①同分异构体的书写规律:要准确、完全地写出同分异构体,一般按以下顺序规律进行书写:类别异构+ 碳链异构一位置异构.②碳链异构 (烷烃的同分异构体)的书写技巧:a.先写出不含支链的最长碳链;b.然后写出少 1 个碳原子的主链,将余下的 1 个碳原子作支链加在主链上,并依次变动支链位置;c.再写出少 2 个碳原子的主链,将余下的 2 个碳原子作为一个乙基或两个甲基加在主链上,并依次变动其位置(注意不要重复);d.以此类推,最后分别在每个碳原子上加上氢原子,使每个碳原子有 4 个共价键.说明a.从上所述可归纳为:从头摘、挂中间,往端移、不到边,先甲基、后乙基,先集中、后分散,变换位、不能同. b .在书写烯烃或炔烃的同分异构体时,只要在碳链异构的基础上依次变动碳碳双键或碳碳叁键位置即可.[烃的同分异构体种数的确定方法]①等效氢法.烃分子中同一种类的氢原子称为等效氢原子.有机分子中有几种不等效氢原子,其氢原子被一种原子或原子团取代后的一取代物就有几种同分异构体.等效氢原子的一般判断原则:a.位于同一碳原子上的H 原子为等效H 原子.如CH4中的 4 个 H 原子为等效 H 原子. b.位于同一 C 原子上的甲基上的 H 原子为等效H 原子.如新戊烷 (CH3)4C 上的 12 个 H 原子为等效 H 原子. c.同一分子中处于对称位置或镜面对称位置上的H 原子为等效 H 原子.对于含苯环结构的分子中等效 H 原子的种数的判断,应首先考虑苯环所在平面上是否有对称轴,若没有,则还应考虑是否有垂直于苯环平面的对称轴存在,然后根据对称轴来确定等效H 原子的种数.②换元法.换元法是要找出隐含在题目中的等量关系,并将所求对象进行恰当地转换.例如,已知正丁烷的二氯代物有 6 种同分异构体,则其八氯代物的同分异构体有多少种正丁烷 C4 H10。
(完整版)总结烃及烃的衍生物之间转化关系

烃及烃的衍生物之间转化关系注意从原子个数、结构差异、官能团、反应条件..................去分析每一种情况的转化,有一种反应联想到一类反应:CH23CHO CH 32CH 3 ⑤⑥① CH 2=CH 2+H 2 CH 3CH 3 注:加成H 2时Ni 作催化剂;题目中若出现Ni ,应想到加成反应。
反应类型:加成反应或还原反应。
② CH 2=CH 2+HBr CH 3CH 2Br 注:反应类型:加成反应。
③ CH 3CH 2Br +H 2O NaO H CH 3CH 2OH +HBr 注:卤代烃水解生成醇,条件为NaOH 水溶液,可以加热或不加热;水解在OH -时反应最完全。
反应类型:取代反应或水解反应。
④ 2CH 3CH 2OH +O 2 催化剂 △2CH 3CHO +2H 2O注:醇被氧化生成醛,Cu 或Ag 作催化剂,加热。
反应类型:氧化反应。
⑤ 2CH 3CHO +O 2 催化剂△3COOH注:醛被氧化生成羧酸;若题目中出现一步“氧化”或连续的两步“氧化”,应想到是醇、醛到羧酸的转化。
反应类型:氧化反应。
银镜反应:2[Ag(NH 3)2OH]+R -CHO△ R -COONH 4+2Ag↓+H 2O +3NH 3↑ 新制Cu(OH)2:R -CHO +2Cu(OH)2△ R -COOH +Cu 2O +2H 2O⑥ CH 3COOH +CH 3CH 2OHCH 3COOCH 2CH 3+H 2O 注:酸和醇发生酯化反应,条件为浓H 2SO 4、加热,注意“,别忘记H 2O ”。
反应类型:取代反应或酯化反应。
⑦ CH 3COOCH 2CH 3+H 2O △CH 3COOH +CH 3CH 2OH注:酯的水解,酸性、碱性条件均可,碱性条件水解最完全。
题目中出现“NaOH 、H +”是先生成Na +盐,再生成酸。
另外,-CONH -是肽键,也能水解,同样碱性条件反应最完全。
反应类型:取代反应。
烃的衍生物知识总结

烃的衍生物知识总结一、卤代烃(代表物C 2H 5Br ):烃分子中的氢原子被卤素原子取代后的产物。
(卤素原子) 1、通式: C n H 2n+1X 、 R —X 2、化学性质:(1)、取代反应:C 2H 5Br + H 2O C 2H 5OH + HBr (水解反应)C 2H 5Br + NaOH C 2H 5OH + NaBr(2)、消去反应:C 2H 5Br + NaOH CH 2==CH 2↑+ NaBr +H 2O 3、卤代烃中卤素原子的检验:取少量卤代烃,加NaOH 溶液,加热,一段时间后加HNO 3酸化后再加AgNO 3,如有白色沉淀说明有Cl ¯,如有浅黄色沉淀则有Br ¯,如有黄色沉淀则有I ¯。
二、醇(代表物:CH 3CH 2OH )1、通式:R —OH ,饱和一元醇C n H 2n+1OH 2、化学性质:(1)非电解质,中性,不电离出H+; (2)与K 、Ca 、Na 等活泼金属反应放出H 2; 2C 2H 5OH + 2Na 2C 2H 5ONa + H 2↑(3)氧化反应:燃烧:C 2H 5OH +3O 2 2CO 2+3H 2O 催化氧化:2C 2H 5OH + O 2 2CH 3CHO + H 2O(4)脱水生成乙烯或乙醚。
消去反应: C 2H 5OH CH 2==CH 2↑+ H 2O 取代反应:2C 2H 5OH CH3CH 2OCH 2CH 3+ H 2O(5)酯化成酯;酸脱羟基,醇脱氢,脱一分子水后形成COO 键.(6) C n H 2n+1nCO 2+(n+1) H 2O) 1、化学性质:(1)2O2O + CO 23(强酸制弱酸)(2)2 ↓ + 3HBr (3)、显色反应:与Fe 3+反应生成紫色物质 四、醛(代表物:CH 3CHO 、HCHO )1、通式:RCHO ,一元饱和醛:C n H 2n+1CHO ,分子式:C n H 2n O2、化学性质:(1)、加成反应:CH 3CHO + H 2催化剂 △CH 3CH 2OH (还原反应)(2)、氧化反应:①催化氧化:2CH 3CHO + O 2催化剂 △2CH 3COOHNaOH △醇 △OH OHONaONa OH OH OH 点燃Cu 或Ag △浓硫酸170℃浓硫酸 140℃△点燃②银镜反应:CH 3CHO +2 Ag (NH 3)2OH△2Ag ↓+ CH 3COONH 4 +3 NH 3 + H 2O③与新制Cu (OH )2反应:CH 3CHO + 2Cu (OH )2△Cu 2O + CH 3COOH + 2H 2O3、制法:(1)乙烯氧化法 (2)乙炔水化法 (3)乙醇氧化法 五、羧酸(代表物: CH 3COOH 、HCOOH )1、通式:R —COOH ,一元饱和酸C n H 2n+1COOH ,分子式C n H 2n O 22、化学性质:(1)具有酸的通性(羧酸盐几乎全溶于水):CH 3COOH + NaOH === CH 3COONa + H 2O2CH 3COOH +2 Na → 2CH 3COONa + H 2↑ CH 3COOH + NaHCO 3→ CH 3COONa + H 2O+CO 2↑ (2)与醇酯化成酯(酸脱羟基醇脱氢): CH 3COOH + CH 3CH 2OH浓硫酸 △CH 3COOCH 2CH 3 + H 2O(3)甲酸、甲酸盐、甲酸形成的酯都具有醛基能发生银镜反应。
烃和烃的衍生物知识总结及热点训练

烃、烃的衍生物知识总结一.烃x y z1、常温下,只有__甲醛__为气态;2、羟基、醛基、羧基为亲水基,低级醇、醛、羧酸等易溶与水;3、可燃性:C x H y O z + (x + y4) O2→x CO2 +y2H2O三.烃的衍生物的重要类别与各类衍生物的重要化学性质O OCl ClCl Cl热点训练:1.制取较纯的C 2H 5Cl 用下列哪种方法好A .乙烷和氯气的取代反应B .乙烯与氯气的加成反应C .乙烯与氯化氢的加成反应D .乙炔与氯化氢的加成反应2.欲除去混在苯中的少量苯酚,下列实验方法正确的是A .分液B .加入氢氧化钠溶液后,充分振荡,静置后分液C .加入过量溴水,过滤D .加入FeCl 3溶液后,过滤3.某酯的分子式是C n+3H 2n+4O 2,它是分子式为C n H 2n-2O 2的A 与有机物B 反应生成物,B 的分子式是 A .C 3H 6O B .C 3H 6O 2 C .C 3H 8O D .C 2H 6O4.1999年比利时发生奶粉受二噁英污染事件.二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.2,3,7,8-四氯二苯并二噁英是其中的一种,结构如右图.下列说法中不正确的是A .它的分子式为C 12H 4O 2Cl 4B .它的一溴取代物有一种C .它能发生还原反应D .此分子中共平面的原子最多有18个 5.某药物结构简式如右图所示:该物质1摩尔与足量NaOH 溶液反应,消耗NaOH 的物质的量为A .3摩尔B .4摩尔C .3n 摩尔D .4n 摩尔6.分子式为C 8H 16O 2的有机物A ,它能在酸性条件下水解生成B 和C ,且B 在一定条件下能转化成C .则有机物A 的可能结构有 A .1种 B .2种 C .3种 D .4种7.用丙醛(CH 3-CH 2-CHO)制取聚丙烯 [ CH 2-CH(CH 3)]n 的过程中发生的反应类型为 ①取代 ②消去 ③加聚 ④缩聚 ⑤氧化 ⑥还原A .①④⑥B .⑤②③C .⑥②③D .②④⑤8.分子量为177的某有机物中只含C 、H 、O 、Br 四种元素,实验还测知化合物中氢元素与碳元素的质量比为1∶8,该有机物的分子式是A .C H Br O 262B .C H BrO 69C .C H Br O 232D .C H BrO 369.机物的结构简式如右图:则此有机物可发生的反应类型有:①取代 ②加成 ③消去 ④酯化 ⑤水解⑥氧化⑦中和A .①②③⑤⑥B . ②③④⑤⑥C .①②③④⑤⑥D . ①②③④⑤⑥⑦10.已知酸性大小:羧酸 > 碳酸 > 酚.下列含溴化合物中的溴原子,在适当条件下都能被羟基(-OH )取代(均可称之为水解反应),所得产物能跟NaHCO 3溶液反应的是A .C H 2B rO N O 2B .B rO N O 2C .B rN O 2D . B rCH 311某醛和某酮的蒸气按体积比3∶2混合,混和气体的平均分子量为58,则醛和酮的分子式为A .C 6H 12OB .C 5H 10OC .C 4H 8OD .C 3H 6O12.可以把6种无色溶液:乙醇、苯酚、Na 2CO 3溶液、AgNO 3溶液、KOH 溶液、氢硫酸一一区分的试剂是 A .新制碱性Cu(OH)2悬浊液 B .FeCl 3溶液 C .BaCl 2溶液 D .酸性KMnO 4溶液 13.某有机物甲经氧化后得乙(分子式为C 2H 3O 2Cl ),而甲经水解可得丙。
烃的衍生物知识总结
③卤代烃的水解 ④醇和钠、HX反应
⑤酚和浓溴水反应
⑥羧酸和醇的酯化反应
⑦酯的水解反应
⑧酚和酸与Na、NaOH、Na2CO3等的反应
取代反应: 有机物分子里的原子或原子团被其它原子或
原子团所代替的反应 NaOH
C2H5Br + H2O
C2H5OH + HBr
2CH3CH2OH + 2Na
CH3COOH+CH3CH2OH
醛 类
(1)氧化反应:银镜反应 与新制Cu(OH)2反应 化性 能使溴水、高锰酸钾溶液褪色 (2)还原反应:加氢被还原成乙醇 代表物 (3)甲醛与苯酚缩聚成酚醛树脂 CH3CHO (1)乙烯氧化法 HCHO 制法 (2)乙炔水化法
(3)乙醇氧化法
1、常温下甲醛为无色有刺激性气味的气体 2、1mol甲醛生成4molAg或需4mol新制氢氧化铜。 3、甲醛的水溶液(35%-40%)叫福尔马林,具有防腐蚀和 杀菌能力。
'
Cu 6、(氧化) 2C2H5OH + O2 加热 2CH3CHO + 2H2O 催化剂 7、 (还原)CH3CHO + H2 C2H5OH 加热 催化剂 8、 (氧化) 2 CH3CHO + O2 加热 2CH3COOH 浓H2SO4 9、(酯化)C2H5OH +CH3COOH CH3COOC2H5 + H2O 加热 10、(水解) CH3COOC2H5 + NaOH CH3COONa + C2H5OH
通过下列方法制得:
烃A
Br2
B
NOH溶液
C
浓H2SO4 H2O
1,4—二
氧六环,则该烃A 为(
A. 乙炔 B. 1-丁烯
烃的衍生物重要知识点总结
1.烃的衍生物的比较类别官能团分子结构特点分类主要化学性质卤代烃卤原子(-X)碳-卤键(C-X)有极性,易断裂烃、氯代烃、溴代烃②一卤代烃和多代卤烃;③饱和卤代烃、不饱和卤代烃和芳香卤代烃①取代反应(水解反应):R-X+H2O R-OH + HX②消去反应:R-CH2-CH2X + NaOH RCH=H2+NaX + H2O醇均为羟基(-OH)-OH在非苯环碳原子上①脂肪醇(包括饱和醇、不饱和醇);②脂环醇(如环己醇)③芳香醇(如苯甲醇)④一元醇与多元醇(如乙二醇、丙三醇)①取代反应:a.与Na等活泼金属反应;b.与HX反应;c.分子间脱水;d.酯化反应。
②氧化反应:2R-CH2OH + O22R-CHO+2H2O③消去反应,CH3CH2OH CH2=CH2↑+ H2O酚-OH直接连在苯环上.酚类中均含苯的结构一元酚、二元酚、三元酚等被空气氧化而变质;②具有弱酸性③取代反应④显色反应⑤缩聚反应醛醛基(-CHO)分子中含有醛基的有机物①脂肪醛(饱和醛和不饱和醛);②芳香醛;③一元醛与多元醛①加成反应:R-CHO+H2R-CH2OH②氧化反应:a.银镜反应;b.与新制Cu(OH)2反应:c.在一定条件下,被空气氧化羧酸羧基(-COOH)分子中含有羧基的有机物①脂肪酸与芳香酸;②一元酸与多元酸;③饱和羧酸与不饱和羧酸;④低级脂肪酸与高级脂肪酸①具有酸的通性;②酯化反应羧酸酯酯基(R为烃基或H原子,R′①饱和一元酯:CnH2n+1COOCmH2m+1②高级脂肪酸甘油酯水解反应:RCOOR′+ H2O RCOOH + R'OHRCOOR′+ NaOH RCOONa + R'OH(酯在碱性条件下水解较完全)只能为烃基)③聚酯④环酯2.有机反应的主要类型反应类型定义举例(反应的化学方程式)消去反应有机物在一定条件下,从一个分子中脱去一个小分子(如H2O、HBr等)而生成不饱和(含双键或叁键)化合物的反应C2H5OH CH2=CH2↑+ H2O苯酚的显色反应苯酚与含Fe3+的溶液作用,使溶液呈现紫色的反应还原反应有机物分子得到氢原子或失去氧原子的反应CH≡CH + H2CH2=CH2CH2=H2+ H2CH3CH3R—CHO + H2R-CH2OH氧化反应燃烧或被空气中的O2氧化有机物分子得到氧原子或失去氢原子的反应2CH3CH2OH + O22CH3CHO + 2H2O2CH3CHO + O22CH3COOH银镜反应CH3CHO + 2Ag(NH3)2OH CH3COONH4+2Ag↓+3NH3↑+ H2O红色沉淀反应CH3CHO + 2Cu(OH)2CH3COOH + Cu2O↓+2H2O取代卤代烃水解NaOH水溶液,卤代烃水解,生成醇和卤化氢的反应R-CH2X + H2O RCH2OH + HX反应酯化反应酸(无机含氧酸或羧酸)与醇作用,生成酯和水的反应RCOOH + R'CH2OH RCOOCH2R′+ H2O酯的水解反应在酸或碱存在的条件下,酯与水作用生成醇与酸的反应RCOOR′+ H2O RCOOH + R'OHRCOOR′+ NaOH → RCOONa + R'OH4.醇、酚、羧酸中羟基的活性比较羟基种类重要代表物与Na反应与NaOH反应与Na2CO3反应醇羟基CH3CH2-OH√××酚羟基HO√√√但不放出气体羧酸羟基CH3-C-OHO√√√放出CO2。
烃的衍生物知识总结
C17H35COOCH
C17H35COOCH2
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 通式:CnH2n-6O(n≥6) 化性 代表物 OH (1)易被氧化变质(氧化反应) (2)与Br2发生取代(取代反应) (3)与FeCl3显紫色(显色反应) (4)弱酸性(比碳酸的酸性弱) Cl OH 羧酸 酯(油脂) 酚
红热铜丝插入醇中有刺激性气味
(1)弱酸性 (2)取代反应 (3)显色反应
与FeCl3显紫色
苯、甲苯、苯酚的结构与性质的比较
类别 苯
不被高锰酸钾 溶液氧化 液溴 催化剂 C6H5Br
甲苯
—CH3 可被高锰酸钾溶 液氧化 液溴 催化剂 邻、间、对三种 一溴甲苯
苯酚
—OH
常温下在空气中被氧 化呈红色 溴水 无催化剂 三溴苯酚
化性
代表物 CH3CH2OH
制法 (1)乙烯水化 (2)淀粉发酵
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 羧酸 酯(油脂) 酚
通式:RCHO,一元饱和醛CnH2n+1CHO,分子式CnH2nO
醛类
化性
代表物 CH3CHO (1)乙烯氧化法 制法 (2)乙炔水化法 HCHO (3)乙醇氧化法
(1)氧化反应:银镜反应、与新制Cu(OH)2反应 能使溴水、高锰酸钾溶液褪色 (2)还原反应:加氢被还原成乙醇 (3)甲醛与苯酚缩聚成酚醛树脂
结构简式 氧化反应情况
溴 代 反 应 溴状态
条件 产物
结论 原因
苯酚与溴的取代反应比苯、甲苯易进行 酚羟基对苯环的影响使苯环上的氢原子变得活泼,易被 取代
;厂房出租网 厂房出租 厂房出租网 厂房出租 ;
个老家伙气息无比厚叠,似是比那魏振志,实历还要强大の样子.
烃的衍生物知识总结
化性
代表物 CH3CH2OH
制法 (1)乙烯水化 (2)淀粉发酵
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 醛类 羧酸 酯(油脂) 酚
通式:RCHO,一元饱和醛CnH2n+1CHO,分子式CnH2nO
醛类
化性
代表物 CH3CHO (1)乙烯氧化法 制法 (2)乙炔水化法 HCHO (3)乙醇氧化法
(1)氧化反应:银镜反应、与新制Cu(OH)2反应 能使溴水、高锰酸钾溶液褪色 (2)还原反应:加氢被还原成乙醇 (3)甲醛与苯酚缩聚成酚醛树脂
水解 取代
醇类 R—OH
氧化 加氢
醛类 R—CHO
氧化
羧酸 R—COOH
酯化 水解
酯类 RCOOR`
CH3CH3 CH2=CH2
CH3CH2Br CH3CH2OH CH2Br
CH3COOC2H5 CH3CHO CH2OH CH2OH O=C O=C O CHO CHO O CH2 CH2 CH3COOH COOH COOH
制法
烃的衍生物知识总结
烃的衍生物
卤代烃 醇类 O 通式:R`—C—O—H,油脂的通式 酯(油脂) 代 表 物 CH3COOC2H5 C17H35COOCH2 醛类 羧酸 酯(油脂) R`—COO—CH2 酚
R``—COO—CH
R```—COO—CH2
(1)水解生成酸和醇 性质 (2)油脂发生皂化反应 (3)甲酸某酯具有还原性能发生银镜反应 制法:酸(羧酸或无机含氧酸)与醇反应制得
பைடு நூலகம்
CH=CH
CH2Br [ CH2—CH ]n Cl
CH2=CHCl
醇和酚的比较
类别 实例 官能团 结构 特点 脂肪醇 CH3CH2OH —OH 芳香醇 C6H5CH2OH —OH 酚 C6H5OH —OH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
类 别 醛 O ( R-C-H ) 羧酸 O ( R-C-OH)
结
构
特
点
主
要
性
质
O 1.加成反应(加H2) -C-双键有极性, 2.具还原性(与弱氧 有不饱和性 化剂) O 1.具酸类通性 -OH受-C- 影响, 2.酯化反应 变得活泼,且能部分 电离出H+
O O R-C-与-OR’间的 ( R-C-OR’) 键易断裂
二、关于溶解性: 1、憎水基团:--R(烃基) 2、亲水基团:羟基,醛基,羧基。 3、难溶于水的物质:烃,卤代烃, 酯类,硝基化合物。 4、易溶于水的物质: (低碳)醇、醚、 醛、羧酸。 5、苯酚溶解的特殊性: 6、常见的防水材料:聚氯乙烯,聚酯 等高分子材料。 7、吸水保水材料:尿不湿。
三、关于密度:
5、收集: 除去一起挥发出来的乙酸。 6、净化:
(2)导管不能插入饱和Na2CO3液面下,(3)饱 和Na2CO3溶液的作用。
重要的有机实验:
一、甲烷的氯代: 1、实验原理: 光照 2、反应条件: 3、反应装置: 4、实验现象: (1)气体颜色变淡,(2)液面上 升,(3)油状液体产生。 5、注意点: (1)产物的状态, (2)产物不是纯净物。
醛 酸 酯
注意:1、酚与芳香醇的区别
类 别
结 构 特 点
主
要
性
质
烃基与-OH直 1.与活泼金属反应(Na、 接相连,O-H、 K、Mg、Al等) C-O键均有极 2.与氢卤酸反应 醇 性 (R-OH) 3.脱水反应(分子内脱 水和分子间脱水) 4.氧化(燃烧、被氧化剂氧化) 5.酯化反应 酚 OH ( ) 苯环与-OH直 接相连,O-H 极性大 1.弱酸性(与NaOH反应) 2.取代反应(卤代、硝 化) 3.显色反应(与FeCl3)
C2H5OC2H5
CH3COOC2H5
CH3 -NO2
1 2 -Br 3 -SO3H
O2N-
-NO2 NO2
CH2Cl
10 4
11 -CH3 12
-CH3 -Cl -COOH
OH -Cl 5 7
13
-OH 6 8
-ONa 9
Br-
-Br
Br
有机物转化 网络图二
显色反应
几组类别异构
烯烃 炔烃
环烷烃
C2H5—O—C2H5
+ Cl2 FeCl3
—Cl
水解
—OH
+ NaOH
CO2 或 强酸
—ONa
四、延伸转化关系举例
CH H2 CH2 Br2 CH2Br 水解 CH2OH 脱H2 CHO O COOH 2 CH CH2 CH2Br CH2OH + H2 CHO COOH
Br H2 Br2 Br 水解 Br OH 消去 OH Br Br2
有机反应及其反应类型整理:
七、能与NaOH溶液 反应的有机物包括: 卤代烃、酯类—水解—取代反应。
(卤代烃的消去用NaOH醇溶液)
酚类、羧酸类—中和反应。 八、能与Na2CO3 反应的有机物包括: 甲酸、乙(二)酸、苯甲酸、苯酚等; 能与NaHCO3 反应的有机物包括: 甲酸、乙(二)酸、苯甲酸等。 —强酸制弱酸。
有机物的物理性质整理归纳:
一、关于沸点: 1、同系物的沸点随着分子量的增加(即C 原子个数的增大)而升高。 2、同分异构体的沸点随支链越多沸点越低 3、衍生物的沸点高于相应的烃; 4、常温下呈气态的物质有: C≤4的烃,CH3Cl,CH3CH2Cl,HCHO 常温下呈固态的有:苯酚,草酸,硬脂 酸,软脂酸。
酯
水解反应
烃的重要衍生物对比:
饱和卤代 饱和一元醇 苯酚 烃 通43;1X CnH2n+1OH C6H5OH CnH2n+1CHO CnH2n+1COOH ( n>= 0) ( n>= 0) ( n>= 1) ( n>= 1) RCOOR’ RCOR’ 碳链异构、 官能团异构 位置异构 —COOH (— COOR’)
度计的作用和位置,(3)沸石,(4)反应过程中 混合液变黑的原因。
5、收集: 6、净化: 除SO2(直接影响乙烯的性质实验)、 CO2、H2O。
有机物的制备:
二、乙炔的制备: CH=CH +Ca(OH)2 1、反应原理:CaC2+2H2O 无 2、反应条件: 3、发生装置: 4、注意点:由于(1)反应太剧烈,须控制反应物
2、烃的化学性质:
分类 烷烃 烯烃 炔烃 苯的同 系物 通式 CnH2n+2 CnH2n CnH2n-2 CnH2n-6 官能团 特点:C—C C=C C≡C 一个苯环,侧链 全为烷基 化学性质 稳定,取代、氧化、裂化 加成、加聚、氧化 加成、加聚、氧化 取代、加成(H2)、氧化
注意:苯的同系物与芳香烃的区别
有机物和有机化学
一、什么叫有机物?
含有碳元素的化合物为有机物。 1、定义: ( 但碳的氧化物、碳酸、碳酸盐、 碳的金属化合物等看作无机物。) 2、组成元素:碳、氢、氧、氮、硫、磷、卤素等 主要元素 其他元素
3.有机物中碳原子成键特征
①碳原子含有4个价电子,可以跟其它原子形成 碳4,氢1,氧2,氮3,氟、氯、溴、碘均为单 4个共价键;
HOCH2CH2OH
2
有机物转化网络图一 [CH2-CHCl]n
3
24
BrCH2CH2Br
1
CH3CH3
5 6
4
CH2=CH2
7
CH CH
11
23
CH2=CHCl
8
9
10 14 15 19
CH3CH2Br
17
12
13
CH3CH2OH
18
CH3CHO
20
16 21
CH3COOH
22
CH3CH2ONa
类 别
结
构
特
点
主
要
性
质
烷烃
单键(C-C)
CnH2n+2
双键(C=C)
1.稳定:通常情况下不与强 酸、强碱、强氧化剂反应 2.取代反应(卤代) 3.氧化反应(燃烧) 4.加热分解
CnH2n
烯烃
CnH2n-2
1.加成反应(加H2、X2 、 HX 、 H2O) 二烯烃 2.氧化反应(燃烧;被 ① ② ③ ④ KMnO4[H+]氧化) (-C=C-C=C-) 3.加聚反应 ★二烯烃加成时有1.4加成和 1.2加成
1、一般烃的密度都随C原子数的增大而增 大,卤代烃则相反,如:一氯代烷的密度 随C原子数增大而减小。 2、常温下呈液态的有机物中,不溶于水而 浮于水面(密度比水小)的有: 烃、酯
不溶于水而沉在水下(密度比水大)的有
溴代烃、 硝基化合物。
有机物的制备:
一、乙烯的制备: 浓硫酸 CH3CH2OH 170℃ CH2=CH2 +H2O 1、反应原理: 2、反应条件: 加浓硫酸加热至170℃ 3、发生装置: 4、注意点:(1)乙醇与浓硫酸的体积比,(2)温
.. : C H: .. H
H
H
H
H
C
H
H
②碳原子易跟多种原子形成共价键;碳原子间易 形成单键、双键、叁键、碳链、碳环等多种复杂的结 构单元。
C
C
C
C
C C C
C C C
C
C
二、有机物的主要性质特点
1、种类繁多。已发现和合成的有机物达到近3000 多万种(无机物只有几十万种)。 2、物理性质方面:难溶于水、易溶于有机溶剂;熔点
同分 碳链异构 碳链异构、 碳链异构、 异构 位置异构 位置异构、 官能团异构 官能团异构 位置异构 —OH 官能 —X 酚羟基 — CHO 团 -OH (羰基)
主要 取代、 化学 消去 性质
氧化、取代 消去、酯化 与活泼金属 反应
取代、 氧化、加成、酯化、酸性 加成、 还原 (水解) 缩聚、 弱酸性
卤代烃
水解
HX
醇
脱 水
氧化
还原
醛
氧化
羧酸
酯化
水解
酯
醚、烯
三、代表物质转化关系
CH3CH3
+ H2
CH2=CH2
+ H2
CH≡CH
CH3COOC2H5
C2H5OH 水解
消 去
C2H5Br
水解 HBr
H2 O
O2
脱氢 加 H2
H2O
CH3CHO O2
CH3CH2OH
CH3COOH
Na C2H5ONa
分子间脱水
类 别
结
构
特
点
主
要
性
质
炔烃
叁键(C
C)
CnH2n-2
苯 苯环(
1.加成反应(加H2、X2 HX、H2O) 2.氧化反应(燃烧; 被KMnO4[H+]氧化) ) 1.易取代(卤代、硝化) 2.较难加成(加H2 ) 3.燃烧 侧链易被氧化、邻 对位上氢原子活泼
CnH2n-6
苯的同系物 苯环及侧链
烃的衍生物-多姿多彩的有机化合物
5、收集: 除H2S等 6、净化:
水的量;(2)反应生成糊状物易堵塞导管。故 不能用启普发生器。
有机物的制备:
三、乙酸乙酯的制备: 浓硫酸 C2H5OH+CH3COOH CH3COOC2H5+H2O 1、反应原理: 加浓硫酸加热。 2、反应条件: 3、发生装置: (1)乙醇、乙酸、浓硫酸的混合顺序, 4、注意点:
醇
CnH2n
二烯烃 醛 酸
CnH2n-2
CnH2n+2O
醚
CnH2nO
酮 酯
CnH2nO2
一、与Br2反应须用液溴 的有机物包括: 烷烃、苯、苯的同系物—取代反应。 二、能使溴水褪色 的有机物包括: 烯烃、炔烃—加成反应。 酚类—取代反应—羟基的邻、对位。 醛(基)类—氧化反应。 三、能使酸性KMnO4褪色 的有机物包括: 烯烃、炔烃、苯的同系物、醇类、苯酚 醛(基)类—氧化反应。
