苯甲酸乙酯的制备
实验苯甲酸乙酯的制备

实验苯甲酸乙酯的制备一、实验目的:1、掌握酯化反应原理,苯甲酸乙酯的制备方法,了解三元共沸除水原理。
2、复习分水器的使用及液体有机化合物的精制方法。
3、进一步练习蒸馏、萃取、干燥和折光率的测定等基本操作。
二、实验原理:苯甲酸,乙醇在浓硫酸的催化下进行酯化反应,生成苯甲酸乙酯与水。
+2OHCH 3+OH 2OOHOOC 2H 5H SO反应机理:由于苯甲酸乙酯的沸点较高,很难蒸出,所以本实验采用加入环己烷的方法,使环己烷、乙醇和水形成三元共沸物,其沸点为62.1℃。
三元共沸物经过冷却形成两相,使环己烷在上层的比例大,再回反应瓶,而水在下层的比例大,放出下层即可除去反应生成的水,使平衡向正方向移动。
三、实验仪器及试剂:仪器:圆底烧瓶、回流冷凝器、分液漏斗、锥形瓶、烧杯、温度计、球形冷凝管、分水器。
试剂:苯甲酸 4g 、无水乙醇10ml 、浓硫酸 3ml 、Na 2CO 3、环己烷8ml 、乙醚、无水MgSO 4、沸石。
装置图:反应装置蒸馏装置试剂d 420b.p./℃nD20乙醇 0.7893 78.5 1.3611 苯甲酸 1.2659 249 1.5397 环己烷0.7785 80 1.4262 乙醚0.731834.511.3526苯甲酸乙酯 1.05 211~213 1.5001四、实验步骤:1、加料:于50ml圆底烧瓶中加入:4g苯甲酸;10ml乙醇;8ml环己烷;3ml浓硫酸,摇匀,加沸石。
按照实验仪器左图组装好仪器(安装分水器),加热反应瓶,开始回流。
2、分水回流:开始时回流要慢,随着回流的进行,分水器中出现上下两层。
当下层接近分水器支管时将下层液体放入量筒中。
继续蒸馏,蒸出过量的乙醇和环己烷,至瓶内有白烟或回流下来液体无滴状(约2h),停止加热。
3、中和:将反应液倒入盛有30mL水的烧杯中,分批加入碳酸钠粉末至溶液呈中性(或弱碱性),无二氧化碳逸出,用PH试纸检验。
4、分离萃取、干燥、蒸馏:用分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有几层。
苯甲酸乙酯的制备
在反应开始时,回流速度要慢,为什么不能加热 太快?
南阳师范学院化学实验教学中心
南阳师范学院化学实验教学中心
苯甲酸乙酯的制备
制作人:刘若雨 副教授
一、实 验 目 的
• 掌握制备苯甲酸乙酯的原理和实验方法 • 掌握分水器的使用 • 巩固萃取、回流、干燥等基本操作
南阳师范学院化学实验教学中心
二、实 验 原 理
1. 反应式
COOH H
C2H5OH
COOC2H5
H2O
O
2. 反应机理 Ph C OH
分液 有机相 乙醚萃取(10mL*2) 合并有机相 无水CaCl2干燥 过滤得透明液 水浴蒸出乙醚 蒸馏 收集211-213℃馏分 产品
南阳师范学院化学实验教学中心
南阳师范学院化学实验教学中心
3. 结构表征
阿贝折射仪
南阳师范学院化学实验教学中心
Байду номын сангаас
四、注 意 事 项
水-乙醇-环己烷三元共沸物的共沸点为62.5℃,其中含 水4.8%、乙醇19.7%、环己烷75.5%。生成水约1.5 g。
南阳师范学院化学实验教学中心
三、实 验 步 骤
1、粗产品的制备 投料量: 6.1 g 苯甲酸 13 mL 95% 乙醇 10 mL 正己烷 2 mL 浓硫酸
南阳师范学院化学实验教学中心
三、实 验 步 骤
2. 产品的精制与提纯
粗产品 加20mL冷水 分批加入Na2CO3 pH检验呈中性 中和至无CO2放出
多余的环己烷和乙醇充满分水器时,可由活塞放出,放 时应移去火源。
当多余的环己烷和乙醇充满分水器时,可由活塞放出, 注意放时要移去火源。
苯甲酸乙酯的制备

实验 21 苯甲酸乙酯的制备
一、目的
1.掌握酯化反应原理,及苯甲酸乙酯的制备方法。
2.复习分水器的使用及液体有机化合物的精制方法。
二、基本原理
Ph-COOH + C2H5OH H2SO4/苯PhCO2C2H5 + H2O
三、试剂
苯甲酸4g(0.033mol) 无水乙醇10ml(0.17mol)
浓硫酸 1.5ml Na2CO3 无水CaCl2
苯80ml 乙醚10ml
四、实验步骤
1、加料:于50ml圆底烧瓶中加入:4g苯甲酸;10ml乙醇;7.5ml苯;3ml浓硫酸,摇匀,加沸石。
2、分水回流:水浴上回流约2h,至分水器中层液体约3ml停止。
记录体积,继续蒸出多余的苯和乙醇(从分水器中放出)。
移去火源。
3、中和:加水30ml,分批加入固体Na2CO3中和至中性。
除2种酸。
即硫酸、苯甲酸。
4、分离萃取、干燥:分液,水层用10ml乙醚萃取。
合并有机层,用无水氯化钙干燥。
5、精馏:回收乙醚,加热精馏,收集210-213 o C馏分。
N201.5001
五、思考题
1、本实验采用何种措施提高酯的产率?
2、为什么采用分水器除水?
3、何种原料过量?为什么?为什么要加苯?
4、浓硫酸的作用是什么?常用酯化反应的催化剂有哪些?
5、为什么用水浴加热回流?
6、在萃取和分液时,两相之间有时出现絮状物或乳浊液,难以分层,如何解决?。
实验苯甲酸乙酯的制备

实验苯甲酸乙酯的制备苯甲酸乙酯,又称苯乙酸乙酯,是一种常用的酯类有机化合物,具有香气和挥发性。
它广泛应用于香料、涂料、塑料制造等领域。
在实验室中,苯甲酸乙酯通常通过酯化反应制备得到,本文将介绍苯甲酸乙酯的制备过程。
一、实验原理苯甲酸乙酯是通过苯甲酸和乙醇之间的酯化反应制备得到的,反应方程式如下:C6H5CH2COOH + CH3CH2OH → C6H5CH2COOCH2CH3 + H2O该反应需要催化剂的存在,通常选用硫酸或盐酸作为催化剂,在适当的条件下反应可得苯甲酸乙酯。
苯甲酸乙酯的制备过程涉及到实验室中常用的反应技术和设备操作,包括重量法称取物质、等压漏斗滴加、加热反应、冷却、筛滤等步骤。
二、实验材料和设备1.苯甲酸:优级2.乙醇:优级3.盐酸:纯度为37%5.硅胶:砂纸用6.滤纸:普通过滤纸7.细口长颈漏斗:50毫升8.反应瓶:100毫升圆底瓶9.反应管:试管3个10.加热设备:油浴锅或电热板11.称量设备:称量纸、电子天平12.搅拌设备:磁力搅拌器、磁子三、实验过程①将乙醇、盐酸、苯甲酸、苯甲酸乙酯分别称量并准备好;②准备滤纸和硅胶装入漏斗中备用;③准备三个试管,其中一个加入几滴盐酸作为酯化反应结束后酸化的指示剂;①称取苯甲酸5克(计量误差不得超过0.01克)放入100毫升圆底瓶中;②加入乙醇8毫升,再加入3毫升浓度为37%的盐酸,用磁力搅拌器搅拌至混合均匀;③使用50毫升细口长颈漏斗,将苯甲酸和乙醇混合物滴入圆底瓶中;④同时以适当速率加热,使反应混合物沸腾,并搅拌20-30分钟;⑤反应结束后,将圆底瓶移至水冷却器中冷却,用水冲洗漏斗和瓶口;⑥将反应液倒入试管中,在试管中加入几滴酸性指示剂查看酯化反应是否结束,如反应完成,则指示剂从红色变成黄色。
⑦反应液中加入一小片硅胶,用滤纸过滤,将得到的苯甲酸乙酯过程中发生的不纯物质过滤,过滤后的苯甲酸乙酯置于容器中储存。
四、实验结果分析经过酯化反应合成得到的苯甲酸乙酯,可通过测量分析其理化性质验证合成品的质量和纯度。
苯甲酸乙酯制备实验的改进

改进后实验条件
01
反应温度:80-85℃
02
03
04
反应时间:2小时
原料比例:苯甲酸:乙醇 = 1:1.5(摩尔比)
催化剂:硫酸(用量为苯甲酸 质量的5%)
05
改进实验方案实施过程
实验材料与设备准备
苯甲酸、乙醇、硫酸等原料:选用高纯度原料, 确保实验质量。
分液漏斗、烧杯、玻璃棒等实验器材:清洗干燥 ,确保无杂质干扰实验。
THANKS
感谢观看
对未来实验的展望
深入研究反应机理
通过深入研究苯甲酸乙酯制备的反应机理,可以更加深入 地理解反应过程,为进一步优化实验条件提供理论依据。
探索绿色合成方法
绿色化学是当前化学研究的重要方向之一,未来可以探索 更加环保、高效的苯甲酸乙酯制备方法,降低对环境的污 染。
拓展应用领域
苯甲酸乙酯是一种重要的有机化合物,未来可以拓展其在 医药、香料等领域的应用,为人类的生产和生活带来更多 的便利和价值。
产率
实验产率也有所提高,相较于传统方法提高了约 10%-15%。
3
实验现象
实验过程中观察到反应速度更快,且反应体系更 为稳定,未出现明显比,改进后的实验方法在纯度 、产率以及实验现象方面均有显著优势。
通过对比实验数据,可以发现改进后的方法 具有更好的重复性和稳定性,实验结果更为
减少废弃物产生
采用绿色合成方法,减少实验过程中产生的废弃物和对环境的影 响。
增强安全性
避免使用有毒催化剂和高温高压条件,提高实验的安全性。
03
原实验方案回顾
原实验步骤
苯甲酸和乙醇在催化 剂存在下进行酯化反 应。
用无水碳酸钾进行干 燥处理,再次蒸馏得 到纯净的苯甲酸乙酯 。
实验五、苯甲酸乙酯合成
实验五、苯甲酸乙酯制备一、实验目的1.掌握有机酸与醇在酸催化下的酯化反应。
2.掌握减压蒸馏的原理及操作。
3. 学习分液漏斗的使用原则及操作二、实验原理有机酸与醇在酸的催化下,进行酯化反应可生成酯。
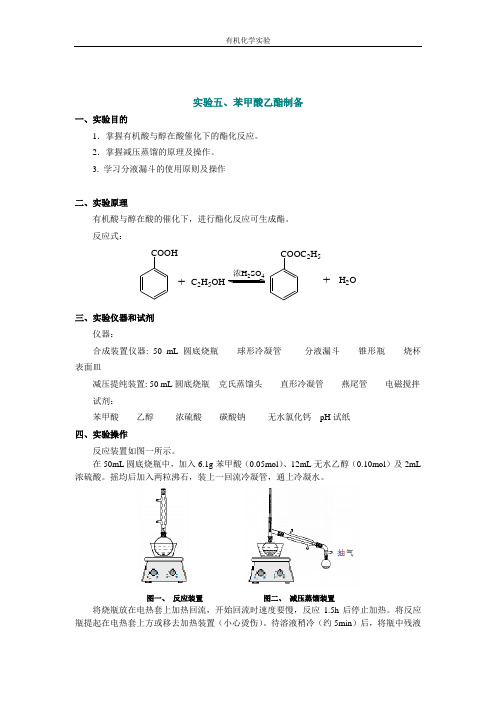
反应式: COOH +C 2H 5OH 24COOC 2H 5+H 2O三、实验仪器和试剂仪器: 合成装置仪器: 50 mL 圆底烧瓶 球形冷凝管 分液漏斗 锥形瓶 烧杯 表面皿减压提纯装置: 50 mL 圆底烧瓶 克氏蒸馏头 直形冷凝管 燕尾管 电磁搅拌 试剂:苯甲酸 乙醇 浓硫酸 碳酸钠 无水氯化钙 pH 试纸四、实验操作反应装置如图一所示。
在50mL 圆底烧瓶中,加入6.1g 苯甲酸(0.05mol )、12mL 无水乙醇(0.10mol )及2mL 浓硫酸。
摇均后加入两粒沸石,装上一回流冷凝管,通上冷凝水。
图一、 反应装置 图二、 减压蒸馏装置 将烧瓶放在电热套上加热回流,开始回流时速度要慢,反应1.5h 后停止加热。
将反应瓶提起在电热套上方或移去加热装置(小心烫伤)。
待溶液稍冷(约5min )后,将瓶中残液倒入50mL冷水的烧杯中,在搅拌下分批加入3.0-3.2g碳酸钠粉末中和到无二氧化碳气体产生(用pH试纸检验至呈中性)。
将反应混合物转移到125 mL分液漏斗中,用分液漏斗分出粗产物(上层),加入2-3g 无水氯化钙干燥4小时以上。
减压蒸馏,收集115~125℃馏分。
纯粹的苯甲酸乙酯的沸点为213℃。
安装减压蒸馏装置(图二)。
用少许棉花塞在漏斗口处,滤出干燥剂,将粗产品滤入25ml 干燥和称重过的圆底烧瓶中。
减压蒸馏,收集115~125℃/0.095Mpa馏分,对所得产品进行称重,测量体积,计算收率。
纯粹的苯甲酸乙酯的沸点为213℃。
附注: 减压蒸馏本次实验只是简单介绍,具体操作安排在实验六五、思考与讨论1.写出苯甲酸和乙醇的酸催化酯化反应的机理。
2.为使平衡趋向于生成更多的酯,有何方法?3.为什么在分液前加入碳酸钠?若采用NaOH结果会怎样?。
苯甲酸乙酯的制备

苯甲酸乙酯的制备Synthesis of Ethyl benzoate11307110279 高涵在本次实验中,我们用苯甲酸(Benzoic acid)和乙醇(Ethyl alcohol)作为反应试剂,以浓硫酸作为反应催化剂,通过酯化反应制作苯甲酸乙酯(Ethyl benzoate)。
在实验中,我们利用了水分离器装置和带水剂环己烷,通过不断将反应生成物水分离出来,达到使反应充分之目的。
最后我们用分液、萃取和蒸馏的方法提纯了粗产物苯甲酸乙酯。
In this experiment, we took benzoic acid and ethyl alcohol as reactants while concentrated sulfuric acid being the catalytic centre, then can we made ethyl benzoate based on esterification reaction. During this experiment, we used water separator and water-carrying agent hexahydrobenzene to keep water separated from the reaction, so that the reaction can go well. In the end we purified impure product using separating funnel by extraction and distillation.关键词:酯化反应;苯甲酸乙酯;水分离器;带水剂;分液漏斗;萃取;esterification reaction;Ethyl benzoate;water separator;water-carrying agent;separating funnel;extraction一、实验简介在酸催化下,羧酸与醇或酚发生脱水反应生成酯的过程称为酯化反应。
苯甲酸乙酯的制备实验报告

苯甲酸乙酯的制备高分子11-3 (09)苯甲酸乙酯(2109O H C )稍有水果气味,用于配制香水香精和人造精油;也大量用于食品中,也可用作有机合成中间体、溶剂如纤维素酯、纤维素醚、树脂等。
本实验利用酯化反应法制备,直接从苯甲酸→苯甲酸乙酯,再利用相应的物理、化学、光谱等方法鉴定它的存在!一、实验原理:直接酸催化酯化反应是经典的制备酯的方法,但反应是可逆反应,反应物间建立如下平衡:COOHC 2H 5OH COOC 2H 5H 2O因为这是反应可逆,为提高酯的转化率,使用过量乙醇(价格相对便宜)或将反应生成的水从反应混合物中除去,就可以使平衡向生成酯的方向移动。
另外,使用过量的强酸催化剂,水转化成它的共轭酸H 3O +, 没有亲核性,也可抑制逆反应的发生。
二、实验仪器及试剂:苯甲酸4.0g 过量无水乙醇10.0ml 浓硫酸 3.0ml Na 2CO 3 无水硫酸镁 8.0ml 环己烷 乙醚 分水回流装置、烧杯、加热套、玻璃棒、分液漏斗等装置图:分水回流装置 蒸馏装置三、实验步骤:1、制备样品:于50ml圆底烧瓶中加入:4.0g苯甲酸;10ml乙醇;8ml环己烷;3ml浓硫酸,摇匀,加沸石。
水浴上回流约2h,至分水器中层液体约5-6ml停止。
记录体积,继续蒸出多余的环己烷和乙醇(从分水器中放出)。
移去火源。
加水30ml,分批加入固体Na2CO3中和至中性。
除2种酸。
即硫酸、苯甲酸。
分液,水层用20ml石油醚分两次萃取。
合并有机层,用无水硫酸镁干燥。
回收石油醚,加热精馏,收集210-213摄氏度馏分。
2、鉴定:物理方法:取少量样品,用手扇动其,在闻其气味!应该稍有水果气味。
化学方法:酯与羟胺反应生成一种氧酸。
氧酸与铁离子形成牢固的品红色的络合物。
在试管中加入两滴新制备的酯,再加入5滴溴水。
有溴水的颜色不变或没有白色沉淀生成,将5滴新制备的酯滴入干燥的试管中,在加入7滴3%的盐酸羟胺的95%酒精溶液和3滴2%的NaOH溶液,摇匀后滴入7滴5%HCl溶液和1滴5% FeCl3溶液,试管内显示品红色,证明酯的存在。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
苯甲酸酯化法:以苯甲酸和乙醇为原料发生酯化反应,浓硫酸为催化剂,环己烷为带水剂制备苯甲酸乙酯
苯甲酰氯法:将苯甲酰氯与无水乙醇反应,加热会留再蒸馏即可得到苯甲酸乙酯。
现实生活中,由于苯甲酸的造价相对于苯甲酰氯较便宜,因此实验室往往选择第一种合成路线对苯甲酸乙酯进行合成。
结果与讨论:
Author:xxx
Direction :itis thematerialof benzoicacid,ethanolto prepareentylbenzoate.Andconcentrated sulfuric acid is catalyst.Cyclohexaneiswater-carryagent.Wewill understand the reaction principle ofestarificationreaction and the principle ofmanifold.Inthemeanwhile,wemust know the operation ofcircumfluence,washinginfo and liquiddry.Finally,tocalculatethe productivity ofethyl benzoate is important.
苯甲酸乙酯的制备
作者:xxx
学号:xxx
摘要:以苯甲酸、乙醇为原料,浓硫酸为催化剂,环己烷为带水剂制备苯甲酸乙酯,了解酯化反应的反应机理,掌握油水分离器的基本原理和操作,掌握回流、洗涤、液体干燥等基本操作,计算苯甲酸乙酯的产率。
关键词:苯甲酸乙酯、反应原理、带水剂、分水器
The preparation of ethyl benzoate
15:20
向烧瓶中加入物料
溶液浑浊且放热
15:40
如图搭好实验装置图
15:42
150
对溶液进行加热和搅拌,稍后调成180度
溶液的浑浊程度降低
15:43
175
溶液澄清且液面上有一层白色的泡沫
15:50
177
溶液开始回流,分水器中的液体出现分层现象
15:53
177
分水器中上层液体逐渐增多,烧瓶上也出现回流
环己烷
84.16
12ml
80.7
0.78
浓硫酸
98.08
2.5ml
330
1.84
无色透明油状液体
碳酸钠
Na
105.99
----
1600
2.54
单斜针状晶体,味涩
石油醚
195.34
15ml
30~130
0.6~0.7
无水氯化钙
110.98
-----
-----
2.152
白色硬质碎块或颗粒
苯甲酸乙酯
150.17
结论:
该试验是酯化反应,反应过程的关键是反应温度,同时该反应在增大反应限度方面是通过分离出反应产物水实现的,选择分离出水而不是苯甲酸乙酯,是因为苯甲酸乙酯的沸点在该反应的原料和可能的副产物中是最大的,如果反应温度控制不好,不仅副产物增多,若产物苯甲酸乙酯也被蒸出该反应体系,则其反应限度的增大难以实现。
液体体积为4.6ml
16:51
174
继续加热
液体仍在回流
16:53
176
分水器中的液体逐渐增多,并未分层
16:55
177
分水器中的液体上层澄清,下层较浑浊,没有明显的界面
16:58
177
分水器中的液体分为两层
将瓶中的残夜倒入盛有45ml冷水的烧杯中
液体分为两层
边搅拌边向烧杯中加入碳酸钠固体
有大量的气泡产生
主反应:
副反应:
主反应的反应机理:
反应时,刚加入反应原料时,由于苯甲酸还未完全溶解,故溶液在一定时间内一直处于浑浊的状态,后来溶液变澄清后,溶液表面有一层气泡,可能是副反应产生的亚流苏分解出二氧化硫溢出溶液,分水器中液体分为三层,最上层为带水剂环己烷和水、乙醇的共沸组分,其中乙醇的含量较多,随着反应的进行,共沸组分的量越来越多,慢慢的往蒸馏烧瓶中转移,直到最下层的水逐渐增多,最上层的液体全部进入蒸馏烧瓶中,分水器中的三层液体变成两层液体,向瓶中的残液中加入少量碳酸钠,一是除去催化剂浓硫酸,二是除去未反应完的苯甲酸,反应生成二氧化碳,因此有气泡产生。
-----
212.6
1.05
兰似的花香和果香香气的无色透明液体
乙烯
28.05
-----
-104
0.61
无色气体,略具有烃类特有的臭味
乙酸
60.05
-----
118.1
1.05
无色透明液体,有刺激性气味
乙醛
44.05
-----
20.8
0.788
无色液体,有强烈的刺激臭味
c.实验步骤
时间பைடு நூலகம்
温度(℃)
操作
现象
测试溶液的pH值
pH试纸为红色
继续加入碳酸钠固体并搅拌,直至无气体产生,测试pH值
溶液为中性
将溶液转移至分液漏斗中,并加入15ml石油醚萃取
溶液分为两层
倒出上层溶液,并加入少量无水氯化钙
溶液显浑浊
对所得溶液进行过滤操作
溶液恢复澄清
将溶液转移至蒸馏烧瓶中,搭好蒸馏装置
150
进行蒸馏,将温度设置为150
18:07
149
液体开始蒸出
18:19
159
将温度设置为170
18:30
171
没有液体蒸出,温度计温度显示为58
产量为4.81g 理论产量为7.38g
产率:4.81/7.38×100%=65.2%
误差分析:该反应为可逆反应,苯甲酸乙酯的产率不可能达到百分之百,同时,在反应的过程中,由于加入的干燥剂无水氯化钙的量太多,导致溶液过于浑浊而不得不进行过滤操作,这个过程损失的产品的合成.李公春、张万强.河北化工33卷第1期
3.有机化学实验兰大、复旦版
4.苯甲酸乙酯制备实验的改进.薛梦伟、施梅.南京晓庄学院学报
5.化学品数据库-----苯甲酸乙酯
实验部分:
a.实验仪器
直型冷凝管、球型冷凝管、蒸馏烧瓶、尾接管、分液漏斗、锥形瓶、温度计、橡胶管、磁力加热搅拌器
b.实验试剂如下表:
项目
药品名称
化学式
相对分子质量
用量
沸点
密度
性状
苯甲酸
122.12
6g
249.4
1.2659
白色单斜片状或针状晶体
无水乙醇
46.07
15ml
78.3
0.79
无色液体,有酒香
Keywords:ethylbenzoate,reactionprinciple,water-carryagent,manifod
苯甲酸乙酯是一种无色澄清液体,有芳香味,微溶于水,易溶于乙醇和乙醚,密度为1.05g/ml,沸点为212.6℃,其存在于烤烟烟叶中,天然存在于桃、菠萝、红茶中。苯甲酸乙酯常用于较重花香型中,尤其是在依兰型中,其他如香石竹、晚香玉等香型香精,亦适用于配制新刈草、香薇等非花香精中。可与岩蔷薇制品共用于革香型香精,也用做食用香料,在鲜果、浆果、坚果香精中均可适用,如香蕉、樱桃、梅子、葡萄等香精以及烟用和酒用香精中,也用作纤维素酯、纤维素醚、树脂等的溶剂。
15:57
179
分水器中的液体分为三层,中间一层较少
16:00
179
分水器中层液体教少,上层液体迅速增多
16:05
180
烧瓶中溶液的量减少
16:13
180
分水器中层液体的量逐渐增多
16:24
181
分水器上下两层液体逐渐变为一层
16:46
180
分水器中只有两层液体
16:50
停止加热,放出分水器中的液体,并测量其体积
