氨基酸的简介PPT讲稿
合集下载
氨基酸组成分析课件

色谱技术的引入为氨基酸分析打开了一扇新的大门。 1941年,Martin等运用色层法分析氨基酸,主要采用乙酰 化氨基酸在硅胶柱上或滤纸上半定量;随后,Moore、 Stein应用离子交换柱直接分离游离的氨基酸,在1958年, Spackman、Stein、Moore制造了自动化的氨基酸分析 仪,使氨基酸定量分析进入了一个崭新的阶段,至今仍是 经典的方法。
以下是几种常见的氨基酸分析方法。
《氨基酸组成分析》PPT课件
(1)茚三酮法 Spackman等人最早将茚三酮试剂运用到氨基酸组成分
析上。离子交换层析后,各种氨基酸与茚三酮反应形成紫色 化合物,最大光吸收在570nm,摩尔消光系数2X104,茚 三酮和二级胺(脯氨酸和羟脯氨酸)形成黄色产物,在 440nm检出,摩尔消光系数3X103。目前此法的灵敏度可 达100pmol,但茚三酮试剂易氧化,必须隔绝空气避光保 存,试剂本身黏性大,需要有个柱后混合器才能与氨基酸充 分反应,对仪器要求较高。
氧化反应被用来转化半胱氨酸和胱氨酸成为半胱磺酸,过 甲酸氧化反应的缺点是它会影响其他氨基酸特别是甲硫氨酸 会转变成甲硫氨酸砜,酪氨酸会降解。为克服这一 缺点,必 须准备能分析两次的样品量,一次提供半胱氨酸数据,另一 次则提供其他氨基酸的组成数据。
《氨基酸组成分析》PPT课件
第四节 氨基酸组成原位分析
《氨基酸组成分析》PPT课件
第一节 氨基酸组成分析的目的
现代分离提纯技术的发展使蛋白质操作微量化,但也给 定量带来了困难,一般很难通过常规的称量或测蛋白质溶液 在280nm的光吸收值来准确定量蛋白质。所以如果在蛋白 质酶解或测序前,取蛋白质样品的一部分进行氨基酸组成分 析,根据结果便可以推算出蛋白量的可靠值。 另外,在蛋白质测序中有时遇到测不出结果的情况, 一种可能是蛋白质的N端封闭, 另一种可能则是样品本身不是蛋白质或绝大部分是非蛋白质 物质, 解决这个问题的很好途径便是做氨基酸组成分析以确定样品 的成分。
以下是几种常见的氨基酸分析方法。
《氨基酸组成分析》PPT课件
(1)茚三酮法 Spackman等人最早将茚三酮试剂运用到氨基酸组成分
析上。离子交换层析后,各种氨基酸与茚三酮反应形成紫色 化合物,最大光吸收在570nm,摩尔消光系数2X104,茚 三酮和二级胺(脯氨酸和羟脯氨酸)形成黄色产物,在 440nm检出,摩尔消光系数3X103。目前此法的灵敏度可 达100pmol,但茚三酮试剂易氧化,必须隔绝空气避光保 存,试剂本身黏性大,需要有个柱后混合器才能与氨基酸充 分反应,对仪器要求较高。
氧化反应被用来转化半胱氨酸和胱氨酸成为半胱磺酸,过 甲酸氧化反应的缺点是它会影响其他氨基酸特别是甲硫氨酸 会转变成甲硫氨酸砜,酪氨酸会降解。为克服这一 缺点,必 须准备能分析两次的样品量,一次提供半胱氨酸数据,另一 次则提供其他氨基酸的组成数据。
《氨基酸组成分析》PPT课件
第四节 氨基酸组成原位分析
《氨基酸组成分析》PPT课件
第一节 氨基酸组成分析的目的
现代分离提纯技术的发展使蛋白质操作微量化,但也给 定量带来了困难,一般很难通过常规的称量或测蛋白质溶液 在280nm的光吸收值来准确定量蛋白质。所以如果在蛋白 质酶解或测序前,取蛋白质样品的一部分进行氨基酸组成分 析,根据结果便可以推算出蛋白量的可靠值。 另外,在蛋白质测序中有时遇到测不出结果的情况, 一种可能是蛋白质的N端封闭, 另一种可能则是样品本身不是蛋白质或绝大部分是非蛋白质 物质, 解决这个问题的很好途径便是做氨基酸组成分析以确定样品 的成分。
氨基酸分析PPT课件

人体必需的氨基酸:人体内不能合成,只 有靠食物供给的氨基酸。
各种蛋白质含氨基酸的种类和数量都各不 相同。
4
二、氨基酸的分类和命名
(一)分类 1、根据氨基酸的酸碱性
氨基酸
酸
碱
中
性
性
性
氨
氨
氨
基
基
基
酸
酸
酸
5
酸性氨基酸
二个羧基 一个氨基
天冬氨酸 谷氨酸
碱性氨基酸
一个羧基 二个或二个以上氨基
赖氨酸 精氨酸 组氨酸
H
R C COOH NH2
13
它们发生分子内酸碱反应:
两性离子
H
H
R C COOH NH2
R C COO NH3
从平衡式可知,氨基酸在溶液中的 荷电状态与溶液的pH值有关。
14
H
R
正离子
pH<pI
R
H
OH H+
R C COOH
NH3
C COOH
NH2
两性离子
pH = pI
H
C COO
NH3
OH
H+
净电荷为零 带正电荷 带负电荷
在电场中不移动
在电场中移向负极 在电场中移向正极
16
要使氨基酸达到等电状态:
中性氨基酸: pI < pH 7 酸性氨基酸: pI < pH 7 碱性氨基酸: pI > pH 7
加少量酸 加酸 加碱
17
(二)与HNO2的反应
除脯氨酸外,其它氨基酸都具有 - NH2,可与 HNO2反应,定量放出氮气( N2 )。
氨基酸分析
1
氨基酸分析在蛋白质化学和生物技术研究、 临床诊断和细胞生理学研究、营养学与卫 生保健、培育农作物优良品种、食品、制 药等领域具有非常重要的意义。
各种蛋白质含氨基酸的种类和数量都各不 相同。
4
二、氨基酸的分类和命名
(一)分类 1、根据氨基酸的酸碱性
氨基酸
酸
碱
中
性
性
性
氨
氨
氨
基
基
基
酸
酸
酸
5
酸性氨基酸
二个羧基 一个氨基
天冬氨酸 谷氨酸
碱性氨基酸
一个羧基 二个或二个以上氨基
赖氨酸 精氨酸 组氨酸
H
R C COOH NH2
13
它们发生分子内酸碱反应:
两性离子
H
H
R C COOH NH2
R C COO NH3
从平衡式可知,氨基酸在溶液中的 荷电状态与溶液的pH值有关。
14
H
R
正离子
pH<pI
R
H
OH H+
R C COOH
NH3
C COOH
NH2
两性离子
pH = pI
H
C COO
NH3
OH
H+
净电荷为零 带正电荷 带负电荷
在电场中不移动
在电场中移向负极 在电场中移向正极
16
要使氨基酸达到等电状态:
中性氨基酸: pI < pH 7 酸性氨基酸: pI < pH 7 碱性氨基酸: pI > pH 7
加少量酸 加酸 加碱
17
(二)与HNO2的反应
除脯氨酸外,其它氨基酸都具有 - NH2,可与 HNO2反应,定量放出氮气( N2 )。
氨基酸分析
1
氨基酸分析在蛋白质化学和生物技术研究、 临床诊断和细胞生理学研究、营养学与卫 生保健、培育农作物优良品种、食品、制 药等领域具有非常重要的意义。
蛋白质的构件-氨基酸(共77张PPT)

苯丙氨酸
酪氨酸
色氨酸
3、杂环aa〔2种)
组氨酸
脯氨酸
按R基的极性性质分类:
1、非极性R基aa
丙氨酸
缬氨酸
亮氨酸
异亮氨酸
苯丙氨酸 酪氨酸
蛋氨酸
脯氨酸
2、不带电荷的极性R基aa
丝氨酸
苏氨酸
酪氨酸
天冬酰胺
谷氨酰胺
半胱氨酸
甘氨酸
3、带正电荷的R基aa
赖氨酸
精氨酸
组氨酸
4、带负电荷的R基aa
天冬氨酸
逆形M流成分 Sec布hitf原f’s侧理碱〔反自响链学〕 上甲硫基:强亲核基团与烃化试剂成锍盐
氨基酸是蛋白质的根本结构单元
固定相是液体,吸附在滤纸上,将样品点在纸上,用流动相展开
K值可以用测定滴定曲线的实验方法获得
C=O + H2N CH
C=N CH
Cu2+,Fe2+,Co2+或Mn2+时,易被氧化
〔Asp+〕
COO-
CH—NH3+
CH2
COOH K2
COO-
CH—NH3+
CH2
COO-
K3
〔Asp0〕 〔Asp-〕
COO-
CH—NH2
CH2
COO-
〔Asp--〕
〔一〕氨基酸的解离
COOH
CH—NH3+
(CH2)4
NH3+
K1
〔Lys++〕
COO-
CH—NH3+
(CH2)4
NH3+
K2
〔Lys+〕
谷氨酸
〔二〕不常见的蛋白质氨基酸
氨基酸PPT课件

和平亲善
1487年
寻找黄金,发展贸易,获取商业利 益。
殖民扩张,
经济 基础
影响
封建自然经济
逐渐兴起的资本主义经济
增进了中国同亚非各国人 正面影响:加强各大陆的联系,促进
民的友谊,促进了中国与 了不同地区人民的相互融合,形成了
亚非各国的经济文化交流, 新的民族;促进了国际贸易的发展;
有助于中国人对世界的了 促进了不同区域文明之间的交流尤其
4、路线:江苏刘家港出发,经东南亚、南亚、西亚,最远到达红海沿岸和非洲东海岸地区。
5、对外贸易:
传出的物品、技术
传入的物品、技术
丝织品、瓷器、茶叶、 印花布、铁器
香料、药材、染料及大量供皇室享用 的珍珠、玛瑙、宝石、象牙等奢侈品
6、意义:是世界航海史上的壮举。促进了中国与亚非各国的经济文化交流,有 助于中国人对世界的了解
应用:分离、提纯蛋白质。
【实验1】在盛有鸡蛋清溶液的试管里,缓慢加 入饱和(NH4)2SO4溶液,观察沉淀的析出。然 后把少量带有沉淀的液体加入到盛有蒸馏水的 试管里,观察沉淀是否溶解。
4.变性
蛋白质发生化学变化凝聚成固体物质而析出。 蛋 白质在加热、紫外线、X射线、强酸、强碱、重金 属盐以及一些有机化合物如甲醛、酒精等的作用 下,均能使蛋白质发生变性,变性是个不可逆的 过程,属于化学变化。蛋白质变性后失去了原来 的可溶性,同时也失去了生理活性。 应用:杀菌消毒、农药等
【实验2】在盛有鸡蛋清溶液的试管里,缓慢加入饱和
CuSO4溶液,观察沉淀的析出。然后把少量带有沉淀的 液体加入到盛有蒸馏水的试管里,观察沉淀是否溶解。
5.水解 蛋白质在酸、碱或酶的作用下能发生水解, 水解的最终产物是多种氨基酸。天然蛋白质水解的 产物是多种α-氨基酸。
1487年
寻找黄金,发展贸易,获取商业利 益。
殖民扩张,
经济 基础
影响
封建自然经济
逐渐兴起的资本主义经济
增进了中国同亚非各国人 正面影响:加强各大陆的联系,促进
民的友谊,促进了中国与 了不同地区人民的相互融合,形成了
亚非各国的经济文化交流, 新的民族;促进了国际贸易的发展;
有助于中国人对世界的了 促进了不同区域文明之间的交流尤其
4、路线:江苏刘家港出发,经东南亚、南亚、西亚,最远到达红海沿岸和非洲东海岸地区。
5、对外贸易:
传出的物品、技术
传入的物品、技术
丝织品、瓷器、茶叶、 印花布、铁器
香料、药材、染料及大量供皇室享用 的珍珠、玛瑙、宝石、象牙等奢侈品
6、意义:是世界航海史上的壮举。促进了中国与亚非各国的经济文化交流,有 助于中国人对世界的了解
应用:分离、提纯蛋白质。
【实验1】在盛有鸡蛋清溶液的试管里,缓慢加 入饱和(NH4)2SO4溶液,观察沉淀的析出。然 后把少量带有沉淀的液体加入到盛有蒸馏水的 试管里,观察沉淀是否溶解。
4.变性
蛋白质发生化学变化凝聚成固体物质而析出。 蛋 白质在加热、紫外线、X射线、强酸、强碱、重金 属盐以及一些有机化合物如甲醛、酒精等的作用 下,均能使蛋白质发生变性,变性是个不可逆的 过程,属于化学变化。蛋白质变性后失去了原来 的可溶性,同时也失去了生理活性。 应用:杀菌消毒、农药等
【实验2】在盛有鸡蛋清溶液的试管里,缓慢加入饱和
CuSO4溶液,观察沉淀的析出。然后把少量带有沉淀的 液体加入到盛有蒸馏水的试管里,观察沉淀是否溶解。
5.水解 蛋白质在酸、碱或酶的作用下能发生水解, 水解的最终产物是多种氨基酸。天然蛋白质水解的 产物是多种α-氨基酸。
生物化学 第三章 氨基酸(共92张PPT)

Tyrosine
色氨酸
Trytophan
氨基酸的结构
芳香族氨基酸
H 2N
O
CH
C
OH
CH 2 CH 2 CH 2 NH
C
NH
NH 2
氨基酸的结构
精氨酸 Arginine
碱性氨基酸
O H 2 N CH C OH
CH 2 CH 2 CH 2 CH 2 NH 2
氨基酸的结构
精氨酸 Arginine
赖氨酸 Lysine
光性。而且发现主要是L型的(也有D型的,但很少)。
-氨基酸的分子构型
1、氨基酸的分类
各种氨基酸的区别在于侧链R基的不同。
20种蛋白质氨基酸按R的极性可分为非极性氨基酸 、极性性氨基酸、酸性氨基酸和碱性氨基酸;按R基的结 构可分为脂肪族氨基酸、芳香族氨基酸及杂环氨基酸3大 类。
氨基酸的三字母简写符号必背熟,单字母符号 要求认识。
芳香族氨基酸: Phe Trp Tyr
1、氨基酸的分类
组成蛋白质的氨基酸按其α-碳原子上侧链R的结构
2缬.氨酸-羧分基V参a为l与ine的反2应0种,20种氨基酸按R的结构和极性的不同有以下
生成烷基咪唑衍生物,并引起酶活性的降低或丧失
两种分类方法。 酪氨酸 tyrosine
Try Y
提问:大 多 数 氨 基 酸 在 中 性(pH=7) 时, 带
[质子供体]
乙酸
+ H
COOH
-
COO
+ H
CO-O
+ K1
H3N CH2
+
H3N CH2
K2
H2N CH2
Gl+y
Gl+-y
色氨酸
Trytophan
氨基酸的结构
芳香族氨基酸
H 2N
O
CH
C
OH
CH 2 CH 2 CH 2 NH
C
NH
NH 2
氨基酸的结构
精氨酸 Arginine
碱性氨基酸
O H 2 N CH C OH
CH 2 CH 2 CH 2 CH 2 NH 2
氨基酸的结构
精氨酸 Arginine
赖氨酸 Lysine
光性。而且发现主要是L型的(也有D型的,但很少)。
-氨基酸的分子构型
1、氨基酸的分类
各种氨基酸的区别在于侧链R基的不同。
20种蛋白质氨基酸按R的极性可分为非极性氨基酸 、极性性氨基酸、酸性氨基酸和碱性氨基酸;按R基的结 构可分为脂肪族氨基酸、芳香族氨基酸及杂环氨基酸3大 类。
氨基酸的三字母简写符号必背熟,单字母符号 要求认识。
芳香族氨基酸: Phe Trp Tyr
1、氨基酸的分类
组成蛋白质的氨基酸按其α-碳原子上侧链R的结构
2缬.氨酸-羧分基V参a为l与ine的反2应0种,20种氨基酸按R的结构和极性的不同有以下
生成烷基咪唑衍生物,并引起酶活性的降低或丧失
两种分类方法。 酪氨酸 tyrosine
Try Y
提问:大 多 数 氨 基 酸 在 中 性(pH=7) 时, 带
[质子供体]
乙酸
+ H
COOH
-
COO
+ H
CO-O
+ K1
H3N CH2
+
H3N CH2
K2
H2N CH2
Gl+y
Gl+-y
氨基酸PPT幻灯片课件
20
等电点(pI)
对于任何一种氨基酸来说,总存在一定的pH值,使其净 电荷为零,这时的pH值被称为等电点。pI是一个氨基酸的 特征常数。在等电点pH时,氨基酸在电场中,不向两极移 动,并且绝大多数处于兼性离子状态,少数可能解离成阳 离子和阴离子,但解离成阴、阳离子的趋势和数目相等。
21
氨基酸的主要反应性质
17
18
特殊的酸碱性质与等电点
由于氨基酸既含有碱性的氨基又含有酸性的羧 基,因此氨基酸具有特殊的解离性质,但氨基 算的碱性和酸性分别弱于单纯的胺和羧酸。一 个氨基酸分子内部的酸碱反应使氨基酸能同时 带有正负两种电荷,以这种形式存在的离子被 称为兼性离子(zwitterions)或两性离子。
19
氨基酸的两性解离
质氨基酸:含硒半胱氨酸(第21种)和吡咯赖氨酸 (第22种)
非蛋白质氨基酸——不能直接参入到蛋白质分子 之中,或者是蛋白质氨基酸翻译后修饰产物
例如:瓜氨酸、鸟氨酸和羟脯氨酸
4
氨基酸的分类
① 脂肪族 ② 芳香族 ③ 含硫族
① 极性/不带电荷 ② 碱性/酸性
疏水:非极性R基团
亲水:极性的R基团 (电中性、带负电荷、 带正电荷)
2
氨基酸的结构通式
不同的侧链基团 不同的理化性质
3
蛋白质氨基酸和非蛋白质氨基酸
蛋白质氨基酸,即标准氨基酸——在蛋白质生物 合成中,由专门的tRNA携带,直接参入到蛋白 质分子之中
共22种:20种常见+2种不常见 ① 相同的结构通式 ② 差别在侧链基团(R基团) ③ 所有的生物体都含有常见的20种;2种不常见的蛋白
5
亲水氨基酸VS疏水氨基酸
亲水氨基酸,即极性氨基酸,其R基团呈极性,一般能 和水分子形成氢键,故对水分子具有一定的亲和性。它 们包括:Ser、Thr、Tyr、Cys、Sec、Asn、Gln、Asp、 Glu、Pyl、Arg、Lys、His;
等电点(pI)
对于任何一种氨基酸来说,总存在一定的pH值,使其净 电荷为零,这时的pH值被称为等电点。pI是一个氨基酸的 特征常数。在等电点pH时,氨基酸在电场中,不向两极移 动,并且绝大多数处于兼性离子状态,少数可能解离成阳 离子和阴离子,但解离成阴、阳离子的趋势和数目相等。
21
氨基酸的主要反应性质
17
18
特殊的酸碱性质与等电点
由于氨基酸既含有碱性的氨基又含有酸性的羧 基,因此氨基酸具有特殊的解离性质,但氨基 算的碱性和酸性分别弱于单纯的胺和羧酸。一 个氨基酸分子内部的酸碱反应使氨基酸能同时 带有正负两种电荷,以这种形式存在的离子被 称为兼性离子(zwitterions)或两性离子。
19
氨基酸的两性解离
质氨基酸:含硒半胱氨酸(第21种)和吡咯赖氨酸 (第22种)
非蛋白质氨基酸——不能直接参入到蛋白质分子 之中,或者是蛋白质氨基酸翻译后修饰产物
例如:瓜氨酸、鸟氨酸和羟脯氨酸
4
氨基酸的分类
① 脂肪族 ② 芳香族 ③ 含硫族
① 极性/不带电荷 ② 碱性/酸性
疏水:非极性R基团
亲水:极性的R基团 (电中性、带负电荷、 带正电荷)
2
氨基酸的结构通式
不同的侧链基团 不同的理化性质
3
蛋白质氨基酸和非蛋白质氨基酸
蛋白质氨基酸,即标准氨基酸——在蛋白质生物 合成中,由专门的tRNA携带,直接参入到蛋白 质分子之中
共22种:20种常见+2种不常见 ① 相同的结构通式 ② 差别在侧链基团(R基团) ③ 所有的生物体都含有常见的20种;2种不常见的蛋白
5
亲水氨基酸VS疏水氨基酸
亲水氨基酸,即极性氨基酸,其R基团呈极性,一般能 和水分子形成氢键,故对水分子具有一定的亲和性。它 们包括:Ser、Thr、Tyr、Cys、Sec、Asn、Gln、Asp、 Glu、Pyl、Arg、Lys、His;
氨基酸药物PPT课件

此法优点为反应条件温和,无需特殊设备, 氨基酸不破坏,无消旋作用。缺点是水解不彻 底,产物中除氨基酸外,尚含较多肽类。工业 上很少用该法生产氨基酸而主要用于生产水解 蛋白及蛋白胨。
.
20 目 录
目前,在药用氨基酸的生产中,组氨酸、 精氨酸、亮氨酸、丝氨酸、胱氨酸及酪 氨酸仍需以水解法生产。
.
21 目 录
.
26 目 录
固定化酶
凡限制在一定的空间范围内并能连续反 复的使用的酶都称为固定化酶。
.
27 目 录
四、发酵法(直接发酵法与微生物转化法)
发酵:生物化学中称酵母无氧呼吸过程 为发酵,工业上,发酵就是微生物纯种 培养过程,实质上是利用微生物细胞中 酶的作用,将培养基中有机物转化为细 胞或其他有机物的过程。
.
48 目 录
药用赖氨酸及其复合药
L-赖氨酸盐酸盐颗粒剂
.
17 目 录
(1)酸水解法
蛋白质原料用6~10mol/L盐酸或8mol/ L硫酸于110~120℃(回流煮沸)水解 12~24h,除酸后即得多种氨基酸混合物。
此法优点是水解迅速而彻底,产物全部为L型氨基酸,无消旋作用。
缺点是色氨酸全部被破坏,丝氨酸及酪氨酸 部分被破坏,且产生大量废酸污染环境。
.
丙氨酸在稀乙醇或甲醇中溶解度较小,
且pI为6.0,故丙氨酸可在pH6.0时,用 50%冷乙醇结晶或重结晶加以精制
.
38 目 录
三、生产实例-水解法生产亮氨酸
.
39 目 录
直接发酵法生产氨基酸
按生产菌株的特性,直接发酵法可分为五类
1、野生菌株发酵法
2、营养缺陷型突变型菌株发酵法 3、氨基酸结构类似物抗性突变株发酵法 4、营养缺陷型突变菌株型兼抗性突变株发酵法 5、基因工程菌
氨基酸优秀PPT课件

调节蛋白、胺类、神经递质、嘌呤、嘧啶等
三.能源: • 17 .19 kJ/克蛋白质 • 次要作用
氮平衡(nitrogen balance): 机体摄入氮 ~ 机体排出氮
总氮平衡: 机体摄入氮 = 机体排出氮 正氮平衡: 机体摄入氮 > 机体排出氮 负氮平衡: 机体摄入氮 < 机体排出氮
总氮平衡的要求: 蛋白质最低需要量:30~50克/日 营养学会推荐量: 80克/日
假神经递质,替代多巴释放
Trp 5-羟色胺(抑制性)
大脑抑制
2 蛋白质的消化、吸收与腐败
(2)脱氨生成氨 • RCH(NH2)COOH RCH2COOH+NH3 NH3 • C=O 2NH3+CO2 NH3
• NH3 重吸收入肝
• NH3
NH4+
氨有毒性,NH3 比 NH4+易吸收,降低肠 道 pH,可减少 NH3 的吸收。
pepsin 自身激活autocatalysis
trypsin
chymotrypsinogen
chymotrypsin
2 蛋白质的消化、吸收与腐败
消化部位:胃、肠(为主)
1. 胃:胃蛋白酶(pepsin)
胃蛋白酶原 H+ 胃蛋白酶 + 6肽 (1) 最适 pH 1.5 ~ 2.5 (2)水解芳香族氨基酸及亮氨酸的羧基端 (3)凝乳作用
R4=任何氨基酸 R4=任何氨基酸 R4=任何氨基酸 R4=任何氨基酸 R2=除脯氨酸外 R6=除精、赖、脯氨酸外 R6=精、赖
O
O
O
H2N-CH-C-NH-CH---NH-CH-C-NH-CH---NH-CH-C-NH-CH-COOH
R1
R2
R3
三.能源: • 17 .19 kJ/克蛋白质 • 次要作用
氮平衡(nitrogen balance): 机体摄入氮 ~ 机体排出氮
总氮平衡: 机体摄入氮 = 机体排出氮 正氮平衡: 机体摄入氮 > 机体排出氮 负氮平衡: 机体摄入氮 < 机体排出氮
总氮平衡的要求: 蛋白质最低需要量:30~50克/日 营养学会推荐量: 80克/日
假神经递质,替代多巴释放
Trp 5-羟色胺(抑制性)
大脑抑制
2 蛋白质的消化、吸收与腐败
(2)脱氨生成氨 • RCH(NH2)COOH RCH2COOH+NH3 NH3 • C=O 2NH3+CO2 NH3
• NH3 重吸收入肝
• NH3
NH4+
氨有毒性,NH3 比 NH4+易吸收,降低肠 道 pH,可减少 NH3 的吸收。
pepsin 自身激活autocatalysis
trypsin
chymotrypsinogen
chymotrypsin
2 蛋白质的消化、吸收与腐败
消化部位:胃、肠(为主)
1. 胃:胃蛋白酶(pepsin)
胃蛋白酶原 H+ 胃蛋白酶 + 6肽 (1) 最适 pH 1.5 ~ 2.5 (2)水解芳香族氨基酸及亮氨酸的羧基端 (3)凝乳作用
R4=任何氨基酸 R4=任何氨基酸 R4=任何氨基酸 R4=任何氨基酸 R2=除脯氨酸外 R6=除精、赖、脯氨酸外 R6=精、赖
O
O
O
H2N-CH-C-NH-CH---NH-CH-C-NH-CH---NH-CH-C-NH-CH-COOH
R1
R2
R3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甘氨酸 Glycine 丙氨酸 Alanine
O
H2N CH C OH
CH3
A
(α-氨基丙酸)
一、脂肪族氨基酸(中性)
甘氨酸 Glycine
丙氨酸 Alanine
缬氨酸 Valine
O
H2N CH C OH
CH CH3
CH3
V
(α-氨基-β-甲基丁酸 )
一、脂肪族氨基酸(中性)
甘氨酸 Glycine 丙氨酸 Alanine 缬氨酸 Valine 亮氨酸 Leucine
绝大多数氨基酸是L-型氨基酸,近年来,D-型 氨基酸在哺乳动物生命活动中的意义引起了越 来越多的关注。
H
O
C
HO C H
CH2OH
L-甘油醛
-O
O
C
H3N+ C H
CH3
L-丙氨酸
O
H
C
H C OH
CH2OH
D-甘油醛
O
O-
C
H
C
NH3+
CH3
D-丙氨酸
1.2 氨基酸的分类
1.2.1、氨基酸的表示方法:
注意:
甘氨酸是唯一不含手性碳原子的氨基酸,因此 不具旋光性。
异亮氨酸分子中的α碳和β碳都是不对称碳原子, 所以异亮氨酸具有四种可能的异构体:L-异亮 氨酸、D-异亮氨酸、 L-别构异亮氨酸和D-别 构异亮氨酸。通常出现在蛋白质中的为L-异亮 氨酸。
丙氨酸、缬氨酸、亮氨酸和异亮氨酸的侧链具 有高度疏水性,在维持蛋白质的三维结构中起 重要作用。
R
H3N+ CH
COO -
氨基(-NH2)质子化为-NH3+ 羧基(-COOH)离子化为COO-
绝大多数氨基酸是L型氨基酸
α-氨基酸除R为H(甘氨酸)外,其α-碳原子 是一个手性碳原子,具有旋光性,存在着两种 不能叠合的镜像立体异构体。
将α-COO-画在顶端,垂直画一个氨基酸,然 后与立体化学参考化合物甘油醛相比较, α氨基位于α-碳左边的为L-异构体,位于右边的 为D-异构体。
S
CH3
M
( α-氨基-γ-甲硫基丁酸 )
注意:
丝氨酸和苏氨酸侧链含有β-羟基,具有伯醇和 仲醇的离子化特性。
丝氨酸的羟甲基可以参与很多酶的活性部位反 应。
苏氨酸具有两个手性碳原子,通常出现在蛋白 质中的是L-苏氨酸。
半胱氨酸在蛋白质中经常以其氧化型的胱氨酸 存在。胱氨酸是由两个半胱氨酸通过它们侧链 上的-SH氧化成共价的二硫桥连接形成的。
H
H C OH HO
-
COO
-
COO
C NH3+ H3N+ C
HH
CH
HO C H H
-
COO C NH3+ C OH
CH3
CH3
CH3
CH3
L-Threonine D-Threonine
L-allo-
D-allo-
Threonine Threonine
苏氨酸的光学异构体
一、脂肪族氨基酸(含羟基或硫)
Ser Thr Trp Tyr Val 丝苏色酪缬
1.2.2、 20种氨基酸可按其侧链分类
氨基酸的侧链可以按照它们的化学结构 分为三类,即:脂肪族氨基酸;芳香族 氨基酸;杂环氨基酸。
一、脂肪族氨基酸(中性)
甘氨酸 Glycine
O H2N CH C OH
H G
(α-氨基乙酸)
一、脂肪族氨基酸(中性)
O
H2N CH C OH CH2
CH CH3
CH3
L
(α-氨基-γ-甲基戊酸 )
一、脂肪族氨基酸(中性)
甘氨酸 Glycine 丙氨酸 Alanine 缬氨酸 Valine 亮氨酸 Leucine 异亮氨酸 Ileucine
O
H2N CH C OH
CH CH3
CH2
CH3
I
(α-氨基-β-甲基戊酸 )
氨基酸的简介课件
蛋白质是生命的表征,氨基酸是蛋白质的 构件分子。
蛋白质在结构和功能上惊人的多样性归 根结底是由20种常见氨基酸的内在性质 决定的。
这些性质包括:1)手性,2)侧链结构 及其化学功能的多样性,3)特有的酸碱 性质,4)聚合能力。
1.1 氨基酸的一般结构 1.2 氨基酸的分类 1.3 氨基酸的酸碱化学 1.4 氨基酸的特征化学反应 1.5 氨基酸的光学活性和光谱性质 1.6 氨基酸混合物的分离分析
人头发的电子显微镜照片与模型
烫发过程:
1、加还原剂(巯基乙 醇)打开二硫键。
2、加氧化剂(双氧水) 重新生成错位二硫键。
一、脂肪族氨基酸(含羟基或硫)
丝氨酸 Serine 苏氨酸 Threonine 半胱氨酸 Cysteine 甲硫氨酸 Methionine
O
H2N CH C OH
CH2 CH2
中文名,如甘氨酸、半胱氨酸等。 三字母简写:如Gly、Cys等。 单字母简写:如G、C等。
记忆技巧 (按字母顺序记忆)
Ala Arg Asp Asn 丙 精 天 天酰
Cys Glu Gln Gly 半 谷 谷酰 甘
His Ile Leu Lys 组 异亮 亮 赖 Met Phe Pro 甲硫 苯丙 脯
一、脂肪族氨基酸(酸性aa、酰胺)
天冬氨酸 Aspartate
O
H2N CH C OH CH2
CO
OH
D
α-氨基丁二酸
一、脂肪族氨基酸(酸性aa、酰胺)
天冬氨酸 Aspartate 天冬酰氨 Asparagine
O
H2N CH C OH CH2 CO
NH2
N
一、脂肪族氨基酸(酸性aa、酰胺)
天冬氨酸 Aspartate 天冬酰氨 Asparagine 谷氨酸 Glutamate
1.1 氨基酸的一般结构
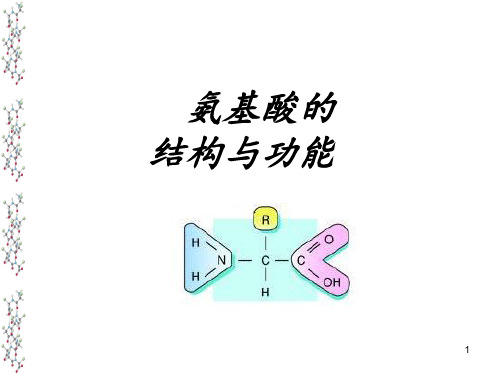
特征: α-碳(与羧酸相邻的碳,Cα )上都有一 个氨基( α-氨基酸 ),此外, Cα 还结合着一 个H原子和一个侧链基团(R)
每一种氨基酸的R都是不同的,侧链上的碳依次 按字母命名为β、γ、δ和ε 碳,分别指的是第3, 4,5和6位碳
生理条件下(pH=7附近),氨基酸呈兼 性离子形式。
一、脂肪族氨基酸(含羟基或硫)
丝氨酸 Serine
O H2N CH C OH
CH2 OH
S
( α-氨基-β-羟基丙酸 )
一、脂肪族氨基酸(含羟基或硫)
丝氨酸 Serine 苏氨酸 Threonine
O H2N CH C OH
CH OH CH3
T
( α-氨基-β-羟基丁酸 )
-
COO
H3N+ C H
丝氨酸 Serine 苏氨酸 Threonine 半胱氨酸 Cysteine
O
H2N CH C OH
CH2
SH
C
( α-氨基-β-巯基丙酸 )
-
ቤተ መጻሕፍቲ ባይዱCOO
+ H3N+ C
H
CH2
-
COO H3N+ C H
CH2
SH
SH
-
COO
H3N+ C
H
-
COO
H3N+ C
H
CH2 S S CH2
两个半胱氨酸氧化可生成胱氨酸
