高考化学一轮复习 酸碱中和滴定曲线大全 专题08 导电能力曲线练习
(全国通用)2019版高考化学一轮复习第8章水溶液中的离子平衡专项突破16滴定曲线(pH曲线)分析学案

(十六)滴定曲线(pH曲线)分析[考纲知识整合]1.中和滴定曲线(pH曲线)示例图示(以0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L盐酸为例)2.酸、碱相互滴定的两类pH曲线碱滴定酸酸滴定碱[高考命题点突破]命题点1 中和滴定的一般pH曲线分析1.已知25 ℃下CH3COOH的电离常数K=1.6×10-5。
该温度下,向20 mL 0.01 mol·L-1CH3COOH 溶液中逐滴加入0.01 mol·L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化)。
请回答下列有关问题:(已知lg 4=0.6)(1)a点溶液中c(H+)为________,pH约为________。
(2)a、b、c、d四点中水的电离程度最大的是________点,滴定过程中宜选用________作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
(3)V0________ 20 mL(填“>”“<”或“=”)。
(4)c点溶液中离子浓度大小顺序为__________________________________。
【解析】(1)电离消耗的醋酸在计算醋酸的电离平衡浓度时可以忽略不计。
由K=c2+得,c(H+)≈ 1.6×10-5×0.01mol·L-1=4×10-4mol·L-1。
c3(2)a点是醋酸溶液,b点是醋酸和少量CH3COOK的混合溶液,c点是CH3COOK和少量醋酸的混合溶液,d点是CH3COOK和KOH的混合溶液,酸、碱均能抑制水的电离,CH3COOK水解促进水的电离,所以c 点溶液中水的电离程度最大。
由于酸碱恰好完全反应时溶液显碱性,故应该选择在碱性范围内变色的指示剂酚酞。
滴定终点应在c 点以上。
(3)恰好反应时,滴入KOH 溶液的体积为20 mL ,此溶液呈碱性,当pH =7时,KOH 溶液加入的少,故V 0<20 mL 。
新高考化学一轮复习中和滴定曲线分析课件(50张)

2.强酸(碱)滴定弱碱(酸)pH曲线比较:
NaOH溶液滴定等浓度等体积的 盐酸滴定等浓度等体积的
盐酸、醋酸的滴定曲线
NaOH、氨水的滴定曲线
曲线起点不同,强酸起点低于弱酸,强碱起点高于弱碱
突跃范围不同:强酸与强碱反应突跃范围大于强酸与弱碱、强 碱和弱酸反应
3.图象题的分析步骤: (1)先看纵坐标,确定酸滴碱还是碱滴酸; (2)再看起点,确定被滴定溶液酸性或碱性的强弱; (3)找滴定终点和pH=7的中性点,判断滴定终点的酸碱性; (4)最后分析其他特殊点,如滴定一半点、过量一倍点。根据Ka1及Ka2表达式的变形,可以得到c(HX-)/c(H2X)= Ka1/c(H+),c(X2-)/c(HX-)=Ka2/c(H+)。由二元酸的Ka1>Ka2可得溶液中 c(HX-)/c(H2X)>c(X2-)/c(HX-),即lg[c(HX-)/c(H2X)]>lg[c(X2-)/c(HX-)],所 以M曲线为lg[c(X2-)/c(HX-)],N曲线为lg[c(HX-)/c(H2X)],B项正确;当N曲 线 lg[c(HX-)/c(H2X)]=0时,pH≈4.4,由c(HX-)/c(H2X)=Ka1/c(H+)可得Ka1≈ 10-4.4,同理可得Ka2≈10-5.4,A项正确;又因为Kh1=Kw/Ka1=10-9.6<Ka2= 10-5.4,所以NaHX电离程度大于水解程度,显酸性,C项正确;由图可知, 当lg[c(X2-)/c(HX-)]=0,即c(X2-)/c(HX-)=1时,pH≈5.4,又因为随着pH的 增大,c(X2-)/c(HX-)变大,所以当pH=7时,c(X2-)>c(HX-),D项错误。
【解析】选 C。20 mL 0.1 mol·L-1 的两种酸 HA、HB 中,HB 的 pH=1,所以 HB 是强酸,HA 对应的 pH 大于 1,是弱酸,化学反应遵循强酸制弱酸的原理, 向 NaA 溶液中滴加 HB 可产生 HA,故 A 正确;20 mL 0.1 mol·L-1 的酸 HA 中滴加 0.1 mol·L-1NaOH 溶液 10 mL,则 HA 酸会剩余,同时产生 NaA,a 点溶液显示酸性,溶液中微粒浓度:c(A-)>c(Na+)>c(HA),故 B 正确;滴加 NaOH 溶液至 pH=7 时,根据电荷守恒,两溶液中分别存在 c(OH-)+c(A-) =c(H+)+c(Na+),c(OH-)+c(B-)=c(H+)+c(Na+),pH=7 时,c(OH-)=c(H+),
高考化学滴定曲线图像专练(含答案)

滴定曲线图像专练1.常温下,用0.100 0 mol·L -1 NaOH 溶液滴定20.00mL0.1 mol•L -1CH 3COOH 溶液所得滴定曲线如图,下列说法正确的是A .点①所示溶液中:c (CH 3COO -)+c (OH -)=c (CH 3COOH )+c (H +)B .点②所示溶液中:c (Na +)=c (CH 3COOH )+c (CH 3COO -)C .点③所示溶液中:c (Na +)>c (OH -)>c (CH 3COO -)>c (H +)D .滴定过程中可能出现:c (CH 3COOH )>c (CH 3COO -)>c (H +)>c (Na +)>c (OH -)2.25 ℃时,在25 mL 0.1 mol·L -1的NaOH 溶液中,逐滴加入0.2 mol·L -1的CH 3COOH溶液,溶液的pH 与醋酸体积关系如图,下列分析正确的是( )A .B 点的横坐标a =12.5B .C 点时溶液中有:c(Na +)>c(CH 3COO -)>c(H +)>c(OH -)C .D 点时溶液中有:c(CH 3COO -)+c(CH 3COOH)=2c(Na +)D .曲线上A 、B 间的任意一点,溶液中都有:c(CH 3COO -)>c(Na +)>c(OH -)>c(H +)3.25℃时,向20.00 mL 的NaOH 溶液中逐滴加入某浓度的CH 3COOH 溶液。
滴定过程中,溶液的pH 与滴入CH 3COOH 溶液的体积关系如图所示,点②时NaOH 溶液恰好被中和。
则下列说法中,错误的是( )A .CH 3COOH 溶液的浓度为0.1 mol·L -1B .图中点①到点③所示溶液中,水的电离程度先增大后减小C .点④所示溶液中存在:(CH 3COOH)+c(H +)=c(CH 3COO -)+c(OH -)D .滴定过程中会存在:c(Na +)> c(CH 3COO -)=c(OH -)> c(H +)4.常温下向25 mL0.1 mol·L -1 NaOH 溶液中逐滴滴加0.2 mol·L -1的HN 3溶液(叠氮酸), pH 的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的K a =10-4.7)。
高考化学一轮复习酸碱中和滴定曲线大全专题08导电能力曲线练习练习

...............................................................................................高考化学一轮复习酸碱中和滴定曲线大全专题08导电能力曲线练习练习1.已知电导率越大导电能力越强。
常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。
下列说法正确的是A. 曲线①代表滴定盐酸的曲线B. 滴定醋酸的过程应该选择甲基橙作为指示剂C. a、b、c三点溶液中水的电离程度:c>a>bD. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)【答案】D【解析】醋酸是弱酸、盐酸是强酸。
同浓度的盐酸、醋酸溶液,盐酸的导电能力强,所以曲线①代表醋酸、曲线②代表盐酸,故A错误;氢氧化钠滴定醋酸,终点时溶液呈碱性,所以应该用酚酞作为指示剂,故B错误;a点表示醋酸钠溶液、c点表示氯化钠溶液、b点表示氢氧化钠与醋酸钠的混合液, b点水电离受到氢氧化钠的抑制,a点水电离受到醋酸钠的促进,c点氯化钠对水电离无影响,所以a、b、c 三点1 / 11...............................................................................................溶液中水的电离程度:a>c>b,故C 错误;b点表示等浓度的氢氧化钠与醋酸钠的混合液,根据电荷守恒c(Na+)+ c(H+)= c(OH-)+c(CH3COO-);根据物料守恒c(Na+)=2c(CH3COO-)+2c(CH3COOH);所以c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH),故c(OH-)>c(H+)+c(CH3COO-正确。
2024届高考化学一轮复习专题8第39讲滴定曲线和中和滴定的拓展应用能力学案

第39讲滴定曲线和中和滴定的拓展应用(能力课)1.理解滴定曲线的含义及各点的粒子浓度大小分析。
2.了解中和滴定的拓展应用——氧化还原滴定、沉淀滴定等。
两类滴定曲线的分析1.中和滴定曲线“5点”分析法1 NaOH溶液,溶液pH的变化如图所示。
2.沉淀滴定曲线分析某温度下,向10 mL 0.01 mol·L-1 PbCl2溶液中滴加0.01 mol·L-1的Na2S 溶液,滴加过程中-lg c(Pb2+)与Na2S溶液体积的关系如图所示。
⇒⎩⎨⎧①b 点恰好生成PbS K sp (PbS )=10-28②将c (Na 2S )改为0.02 mol ·L -1,b 点向左平移至V (Na 2S )=5 mL1.常温下,用氢氧化钠溶液滴定16.00 mL 稀盐酸时,溶液pH 随NaOH 溶液的体积变化如图所示。
下列说法正确的是( )A .一般用蓝色手柄滴定管量取稀盐酸B .一般选用甲基橙试液作终点指示剂C .稀盐酸的浓度为1 mol/LD .氢氧化钠溶液的浓度为0.08 mol/LD [A.蓝色手柄滴定管用于盛放碱性物质,盐酸为酸性,A 错误;B.甲基橙变色范围为酸性,氢氧化钠和盐酸生成中性氯化钠,氢氧化钠能使酚酞试液变红色,故指示剂选酚酞,B 错误;C.由题图可知,起点pH =1,氢离子浓度为0.1 mol/L ,盐酸为强酸,则稀盐酸的浓度为0.1 mol/L ,C 错误;D.HCl 和NaOH反应关系为1∶1,则氢氧化钠溶液的浓度为0.1 mol/L ×16.00 mL 20.00 mL=0.08 mol/L ,D 正确。
]2.用一定浓度的H 2SO 4溶液分别滴定体积均为20.00 mL 浓度均为0.200 mol ·L -1的Ba(OH)2、NaOH 和NH 3·H 2O 三种溶液,滴定过程中用传感器测得三种溶液的电导率如图所示。
下列说法错误的是( )A .滴定前三种溶液的pH 大小关系:Ba(OH)2>NaOH >NH 3·H 2OB .b 、d 两点的c (NH +4)大小关系:d =bC .水的电离程度:b >a >dD .H 2SO 4的浓度为0.200 mol ·L -1B[溶液电导率越大,导电能力越强,离子浓度越大,H2SO4溶液滴定Ba(OH)2溶液时,离子浓度先减小,恰好反应时,离子浓度最小,然后逐渐增大,故曲线①为Ba(OH)2,c点H2SO4溶液和Ba(OH)2溶液恰好完全反应,可知H2SO4的浓度为0.200 mol·L-1,氨水为弱电解质,H2SO4溶液滴定氨水溶液时,离子浓度先增大,恰好反应后继续加入硫酸,离子浓度继续增大,增大的程度变的缓慢一些,故曲线③为氨水溶液,则曲线②为氢氧化钠溶液。
高考化学专题训练—离子浓度关系曲线之导电能力曲线
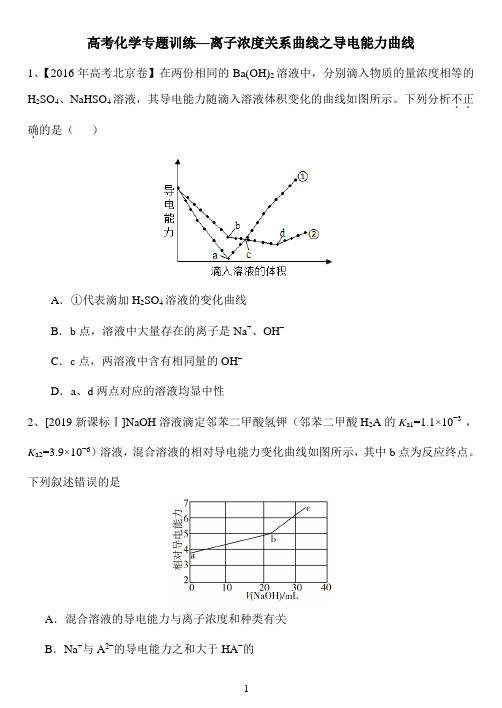
高考化学专题训练—离子浓度关系曲线之导电能力曲线1、【2016年高考北京卷】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
下列分析不正..确.的是()A.①代表滴加H2SO4溶液的变化曲线B.b点,溶液中大量存在的离子是Na+、OH–C.c点,两溶液中含有相同量的OH–D.a、d两点对应的溶液均显中性2、[2019新课标Ⅰ]NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的K a1=1.1×10−3 ,K a2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
下列叙述错误的是A.混合溶液的导电能力与离子浓度和种类有关B.Na+与A2−的导电能力之和大于HA−的C.b点的混合溶液pH=7D.c点的混合溶液中,c(Na+)>c(K+)>c(OH−)3、常温下,用一定浓度的盐酸滴定某浓度的氨水。
滴定终点附近溶液的pH和导电能力的变化如图所示(利用溶液导电能力的变化可判断滴定终点,溶液总体积变化忽略不计)。
下列说法错误的是()A.a点对应的溶液中:c(Cl-)=c(NH4+)B.a→b过程中,n(NH4+)不断增大C.c→d溶液导电性增强的主要原因是c(H+)和c(Cl-)增大D.根据溶液pH和导电能力的变化可判断:V2 < V34、25℃,向20 mL 0.1 mol·L−1 MOH溶液中滴加0.1 mol·L−1 CH3COOH溶液, 所得溶液的pH(对应曲线M)及导电能力(对应曲线N)变化如图所示。
下列叙述正确的是A.MOH是弱碱,其K b=1.0×10−21B.b点溶液中,c(CH3COO−) +c(CH3COOH)=0.1 mol·L−1C.水的离子积常数K w:b>c>aD.c点溶液中,c(CH3COO−)>c(M+)>c(H+)>c(OH−)5、下图是0.01 mol/L甲溶液滴定0.01 mol/L乙溶液的导电能力变化曲线,其中曲线③是盐酸滴定NaAc溶液,其他曲线是醋酸滴定NaOH溶液或者NaOH溶液滴定盐酸。
2024届全国高考(统考版)化学复习历年真题好题专项(滴定曲线的综合应用)练习(附答案)

2024届全国高考(统考版)化学复习历年真题好题专项(滴定曲线的综合应用)练习 1.[2022ꞏ浙江卷1月]某同学在两个相同的特制容器中分别加入20 mL 0.4 molꞏL-1 Na2CO3溶液和40 mL 0.2 molꞏL-1NaHCO3溶液,再分别用0.4 molꞏL-1盐酸滴定,利用pH 计和压力传感器检测,得到如下曲线:下列说法正确的是( )A.图中甲、丁线表示向NaHCO3溶液中滴加盐酸,乙、丙线表示向Na2CO3溶液中滴加盐酸B.当滴加盐酸的体积为V1 mL时(a点、b点),所发生的反应用离子方程式表示为:HCO-3+H+===CO2↑+H2OC.根据pH-V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点D.Na2CO3和NaHCO3溶液中均满足:c(H2CO3)-c(CO2-3)=c(OH-)-c(H+)2.用0.100 0 molꞏL-1盐酸滴定20.00 mL Na2A溶液,溶液中H2A、HA-、A2-的分布分数δ随pH变化曲线及滴定曲线如图。
下列说法正确的是( )[如A2-分布分数:δ(A2-)=c(A2-)c(H2A)+c(HA-)+c(A2-)]A.H2A的K a1为10-10.25B.c点:c(HA-)>c(A2-)>c(H2A)C.第一次突变,可选酚酞作指示剂D.c(Na2A)=0.200 0 molꞏL-13.常温下,用0.100 0 molꞏL-1的盐酸分别滴定20.00 mL浓度均为0.100 0 molꞏL-1的三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。
下列判断错误的是( )A.该NaX溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)B.三种一元弱酸的电离常数:K a(HX)>K a(HY)>K a(HZ)C.当pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-)D.分别滴加20.00 mL盐酸后,再将三种溶液混合:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-)4.[2022ꞏ河北卷]某水样中含一定浓度的CO2-3、HCO-3和其他不与酸碱反应的离子。
高考化学总复习《酸碱中和滴定及曲线》专项复习
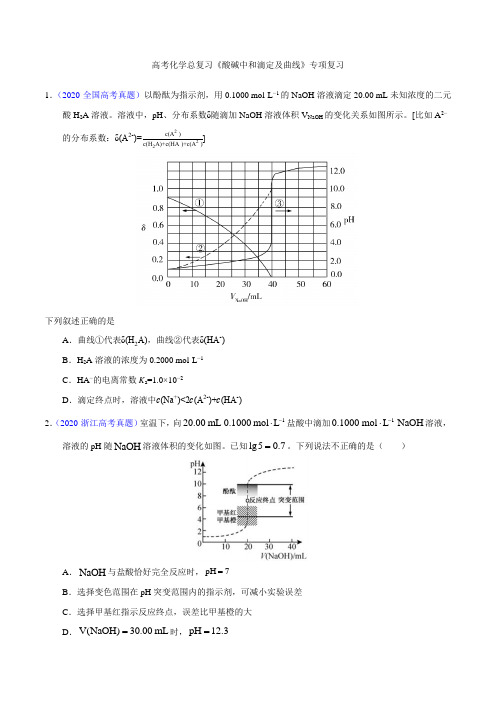
高考化学总复习《酸碱中和滴定及曲线》专项复习1.(2020·全国高考真题)以酚酞为指示剂,用0.1000 mol·L −1的NaOH 溶液滴定20.00 mL 未知浓度的二元酸H 2A 溶液。
溶液中,pH 、分布系数δ随滴加NaOH 溶液体积V NaOH 的变化关系如图所示。
[比如A 2−的分布系数:δ(A 2-)=c(A 2-)c(H 2A)+c(HA -)+c(A 2-)]下列叙述正确的是A .曲线①代表δ(H 2A),曲线②代表δ(HA -)B .H 2A 溶液的浓度为0.2000 mol·L −1C .HA −的电离常数K a =1.0×10−2D .滴定终点时,溶液中c (Na +)<2c (A 2-)+c (HA -)2.(2020·浙江高考真题)室温下,向120.00mL 0.1000mol L -⋅盐酸中滴加10.1000mol L NaOH -⋅溶液,溶液的pH 随NaOH 溶液体积的变化如图。
已知lg50.7=。
下列说法不正确的是( )A .NaOH 与盐酸恰好完全反应时,pH 7=B .选择变色范围在pH 突变范围内的指示剂,可减小实验误差C .选择甲基红指示反应终点,误差比甲基橙的大D .V(NaOH)30.00mL =时,pH 12.3=3.(2020·山东高考真题)25℃时,某混合溶液中()()133CH COOH CH COO 0.1mol L c c --+=⋅,1gc( CH 3COOH)、1gc(CH 3COO -)、lgc(H +)和1gc(OH -)随pH 变化的关系如下图所示。
K a 为CH 3COOH 的电离常数,下列说法正确的是A .O 点时,()()33CH COOH CH COO c c -= B .N 点时,a pH=-lgKC .该体系中,()()()+-13+a 0.1c H c CH COOH =mol L K +c H ⋅ D .pH 由7到14的变化过程中, CH 3COO -的水解程度始终增大4.(2019·全国高考真题)NaOH 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H 2A 的K a1=1.1×10−3 ,K a2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b 点为反应终点。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题08 导电能力曲线1.已知电导率越大导电能力越强。
常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。
下列说法正确的是A. 曲线①代表滴定盐酸的曲线B. 滴定醋酸的过程应该选择甲基橙作为指示剂C. a、b、c三点溶液中水的电离程度:c>a>bD. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)【答案】D【解析】醋酸是弱酸、盐酸是强酸。
同浓度的盐酸、醋酸溶液,盐酸的导电能力强,所以曲线①代表醋酸、曲线②代表盐酸,故A错误;氢氧化钠滴定醋酸,终点时溶液呈碱性,所以应该用酚酞作为指示剂,故B错误;a点表示醋酸钠溶液、c点表示氯化钠溶液、b点表示氢氧化钠与醋酸钠的混合液, b点水电离受到氢氧化钠的抑制,a点水电离受到醋酸钠的促进,c点氯化钠对水电离无影响,所以a、b、c三点溶液中水的电离程度:a>c>b,故C错误;b点表示等浓度的氢氧化钠与醋酸钠的混合液,根据电荷守恒c(Na+)+ c(H+)= c(OH-)+c(CH3COO-);根据物料守恒c(Na+)= 2c(CH3COO-)+2c(CH3COOH);所以c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH),故c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH),D正确。
2.电解质溶液电导率越大导电能力越强。
常温下用0.100 mol/L盐酸分别滴定10.00mL浓度均为0.100mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温下Kb=1.6×10-4)。
利用传感器测得滴定过程中溶液的电导率如图所示。
下列说法错误的是A. a、d、e三点的溶液中,水的电离程度最大的是d点B. 溶液温度c点高于d点C. b点溶液中:c[(CH3)2NH2+] +c[(CH3)2NH·H2O]=2c(Cl-)D. d点溶液中: c(H+) + c[(CH3)2NH·H2O]=c(OH-)【答案】D3.已知K b(NH3·H2O)=1.7×10-5,K a(CH3COOH)=1.7×10-5。
25℃时,向20mL浓度均为0.01mol·L-1的盐酸和醋酸的混合溶液中逐滴加入0.01mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法错误的是A. a点溶液中,c(CH3COO-)数量级约为10-5B. b点溶液中,c(NH4+) > c(CH3COOH)C. c点溶液中,c(NH4+) +c(NH3·H2O) = c(Cl-)+c(CH3COO-)+c(CH3COOH)D. c点水的电离程度小于d点【答案】D【解析】分析:氨水逐滴滴入盐酸和醋酸的混合液中,依次发生的反应为:HCl+NH3·H2O=NH4Cl、CH3COOH+NH3·H2O=CH3COONH4+H2O;盐酸为强酸,随着氨水的滴入,溶液的体积变大,溶液中离子浓度变小,溶液的电导率逐渐变小,当盐酸恰好完全反应时电导率最小,b点为等浓度的NH4Cl和CH3COOH的混合液;继续滴加氨水,弱酸醋酸与氨水反应生成强电解质CH3COONH4,溶液中离子浓度变大,溶液的电导率又逐渐变大,c点为等浓度的NH4Cl和CH3COONH4的混合液;醋酸恰好完全反应后,继续滴加氨水,氨水属于弱碱水溶液,溶液中离子浓度又变小,溶液的导电率又变小。
A项,由CH3COOH的电离平衡常数、盐酸和醋酸的浓度计算;B项,b点为等浓度的NH4Cl和CH3COOH的混合液,根据NH3·H2O的K b计算NH4+的水解平衡常数,比较NH4+的水解平衡常数与CH3COOH的K a;C项,c点为等浓度的NH4Cl和CH3COONH4的混合液,根据物料守恒判断;D项,分析c点和d点溶液的组成,根据酸、碱、盐对水的电离平衡的影响判断。
4.电解质溶液电导率越大导电能力越强。
常温下用0.100 mol·L-1盐酸分别滴定10.00 mL 浓度均为0.100 mol·L-1的NaOH 溶液和二甲胺[(CH3)2NH]溶液,利用传感器测得滴定过程中溶液的电导率如图所示(已知常温下二甲胺的电离常数K b=1.6×10-4)。
下列说法正确的是A. 曲线①代表滴定二甲胺溶液的曲线,pH=7时所消耗的V[HCl(aq)]大于10 mLB. 在a、b、c 三点溶液中,水电离出的c(H+):a<c<bC. 曲线中c点电导率最小,原因是c点溶液中导电微粒的数目最少D. d 点溶液呈酸性,且有3c(H+)=c(Cl-)+3c(OH-)【答案】D【解析】A. 曲线①代表滴定二甲胺溶液的曲线,二甲胺与盐酸反应生成的是强酸弱碱盐,根据题意要使pH=7,所消耗的V[HCl(aq)]小于10 mL,故A错;B. 在a点二甲胺与盐酸恰好反应,生成强酸弱碱盐,会发生水解,促进水的电离;在b点为酸过量,抑制水的电离;c点时NaOH和盐酸恰好完全反应,生成NaCl为强酸强碱盐,不水解,溶液显中性,所以a、b、c三点溶液中,水电离出的c(H+):b<c<a,故B错误;C. 曲线中c点NaOH和盐酸恰好完全反应,生成NaCl属于强电解质,完全电离,导电率大于a点,故C错误; D. 因为HCl+NaOH=NaCl+H2O,0.100 mol·L-1盐酸15mL与10.00 mL 浓度均为0.100 mol·L-1的NaOH 溶液混合,酸过量,所以溶液显酸性,溶液中存在下列电离H2O H++OH- NaCl=Na++ Cl-HCl= H++ Cl- 根据物料守和电荷守恒可得3c(H+)=c(Cl-)+3c(OH-),故D正确。
5.电解质溶液导电能力越强,电导率越大。
常温下用0.1000 mol/L 盐酸分别滴定10.00 mL 浓度均为0.1000 mol/L的NaOH溶液和二甲胺[ (CH3)2NH]溶液( 二甲胺在水中电离与氨相似,已知在常温下K b[(CH3)2NH·H2O] =1.6×10-4),利用传感器测得滴定过程中溶液的电导率如图所示。
下列说法正确的是A. 盐酸滴定二甲胺实验中选择酚酞做指示剂比选甲基橙误差更小B. d点溶液中:c(H+)<c(OH-)+c [(CH3)2NH2+]C. a 点溶液与d点的溶液混合后的溶液中:c[(CH3)2NH2+]<c[(CH3)2NH·H2O]D. b、c、e.三点的溶液中,水的电离程度最大的是e点【答案】B【解析】假设图中最上方的曲线为②,下方曲线为①;加入盐酸前,浓度均为的和二甲胺[]溶液,是强碱,完全电离,溶液导电能力较强,则曲线①代表滴定溶液的曲线,曲线②代表滴定溶液的曲线。
盐酸滴定二甲胺所得溶液为强酸弱碱盐,溶液水解显酸性,甲基橙的变色范围为pH:3.1~4.4之间,酚酞的变色范围:pH:8.2~10之间,因此使用甲基橙误差更小,A错误;d点溶液中,溶质为,,d点溶液中,存在质子守恒,即:,所以:c(H+)<c(OH-)+c[(CH3)2NH2+],B正确;a 点溶液溶液为氢氧化钠和氯化钠混合液(各为0.0005mol), d点的溶液为,其量为0.001 mol,两溶液混合后,溶质变为和氯化钠的混合液,溶液显酸性,所以c[(CH3)2NH2+]>c[(CH3)2NH·H2O],C错误;由分析可以知道,曲线②为的变化曲线,b点溶液中溶质为和,电离出氢氧根离子抑制水的电离,c点溶质为NaCl对水的电离无影响,d点为,水解促进水的电离,溶液e点的溶液中溶质为和HCl,HCl抑制水的电离,所以b、c、e.三点的溶液中,水的电离程度最大的是c点;D错误;正确选项B。
6.利用电导率传感器可绘制电导率曲线图,下图为用0.1mol/LNaOH溶液滴定10mL0.lmol/L 盐酸过程中的电导率曲线。
下列说法错误的是A. 电导率传感器能用于判断酸碱中和滴定的终点B. a、b、c 点的溶液中,离子浓度由大到小顺序为a>b>cC. d点所示溶液中存在:c(Cl-) +c(OH-) =c(H+) +c(Na+)D. C点电导率最小是因为此时溶液中导电微粒数目最少【答案】D【解析】A.HCl和NaOH反应方程式为HCl+NaOH=NaCl+H2O,根据图象知,从0-10mL之间,随着反应的进行,溶液中c(H+)浓度逐渐减小,溶液的电导率逐渐降低,加入溶液体积大于15mL时,溶液中氢氧根离子浓度逐渐增大,溶液的电导率增大,根据图知当恰好中和时电导率最小,所以可以电导率传感器能用于酸碱中和滴定终点的判断,选项A正确;B.电导率与导电性成正比,根据图知该点电导率最大,所以其导电性最强,离子浓度由大到小顺序为a>b>c,选项B正确;C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Cl-)+c(OH-)=c(H+)+c(Na+),选项C正确;D.溶液电导率与离子浓度成正比,c点电导率低是因为离子浓度小,而不是导电微粒数目最少,选项D错误。
答案选D。
7.电解质溶液电导率越大导电能力越强。
常温下用0.0200mol/L盐酸分别滴定10.00mL浓度均为0.0200mol/L 的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似)。
利用传感器测得滴定过程中溶液的电导率如图所示。
下列说法不正确的是A. 曲线②代表滴定NaOH溶液的曲线,在相同温度下,水的电离程度A>C>D>BB. 常温下,测得A点溶液的pH=6,则二甲胺常温下电离常数K b约为10-4C. 向二甲胺溶液中滴加盐酸10~20mL过程中:c(Cl-)>c[(CH3)2NH2+] >c(H+)>c(OH-)D. B点溶液中:c(H+)=c(OH-)+ c[(CH3)2NH2+] +2c[(CH3)2NH·H2O]【答案】C8.常温下,向10mL0.1mol·的HA溶液中逐滴滴入0.1mol·的ROH溶液,所得溶液pH及导电能力的变化如图,下列判断正确的是A. ROH在溶液中的电离方程式为B. c点由电离出的浓度最小C. b点存在:D. 若升高温度,a、d两点pH增大【答案】C9.298K时,向20mL0.1mol·L-1MOH溶液中滴加0.1mol·L-1CH3COOH溶液,所得溶液的pH及导电能力变化如图所示。
