第29届中国化学奥林匹克(决赛)实验试题的设计与解析
第29届中国化学奥林匹克化学初赛试题答案word打印版

第29届中国化学奥林匹克(初赛)试题答案(2015-8-30)1-12Pb2++H2O+3CrO42 - → Pb2(OH)2CrO4 + Cr2O72-1-26HCN +Fe + 2K2CO3 → K4Fe(CN)6 + H2↑+2CO2↑+2H2O1-35Fe(CN)64- + 61MnO4- + 188H+→ 5Fe3+ + 30NO3- +30 CO2↑+ 61Mn2+ +94H2O1-43Ag2SO4 + 4S+4H2O → 3Ag2S + 4H2SO42-1(1)乙酸,CaCO3溶解(2)硝酸或盐酸,BaCrO4溶解(3)NaOH,Zn(OH)2显两性,可溶(4)氨水,AgCl与NH3作用形成Ag(NH3)2+络离子而溶解(5)盐酸或硝酸,ZnS溶解2-2a SO2 + 6I-→ 2I3- + S + 2H2O 或SO2 + 4I-→ 2I2 + S + 2H2O2-2b SO2 +I3- + 2H2O → SO42- + 3I- + 4H+ 或SO2 +I2 + 2H2O → SO42- + 2I- + 4H+2-2c 2H2O + 3SO2→2SO42- + S + 4 H+ KI起催化作用2-3-1 A 2-3-2 可以和水形成氢键2-3-33-1-3 40.0 ×c m ×(100℃-17.2℃)=50.0g×4.18Jg-1℃-1×(17.2℃-15.2℃)c m =0.126 J g-1℃-1原子量:6×4.18Jg-1℃-1/(0.126 Jg-1℃-1)=199摩尔质量199g mol-13-1-2 设金属氧化物的化学式为M n O m,其中:金属的摩尔数:1.000/199 =5.03×10-3(mol) 氧的摩尔数:0.336/16.00 = 0.0210(mol) n:m = 1:4.17≈1:4,故化学式为MO4金属的摩尔质量=1.336×4×16.00/0.336 -4×16.00 = 190(g mol-1)3-1-3 Os或锇3-2 设有100g原料样品,高岭土:100g×10.0%/258.2g mol-1 = 0.0387mol 铝:0.0774mol 硅:0.0774mol 水铝石:100g×90.00%/78.00g mol-1=1.154mol 铝的总摩尔数:1.231mol 高岭土变成“泥”需要的铝:0.0774mol×6/5 =0.0929mol 铝的损失率:0.0929mol/1.231mol = 7.54%4-12Cr2O72- + 3C +16H+→4Cr3+ + 3CO2 + 8H2O或2K2CrO7 + 3C + 8H2SO4→4Cr2(SO4)3 + K2SO4 + 3CO2 + 8H2O4-2Cr2O72- + 6Fe2+ +14H+→6Fe3+ +2Cr3+ + 7H2O或K2Cr2O7 + 6FeSO4 + 7H2SO4→3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O4-3 土样经高温灼烧后,其中的腐殖质全部被除去,故空白实验和测定实验结果之差即为氧化腐殖质中的C所需要的Cr2O72-土样测定中剩余的Cr2O72-:0.1221×10.02 mL/6 = 0.2039 m mol空白样品中测得的Cr2O72-: 0.1221×22.35 mL/6 = 0.2039 m mol被氧化的C:(0.4548-0.2039)m mol×3/2 = 0.3764 m mol腐殖质中总碳量:0.3764 m mol/0.90 = 0.418 m mol折合的腐殖质质量:0.418 m mol×12.0g mol-1/58% =8.65mg土壤中腐殖质含量:8.65mg/0.1500g×100% = 5.8%腐殖质% = 1/6 ×10-3×0.1221×12.01/58% ÷90%÷0.1500×100% = 5.8%5-1 4个锆原子,8个钨原子 5-2 ZrW2O8 5-3 氧原子有两种类型桥氧和端氧桥氧24个,端氧8个5-4 D = zM/(V e N A)= [4×(91.22 + 183.8×2 + 16.00×8)g mol-1]/(V e N A) =4×586.8g mol-1/(0.9163×10-21cm3×6.022×1023mol-1) = 5.07 g cm-36-1 正极:C n[AlCl4] + e-→AlCl4- + C n负极:Al + 7 AlCl4-→4Al2Cl7- + 3e- 电池反应:Al + 3C n[AlCl4] + 4AlCl4- →4Al2Cl7- + 3C n6-2CH4 → C + 2H2可以促进甲烷热解(1),使得所得石墨具有多孔特性(2),有利于保持电池的可逆性能(3),抑制充放过程中正极的体积变化(4)。
“扬子石化杯”第届中国化学奥林匹克竞赛江苏赛区夏令营暨选拔赛试题含答案
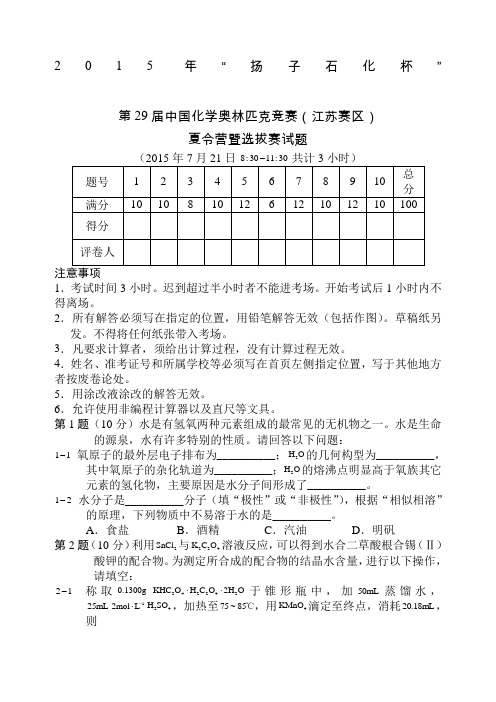
2015年“扬子石化杯”第29届中国化学奥林匹克竞赛(江苏赛区)夏令营暨选拔赛试题8:3011:30-1.考试时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
2.所有解答必须写在指定的位置,用铅笔解答无效(包括作图)。
草稿纸另发。
不得将任何纸张带入考场。
3.凡要求计算者,须给出计算过程,没有计算过程无效。
4.姓名、准考证号和所属学校等必须写在首页左侧指定位置,写于其他地方者按废卷论处。
5.用涂改液涂改的解答无效。
6.允许使用非编程计算器以及直尺等文具。
第1题(10分)水是有氢氧两种元素组成的最常见的无机物之一。
水是生命的源泉,水有许多特别的性质。
请回答以下问题:11- 氧原子的最外层电子排布为__________;2H O 的几何构型为__________,其中氧原子的杂化轨道为__________;2H O 的熔沸点明显高于氧族其它元素的氢化物,主要原因是水分子间形成了__________。
12- 水分子是__________分子(填“极性”或“非极性”),根据“相似相溶”的原理,下列物质中不易溶于水的是__________。
A .食盐B .酒精C .汽油D .明矾 第2题(10分)利用2SnCl 与224K C O 溶液反应,可以得到水合二草酸根合锡(Ⅱ)酸钾的配合物。
为测定所合成的配合物的结晶水含量,进行以下操作,请填空:21- 称取0.1300g 242242KHC O H C O 2H O ⋅⋅于锥形瓶中,加50mL 蒸馏水,25mL 12mol L -⋅24H SO ,加热至75~85℃,用4KMnO 滴定至终点,消耗20.18mL ,则()4KMnO c =____________1mol L -⋅。
22-称取0.1500g 配合物样品于锥形瓶中加50mL 蒸馏水,20mL 12mol L -⋅24H SO 。
加热至75~85℃,用上述4KMnO 溶液滴定至终点,用去20.79mL 。
2015年江西省高中学生化学竞赛暨第29届中国化学奥林匹克(初赛)选拔赛试题答案暨评分标准(高一年级)

2015年江西省高中学生化学竞赛暨第29届中国化学奥林匹克(初赛)选拔赛试题答案暨评分标准(高一年级)一、选择题(本题共20小题,每小题2分,共40分,每小题只有一个选项符合题意)1-5:CACCB 6-10:ACDBD 11-15:ACDCB 16-20:CDACC二、填空题(本题共7小题,共60分)21、(8分)(1)NO2 (1分)(2)1:2 (1分)(3)Cu+4H++2NO3—= Cu2++2NO2↑+2H2O (1分)(4)4OH—-4e—= O2↑+2H2O(2分)1.12 L (1分)(5)3CuO+2NH33Cu+3H2O+N2↑(2分)22、(9分)(1)AlO2—+CO2+ 2H2O =2Al(OH)3↓+HCO3—(1分)(2)(1分)②(1分)途径①制取的AlCl3溶液中混有NaCl杂质(1分)(3)Fe3+(1分)取少量该溶液于试管中,滴加酸性高锰酸钾,若紫色褪去,则有Fe2+。
(1分)(4)成本低不产生有毒气体(1分,其他合理答案酌情给分)(5)2Cu+2H2SO4+O2=2CuSO4+2H2O (1分)(6)蒸发浓缩冷却结晶(1分)23、(4分)(1)CO32-(1分,若答Na2CO3给0.5分)(2)D(1分)(3)CD(2分)24、(8分)(1)AB (1分)(2)抽滤(或过滤)、洗涤、灼烧(1分)(3)N2气氛下,防止Fe2+被氧化(1分)(4)不能(1分)胶体粒子太小,抽滤时容易透过滤纸(1分)(5)0.7350 (1分,若答0.735,不得分)250 mL容量瓶、胶头滴管(1分)(6)偏大(1分)25、(11分)(1)球形冷凝管(1分)冷凝回流(1分)(2)A(1分)(3)防止温度降低而使Na2S2O3·5H2O晶体析出(1分)(4)直接蒸发结晶易使Na2S2O3·5H2O熔化分解(1分)(5)A(1分)(6)①滴加足量BaCl2溶液(1分)②过滤,用蒸馏水洗净沉淀,向沉淀中加入足量稀盐酸(1分)重结晶(1分)(7)S2O32–+4Cl2+5H2O=2SO42–+8Cl–+10H+(2分)26、(10分)(1)第三周期第ⅥA族(1分)(2)离子键、非极性共价键(1分)(3)(1分);Na2SO3(答NaHS也得分)(1分)(4)Fe-6e–+8OH–= FeO42–+4H2O(1分);0.28g(1分)(5)FeO42–+3e–+4H2O=Fe(OH)3↓+5OH–(1分)(6)a (1分)O、S、Se同主族,与氢气化合的能力逐渐减弱,反应放出的热量逐渐减少,吸收能量逐渐增加(2分)27、(10分)(1)①<(1分)②B(1分)(2)12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3(2分)(3)①A(1分)2NO3–+6H2O+10e–=N2↑+12OH–(1分)②7.2(2分)(4)①增大气体与溶液的接触面积,有利于SO2与碘水反应(1分)②偏低(1分)。
第29届全国高中学生化学竞赛(决赛)理论试题

纸举监员
将营员号写 试
页
页
则
许
编计
带铅笔 书
讯
场
将 纸带 场
卫 间举
经监 员 许 离开
场场
领
题
转轴 并写
属钠
释红
研
论画
属钠
氨
应
组 为 óó
ž
区 画 该 结构 图 须 标
种类
学应
ó
氨应
种红 钠 盐 写
产
发现 压 属
单
试
电对
并说
状
条
标 学应
层电 对
题
为
将 银 电极插
测 电极 电势 吧 随 吕 气体 数
变
过 长 温时间来
变
负 并从 学热 学
针对
体
况
够
体现
发
会现
从热 学 证 对
届 国 学奥
决赛 试题
页
页 营员号
题
应 体 为气体
体 剂 发 单层
数 随压 变
剂为 体 异
气体
条
达
时
将压
变 设温
围内 尔
焓变为 值
应 哆垦
叻
应
为
体剂
个
态
转
气产
浓
为
产
测
试计 气体
发
垦
叻
压为
应
叻应
时
变为
应很
设气体 匀
间
体
为
估
该体
尔
钠
应
碘钾
应
沉
将获
进
氧气
质
构
将
与
第29届化学决赛(冬令营)模拟试题

第29届中国化学奥林匹克(决赛)理论试题模拟试题2015年4月1日武汉by TPZero第1题(20分)化学周期性原理对无机化学的研究十分重要,元素周期表能使已知的化学事实系统化和合理化,能预言新的化学事实并进一步提出富有成果的研究领域。
在周期表中处于相近位置的元素常常会有相似的性质:1-1 氮、磷、铋都是V A 族元素,它们都可以形成氯化物,例如:NCl3、PCl3、PCl5和BiCl3。
1-1-1 试解释为什么不存在NCl5及BiCl5而有PCl5。
1-1-2 请写出NCl3、PCl3、BiCl3 水解反应反应方程式。
1-1-3 热电材料Bi2Te(3-x)的性质在x 由正值变负值时会发生急剧的变化,欲使x由+0.01变到-0.01,应在5.000gBi2Te(3-x)中加碲多少克。
1-1-4 四氮化四硫在沸腾的碱性溶液中会发生歧化反应,歧化产物取决于溶液碱性的强弱。
在弱碱性溶液中,产物中硫的高氧化态阴离子为连硫酸根离子,其中含硫质量分数为50%;在强碱性溶液中,歧化产物的两个阴离子中硫均呈正整数氧化态。
在两个歧化反应中硫的低氧化态(+2 价)阴离子产物是相同的,写出这两个歧化反应的离子方程式。
1-2 比较HF 和H2O 沸点和气化热的高低和大小,并简述理由。
1-3 Be为ⅡA 族第一个元素,Zn为ⅡB 族第一个元素,它们在化学性质上亦有部分相似之处。
1-3-1 乙酸铍溶于水制得配合物A,A 中氧有2 种环境,个数比为12:1,氢只有一种环境。
分子为Td 点群,试写出其化学式并画出结构。
1-3-2 乙酸铍可由A 和无水乙酸和乙酰氯反应得到,写出该过程的化学方程式。
1-3-3 为什么乙酸铍易水解,请给出2 点最主要的原因。
1-3-4 将锌溶于等浓度等体积的少量乙酸和盐酸溶液,实验发现产生的氢气量不同,试用三个观点解释之。
1-3-5 铍对生物体有较大的毒性,请从配位化学的角度给出最主要的原因。
第2题(6分)五氧化二氮是硝酸的酸酐,可通过在低温下用五氧化二磷脱水制得。
第29届国际化学奥林匹克竞赛试题

。
第七 题
分
设 服 从理 想 气 体 定律 起 始 温 度 为
,
摩尔
压力 为
义
,
在固定外
年第
期
护
化
学
教
育
, ,
・
月
・
压力 为 到
一 ’
的条 件 下 膨 胀 至 最 终 压 力 为
,
由于 膨 胀 气 体 的 温 度 降 低 的摩 尔热 容 为
的摩尔热容为
一 ’
一 ’
。 。
,
即
一 ’,
的 正 常沸 点 的密度 为
,
摩 尔 澳代 乙 烷 反 应
生 成 的 主 要 产 物 的结 构 加
摩 尔碱
。
加
摩尔碱
。
偶联反应 意 味着 的未 成 键 电 子
会 发生 氧化双 聚 作用
试 画 出 二 聚 产 物 的结 构 式 并 标 出 该 产 物 的所 有
,
。
第四题
分
注 意 用 提 供 的绘 图 纸 来 回 答 本 题
。
是一种弱酸型指示 剂
学
教
育
年第
期
联 如下所示
,
」 ,
。 一
一
又
。。
一
基于 对上述反 应 的立体化学 的观察 问 偶 联 反 应 的机理 是 什 么
,
按 照 你所 提 出 的 机 理 假 定 硫 醇 盐 的 浓 度 和 取 代 物
,
的 浓 度 同时 增 加
倍 总反 应速率将
,
会发 生 什 么 变 化
利 用 澳 代 乙 烷 为 取 代 物 完 善 上 述 偶 联 的 模 型 研 究 试 画 出 下 列 物 质与
“扬子石化杯”第届化学奥林匹克竞赛江苏赛区夏令营暨选拔赛试题含答案

2015年“扬子石化杯”第29届中国化学奥林匹克竞赛(江苏赛区)夏令营暨选拔赛试题8:3011:30-1.考试时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
2.所有解答必须写在指定的位置,用铅笔解答无效(包括作图)。
草稿纸另发。
不得将任何纸张带入考场。
3.凡要求计算者,须给出计算过程,没有计算过程无效。
4.姓名、准考证号和所属学校等必须写在首页左侧指定位置,写于其他地方者按废卷论处。
5.用涂改液涂改的解答无效。
6.允许使用非编程计算器以及直尺等文具。
第1题(10分)水是有氢氧两种元素组成的最常见的无机物之一。
水是生命的源泉,水有许多特别的性质。
请回答以下问题:11- 氧原子的最外层电子排布为__________;2H O 的几何构型为__________,其中氧原子的杂化轨道为__________;2H O 的熔沸点明显高于氧族其它元素的氢化物,主要原因是水分子间形成了__________。
12- 水分子是__________分子(填“极性”或“非极性”),根据“相似相溶”的原理,下列物质中不易溶于水的是__________。
A .食盐B .酒精C .汽油D .明矾 第2题(10分)利用2SnCl 与224K C O 溶液反应,可以得到水合二草酸根合锡(Ⅱ)酸钾的配合物。
为测定所合成的配合物的结晶水含量,进行以下操作,请填空:21- 称取0.1300g 242242KHC O H C O 2H O ⋅⋅于锥形瓶中,加50mL 蒸馏水,25mL 12mol L -⋅24H SO ,加热至75~85℃,用4KMnO 滴定至终点,消耗20.18mL ,则()4KMnO c =____________1mol L -⋅。
22-称取0.1500g 配合物样品于锥形瓶中加50mL 蒸馏水,20mL 12mol L -⋅24H SO 。
加热至75~85℃,用上述4KMnO 溶液滴定至终点,用去20.79mL 。
第29届中国化学奥林匹克初赛试题解析

第29届中国化学奥林匹克初赛试题解析
贺麒霖;米天雄;孙桐;杨中天;余子迪;柳晗宇
【期刊名称】《大学化学》
【年(卷),期】2015(030)005
【摘要】详细介绍和评析了第29届中国化学奥林匹克初赛试题,提供了解题思路、计算过程,并提供了有关参考文章.
【总页数】20页(P69-88)
【作者】贺麒霖;米天雄;孙桐;杨中天;余子迪;柳晗宇
【作者单位】北京大学化学与分子工程学院北京100871;北京大学化学与分子工
程学院北京100871;北京大学化学与分子工程学院北京100871;北京大学化学与分子工程学院北京100871;北京大学化学与分子工程学院北京100871;北京大学化学与分子工程学院北京100871
【正文语种】中文
【中图分类】O6;G64
【相关文献】
1.第31届中国化学奥林匹克(初赛)试题解析(一) [J], 常泰维;戴昱民;方润亭;李宇轩;孙斯达;孙泽昊;王泽淳;曾承禹;张宇婷
2.第31届中国化学奥林匹克(初赛)试题解析(二) [J], 常泰维;戴昱民;方润亭;李宇轩;孙斯达;孙泽昊;王泽淳;曾承禹;张宇婷
3.第32届中国化学奥林匹克初赛试题解析(一) [J], 余子迪
4.第32届中国化学奥林匹克初赛试题解析(二) [J], 余子迪
5.第33届中国化学奥林匹克(初赛)试题解析 [J], 柳晗宇
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(Chemistry Experiment Teaching Center, University of Science and Technology of China, Hefei 230026, P. R. China)
*通讯作者,Email: zhupp@
104
Univ. Chem. 2016
Vol.31
表 1 相关物质的物理化学性质
序号 名称
化学式 相对分子质量 熔点
沸点
溶解性
备注
1 3-苯基丙烯酸 C9H8O2
2
碘苯
C6H5I
3
丙烯酸
C3H4O2
4
醋酸钯
Pd(OAc)2
5
碳酸钠
Na2CO3
June
∙竞赛园地∙
大学化学(Daxue Huaxue) Univ. Chem. 2016, 31 (6), 103-110
doi: 10.3866/PKU.DXHX201604027
103
第 29 届中国化学奥林匹克(决赛)实验试题的设计与解析
查正根 金 谷 兰 泉 黄 微 朱平平*
10 无水乙醇
C2H6O
11 酚酞溶液
C20H14O4
126.06 46.07 318.33
252 °C -117.3 °C
261 °C
-
78.5 °C
-
易溶于水 与水、醇、醚等混溶 与醇、丙酮等有机溶剂混溶
白色固体 无色液体 0.5%乙醇溶液
1.3 3-苯基丙烯酸的制备 在 100 mL 圆底烧瓶中加入 17 mg 醋酸钯(已提供)和 38 mg 三聚氰胺(已提供),再加入 50 mL 蒸馏
1 实验试题:3-苯基丙烯酸的合成及其纯度分析
1.1 实验内容简介 Heck 反应通常是指在碱性条件以及钯的催化下,不饱和卤代烃和烯烃之间发生的偶联反应。自 20
世纪 70 年代初 Heck 等发现该反应以来,化学家通过对催化剂和反应条件的不断改进使其得到广泛应 用[1,2]。该反应已成为构建 C―C 键的重要方法之一,具有简单、便捷和高效的优势,在天然产物合成、 医药以及新型高分子材料制备等领域具有重要的应用价值,Heck 因此获得了 2010 年诺贝尔化学奖[3,4]。
水,室温搅拌 6 min。 用注射器分别移取 1.7 mL 碘苯(需记录,0.015 mol)和 1.2 mL 丙烯酸(需记录,0.018 mol),加入上
述反应瓶中,再缓慢加入 3.2 g 碳酸钠(已提供),设置搅拌器温度约为 220 °C,搅拌下(转速 1000- 1300 r∙min-1)回流 45 min。移除热源,趁热进行减压过滤(注意:使用棉线手套操作!在布氏漏斗的滤 纸上垫一层硅藻土,厚度约 1 cm,现场黑板上给出说明)。将滤液转移至 250 mL 烧杯中,搅拌下滴加 约 45 mL 1 mol∙L-1盐酸,析出白色固体。减压过滤,将烧杯内所生成固体完全转移至布氏漏斗中, 并用少量冷水洗涤。收集固体产品于大称量瓶(规格 70 mm ´ 35 mm、标注营员号、空称量瓶需称重 并记录),置于烘箱中,于 110 °C 下干燥约半小时(需记录干燥起始时间),称重(需记录)并计算收率。 产品转移至小称量瓶(规格 25 mm ´ 40 mm)中,进行纯度分析。 1.4 3-苯基丙烯酸的纯度分析
(中国科学技术大学化学实验教学中心,合肥 230026)
摘要:详细介绍和评析了第 29 届中国化学奥林匹克决赛实验试题;并详细介绍了实验设计思路和筛选 过程,给出了评分规则制定的原则。
关键词:中国化学奥林匹克;化学竞赛;实验试题 中图分类号:O6;G64
The Design and Analysis of Experimental Test for the 29th Chinese Chemical Olympiad (Finals)
淡黄色液体
141 °C 与水混溶,可混溶于乙醇、乙醚 无色液体,有刺激性气味
-
不溶于水
黄棕色粉末
1600 °C水,可溶于甲醇、甘油等
白色固体
-
易溶于水、乙醇等
1 mol∙L-1
8 氢氧化钠
NaOH
40.00
318.4 °C 1390 °C
易溶于水、乙醇
无色溶液
9 二水合草酸 H2C2O4∙2H2O
Key Words: Chinese Chemical Olympiad; Chemistry competition; Experimental test
第 29 届中国化学奥林匹克(决赛)暨冬令营实验考试于 2015 年 11 月 29 日在中国科学技术大学化学 实验教学中心顺利举行。实验试题兼顾了内容的新颖性和综合性,全面考查了营员的基本实验技能和 综合分析问题能力。本文是命题小组对本届实验试题的回顾和总结。
本实验即利用水相 Heck 反应合成 3-苯基丙烯酸,并分析其纯度,主要内容如下。 (1) 3-苯基丙烯酸的合成:原位生成催化剂,在其催化作用下,以碘苯和丙烯酸为原料,在水溶 液中合成 3-苯基丙烯酸。 (2) 3-苯基丙烯酸的纯度分析:用酸碱滴定法测定自制 3-苯基丙烯酸的纯度。 1.2 相关物质的物理化学性质 表 1 列出了相关物质的物理化学性质。
Abstract: The design of experimental test for the 29th Chinese Chemical Olympiad (Finals) was introduced and analyzed. Experimental test, design ideas, the development of experimental selection and evaluation rules were provided.
6 三聚氰胺
C3H6N6
7
盐酸
HCl
148.16 204.01 72.06 224.49 105.99 126.12 36.46
133 °C -30 °C 13 °C 205 °C 851 °C 250 °C
-
300 °C 溶于乙醇、甲醇、氯仿,微溶于水 白色至淡黄色粉末
188 °C 溶于醇、醚、苯、氯仿,不溶于水
