第3章 稳态电化学研究方法
合集下载
第三章 稳态研究方法

电化学测量技术34表电化学极化与浓差极化的比较反应速率正比于表观面积与真实表面积无关反应速率与电极的真实表面积成正比电极真实表面积对反应速率的影响较低2一般比较高活化能高反应速率的温度系数无影响有影响改变界面电势分布对反应速率的影响无影响有显著的影响电极材料及表面状态对反应速率的影响不改变电流密度搅拌溶液对电流密度的影响反应产物不溶时lgididi成正比
搅拌溶液对电流密度的影响
电极材料及表面状态对反应速 率的影响
不改变电流密度 有显著的影响
i ∝ 搅拌速度
无影响
改变界面电势分布对反应速率 的影响
有影响
无影响
反应速率的温度系数
一般比较高(活化能高)
较低,2%/℃
电极真实表面积对反应速率的 反应速率与电极的真实表 反应速率正比于表观面积,与
影响
面积成正比
真实表面积无关
电化学测量技术
34
(3)欧姆极化ηR
¾影响因素
ηR = −iRL
① 溶液的电导率;
② 浓度———影响电导率;
③ 温度(主要对弱电解质),影响扩散过程和离子导电过程。 ④ 电极间距 ¾特点 ① 跟随性;
② ηR与i成正比。
电化学测量技术
35
三、控制电流法与控制电位法(稳态测量)
控制电流(电位)法:控制流经研究电极的电流(研究 电极的电位),按人为规律发生变化,同时测量极化电位 (电流)的方法。
i0→∞
理想不极化 电极 完全“可逆”
电极电势不 会改变
电化学测量技术
20
实际稳态极化曲线与其特征区域划分:
EF—新反应区
DE—扩散控制区
CD—混合控制区 BC—强极化区(Tafel区)
AB—弱极化区 OA—线性区
搅拌溶液对电流密度的影响
电极材料及表面状态对反应速 率的影响
不改变电流密度 有显著的影响
i ∝ 搅拌速度
无影响
改变界面电势分布对反应速率 的影响
有影响
无影响
反应速率的温度系数
一般比较高(活化能高)
较低,2%/℃
电极真实表面积对反应速率的 反应速率与电极的真实表 反应速率正比于表观面积,与
影响
面积成正比
真实表面积无关
电化学测量技术
34
(3)欧姆极化ηR
¾影响因素
ηR = −iRL
① 溶液的电导率;
② 浓度———影响电导率;
③ 温度(主要对弱电解质),影响扩散过程和离子导电过程。 ④ 电极间距 ¾特点 ① 跟随性;
② ηR与i成正比。
电化学测量技术
35
三、控制电流法与控制电位法(稳态测量)
控制电流(电位)法:控制流经研究电极的电流(研究 电极的电位),按人为规律发生变化,同时测量极化电位 (电流)的方法。
i0→∞
理想不极化 电极 完全“可逆”
电极电势不 会改变
电化学测量技术
20
实际稳态极化曲线与其特征区域划分:
EF—新反应区
DE—扩散控制区
CD—混合控制区 BC—强极化区(Tafel区)
AB—弱极化区 OA—线性区
稳态研究方法ppt课件

2.2.1 各种类型的极化和过电 为位了便于讨论,假定电化学反应为简
单的电荷传递反应
One R
(因2-5为) 稳态电流全部由于电极反应
所产生,所以i与反应速度υ成正
比,即: i n F n F i i n F k fc O 0 n F k b c R 0 i0 e R n T F e R n T F (2-6)
Rη 可 视 为 三 个 电 阻
,
RT nF
1 i0
, RT
nF
1
id
O
和RT nF
1
id R
的串联。对于可逆电极,即i0远
大于(id)O和(id)R时,Rη决定于后两项稳态
2.2.1 各种类型的极化和过电
位
整理后得
除 Rct了:电称 化为R n 学电F T 极荷ii0化传 和递浓电 i差阻 极。R n F T 化i1 0 外 ,R c t还有(欧2-1姆8) 极化。
内的第二可略,因此
整理
i
i0
1idiO
nF e RT
(2-13)
得
R nT Flnii0R nT FlnididO O i
(2-14)
(2-14)式的等号右边二项分别表示电 化e 学极
化过电 c 位 和浓差过电位 ,即:
2.2.1 各种类型的极化和过电
位
e
RT
nF
ln
i0 i
(2-15)
c
RT
又根据法拉第定律:
所以有:
i nFf nFDcx
i nFDOddcOxx0
对稳态系统,是常数,与x无关,所以上式极化电流可以写成:
inFOD cxOnFcO D 0cO s
电化学研究方法(2014)(1)解析

为什么我这里用扩散方程?根据是什么?
• Laplace逆变换用卷积定理得到:
cO (o, t ) c
b O
1 nF DO
t
o
i( ) d t
cR (o, t )
1 nF DR
t
o
i( ) d t
• 得:
b i nFco DonF / RT
Ir
b i p 0.4463 nFcO DOnF / RT
φ(t)
i
下降,相反的作用共同造成了电流峰。
问题
• 为何超电势变大,电流反而下降? • 如果扫速加大,电流应如何变化?为什么?
2、扫描速度对响应曲线的影响
i υ
φ(t)
3、双电层充电电流始终存在
j jc jr
dCd dQ d jc Cd d dt dt
d v ,时,jc:常数 dt
7.5 线性扫描电位实验
• 与电势阶跃不同点在于电位是时间的线性 函数,数学处理更复杂。 1.溶液浓差过程:
平面电极上反应:
kf
O + ne
⇌
R
kb
• 扩散方程为:
cO ( x, t ) cO ( x, t ) DO 2 t x
2
cR ( x, t ) 2 c R ( x, t ) DR t x 2
• 25℃时: •
b i p (2.69105 )n3/ 2 Do cO
D. RL→0,电极表面无高阻膜; E. 某电位下测Rr、Cd是近似值。
线性电势扫描法(伏安法)
控制研究电极的电势,按线性规律变化,即 d ,同时记
dt
录 j ~ t 、 j ~ 曲线,不受电解池阻抗的影响。
• Laplace逆变换用卷积定理得到:
cO (o, t ) c
b O
1 nF DO
t
o
i( ) d t
cR (o, t )
1 nF DR
t
o
i( ) d t
• 得:
b i nFco DonF / RT
Ir
b i p 0.4463 nFcO DOnF / RT
φ(t)
i
下降,相反的作用共同造成了电流峰。
问题
• 为何超电势变大,电流反而下降? • 如果扫速加大,电流应如何变化?为什么?
2、扫描速度对响应曲线的影响
i υ
φ(t)
3、双电层充电电流始终存在
j jc jr
dCd dQ d jc Cd d dt dt
d v ,时,jc:常数 dt
7.5 线性扫描电位实验
• 与电势阶跃不同点在于电位是时间的线性 函数,数学处理更复杂。 1.溶液浓差过程:
平面电极上反应:
kf
O + ne
⇌
R
kb
• 扩散方程为:
cO ( x, t ) cO ( x, t ) DO 2 t x
2
cR ( x, t ) 2 c R ( x, t ) DR t x 2
• 25℃时: •
b i p (2.69105 )n3/ 2 Do cO
D. RL→0,电极表面无高阻膜; E. 某电位下测Rr、Cd是近似值。
线性电势扫描法(伏安法)
控制研究电极的电势,按线性规律变化,即 d ,同时记
dt
录 j ~ t 、 j ~ 曲线,不受电解池阻抗的影响。
电化学研究方法及试验天津大学研究生eLearning平台ppt课件

精选课件ppt
7
《电化学》内容,吴辉煌 主编, 化学工业出版社,2006年1月
共有8章 • 固体/电解液界面区的结构与性质 • 电子传递理论 • 电化学催化 • 有机电化学和生物电化学 • 光电化学 • 电化学沉积与微建造技术 • 固态电化学 • 电化学原位实验技术
精选课件ppt
8
《应用电化学》内容
1800 尼克松发明电解水
1833 法拉第定律发现
(戴维/法拉第\\霍普金斯/麦克斯韦)
1870 亥姆荷茨提出双电层概念
1889 能斯特提出电极电位公式
1905 塔菲尔提出塔菲尔公式
精选课件ppt
12
二、电化学发展缓慢(20世纪上半叶)
• 电化学家企图用热力学方法解决一切电化学问题,遭到失败。
• 热力学一、二、三定律,化学平衡理论
• 非平衡热力学 薛定谔/普利高津
“混沌理论(Chaos Theory) ”之父罗伦兹(Edward Lorenz) 四月十六 日在其位于美国麻省的家中逝世,终年九十岁。“混沌理论”是在数学 和物理学中,研究非线性系统在一定条件下表现出的现象的理论。 “一 九六一年冬季的一天,罗伦兹在计算机上进行关于天气预报的计算。为 了考察一个很长的序列,他走了一条捷径,没有令计算机从头运行,而 是从中途开始.他把上次的输出直接打入作为计算的初值,然后他穿过 大厅下楼,去喝咖啡。一小时后他回来时,发生了出乎意料的事,他发 现天气变化同上一次的模式迅速偏离,在短时间内,相似性完全消失了。 进一步的计算表明,输入的细微差异可能很快成为输出的巨大差别”。 提出 “蝴蝶效应(Butterfly Effect)。罗伦兹认为,人类本身都是非线性 的:与传统的想法相反,健康人的脑电图和心脏跳动并不是规则的,而 是混沌的,混沌正是生命力的表现,混沌系统对外界的刺激反应,比非 混沌系统快得多。
电化学研究方法第三章
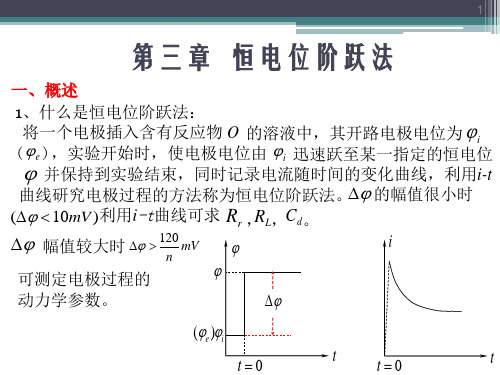
(3-2)
反应还没开始,溶液中反应物 O 的浓度均匀分布,为本体浓度
ii:边界条件:a, 半无限边界条件:
X
0 CO (, t ) CO
(3-3)
X ,可以理解为,离电极表面无穷远处,不出现浓度极化。
7
b, 电极表面边界条件:从极化条件,电化学性质两方面来分析 之一、极化条件:对于浓差极化时,当电流通过时,电极表面的 电化学平衡基本上没有受到破坏,维持恒定的电极电位,反应物 粒子表面浓度维持不变,即
根据误差函数的性质③,OL的斜率为 。
2
15
从图中可以看出,当L点的纵坐标为1时,
0 C C O O 1 L 1
应有
X 2 2 DO t
1 2 X 2 DO t
2
O
2
X
4 DO t
X 2 Dot
∴
∴
X DOt
定义:在电极表面浓度梯度为一恒定值的液层厚度称为扩散层 的有效厚度。 表达式:用δ 表示, DOt
X erf ( ) 2 DOt 0 CO ( X , t ) CO 1 X erfc ( ) 2 D t R 0 CR ( X , t ) CR 1
3-11-a
3-11-b
(3 7)
δ也是t的函数。
∴在电极表面附近有扩散层总厚度 X ,也有扩散层的有效厚度δ 。
16
X 4 DOt 总厚度大于有效厚度,有效厚度是假设的,浓度梯度
DOt 为常数,δ也与t有关,不是常数。
显然随着时间的延长,δ越来越大,表明在非稳态扩散过程中, 电极表面浓度变化涉及的范围愈来愈广。 电极表面任一点的浓度 CO 随t的延长而下降,当 X 时, 任一点浓度浓度等0,∴平面电极上,单纯依靠扩散很难建立 稳态传质过程。
《电化学研究方法》课件

《电化学研究方法》ppt课件
目录
• 电化学简介 • 电化学研究方法 • 电化学测量技术 • 电化学研究实例
01 电化学简介
电化学的定义
定义
电化学是研究电和化学反应相互关系的科学,主要研 究电能和化学能之间的相互转化。
起源
电化学起源于18世纪末,随着电池和电解的发展而兴 起。
学科交叉
电化学涉及到物理学、化学和工程学等多个学科领域 。
谱学电化学方法
总结词
谱学电化学方法利用光谱技术来研究电极表面发生的反应,主要包括紫外-可 见光谱、红外光谱、拉曼光谱等。
详细描述
通过这些光谱技术可以获取电极表面反应产物的结构和组成信息,从而深入了 解电极反应过程和机理。谱学电化学方法具有高灵敏度和高分辨率的优点,因 此在研究复杂电极反应过程中具有重要应用价值。
生物系统的电化学机 理探究,如生物电的 产生和作用机制等。
THANKS FOR WATCHING
感谢您的观看
总结词:利用电化学方法研究金 属材料的腐蚀行为,探究腐蚀机 理,评估材料的耐腐蚀性能。
耐腐蚀性能评估,如金属涂层、 缓蚀剂等防腐措施的效果。
实例三:光电化学研究
详细描述
光电转换机理研究,如光生载流 子的分离、传输和收集等;
总结词:利用电化学方法研究光 电转换材料的光电性能,探究光 电转换机理,提高光电转换效率 。
详细描述
通过测量电化学系统的阻抗随正弦波 频率的变化,可以得到系统的等效电 路和相关参数,进而分析电极界面双 电层、电荷转移和扩散过程。
循环伏安法技术
总结词
循环伏安法技术是一种用于研究电化学 反应可逆性和电化学反应机理的方法。
VS
详细描述
通过在电极上施加一系列的电压扫描,可 以观察到电流随电压变化的响应,从而判 断电化学反应的可逆性、反应机理以及反 应产物。
目录
• 电化学简介 • 电化学研究方法 • 电化学测量技术 • 电化学研究实例
01 电化学简介
电化学的定义
定义
电化学是研究电和化学反应相互关系的科学,主要研 究电能和化学能之间的相互转化。
起源
电化学起源于18世纪末,随着电池和电解的发展而兴 起。
学科交叉
电化学涉及到物理学、化学和工程学等多个学科领域 。
谱学电化学方法
总结词
谱学电化学方法利用光谱技术来研究电极表面发生的反应,主要包括紫外-可 见光谱、红外光谱、拉曼光谱等。
详细描述
通过这些光谱技术可以获取电极表面反应产物的结构和组成信息,从而深入了 解电极反应过程和机理。谱学电化学方法具有高灵敏度和高分辨率的优点,因 此在研究复杂电极反应过程中具有重要应用价值。
生物系统的电化学机 理探究,如生物电的 产生和作用机制等。
THANKS FOR WATCHING
感谢您的观看
总结词:利用电化学方法研究金 属材料的腐蚀行为,探究腐蚀机 理,评估材料的耐腐蚀性能。
耐腐蚀性能评估,如金属涂层、 缓蚀剂等防腐措施的效果。
实例三:光电化学研究
详细描述
光电转换机理研究,如光生载流 子的分离、传输和收集等;
总结词:利用电化学方法研究光 电转换材料的光电性能,探究光 电转换机理,提高光电转换效率 。
详细描述
通过测量电化学系统的阻抗随正弦波 频率的变化,可以得到系统的等效电 路和相关参数,进而分析电极界面双 电层、电荷转移和扩散过程。
循环伏安法技术
总结词
循环伏安法技术是一种用于研究电化学 反应可逆性和电化学反应机理的方法。
VS
详细描述
通过在电极上施加一系列的电压扫描,可 以观察到电流随电压变化的响应,从而判 断电化学反应的可逆性、反应机理以及反 应产物。
电化学研究方法-001-4

位,使①②③过程退居次要地位。 方法:电导池用铂黑电极,加速电化学反应速度,
加大双电层电容,提高交流电频率。 发展各种暂定方法:
测量电化学反应速度:10-2~10cm.s-1 分析灵敏度:10-5M~10-8M
理论上必须深刻认识各种过程,方法上必须不断创新。
1.2 电化学研究方法的主要组成部分
三个主要组成部分:
上述基本过程的地位随具体条件而变化,因此总过 程的主要矛盾也会随之变化,具体情况要具体分析。
基本原则: 为了有效地研究某一基本过程,必须创造条件使
该过程在电极总过程中占主导地位或主要地位,使 该过程的主要矛盾成为电极总过程的主要矛盾,规 定着总过程的发展,这是现代各种电化学研究方法 所依据的基本原则。 例如:测溶液的电阻或电导,必须使④过程占主导地
绪言 电化学测试方法和仪器 电化学数学方法 稳态研究方法 暂态研究方法总论 控制电流的研究方法 控制电位的研究方法 电化学阻抗谱 光电化学方法 光谱电化学
第一章 绪言
1.1 从电极过程存在的矛盾看电化学研究方法
电极过程——
多复步杂骤各种矛盾抓主要矛盾
电极总过程——基本过程
①电化学反应(电荷传递反应)过程 ②反应物和产物的传质过程 ③电极界面双电层充放电过程 ④离子及电子的电迁移/电导过程 ⑤电极表面的吸、脱附过程 ⑥晶体生长过程 ⑦伴随的化学反应
计算某些参数。
计算机模拟解析:数字模拟、等效电路模拟
• 计算机最优化曲线拟合:
•
建立方程组采用拟合方法求出最佳的待
•
定电化学参数。
结合化学热力学、动力学、结构化学等知识深 入研究电极历程。
配合非电化学实验技术:表面技术、光谱技术 等、X线、电子能、显微技术、 示踪原子等。
加大双电层电容,提高交流电频率。 发展各种暂定方法:
测量电化学反应速度:10-2~10cm.s-1 分析灵敏度:10-5M~10-8M
理论上必须深刻认识各种过程,方法上必须不断创新。
1.2 电化学研究方法的主要组成部分
三个主要组成部分:
上述基本过程的地位随具体条件而变化,因此总过 程的主要矛盾也会随之变化,具体情况要具体分析。
基本原则: 为了有效地研究某一基本过程,必须创造条件使
该过程在电极总过程中占主导地位或主要地位,使 该过程的主要矛盾成为电极总过程的主要矛盾,规 定着总过程的发展,这是现代各种电化学研究方法 所依据的基本原则。 例如:测溶液的电阻或电导,必须使④过程占主导地
绪言 电化学测试方法和仪器 电化学数学方法 稳态研究方法 暂态研究方法总论 控制电流的研究方法 控制电位的研究方法 电化学阻抗谱 光电化学方法 光谱电化学
第一章 绪言
1.1 从电极过程存在的矛盾看电化学研究方法
电极过程——
多复步杂骤各种矛盾抓主要矛盾
电极总过程——基本过程
①电化学反应(电荷传递反应)过程 ②反应物和产物的传质过程 ③电极界面双电层充放电过程 ④离子及电子的电迁移/电导过程 ⑤电极表面的吸、脱附过程 ⑥晶体生长过程 ⑦伴随的化学反应
计算某些参数。
计算机模拟解析:数字模拟、等效电路模拟
• 计算机最优化曲线拟合:
•
建立方程组采用拟合方法求出最佳的待
•
定电化学参数。
结合化学热力学、动力学、结构化学等知识深 入研究电极历程。
配合非电化学实验技术:表面技术、光谱技术 等、X线、电子能、显微技术、 示踪原子等。
电化学研究方法

2. 循环伏安法
b
a
a
t i
在很低的扫描速度下,当
电极反应可逆时,
Ep
(1)相对应的峰电流相等, 反应电量相等; (2)Ep = 2.3RT/nF
循环伏安法的应用 1. 研究电化学反应的可逆性,尤其是二次电池的 反应可逆性和循环稳定性;
2. 研究多电子反应,求出反应电子数;
3. 与恒电流法配合,研究电极反应的相变化,例 如,金属Sn, 石墨碳的多种含锂化合物(LiC18, LiC12, LiC6)。
3. 交流阻抗法 电池和电解池的等效电路
Cd Rl
Zf
实际的电化学系统中,法拉第阻抗包括反应电阻Rr和 浓差极化引起的Warburg阻抗Zw.
Cd Rl
Rw = -0.5 Cw = -0.5 /
Zf
Rw Cw
= RT/ [n2F2Co(2Do)0.5]
Z''
B
Cd = 1/BRr
Levich通过解稳态条件下的流体力学方程: 在非极限情况下:I = 0.62nFAD2/3-1/61/2(Co-Cs) 在极限条件下: IL = 0.62nFAD2/3-1/61/2Co 其中, 为介质的动力粘度, = 粘度/密度
i
IL 1/2
D,
四、电化学研究方法
1、稳态极化曲线测量:
一般采用三电极体系,采用慢速动电流扫描或慢速动电位扫 描法。若有电流极大值,则必须用动电位扫描。
曲线类型:i ~ E, i ~ , i ~ log 慢扫描近稳态条件下的测试可以防止电流或电位的迟后效应, 也能避免双电层充电电流的影响。
为了提高电位的测试精度,需要消除研究电极与参比电极之 间的欧姆电位降,主要的方法有:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电化学研究方法及实验课程
第3章 稳态电化学研究方法
孟惠民
§3.1 稳态极化曲线与动力学方程式 §3.2 稳态极化曲线测定的注意事项
§3.1 稳态极化曲线与动力学方程式
一、电极的极化
1、电极的极化:有电流通过电极时,电极电位偏离 平衡电位(或稳定电位)的现象。
2、阴极极化:电极电位偏离平衡电位向负移。 3、阳极极化:电极电位偏离平衡电位向正移。 4、极化电位:有电流通过时的电极电位。 5、静止电位:无电流通过时的电极电位,包括平衡
m S t
D
C X
x0
设电极反应为:O ne R
在稳态扩散条件下,
C x
为常数,
x0
即:
C x
x0
C0
Cs
扩散层有效厚度
得稳态扩散电流密度:
i扩=
nFD
C x
x0
nFD
C0
Cs
2、恒电位法:给定电极电位,测量电流密度,得到 电流密度与电极电位的关系曲线。
j f()
3、稳态法:测定电极过程达到稳定状态后的 电流密度与电极电位的关系。
4、暂态法:测定电极过程未达到稳定状态的 电流密度与电极电位的关系,包含时间因素 的影响。
控制电流法与控制电位法
• 稳态法分为控制电流法与控制电位法。
id
1
Cs C0
或:
Cs
C0
1
ik id
• 因假定扩散过程为整个电极过程的控制步骤,也就意味
着电极反应本身仍处于可逆状态,能斯特公式仍适用。
因此,在电极上有电流通过时,反应产物生成独立相
(不可溶)时的电极电位为 : 0 RT ln Cs
电化学极化:由于电极表面得、失电子的电化 学反应的迟缓,而引起的电极电位偏离平衡 电位(稳定电位)的现象。
二、极化曲线
• 电极电位(或过电位)与电流密度之间的 关系画成曲线叫做极化曲线
三、极化曲线的测量
1、恒电流法:给定电流密度,测量电极电位,得到 电极电位与电流密度的关系曲线。 f(j)
电位和稳定电位。
6、过电位:在一定电位下,电极电位与平衡电位的
差值。
平
过电位取正值:
c 平 c
a a 平
7、极化值:有电流通过时的电极电位(极化电位) 和无电流通过时的电极电位(静止电位)的差值。
浓差极化和电化学极化
浓差极化:由于液相传质步骤的迟缓,使得电 极表面反应离子的浓度低于溶液本体浓度, 造成电极电位偏离平衡电位(稳定电位)的 现象。
nF
代入Cs得:
0
RT nF
ln C0
RT nF
ln
1
ik id
未发生浓差极化时的平衡电位 :平 0 RT ln C0
nF
可得:
• 过电位存在是净反 应发生的必要条件。
0,j 0
实际稳态极化曲线与其特征区域划分
EF—新反应区
DE—扩散控制区 CD—混合控制区 BC—强极化区(Tafel区) AB—弱极化区 OA—线性区
线性极化方程式—线性极化测量技术 低过电位区(线性极化区OA)
• 当 很小时,
j
j
0
• 对于极化曲线中有电流极大值的情况,只能用恒电位法,如测定 具有阳极钝化行为的阳极极化曲线时,由于这种极化曲线具有S 形,对应一个电流有几个电位值。若用恒电流法只能测得正程曲 线ABFF,或返程曲线FEDA,不能测得真实完整的极化曲线。用 恒电位法则可测得完整的阳极钝化曲线。
• 反之,如果极化曲线中有电位极大值exp(
F
RT
)
exp(
F
RT
)
由:
jk
j
j
j
0
exp(
nF
RT
k
)
exp(
nF
RT
k
)
ja
j
j
j
0
exp(
nF
RT
a
)
exp(
nF
RT
a
)
得:
•
• 由将实 验可测得lg不同作对 下图的,得iA一和直ik线,,求直出线相的应斜的率 。
就是 ,即
1 。 1
bk
bA
而:
•
• 可见,由作图法求得 后,可得 bk和bA
进一步可获得 α 和 β 。
且
1 bk
1 nF
2
2.3RT
1 lg ik n iA
1 bA
1 nF
2
2.3RT
1 lg ik
iA
•所以在弱极化区 20 ~ 70mV ,也可用恒电位
• 当扩散步骤为控制步骤时,扩散速度即为电极反应速度, 由于扩散速度“缓慢”而引起的极化就是浓差极化。
ik
i扩=nFD
C0 Cs
• 当 Cs=0 时,扩散电流达到极大值,称为极限扩散电流
此时的浓差极化为完全浓差极化:
nFDC 0
id
可得:
ik
nFDC 0
1
Cs C0
(Butler—Volmer)
密度
宏观量 微观量
交换电流密度:当 平 时 j j
j0
j
j
nFKCO (1-α) ·CRα
• CO 、·CR、:反应物、生成物的浓度,所以 j 0 与浓度有关
• K:电极反应标准速度常数,即当电位为标准平衡电位时,反应物的活 度为1时电极反应的速度,单位为cm/s。特点:与浓度无关,比较方便。
RT
c
)
氧化反应
j
j
0
exp(
nF
RT
a
)
α,β:传递系数 ,α + β = 1
稳态电化学极化基本方程式:
由 j j净
有
外电流 或电极 反应净 速度
电极上 氧化还 原电流 的差值
j
j
0
exp(
F
RT
) exp( F
RT
)
巴特勒-伏尔摩方程
交换 电流
大约相当于 <<
50 mV n
线性区域范围(低过电位条件)与体系交换电流密度相关
当 j j0
时
j
j ,电极反应近似可逆,近平衡状态。
j 0.1A / cm2
j j
j
9.95
A
/
cm
2
j
10
.05
A
/
cm
2
j j
j
10
9
A
/
cm2
j
0.1A
0
exp(
nF
RT
c
)
exp(
nF
RT
c
)
相差100倍以上 满足塔菲尔关系
250C时, (116/ n)mV c
• 半对数极化曲线与电化学极化方程式
log j
log j
强极化区
平
0
log j 0
log j 0
• 强极化区遵循Tafel式
c
2.3RT
j
j
0
exp(
F
RT
) exp( F
RT
)
•总传递系数:
k
1 v
k
控制步骤 的正向反 应序号
n
k v
1
k
n
v
控制步 骤的传 递系数
控制步骤 重复的次 数
巴特勒-伏尔摩方程曲线
• 平衡电位时无净反 应发生。 0,j 0
/
cm2
j0 j0
j
j
j
0.1A / cm2
弱极化区(AB)测试技术
• 极化曲线的线性极化区与塔费尔极化区之间称为弱
极化区,过电位大约在20~70mV范围内。
• 在此区域内,电极上的氧化反应速度与还原反应速 度既不接近相等,也不相差十分悬殊。
• 在弱极化区进行电化学测量优于线性区和塔菲尔区。 • 电极过程的电化学极化规律用完整的巴氏方程描述:
电流密度
单位电流密度 温度系数 下的过电位
电极材料 表面状态 溶液组成 温度
一般为 0.12V
2、线性关系:
j 0时, 0
j
常数
~ 欧姆定律
电极材料表面状态溶液 组成温度:极化电阻
电极反应速度理论与速度方程式
电极反应 O + ne
R
速度方程式:
还原反应
j
j
0
exp(nF
ja
j
j
j0 exp(
nF
RT
a
)
exp(
nF
RT
a
)
多电子转移步骤的动力学方程式
• 稳态极化时,各个单电子转移步骤的速度相 等,且等于控制步骤的速度。
• 电极反应的净电流密度等于各个单电子转移
步骤电流之和。
第3章 稳态电化学研究方法
孟惠民
§3.1 稳态极化曲线与动力学方程式 §3.2 稳态极化曲线测定的注意事项
§3.1 稳态极化曲线与动力学方程式
一、电极的极化
1、电极的极化:有电流通过电极时,电极电位偏离 平衡电位(或稳定电位)的现象。
2、阴极极化:电极电位偏离平衡电位向负移。 3、阳极极化:电极电位偏离平衡电位向正移。 4、极化电位:有电流通过时的电极电位。 5、静止电位:无电流通过时的电极电位,包括平衡
m S t
D
C X
x0
设电极反应为:O ne R
在稳态扩散条件下,
C x
为常数,
x0
即:
C x
x0
C0
Cs
扩散层有效厚度
得稳态扩散电流密度:
i扩=
nFD
C x
x0
nFD
C0
Cs
2、恒电位法:给定电极电位,测量电流密度,得到 电流密度与电极电位的关系曲线。
j f()
3、稳态法:测定电极过程达到稳定状态后的 电流密度与电极电位的关系。
4、暂态法:测定电极过程未达到稳定状态的 电流密度与电极电位的关系,包含时间因素 的影响。
控制电流法与控制电位法
• 稳态法分为控制电流法与控制电位法。
id
1
Cs C0
或:
Cs
C0
1
ik id
• 因假定扩散过程为整个电极过程的控制步骤,也就意味
着电极反应本身仍处于可逆状态,能斯特公式仍适用。
因此,在电极上有电流通过时,反应产物生成独立相
(不可溶)时的电极电位为 : 0 RT ln Cs
电化学极化:由于电极表面得、失电子的电化 学反应的迟缓,而引起的电极电位偏离平衡 电位(稳定电位)的现象。
二、极化曲线
• 电极电位(或过电位)与电流密度之间的 关系画成曲线叫做极化曲线
三、极化曲线的测量
1、恒电流法:给定电流密度,测量电极电位,得到 电极电位与电流密度的关系曲线。 f(j)
电位和稳定电位。
6、过电位:在一定电位下,电极电位与平衡电位的
差值。
平
过电位取正值:
c 平 c
a a 平
7、极化值:有电流通过时的电极电位(极化电位) 和无电流通过时的电极电位(静止电位)的差值。
浓差极化和电化学极化
浓差极化:由于液相传质步骤的迟缓,使得电 极表面反应离子的浓度低于溶液本体浓度, 造成电极电位偏离平衡电位(稳定电位)的 现象。
nF
代入Cs得:
0
RT nF
ln C0
RT nF
ln
1
ik id
未发生浓差极化时的平衡电位 :平 0 RT ln C0
nF
可得:
• 过电位存在是净反 应发生的必要条件。
0,j 0
实际稳态极化曲线与其特征区域划分
EF—新反应区
DE—扩散控制区 CD—混合控制区 BC—强极化区(Tafel区) AB—弱极化区 OA—线性区
线性极化方程式—线性极化测量技术 低过电位区(线性极化区OA)
• 当 很小时,
j
j
0
• 对于极化曲线中有电流极大值的情况,只能用恒电位法,如测定 具有阳极钝化行为的阳极极化曲线时,由于这种极化曲线具有S 形,对应一个电流有几个电位值。若用恒电流法只能测得正程曲 线ABFF,或返程曲线FEDA,不能测得真实完整的极化曲线。用 恒电位法则可测得完整的阳极钝化曲线。
• 反之,如果极化曲线中有电位极大值exp(
F
RT
)
exp(
F
RT
)
由:
jk
j
j
j
0
exp(
nF
RT
k
)
exp(
nF
RT
k
)
ja
j
j
j
0
exp(
nF
RT
a
)
exp(
nF
RT
a
)
得:
•
• 由将实 验可测得lg不同作对 下图的,得iA一和直ik线,,求直出线相的应斜的率 。
就是 ,即
1 。 1
bk
bA
而:
•
• 可见,由作图法求得 后,可得 bk和bA
进一步可获得 α 和 β 。
且
1 bk
1 nF
2
2.3RT
1 lg ik n iA
1 bA
1 nF
2
2.3RT
1 lg ik
iA
•所以在弱极化区 20 ~ 70mV ,也可用恒电位
• 当扩散步骤为控制步骤时,扩散速度即为电极反应速度, 由于扩散速度“缓慢”而引起的极化就是浓差极化。
ik
i扩=nFD
C0 Cs
• 当 Cs=0 时,扩散电流达到极大值,称为极限扩散电流
此时的浓差极化为完全浓差极化:
nFDC 0
id
可得:
ik
nFDC 0
1
Cs C0
(Butler—Volmer)
密度
宏观量 微观量
交换电流密度:当 平 时 j j
j0
j
j
nFKCO (1-α) ·CRα
• CO 、·CR、:反应物、生成物的浓度,所以 j 0 与浓度有关
• K:电极反应标准速度常数,即当电位为标准平衡电位时,反应物的活 度为1时电极反应的速度,单位为cm/s。特点:与浓度无关,比较方便。
RT
c
)
氧化反应
j
j
0
exp(
nF
RT
a
)
α,β:传递系数 ,α + β = 1
稳态电化学极化基本方程式:
由 j j净
有
外电流 或电极 反应净 速度
电极上 氧化还 原电流 的差值
j
j
0
exp(
F
RT
) exp( F
RT
)
巴特勒-伏尔摩方程
交换 电流
大约相当于 <<
50 mV n
线性区域范围(低过电位条件)与体系交换电流密度相关
当 j j0
时
j
j ,电极反应近似可逆,近平衡状态。
j 0.1A / cm2
j j
j
9.95
A
/
cm
2
j
10
.05
A
/
cm
2
j j
j
10
9
A
/
cm2
j
0.1A
0
exp(
nF
RT
c
)
exp(
nF
RT
c
)
相差100倍以上 满足塔菲尔关系
250C时, (116/ n)mV c
• 半对数极化曲线与电化学极化方程式
log j
log j
强极化区
平
0
log j 0
log j 0
• 强极化区遵循Tafel式
c
2.3RT
j
j
0
exp(
F
RT
) exp( F
RT
)
•总传递系数:
k
1 v
k
控制步骤 的正向反 应序号
n
k v
1
k
n
v
控制步 骤的传 递系数
控制步骤 重复的次 数
巴特勒-伏尔摩方程曲线
• 平衡电位时无净反 应发生。 0,j 0
/
cm2
j0 j0
j
j
j
0.1A / cm2
弱极化区(AB)测试技术
• 极化曲线的线性极化区与塔费尔极化区之间称为弱
极化区,过电位大约在20~70mV范围内。
• 在此区域内,电极上的氧化反应速度与还原反应速 度既不接近相等,也不相差十分悬殊。
• 在弱极化区进行电化学测量优于线性区和塔菲尔区。 • 电极过程的电化学极化规律用完整的巴氏方程描述:
电流密度
单位电流密度 温度系数 下的过电位
电极材料 表面状态 溶液组成 温度
一般为 0.12V
2、线性关系:
j 0时, 0
j
常数
~ 欧姆定律
电极材料表面状态溶液 组成温度:极化电阻
电极反应速度理论与速度方程式
电极反应 O + ne
R
速度方程式:
还原反应
j
j
0
exp(nF
ja
j
j
j0 exp(
nF
RT
a
)
exp(
nF
RT
a
)
多电子转移步骤的动力学方程式
• 稳态极化时,各个单电子转移步骤的速度相 等,且等于控制步骤的速度。
• 电极反应的净电流密度等于各个单电子转移
步骤电流之和。
