唑类含能化合物的合成研究进展
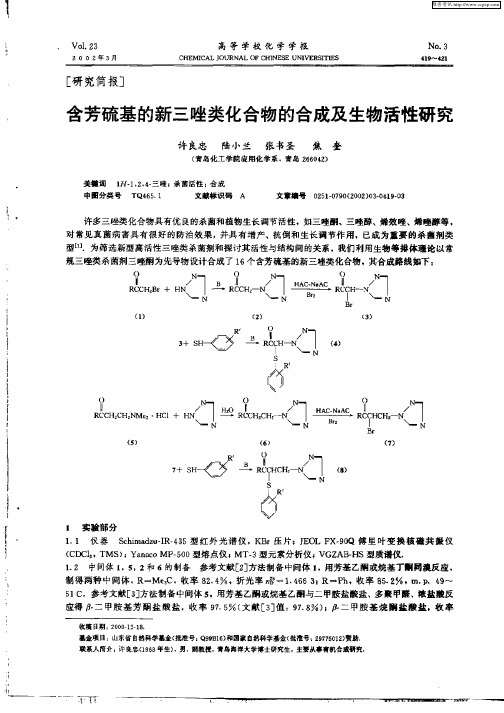
含芳硫基的新三唑类化合物的合成及生物活性研究
眦 班 \l三 州 _一 _ ] 一
+
N R
一 \_ _
] : c~_l 一 一 I ] ! \N l _ — 生
N
一
一
” s
三
( /] f
!
』“
R CH2 C CH2 NM e 2*HCI +
"
门
 ̄ N
啪
w
HAC- AC Na I 、 一 N
维普资讯 } . I
●
Vo. 3 i2
2 0 0 2年 3月
高 等 学 校 化 学 学 报
CHEM I CAL J OURNAL OF CHI NES UNI E VERSI ES T1
No 3 .
4 9 4 1 l ~ 2
[ 究简报] 研
Tab e 1 The ph sc lda f e m p l y ia h o o oan nd 8 ds 4 a
胺和 1 0mL丙酮的混合溶液, . O5 h滴毕.继续在 0 左右搅拌反应 1 .减压抽滤,  ̄ C h 滤液经减压旋蒸 得浅黄色 固体,用体积比 4 1 石油醚. 乙酸乙酯为淋洗剂, 通过硅胶(0  ̄10目) 10 6 柱层析分离纯化 , 得 22 .8g白色固体, 产率 7. , . . 1 3℃.用同样方法共合成 了 1 个标题化合物. 0 9 m P 8 ~8 6 2 结 果 与讨论 化合物 4 8 和 的熔点、 产率及元素分析数据列于表 1 .
移 至 5 0mL分 液漏斗 中, 入 8 0 加 0mL氯仿 和 10mL水 ,有机层 分别 用水、饱 和 N HC 溶 液和 水洗 5 a O。 至 中性 .分 出 有 机 相 ,用无 水 Mg O S 干燥 ,将 氯 仿 液取 1 1 入 10mL 四 口瓶 中 ,加人 14 /0滤 0 . 5g (.1mo) Oo 1对氯 苯硫 酚和 3 0mL丙 酮 ,用冰 盐浴冷 却 至 O ℃以下 , 拌下滴 加 10 o0 搅 . 0g(_1mo) 乙 1三
聚苯并咪唑的合成及应用研究进展

V ol 36N o 8 36 化 工 新 型 材 料N EW CH EM ICAL M A T ERIA L S 第36卷第8期2008年8月作者简介:马涛(1978-),男,兰州大学高分子化学与物理专业在读博士,师承李彦锋教授,从事于耐高温高分子材料的研究。
联系人:李彦锋。
聚苯并咪唑的合成及应用研究进展马 涛 李彦锋* 赵 鑫 邵 瑜 宫琛亮 杨逢春(兰州大学化学化工学院,兰州大学生物化工及环境技术研究所,兰州730000)摘 要 介绍了国内外有关聚苯并咪唑高分子材料的研究状况。
论述了聚苯并咪唑的发展,二元酸和四胺单体的合成方法、聚合工艺、种类及国内外应用状况,并对聚苯并咪唑的发展方向和研究热点进行了分析。
关键词 聚苯并咪唑,单体合成,聚合,应用Progress on synthesis and application of polybenzimidazolesM a Tao Li Yanfeng Zhao Xin Shao Yu Go ng Chenliang Yang Feng chun (College of Chemistr y and Chemical Eng ineering ,Institute of Biochemical Eng ineering &Environmental Technolog y,Lanzhou U niversity ,Lanzhou 730000)Abstract T he pro g ress of polybenzim idazoles was reviewed.T he char act er o f polybenzimizo les on phylog eny ,monomer,poly merization technolog y,and applicatio ns w ere detailedly descr ibed,meanwhile,the develo pments of po ly benzim izo les w ere obviously presented.Key words po ly benzimidazo le,monomer sy nthesis,polymer ization,applicat ion随着航天技术的发展,特别是航天器飞行速度和有效载荷与结构质量比的提高,耐高温先进复合材料正在成为最主要的航天结构新材料。
苯并咪唑类化合物的合成与性能研究

苯并咪唑类化合物的合成与性能研究苯并咪唑类化合物是一类重要的有机光电功能材料。
它们在光电显示、有机场效应管、光电传感器、光电导等领域有广泛的应用。
本文将介绍苯并咪唑类化合物的合成方法和性能研究进展。
一、合成方法苯并咪唑类化合物的合成方法有多种,常用的有酰胺法、缩合法、溶剂热法、溶胶-凝胶法等。
1. 酰胺法酰胺法是该类化合物的常见合成方法之一。
其基本反应原理如下:在酰胺的作用下,苯并咪唑染料与各种不同官能团化合物反应,形成新的化合物。
2. 缩合法缩合法是另一种广泛使用的合成方法。
缩合法的基本反应原理如下:通过缩合剂的作用,苯并咪唑染料被还原为具有缩合基团的中间体,然后中间体与另一个官能团化合物反应,形成新的苯并咪唑类化合物。
3. 溶胶-凝胶法溶胶-凝胶法是一种发展较快的合成方法。
溶胶-凝胶法通常将一种有机物或无机物加入到聚合胶凝物中,便可以形成含有苯并咪唑类化合物的溶胶-凝胶体系。
二、性能研究苯并咪唑类化合物有良好的光物理性质,如强的吸收和荧光发射性质,它们也具有优异的电学性能和储存特性。
1. 光物理性质当苯并咪唑类化合物处于激发状态时,它们显示出很强的吸收波长范围和很强的发射特性。
这些性质使得它们在透明材料中拥有良好的荧光性质,因此常被用于光电显示和光电传感器中。
2. 电学性能苯并咪唑类化合物也具有优异的电学性能。
因为这些化合物具有不平衡的电荷分布,它们的跃迁会导致电子的移动和激子的扩散,因此适用于场效应管和有机发光二极管等电子器件。
3. 储存特性苯并咪唑类化合物具有良好的储存特性,主要是由于这些化合物的分子结构中含有多个环对结构。
在分子内,存在许多离散的高能状态,使其具有很好的长寿命。
许多有机光电传感器中使用了苯并咪唑类化合物来存储信号。
结论苯并咪唑类化合物是一类很有前途的有机光电功能材料。
它们具有良好的光物理性质、电学性能和储存特性。
目前,苯并咪唑类化合物的合成方法和性能研究在不断发展进步,能够为光电功能材料领域带来更多新的发展机遇。
噻唑类杂环化合物的合成和应用研究进展

噻唑类杂环化合物的合成及应用研究进展常子钊 201414020049摘要噻唑环是一类重要的含氮硫杂原子的五元芳杂环, 其特殊的结构使得噻唑类化合物在化学、药学、生物学和材料科学等诸多领域具有广阔的应用前景,显示出巨大的开发价值, 受到广泛关注。
本文结合近几年文献系统地综述了噻唑类化合物的合成方法及其在医药、农药、材料、生物染色剂和超分子化学领域应用研究进展。
关键词噻唑杂环化合物合成应用1.合成方法含有噻唑环的化合物具有广泛的药理学活性,对其合成方法和结构的修饰研究已成为热点。
合成含有噻唑环的小分子化合物库,从中筛选出具有生理活性的药物,是近年来药物化学的一大热点,倍受化学家们的关注。
大量文献报道了噻唑及其衍生物的合成方法,本文将对各合成方法进行简要概述。
Ueno[1]利用负载在聚合体上的羟基磺酰氧基碘苯与酮或醇反应得中间体,中间体再与硫代酰胺缩合得到噻唑类化合物(图 1)。
Goff 和 Fernandez[2]利用缩氨酸联结反应将 4-腈基苯甲酸固定在含有氨基的脂上,再将腈基转化为硫代酰胺,再与α-卤代酮反应得到 2,4-二取代的噻唑,最后用三氟乙酸的水溶液进行解离(图 2)。
Kodomari 等[3]报道了负载在二氧化硅上的硫氰化钾和负载在三氧化二铝上的醋酸铵合成 2-氨基噻唑衍生物。
该反应体系的α-溴代酮与负载在二氧化硅上的硫氰化钾反应得到α-硫氰化酮,α-硫氰化酮再与负载在三氧化二铝上的醋酸铵应得到 2-氨基噻唑衍生物(图 3)。
2 医药领域的研究与应用噻唑类化合物作为药物显示出巨大的开发价值, 至今已有众多噻唑类药物用于临床治疗多种疾病, 为保障人类健康发挥着重要作用. 噻唑类化合物相关医药研究工作众多, 较为活跃, 在抗细菌、抗真菌、抗结核、抗癌、抗病毒、消镇痛、降血糖、抗癫痫、抗寄生虫和抗氧化等领域显示出广阔的应用前景。
.2.1 抗细菌类噻唑化合物抗细菌药物是临床上使用最广泛的抗感染药物之一, 已有大量的药物用于临床, 如人工合成抗菌药(喹诺酮类、磺胺类等)和抗生素(青霉素类、头孢菌素类、大环内酯类等). 然而, 近些年来耐药性成为全球性的问题, 耐药菌株频发严重且病原体耐药性增强, 如 2010 年暴发的“超级细菌”、“致命大肠杆菌”使现有所有药物疗效低, 导致细菌感染死亡率增加, 给人类的健康带来了严重的威胁, 迫切需要开发出新型结构的抗菌药物. 大量文献显示唑类化合物如研究最深入的三唑、咪唑、咔唑以及易于合成且活性较好的唑等在抗细菌领具有良好的发展潜力. 噻唑作为三唑、咪唑、唑等的电子等排体成为抗菌药物研发的新成员, 也是最为活跃的领域之一, 尤其是 2-氨基噻唑作为其他活性基团的电子等排体可以改善脂溶性和药代动力学性质迄今已有众多含噻唑环的抗细菌药物如头孢地尼(8, Cefdinir) 、头孢布烯(9, Ceftibuten) 、头孢甲肟 (10, Cefmenoxime)、头孢唑肟钠(11, Monosodium salt)等用于临床, 对革兰阳性菌具有较好的抑制作用, 尤其是对革兰阴性菌的抑制作用更为优越. 在治疗细菌感染方面发挥着重要作用. 噻唑类抗菌药物的广泛使用, 导致病原体耐药性的频发, 迫切需要开发新结构噻唑类化合物. 含有金刚烷结构的噻唑类衍生物 12 对革兰阳性细菌、革兰阴性细菌和真菌有强的抑制活性. 尤其是抑制微球菌、金黄色葡萄球菌和沙门菌等细菌菌株的能力优于一线药物链霉素 (Streptomycin) 和氨苄西林查尔酮是一类天然存在的药物活性成分, 因具有强的抗菌活性而备受关注. 引入噻唑环得到的查耳酮衍生物抗黄色微球菌的活性强于氨苄西林近三倍. 在苯并噻唑上引入噻唑、噻吩、吡唑等基团有利于增强抗菌活性, 因此设计合成了一系列含有噻吩、吡唑等活性基团的苯并噻唑类衍生物.其中噻唑化合物 14a 对金黄色酿脓葡萄球菌的最低抑制浓度(MIC)值为 3.125 mg/m L, 与临床药物氯霉素(Chlo- ramphenicol)相当. 引入苯基后的 14b 抗金黄色酿脓葡萄球菌和酿脓链球菌的能力与先锋霉素(Cephalo- sporin)相近. 噻唑啉类化合物以抗菌谱宽、抗革兰阳性菌活性好而备受青睐, 相关的结构修饰得到重视. 用氯代噻唑修饰的噻唑啉衍生物 15 对耐甲氧西林金黄色葡萄球菌、金黄色葡萄球菌和大肠杆菌表现出中等的抑制活性, 抗金黄色酿脓葡萄球菌活性则与临床药物氨苄西林相当。
三四唑类含能化合物的制备、结构及性质研究

三/四唑类含能化合物的制备、结构及性质研究随着含能材料能量与感度之间的矛盾越发尖锐,合成钝感的高能量密度材料(HEDMs)成为含能材料领域研究的热点。
三/四唑类化合物具有氮含量高,密度大,稳定好,配位模式多样,易于形成氢键等特点,是构筑新型HEDMs的良好选择。
本论文选择以三/四唑类化合物为能量来源,制备了14个含能化合物;并研究了它们的结构、热分解机理、爆轰参数以及感度等,为筛选新一代HEDMs提供实验和理论的支持。
主要研究内容和结论如下:(1)以2,3-二(5-1H-四唑基)吡嗪(H<sub>2</sub>DTZPZ),3,3′-二氨基-5,5′-二(1H-1,2,4-三唑)(DABT),5-四唑基-3-三唑(H<sub>2</sub>tztr)和5-吡嗪基四唑(pzta)为含能配体,制备了11个含能配合物:[Co(pzta)<sub>2</sub>(H<sub>2</sub>O)<sub>2</sub>](1)、[Ag(pzta)]<sub>n</sub>(2)、[Cu(pzta)<sub>2</sub>(H<sub>2</sub>O)<sub>2</sub>]·H<sub>2</sub>O(3)、{[Cu(pzta)<sub>2</sub>]·H<sub>2</sub>O}<sub>n</sub>(4)、[Ag<sub>2</sub>(DTZPZ)]<sub>n</sub>(5)、[Cu(H<sub>2</sub>O)(C<sub>2</sub>O<sub>4</sub>)(DABT)]·H<sub>2</sub>O(6)、[Cu(H<sub>2</sub>O)(DABT)<sub>2</sub>](NO<sub>3</sub>)<sub>2</sub>·H<sub>2</sub>O(7)、[Cu(tztr)]<sub>n</sub>(8)、[Pb(Htztr)<sub>2</sub>H<sub>2</sub>O]<sub>n</sub>(9)、[Li<sub>2</sub>(Htztr)<sub>2</sub>(H<sub>2</sub>O)<sub>4</sub>](10)和[K(Htztr)(H<sub>2</sub>O)]<sub>n</sub>(11)。
1,2,3-三唑化合物的合成研究进展

2009年第29卷有机化学V ol. 29, 2009第1期, 13~19 Chinese Journal of Organic Chemistry No. 1, 13~19zgs@*E-mail:Received December 25, 2007; revised March 26, 2008; accepted June 5, 2008.国家自然科学基金(No. 20672031)、河南省创新型科技人才建设工程(No. 084100510002)及新世纪优秀人才支持计划(No. 2006HANCET-06)资助项目.14有 机 化 学 V ol. 29, 20091.1 Cu(II)盐还原产生Cu(I)催化合成1,2,3-三唑铜催化的有机叠氮化合物和端炔烃之间的1,3-偶极Huisgen 环加成反应机理上是Cu(I)起到催化作用[6], 但Cu(I)盐在空气中的不稳定性会使其催化效果大大降低. 而进一步研究发现在反应过程中由Cu(II)盐还原产生Cu(I)来催化反应进行却能取得更好的效果, 像实验室常用的CuSO 4•5H 2O, Cu(OAc)2, CuSO 4等都可与铜金属或其它一些还原剂共同作用产生Cu(I)催化剂, 例如CuSO 4•5H 2O-抗坏血酸钠[5], CuSO 4•5H 2O-抗坏血酸[7], CuSO 4•5H 2O-Cu(0)[8], Cu(OAc)2•H 2O-抗坏血酸钠[9]等体系. 这些催化剂体系反应条件温和, 反应非常可靠, 对氧气、水不敏感, 产物立体选择性好, 产率高, 反应后处理及产物分离简单, 速率达到无催化剂时的107倍[6], 因此称之为是一种“click ”化学. 广泛取代的反应物、温和的反应条件以及产物区域专一性使得该方法一经发现就被广泛应用于药物发现[10]、生物分子的修饰[11]以及材料科学[12](Eq. 2)等.近年来又有许多关于该方法催化click 化学反应溶剂方面的报道[13], 反应大多是在叔丁醇/水体系中进行, 亲脂性、亲水性试剂在此体系中都能取得很好的效果. 另外水和其它一些有机溶剂如乙醇、二甲亚砜、四氢呋喃、乙腈、二甲基甲酰胺、丙酮等与水互溶的有机溶剂的混合溶剂中也有很好的效果. 2006年, Lee 等[13]又研究了生成三唑环的一种新的有效溶剂体系: 二氯甲烷/水. 这种溶剂体系和其它体系相比不仅提高了反应产率, 缩短了反应时间, 而且扩大了应用范围, 在此体系中已高效合成出了一些结构复杂的分子.随着对合成1,2,3-三唑研究的不断深入, 一锅法催化合成1,2,3-三唑受到人们极大关注. 该方法是在反应过程中由底物首先生成有机叠氮, 然后不经分离直接进行铜催化1,3-偶极环加成反应. 这样可以使一些不稳定的或不易分离的叠氮化合物直接和炔基反应生成稳定的三唑.如2005年Wang 等[14]利用click 反应以未保护单糖为起始原料一锅合成了含1,4-二取代-1,2,3-三唑的糖聚体. 反应经过乙酰化、溴化、叠氮化、Cu(I)盐催化的Huisgen 环加成生成目标化合物(Eq. 3). 该方法简化了糖化学反应过程中繁琐的操作, 避免了分离上的困难.2007年Yadav 等[15]将环氧化合物通过click 反应有效合成了各种β-羟基-1,2,3-三唑化合物(Eq. 4). 反应条件温和, 易于操作.Fukuzawa 等[16]最近利用Cu(OTf)2作为双重催化剂催化芳香烃的酯和三甲基硅叠氮(TMSN 3)及端炔烃, 一锅合成1,4-二取代-1,2,3-三唑(Eq. 5). 反应进程不需再加其它催化剂.多组分一锅法反应应用于1,2,3-三唑的合成, 不仅依然具有条件温和、产物选择性好、产率高, 反应后处理及产物分离简单等合成上的优势, 而且提高了合成效率, 很大程度上扩大了click 化学的底物应用范围.自从1986年Gedye 等[17]研究了在微波辅助下的酯化反应, 微波技术在有机反应中的应用得到了快速发展. 尽管叠氮化合物和端炔烃之间的1,3-偶极环加成反应一般不需要高温, 但微波辅助催化能使反应时间由几十小时缩短到几十分钟甚至几分钟[18]. 例如一锅法CuSO 4-Cu(0)催化合成1,2,3-三唑中, 在微波辅助条件下一系列1,2,3-三唑化合物15 min 内可由卤代烃直接反应得到[19], 极大地提高了传统一锅法的合成效率. 微波具有清洁、高效、耗能低、污染少等特点, 它的应用将会No. 1王景梅等:1,2,3-三唑化合物的合成研究进展15使click 化学向一个更高效、更环保的方向发展.综上所述, Cu(II)盐-抗坏血酸钠等体系的催化剂无论在传统合成方法中, 还是在一锅法合成或微波辅助下的合成都有广泛的应用, 但同时也可以看到它多数是在含水体系中的应用, 一些水敏感性基团却需要在有机溶剂中进行反应, 这就需要寻找一些在有机溶剂中溶解性能好的铜盐催化剂, 来扩大click 反应的应用范围. 1.2 Cu(0)氧化产生Cu(I)催化合成1,2,3-三唑在合成1,2,3-三唑的众多催化体系中, 铜金属是一种特别引人注目的催化剂. 铜金属催化安全廉价, 操作简便. 例如铜金属在一些氧化剂(CuSO 4, FeCl 3[20]等)存在下生成Cu(I)催化反应进行. 又如有机叠氮和炔烃的水/醇的混合液中加入过量的铜金属也能高效地得到相应的1,2,3-三唑环[6](Eq. 6). 但用铜金属和其它催化体系相比需要较长的反应时间和较大的量. 这就需要对铜金属催化体系加以改进, 使其既能提高催化活性又能保持操作简便的优势.相比之下对纳米铜粒子的利用则提供一个较好的方法, 例如在胺的盐酸盐存在下, 可溶性活性纳米铜粒子[21]可高效地催化反应进行(Eq. 7), 表现了和其它铜盐催化体系同样广泛的应用范围. 但反应体系需要加入铵盐、或者炔烃或叠氮分子上存在铵盐, 这从某种程度上限制了该方法进一步深入和广泛的应用.值得一提的是2006年Choudary 等[22]将卤代烃与叠氮化钠及炔烃在水相中利用Cu-Al 2O 3纳米粒子催化, 一锅得到1,4-二取代-1,2,3-三唑化合物(Eq. 8). 反应不仅扩大了底物的范围, 而且水相的利用也减少了对环境的污染.铜纳米簇[23]在无任何铵盐的条件下, 也能高效催化有机叠氮化合物和端炔烃之间的环加成反应生成1,4-二取代-1,2,3-三唑(Eq. 9). 研究表明反应中催化作用可能发生在铜的表面, 且仍可能有Cu(I)-炔中间体的产 生[24].从Eq. 9可知铜纳米簇催化剂有很高的催化活性, 但铜纳米簇和其它铜催化体系相比要昂贵许多, 较大程度地限制了它在工业和科研中的应用. 1.3 Cu(I)盐催化合成1,2,3-三唑2002年Meldal 等[4]最早报道了Cu(I)盐在固相中催化有机叠氮化合物和端炔烃之间的1,3-偶极环加成反应得到1,4-二取代-1,2,3-三唑肽化合物. 他们将Cu(I)盐加到树脂固载的端炔烃中, 在碱如DIPEA (N ,N -diisoprop- ylethylamine)的存在下进行反应得到1,4-二取代-1,2,3-三唑化合物. 研究表明固相中Cu(I)催化的叠氮化合物和端炔烃的环加成反应适用于多种反应条件和树脂类型, 但由于过量炔烃的自身偶联使得反应产率较低. 近年来一些文献[25]报道了即使在炔烃浓度较大的情况下, 仍然可以利用树脂固载叠氮的固相反应高效合成1,2,3-三唑的方法. 但由于树脂对叠氮基团的空间位阻影响, 一些反应可能会由于炔基偶联占优势导致产率下降. 因此还需要进一步探索和改进.Wong 等[26]较早在液相中直接用Cu(I)盐催化叠氮化合物和端炔烃之间的1,3-偶极环加成反应. 近几年Cu(I)盐在液相中催化叠氮化合物和端炔烃之间偶合的应用很多且反应条件更加温和, 像CuI, CuBr, CuCl, CuCN 等铜盐都可用来催化并能取得很好的产率, 例如在糖化学[27]中应用CuI 催化得到取代位置专一的糖聚体(Eq. 10), 产率达到96%.随着对反应的深入研究, Cu(I)催化的反应体系也逐渐多样化. 如2005年Yan 等[28]报道了在三乙胺的存在16有 机 化 学 V ol. 29, 2009下, Cu(I)催化反应在水相中进行(Eq. 11). 反应条件温和, 且不需要任何有机溶剂.2006年Zhao 等[29]利用[bmim][BF 4]/H 2O (V ∶V =1∶1)作为溶剂, 在各种Cu(I)盐催化下得到相应的1,4-二取代-1,2,3-三唑化合物(Eq. 12). 离子液体应用于该反应体系, 不仅使得反应依然保持较高的反应产率, 而且溶剂能被回收利用, 减少了对环境的污染.同年, Sreedhar 等[30]报道了Cu(I)盐催化下利用聚乙二醇(PEG-400)作为媒介, 高效地得到1,4-二取代-1,2,3-三唑化合物. PEG 是一种廉价低毒的高分子聚合物, 不含卤素且易降解, 对环境的污染小. 许多有机反应像Heck 反应[31]、Suzuki 偶联[32]等反应都用到聚乙二醇作为反应媒介.从上述我们可看到Cu(I)盐催化叠氮化合物和端炔烃之间的1,3-偶极环加成反应不仅可以应用于固相或液相反应体系, 而且反应条件温和, 溶剂体系广泛, 有机相、水相、离子液体、高分子聚合物及混合体系中都能有效得到目标产物, 反应原料可根据自身特点选择合适的反应条件. 但Cu(I)盐容易歧化或被氧化, 且Cu(I)盐催化的反应体系需加入一定量的碱来去除炔基上的端氢得到铜炔盐的活性中间体, 使得其应用有一定的局限性. 这就需要Cu(I)盐和其它铜盐催化体系相辅相成, 互相补充. 同时也需要进一步研究更稳定的催化体系. 1.4 配体辅助Cu(I)催化合成1,2,3-三唑由于Cu(I)易被氧化或发生歧化会造成反应速率降低或产率下降等问题. 近来一些文献提出了在铜盐催化体系中加配体共同作用来催化合成1,2,3-三唑. 研究发现配体不仅能促进Cu(I)中间体的转化, 而且能和Cu(I)形成很强的键, 起到稳定Cu(I)和加强Cu(I)催化活性的作用, 从而大大提高了反应的产率[33]. 例如TBTA[tris-(benzyltriazolymethyl)amine]已被成功地应用于多个反应[34], 它使Cu(I)有很强的稳定性, 避免了氧化和歧化. 配体TBTA 本身可作为Cu(I)的受体以及氢的接受者, 可使反应即使在有机溶剂中也可避免碱的使用(Eq.13).一些类似配体也得到了人们的研究和应用. 例如Chan 等[34a]合成了一些辅助铜盐催化的配体, 都非常有效地促进了催化剂的活性(Eq. 14).另外, 其它一价配位铜盐像(EtO)3P•CuI 和(Ph 3P)3• CuBr [35]也是常用的催化剂. 它们即使在空气中也具有很强的稳定性, 并且比无机Cu(I)盐能更好地溶于有机溶剂, 能使反应在均相中进行. 例如, 2006年我们[2c]通过1,2,3-三唑环对两分子道诺霉素进行连接和修饰. 利用(EtO)3P•CuI 作催化剂, 室温条件下反应底物在四氢呋喃中发生均相反应, 高效地合成了7种二聚道诺霉素.对于一些特定结构的底物, 人们也发现了一些特殊的合成1,4-二取代-1,2,3-三唑的方法. 例如, 2002年Katritzky 等[36]报道了无溶剂微波辅助条件下叠氮化合物和炔基酰胺之间的1,3-偶极环加成反应, 反应不需含铜催化剂, 速率较传统方法有显著地提高.2 1,5-二取代-1,2,3-三唑的合成Cu(I)催化Huisgen 环加成合成1,4-二取代-1,2,3-三唑化合物的方法具有条件温和、产物选择性好、产率高、产物分离简单等特点, 是一种新的、方便的、近乎完美的合成方法. 利用它可以完成许多在其它反应中无法完成的一些功能化合物骨架的合成, 被化学界公认为万能合成法. 因此, 1,4-二取代-1,2,3-三唑化合物在生产和生活各方面的应用非常广泛. 而作为1,4-二取代的异构体, 1,5-二取代-1,2,3-三唑合成和应用也越来越受到化学家的重视.20世纪60年代末Akimova 等[37]曾得到取代位置专No. 1王景梅等:1,2,3-三唑化合物的合成研究进展17一的1,5-二取代-1,2,3-三唑, 但可能由于产率很低, 他们这种1,5-二取代-1,2,3-三唑的合成方法并没有得到深入研究和广泛应用. 2004年Krasinski 等[38]在此基础上经过进一步研究, 以更高产率得到1,5-二取代-1,2,3-三唑, 产物也不需要过多的纯化. 更有意义的是反应进程中的中间体4-镁卤取代的三唑可以被一些非质子的亲电试剂捕获, 得到1,4,5-三取代-1,2,3-三唑(Scheme 1), 为三取代-1,2,3-三唑的合成提供了一种可行的方法.Scheme 12005年, Fokin 等[39]尝试了几种钌的配合物催化有机叠氮和炔烃的环加成反应. 研究发现Cp*RuCl(PPh 3)2催化下仅专一地生成1,5-二取代-1,2,3-三唑化合物(Eq. 15). 其它含有[Cp*Ru]的配合物如[Cp*RuCl 2]2, Cp*RuCl(NBD)和Cp*RuCl(COD)等, 也都能起到很好的催化作用. 值得一提的是这类含有[Cp*Ru]的催化剂不仅能催化有机叠氮和端炔烃之间环加成, 还能很好地催化叠氮和中间炔烃的环加成反应得到1,4,5-三取 代-1,2,3-三唑化合物(Eq. 15). 2007年他们[40]又发现了一种新型催化剂[Cp*RuCl]4催化芳基叠氮和端炔烃合成1,5-二取代-1,2,3-三唑的方法. 该方法对Cp*RuCl- (PPh 3)2催化下难进行反应的原料也非常有效, 微波辅助则可以进一步提高反应收率、缩短反应时间.近来, Kumar 等[41]报道了烃基叠氮和过量丙二烯溴格氏试剂室温下在四氢呋喃中发生连锁反应, 合成了5-炔丁基的1,5-二取代-1,2,3-三唑. 随后他们[42]又将此方法应用于不同的糖基叠氮. 并且他们将此方法和Cu(I)盐催化的Huisgen 环加成联用, 得到不对称的1,4-二取代和1,5-二取代的双三唑环化合物(Scheme 2), 丰富了1,2,3-三唑化合物的结构类型.3 1,4,5-三取代-1,2,3-三唑的合成1,4,5-三取代-1,2,3-三唑与1,4-和1,5-二取代三唑相比, 结构更具有多样性, 它的区域选择性合成的研究正Scheme 2逐渐成为一个热点. 近年来, 多种三取代-1,2,3-三唑的合成方法得到研究和应用. 如前文提到的有机叠氮和溴格氏试剂取代的乙炔化合物之间的反应[38], 三取代的1,2,3-三唑是在反应进程中亲电试剂捕获中间体而得到的.2005年Wu 等[43]用Cu(I)催化多种有机叠氮和端炔烃及ICl 存在下首次一锅合成5-碘-1,4,5-三取代-1,2,3-三唑(Scheme 3). 此反应更深远的意义在于三取代- 1,2,3-三唑的5位碘基可以被转化为其它功能团, 就此他们[44]经过进一步深入研究发现, 钯催化下, 5位碘代的1,2,3-三唑通过交叉偶联反应(Suzuki, Heck, Sonoga-shira reactions)可得到各种类型的1,4,5-三取代三唑化合物(Scheme 3). 2006年他们[45]利用5-碘-1,2,3-三唑得到5-乙炔基-1,4,5-三取代三唑后, 通过端炔基偶联反应成功得到了1,2,3-三唑的二聚体和四聚体.Wu 等[43]研究还发现有机叠氮和端炔烃在CuI/Et 3N 等条件下, 反应中间体也可直接被其它一些亲电试剂如烯丙基溴等捕获, 生成5位为其它取代基的1,4,5-三取代-1,2,3-三唑(Eq. 16). 但该方法产率中等, 一些亲电性较弱的试剂(三甲基硅氯、氯甲酸乙酯、甲磺酰氯、苄基溴、丁基溴等)并不能反应.18有 机 化 学 V ol. 29, 2009Scheme 32007年Gevorgyan 等[46]用钯催化首次合成5-芳基-三取代-1,2,3-三唑(Eq. 17). 多种1,4-二取代-1,2,3-三唑都能成功地在5位进行芳基化反应. 同时他们还利用4,5位未取代的1,2,3-三唑进行5位芳基化反应, 高选择性得到1,5-二取代-1,2,3-三唑.1,4,5-三取代-1,2,3-三唑的合成方法尽管取得了一定程度的进展, 但这些方法针对性较强, 应用范围不够广泛. 并且由于1,4,5-三取代-1,2,3-三唑结构的多样性和复杂性, 如何获得更多条件温和、选择性好, 应用更广泛的合成方法会成为该领域极具有挑战性的工作.4 结语与展望主要对近年来涌现出的1,2,3-三唑化学合成方法进行了综述. 自Meldal 和Sharpless 发现一价铜催化专一性生成1,4-二取代-1,2,3-三唑的新方法以来, 对于合成1,2,3-三唑方法学的研究成为新的热点. 多样化的催化体系和反应溶剂体系的开发和应用已为适用于各种不同性质底物的click 反应提供了广泛的选择, 为click 化学近年来在不同领域中的蓬勃发展提供了合成基础.但是作为理想的合成工具, 合成1,2,3-三唑的方法仍然有其局限性: 比如更加符合生理研究的反应条件的研究, 更加高效地一锅法多组分合成1,2,3-三唑新方法以及1,5-二取代-1,2,3-三唑和1,4,5-三取代-1,2,3-三唑的合成新方法仍然需要进一步的探索. 我们相信, 随着1,2,3-三唑合成方法的不断完善, 基于该反应的click 化学将会在药物研究、生物缀合、材料合成等领域得到更广泛和深入的应用.References1(a) Dong, W.-L.; Zhao, W.-G.; Li, Y .-X. Chin. J. Org. Chem. 2006, 26, 271 (in Chinese).(董文莉, 赵卫光, 李玉新, 有机化学, 2006, 26, 271.)(b) Li, Y .; Ju, Y .; Zhao, Y .-F. Chin. J. Org. Chem. 2006, 26, 1640 (in Chinese).(李研, 巨勇, 赵玉芬, 有机化学, 2006, 26, 1640.)2(a) Li, L.-J. Ph.D . Dissertation , Peking University, Beijing, 2007 (in Chinese).(李凌君, 博士论文, 北京大学, 北京, 2007.)(b) Fang, L.; Zhang, G.; Li, C.; Zheng, X.; Zhu, L.; Xiao, J. J.; Szakacs, G.; Nadas, J.; Chan, K. K.; Wang, P. G.; Sun, D. J . Med . Chem . 2006, 49, 932.(c) Zhang, G.; Fang, L.; Zhu, L.; Sun, D.; Wang, P. G . Bioorg . Med . Chem . 2006, 14, 426.3(a) L'Abbe, G. Chem. Rev . 1969, 69, 345.(b) Huisgen, R. In 1,3-Dipolar Cycloaddition Chemistry , Ed.: Padwa, A., Wiley, New York, 1984, pp. 1~176. (c) Huisgen, R. Angew. Chem ., Int. Ed. 1963, 2, 565.4 Tornoe, C. W.; Christensen, C.; Meldal, M. J. Org. Chem . 2002, 67, 3057.5 Rostovstev, V. V.; Green, L. G.; Fokin, V. V.; Sharpless, K. B. Angew. Chem ., Int. Ed. 2002, 41, 2596.6Himo, F.; Lovell, T.; Hilgraf, R.; Rostovtsev, V. V.; Noo-dleman, L.; Sharpless, K. B.; Fokin, V. V. J. Am. Chem. Soc. 2005, 127, 210.7 David, P.; Zeller, T. M.; Norris, P. Carbohydr. Res . 2006, 341, 1081.8 Chandrasekhar, S.; Rambabu, D. B. C. Tetrahedron Lett . 2006, 47, 3059.9 Camp, C.; Dorbes, S.; Picard, C.; Benoist, E. Tetrahedron Lett . 2008, 49, 1979.10Brik, A.; Muldoon, J.; Lin, Y .-C.; Elder, J. H.; Goodsell, D. S.; Olson, A. J.; Fokin, V . V .; Sharpless, K. B.; Wong, C.-H. ChemBioChem 2003, 4, 1246.11 Suarez, P. L.; Gandara, Z.; Fall, Y. Tetrahedron Lett . 2004, 45, 4619.12 Jim, C. K. W.; Qin, A.; Lam, J. W. Y.; Hau βer, M.; Tang, B. Z. J . Inorg. Organomet . Polym. 2007, 17, 289.13 Lee, B.-Y.; Park, S. R.; Jeon, H. B.; Kim, K. S. Tetrahedron Lett . 2006, 47, 5105.14 Chittaboina, S.; Xie, F.; Wang, Q. Tetrahedron Lett . 2005, 46, 2331.15Yadav, J. S.; Reddy, B. V. S.; Reddy, G. M.; Chary, D. N. Tetrahedron Lett . 2007, 48, 8773.16 Fukuzawa, S.; Shimizu, E.; Kikuchi, S. Synlett 2007, 2436. 17(a) Gedye, R.; Smith, F.; Westaway, K.; Baldisera, H. A. L.; Laberge, L.; Rousell, J. Tetrahedron Lett . 1986, 27, 279. (b) Giuere, R. J.; Bray, T. L.; Duncan, S. M.; Majetich, G.No. 1 王景梅等:1,2,3-三唑化合物的合成研究进展19Tetrahedron Lett. 1986, 27, 4945.18 Lucas, R.; Neto, V.; Bouazza, A. H.; Zerrouki, R.; Granet,R.; Krausz, P.; Champavier, Y. Tetrahedron Lett. 2008, 49, 1004.19 Appukkuttan, P.; Dehaen, W.; Fokin, V. V.; Eycken, E.Org. Lett. 2004, 6, 4223.20 Saha, B.; Sharma, S.; Sawant, D.; Kundu, B. Synlett2007,1591.21 Orgueira, H. A.; Fokas, D.; Isome, Y.; Chane, C.-M.;Baldino, C. M. Tetrahedron Lett. 2005, 46, 2911.22 Kantam, M. L.; Jaya, V. S.; Sreedhar, B.; Rao, M. M.;Choudary, B. M. J. Mol. Catal. A: Chem. 2006, 256, 273.23 Pachon, L. D.; van Maarseveen, J. H.; Rothenberg, G. Adv.Synth. Catal.2005, 347, 811.24 Thathagar, M. B.; Beckers, J.; Rothenberg, G. Green Chem.2004, 6, 215.25 (a) Löber, S.; Rodriguez-Loaiza, P.; Gmeiner, P. Org. Lett.2003,5, 1753.(b) Löber, S.; Gmeiner, P. Tetrahedron2004, 60, 8699.(c) Bettinetti, L.; Löber, S.; Hübner, H.; Gmeiner, P. J.Comb. Chem. 2005, 7, 309.26 Fazio, F.; Bryan, M. C.; Blixt, O.; Paulson, J. C.; Wong,C.-H. J. Am. Chem. Soc.2002, 124, 14397.27 Hotha, S.; Kasyap, S. J. Org. Chem. 2006, 71, 364.28 Yan, Z.-Y.; Zhao, Y.-B.; Fan, M.-J.; Liu, W.-M.; Liang,Y.-M. Tetrahedron 2005, 61, 9331.29 Zhao, Y.-B.; Yan, Z.-Y.; Liang, Y.-M. Tetrahedron Lett.2006, 47, 1545.30 Sreedhar, B.; Reddy, P. S.; Kumar, N. S. Tetrahedron Lett.2006, 47, 3055.31 Chandrasekhar, S.; Narasimhulu, C.; Sulthana, S. S.; Reddy,N. R. Org. Lett. 2002, 4, 4399.32 Namboodri, V. V.; Varma, R. S. Green Chem. 2001, 3, 146.33 Meng, J.-C.; Fokin, V. V.; Finn, M. G. Tetrahedron Lett.2005, 46, 4543.34 (a) Chan, T. R.; Hilgraf, R.; Sharpless, K. B.; Fokin, V. V.Org. Lett. 2004, 6, 2853.(b) Beckmann, H. S. G.; Wittmann, V. Org. Lett. 2007,9, 1.(c) Ustinov, A. V.; Dubnyakova, V. V.; Korshun, V. A.Tetrahedron2008, 64, 1467.35 Balderas, F. P.; Munoz, M. O.; Sanfrutos, J. M.; Mateo, F.H.; Flores, F. G. C.; Asin, J. A. C.; Garcia, J. I.; Gonzalez,F. S. Org. Lett. 2003, 5, 1951.36 Katritzky, A. R.; Singh, S. K. J. Org. Chem. 2002, 67, 9077.37 Akimova, G. S.; Chistokletov, V. N.; Petrov, A. A. Zh. Org.Khim. 1967, 3, 968.38 Krasinski, A.; Fokin, V. V.; Sharpless, K. . Lett.2004, 6, 1237.39 Zhang, L.; Chen, X.; Fokin, V. V.; Jia, G. J. Am. Chem. Soc.2005, 127, 15998.40 Rasmussen, L. K.; Boren, B. C.; Fokin, V. V. Org. Lett.2007, 9, 5337.41 Shafi, S.; Banday, A. H.; Ismail, T.; Kumar, H. M. S.Synlett 2007, 1109.42 Arora, B. S.; Shafi, S.; Singh, S.; Ismail, T.; Kumar, H. M.S. Carbohydr. Res. 2008, 343, 139.43 Wu, Y.-M.; Deng, J.; Li, Y.; Chen, Q.-Y. Synthesis 2005,1314.44 Deng, J.; Wu, Y.-M.; Chen, Q.-Y. Synthesis2005, 2730.45 Wu, Y.-M.; Deng, J.; Chen, Q.-Y. Synlett2006, 645.46 Chuprakov, S.; Chernyak, N.; Gevorgyan, V. Org. Lett.2007, 9, 2333.(Y0712251 Cheng, B.)。
1,2,4-三唑类化合物杀菌活性的研究进展

1,2,4-三唑类化合物杀菌活性的研究进展王献友;薛潇沛;庞艳萍;郭强;闵娜娜;窦玉蕾【摘要】从杀菌剂方面对关于1,2,4-三唑类化合物的生物活性研究进行了分类综述.重点介绍了不同取代基对三唑类化合物生物活性的影响,并对其发展趋势和应用前景作出了展望.【期刊名称】《江苏农业科学》【年(卷),期】2013(041)008【总页数】4页(P134-137)【关键词】三唑类化合物;合成;杀菌活性;进展【作者】王献友;薛潇沛;庞艳萍;郭强;闵娜娜;窦玉蕾【作者单位】河北大学质量技术监督学院,河北保定071002;河北大学质量技术监督学院,河北保定071002;河北大学质量技术监督学院,河北保定071002;河北大学质量技术监督学院,河北保定071002;河北大学质量技术监督学院,河北保定071002;河北大学质量技术监督学院,河北保定071002【正文语种】中文【中图分类】S482.2+7在现有的众多杂环化合物中,1,2,4-三唑类衍生物由于其广谱的生物活性及广阔的应用前景而一直颇受人们的青睐。
在农用化学品中,三唑类化合物己经被开发成为一类引人注目的超高效农药,目前已经有几十个商业化品种。
目前对于该类化合物的研究和开发仍然很活跃,研究的内容和主要目标是在保留三唑环分子结构的基础上对其他部分进行适当的改造和修饰,以求达到进一步扩大其杀菌谱和应用范围,从而进一步提高其生物活性并减少其用药量的目的。
自20世纪60年代中期荷兰Philiph-Dupher公司开发出了第一个1,2,4-三唑类杀菌剂——威菌灵[1]以来,目前己报道的三唑类杀菌剂数以万计,其发展之快、数量之多,是以往的任何杀菌剂所不能比拟的。
多数三唑类杀菌剂具有如下活性特点:强内吸性、广谱性、长效、高效、立体性选择和共同的作用机制。
三唑类化合物的高效杀菌活性已经引起了国际农药界的高度重视,各大公司先后开发出一系列商品化的杀菌剂。
三唑类衍生物是甾醇生物合成中C-14脱甲基化酶的抑制剂,对白粉病、锈病、灰霉病等多种病害具有较高的抑制率。
124-恶二唑类含能化合物研究进展

构 体—— 1 , 2 , 4 . 嗯 二 唑
。
最新 研 究 发 现 , 1 , 2, 4 一 嗯二 唑 类 化合 物 的总 体 能
量 水平 略低 于 1 , 2, 5 . 嗯二 唑 类 化合 物 , 但 在 感 度 性 能 方 面则 要 相 对 低 感 , 可 在 侧 链 上 引 入 高 能 化 学 基 团 ( 如 呋 咱基 、 偶 氮基、 硝基 、 硝胺基 及硝仿基等 ) 。 。 可进 一步 提 高 1 , 2, 4 . 嗯 二 唑类 化 合 物 的 能量 密 度 , 因
以其高 密度 、 高氮含 量 、 高 氧平衡 和 高热 稳定 性等 特点
得 到 了广泛 关 注 - , ‘ 。 。
间 。本文 综述 了国 内外 关 于单 一 1 , 2 , 4 一 嗯二 唑 类 、 偶 氮 基- 1 , 2, 4 一 嗯二 唑类 以及联 一 1 , 2, 4 一 嗯 二 唑类 等 三 十 余 种含 能化 合物 的最 新 研究 成 果 , 并对 部 分 化 合 物 的性 能进行 了 阐述 。通 过 与 传 统 硝 胺 类 含 能 材 料 黑 索 今 ( R DX ) 和奥 克 托今 ( HMx) 的综 合 性 能 对 比 , 发现 1 , 2 , 4 一 嗯 二 唑类含 能 化 合 物 具有 高 氧平 衡 、 高 能及 不 敏
到理想 平衡 的方法 。 因 而在 最 近 一 段 时 间 , 国 内 外 一
些 研究 机构 已逐 渐将 关 注 目光 转 移至 另一 种嗯二 唑 异
面提 出了越 来越 高 的要 求 , 而传 统 含 能 材 料 无 论 是 其
性 能 还是 生 产过 程都 已很 难 满 足 以上 要 求 。因 此 各 国科研 工作 者 为获 得 高 性 能 含 能 材 料 , 在 含 能 化 合
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三唑及其衍生物
• 三唑为白色针状晶体,工业品为浅黄色或褐色针状晶体 ,吸水性强。三唑有两种结构,即1,2,4-三唑和1,2,3-三 唑。从结构上来说,1,2,4-三唑比1,2,3-三唑更稳定,所 以三唑类含能化合物中,以1,2,4-三唑的含能材料明显多 于1,2,3-三唑。
5-氨基-3-硝基-1,2,4-三唑(ANTA)是一种钝感的 含能材料,密度是1.8199/cm3,熔点238℃。首次由 Pevzner等人合成。经众多研究,2006年,王锡杰 等[8]人又对其合成工艺进行改进,使收率提升至64 %,纯度达98%。合成方法如下:
吡唑及其衍生物
• 吡唑类化合物是典型的高能量密度化合物,近年来 ,此类杂环化合物的合成引起了广大含能材料工作 者的广泛关注,杂环化合物通常比传统的常规含能 材料具有更高的氧平衡和密度,尤其是富氮杂环。 • 吡唑分子是含有两个氮原子的五元杂环化合物,是 设计含氮杂环物的理想结构单元。 • 吡唑类含能材料主要分为两类:单吡唑及并吡唑。 并吡唑类含能化合物由于其紧凑的结构通常比单吡 唑类具有更:xxx
综述背景及目的
综述内容 综述结果与意义 讨论与总结
在工业不断发展的今天,火药、炸药等高能产物越来越受到各国的 青睐,对含能化合物的研究更是日益重视,含能化合物的研究有助于国 家军事力量的提升。国内外各研究机构正在寻找能量密度高、且安全性 能好的含能材料。 目前,含能材料多用于火药、炸药、火箭推进剂、烟火剂等,给我 们的生活带来了极大的提升。
• 4,5-二硝基咪唑(4,5-DNI)是含有两个C-NO2五元杂 环化合物,在含能材料中用作推进剂,与氨反应所 制得的铵盐,可作为燃烧催化剂。是一种高能钝感炸 药,环上两个硝基的强吸电特性,导致N-H显酸性,其 应用受到一定限制。杨国臣等人以价格低廉的咪唑 为原料,一次制备成4,5-二硝基咪唑。
• 5,5 -二硝基-3,3’-偶氮-I H-1,2 ,4-三唑( DNAT)是 通过ANTA的氧化来制备的。在酸性介质中,用高锰 酸钾氧化ANTA的钾盐可得到DNAT,但收率低,产品 纯度差。Daren等用现生成的高锰酸来氧化制备 DNAT时,得到的产率和纯度更好,但仍在尝试大量生 产中。
1,2,3-三唑是五元氮杂环, 是酰胺键的电子等 排物,它在代谢转化、氧化还原及酸碱条件下都具有 相当强的稳定性。 由一价铜催化的端炔烃和有机叠氮化合物制备 1,4-二取代-1,2,3-三唑的方法具有反应条件温和、 选择性高等满足click化学要求的优点。
近几十年来,一系列新型唑类含能化合物相继被合成较 为典型的有DNT、ANTA、MDNT、DNP等,这些典型的 唑类化合物已在高能钝感炸药、推进剂、烟火剂及其他领 域有了好的应用。 在此基础上,对此类化合物研究进展的综述是非常有必 要,且有助于更好的研究此类化合物。
综述内容
一、唑类化合物的简单介绍 二、简单唑类化合物的合成进展 三、结果与展望
back
• 唑类含能化合物是含能材料中重要的一类化合物,其中很多化 合物及其衍生物展示了较好的含能材料应用前景,高能量、高 稳定性和环境友好等特点,属于一类新型的高能量密度材料, 必将成为含能材料领域的一个重要的研究方向。
• 希望通过此综述,大家能对唑类化合物目前的研究 有所了解,有所认识,同时希望有助于含能材料工 作者的工作。
唑类化合物分子结构中含有N - N 键、C- N 键等高能化学键,具有高氮的特点,是一类新型的 含能材料,唑类化合物有三唑、咪唑、吡唑、四唑 等,可作为高能量密度的新型材料。
back
咪唑及其衍生物
• 咪唑为无色棱形结晶或微黄色结晶,有氨气味,显弱碱性。由乙二醛 经环合;中和而得。 • 咪唑用作环氧树脂固化剂,铜的防锈剂、医药、农药原料,也用作脲醛 树脂固化剂、摄影药物、粘合剂、涂料、橡胶硫化剂、防静电剂等 的原料及有机合成中间体。
• 3,6-二硝基吡唑[4,3-C]并吡唑(DNPP),是吡 唑类富氮化合物,氮含量42.42%,DNPP胺盐具有 较高的含氮量和生成焓,其燃烧的中间产物为碱性 物质,可成为火焰配方抑制剂和燃速改良剂。 back • 目前对DNPP的合成研究是以乙酰丙酮为起始原料 ,经环化、重氮化、双环构建、硝化、氧化、脱羧 硝化等反应合成DNPP。
• 硝基咪唑是指硝基取代的咪唑类化合物,具 有对静电、摩擦和撞击顿感、热稳定性好的 性能,是一类新型优良的不敏感含能材料。 这类硝基取代的含能化合物主要有1, 4-二硝 基咪唑、4, 5-二硝基咪唑 、2, 4, 5-三硝基 咪唑,它们所含的硝基的数目和位置不同, 在 含能性能方面也有些差异。
1,4-二硝基咪唑(1,4-DNI)可用以咪唑为原料, 浓硫酸和乙酸酐及硝酸铵组成硝化剂直接硝 化制得,也可用硝基咪唑加入乙酸,乙酸酐 和浓硝酸混合液硝化制得,制法如下:
谢谢观赏
