标准曲线的制作方法
使用excel制作标准曲线的步骤

使用excel制作标准曲线的步骤Excel是一款功能强大的电子表格软件,可以用于制作标准曲线。
标准曲线是一种用于分析数据和确定未知浓度的常用工具。
下面是使用Excel制作标准曲线的详细步骤。
步骤一:准备数据首先,你需要有一组已知浓度和对应的实验测量值。
这些浓度可以是不同范围内的连续值,比如0、1、2、3、4、5等。
你可以通过实验室测量或者其他方法获取这些数据。
步骤二:打开Excel在电脑上找到并打开Excel软件。
如果你没有安装Excel,你可以在Microsoft官方网站上下载安装。
步骤三:创建表格在Excel中,创建一个新的电子表格。
点击"文件"选项卡,然后选择"新建"创建一个新的表格。
你也可以直接双击Excel图标打开空的电子表格。
步骤四:输入数据在电子表格中,按照已知浓度和实验测量值的顺序输入数据。
比如,在A列中输入浓度值,然后在B列中输入对应的实验测量值。
步骤五:绘制散点图选中浓度和测量值的数据范围。
点击"插入"选项卡,然后在"图表"组中选择"散点图"。
选择一个散点图的样式,比如"散点图"。
步骤六:添加趋势线在Excel中,趋势线是对曲线的近似描述。
在绘制曲线图之后,你可以选择添加趋势线。
选择绘制的曲线,然后右键点击,选择"添加趋势线"。
在弹出的"添加趋势线"对话框中,选择一个适合的趋势线类型,比如线性、二次或三次拟合曲线。
然后点击"确定",Excel会自动生成趋势线。
步骤七:调整图表样式你可以调整图表的样式,使其更易于理解和使用。
你可以修改图表的标题、坐标轴标签等。
点击"图表设计"选项卡,选择合适的图表布局、图表样式等。
步骤八:计算未知浓度标准曲线可以用于计算未知浓度。
你可以通过测量未知样本的实验测量值,然后使用标准曲线的方程来计算未知浓度。
标准曲线制作方法

标准曲线制作方法
标准曲线是实验室常见的一种分析方法,通过标准曲线可以准
确地测定样品中目标成分的含量。
下面将介绍标准曲线的制作方法,希望能对您有所帮助。
首先,准备标准溶液。
选择纯准的目标成分,按照一定的浓度
比例,分别配制出一系列浓度不同的标准溶液。
通常情况下,至少
需要3个不同浓度的标准溶液,以便绘制出一条较为准确的标准曲线。
其次,进行实验测定。
将标准溶液和待测样品分别加入相应的
试剂,进行反应后进行测定。
通常情况下,测定的方法包括光谱法、色谱法、电化学法等,根据不同的目标成分选择合适的测定方法。
然后,绘制标准曲线。
将实验测定得到的各个标准溶液的浓度
和相应的测定数值进行配对,利用绘图软件或者手工绘图,绘制出
标准曲线。
标准曲线通常为一条直线或者曲线,其斜率和截距与目
标成分的浓度成正比。
最后,进行样品测定。
将待测样品进行相同的实验测定,并利
用标准曲线来计算出目标成分的浓度。
根据标准曲线的方程,将待测样品的测定数值代入方程中,即可得到目标成分的浓度。
需要注意的是,在制作标准曲线的过程中,应该尽量避免实验误差的影响。
在配制标准溶液时,应该使用精密的量具,确保浓度的准确性;在实验测定时,应该严格按照操作规程进行,减小实验误差的发生;在绘制标准曲线时,应该选择合适的拟合方法,确保曲线的拟合度较高。
总之,标准曲线制作方法是一项重要的实验技术,正确的制作和应用标准曲线,可以提高实验数据的准确性和可靠性,为科研工作提供有力的支持。
希望本文介绍的标准曲线制作方法能够对您有所帮助,谢谢阅读!。
怎么做标准曲线

怎么做标准曲线标准曲线是实验室常见的实验操作,它是一种用于定量分析的重要工具。
标准曲线可以帮助我们确定未知样品中目标物质的浓度,从而进行准确的定量分析。
下面将介绍如何制作标准曲线的步骤和注意事项。
首先,准备标准溶液。
标准曲线的制作首先需要准备一系列已知浓度的标准溶液。
这些标准溶液的浓度应该覆盖到你需要分析的样品中目标物质的浓度范围。
比如,如果你需要分析样品中某种药物的浓度,那么你需要准备一系列不同浓度的该药物标准溶液。
其次,进行实验操作。
取一定体积的标准溶液,加入适量的试剂,进行反应或者测量。
比如,你可以使用分光光度计测量吸光度,或者进行色谱分析等。
记录下每个标准溶液的测量值。
接下来,绘制标准曲线。
将每个标准溶液的浓度和对应的测量值绘制成图表,通常是浓度作为横坐标,测量值作为纵坐标。
然后使用拟合曲线的方法,比如线性拟合、二次拟合等,得到标准曲线的方程式。
最后,验证标准曲线。
使用未知样品进行测量,得到测量值后,代入标准曲线的方程式,计算出未知样品中目标物质的浓度。
如果计算出的浓度与实际测量值相符合,说明标准曲线是可靠的。
在制作标准曲线的过程中,需要注意一些事项。
首先,标准溶液的制备要求准确,需要严格按照配制方法进行操作,避免浓度误差。
其次,实验操作要规范,避免操作失误带来的数据偏差。
最后,在绘制标准曲线时,要选择合适的拟合方法,确保拟合曲线与实验数据吻合度高。
总之,制作标准曲线是一项需要严谨操作和精确计算的工作,但它对于定量分析具有重要意义。
只有通过正确的制备标准溶液、准确的实验操作和合适的拟合方法,才能得到可靠的标准曲线,为后续的定量分析提供准确的数据支持。
希望以上内容能够帮助您更好地理解和掌握标准曲线的制作方法。
怎样绘制标准曲线

怎样绘制标准曲线
首先,准备实验所需的材料和仪器。
通常情况下,我们需要准备标准样品、实验室常用的仪器(比如分光光度计、色谱仪等)、实验室常用的试剂和溶剂等。
确保所有的材料和仪器都是干净的,并且处于良好的工作状态。
其次,根据实验的需要选择合适的标准样品。
标准样品的选择应当与待测样品的性质相符合,确保标准样品的浓度范围覆盖到待测样品的浓度范围内。
这样才能够绘制出准确的标准曲线。
然后,按照实验的要求进行标准样品的稀释。
通常情况下,标准样品的浓度会比较高,需要进行适当的稀释,使得标准样品的浓度可以覆盖到待测样品的浓度范围内。
在进行稀释的过程中,需要注意精确的操作,避免出现误差。
接着,进行实验测量。
将稀释后的标准样品依次放入仪器中进行测量,记录下每个标准样品的测量数值。
在记录数据的过程中,需要注意保持仪器的稳定,避免外界因素对实验结果的影响。
最后,根据实验测量得到的数据绘制标准曲线。
通常情况下,
我们会将标准样品的浓度作为自变量,测量数值作为因变量,绘制
出标准曲线的图像。
在绘制曲线的过程中,需要选择合适的曲线拟
合方法,确保曲线能够准确地反映出标准样品浓度与测量数值之间
的关系。
绘制标准曲线是实验室工作中非常重要的一环,准确的标准曲
线可以帮助我们准确地测量和分析样品中的成分。
通过以上的步骤,我们可以清晰地了解到如何绘制标准曲线,希望这些内容对你有所
帮助。
标准曲线的制作方法

标准曲线的制作方法一、引言在科学研究和实验室分析中,标准曲线常常被用于定量分析和测量。
标准曲线是一种通过已知样品与相应浓度的反应来建立反应的浓度与光学信号或其他物理信号之间的关系的方法。
本文将介绍标准曲线的制作方法,以帮助读者理解并在实践中正确应用标准曲线。
二、标准曲线的基本原理标准曲线的制作是建立在测量信号和物质浓度之间的线性关系基础上的。
通过使用已知浓度的标准溶液,测量其光学或其他物理信号的强度,并在坐标图上绘制这些测量值,就可以得到一条标准曲线。
标准曲线的关键是选择合适的测量方法和目标反应体系,以确保反应的可重复性和准确性。
三、标准曲线的制作步骤1.准备标准溶液:根据实验需要,选择适当浓度的标准溶液。
使用已知精确浓度的标准物质按需稀释制备一系列标准溶液。
2.进行测量:使用合适的仪器或方法,测量每个标准溶液的光学信号或其他物理信号的强度。
确保测量过程中的实验条件相同,以保证结果的准确性。
3.绘制标准曲线:将每个标准溶液的测量结果作为坐标,绘制浓度与信号强度之间的关系图。
一般来说,浓度作为横坐标,信号强度作为纵坐标。
使用合适的软件工具或手工绘图完成。
4.拟合曲线:对标准曲线进行拟合,以获得曲线的数学方程。
常见的拟合方法包括线性回归、多项式回归和指数回归等。
选择最适合数据集的拟合方法,拟合结果要具有良好的拟合度和准确性。
5.验证曲线:使用额外的未知浓度样品进行验证,通过测量样品的信号强度,并利用标准曲线反推出样品的浓度。
与已知的样品浓度进行比较,验证标准曲线的准确性和可靠性。
四、注意事项在制作标准曲线的过程中,需要注意以下几点: - 标准溶液的制备要精确,以确保每个标准溶液的浓度是准确的。
- 测量过程中要严格控制实验条件,避免其他因素对测量结果的影响。
- 标准曲线的选择要根据实验需要和样品性质来确定,确保曲线能够准确描述样品浓度与信号强度之间的关系。
- 尽量使用合适的拟合方法,以减小拟合误差和提高曲线的准确性。
标准曲线怎么做

标准曲线怎么做标准曲线是实验室常见的一种实验方法,它可以用来测定物质的浓度、纯度等参数,是化学分析中常用的一种定量分析方法。
下面将介绍标准曲线的制作方法及注意事项。
首先,准备工作。
在进行标准曲线制作之前,需要准备好实验所需的仪器和试剂,确保实验环境清洁整洁,避免外部因素对实验结果的影响。
其次,制作标准溶液。
选择一种纯度较高的化合物作为标准品,按照一定的比例将其溶解于溶剂中,制备出一系列不同浓度的标准溶液。
在制备标准溶液的过程中,需要严格控制各个浓度点的溶液配制,确保溶液浓度的准确性和稳定性。
接下来,进行实验操作。
将制备好的标准溶液分别加入到实验样品中,进行分析测定。
根据实验结果,绘制出标准曲线图表,通常是以浓度为横坐标,测定数值(如吸光度、电流等)为纵坐标,通过实验数据的拟合,得到标准曲线的方程式。
最后,分析实验结果。
利用标准曲线方程,可以根据待测样品的测定数值,反推出其浓度或其他参数。
需要注意的是,在进行实验分析时,要严格按照实验操作规程进行,确保实验结果的准确性和可靠性。
在进行标准曲线制作的过程中,需要注意以下几点事项:1. 选择合适的标准品,确保其纯度和稳定性,以提高标准曲线的准确性和可靠性。
2. 在制备标准溶液时,需要精确称量和配制,避免因为操作失误导致标准溶液浓度不准确。
3. 实验操作过程中,要注意仪器的使用和维护,确保实验数据的准确性。
4. 在进行实验分析时,要注意环境因素的影响,避免外部因素对实验结果的干扰。
总之,标准曲线的制作是一项重要的实验方法,它可以用来定量分析物质的浓度、纯度等参数,是化学分析中不可或缺的一部分。
在进行标准曲线制作时,需要严格按照操作规程进行,确保实验结果的准确性和可靠性。
同时,也需要不断积累经验,提高实验操作的技能,以提高标准曲线制作的效率和准确性。
标准曲线的制作方法

标准样品的准备由于你做的是基因表达分析,样品的准备就比较简单了,因为你要知道都是相对的数值(你的对照样品和实验样品中基因表达的比值),这样就不需要知道精确的拷贝数,所以标准品也就无须知道精确的拷贝数,只需知道稀释的倍数就可以了。
你实验中的标准品可以是来源比较丰富的细胞或组织的RNA转录得到的cDNA。
将这种cDNA进行梯度的稀释,可以是稀释10倍,100,1000,10000等倍(具体到你的实验要根据具体的情况来调整稀释倍数。
最好能作一个预实验来看看什么样的稀释倍数比较适合你的这种基因的扩增)。
而对于各个稀释倍数我们要对它的拷贝数进行赋值,这个值当然不是标准品中真实含有的基因数量(在基因表达分析中也不需要),而是我们根据稀释倍数给每一个稀释度人为赋予的拷贝数,这只是为了方便实验最终结果的计算而已。
比如我们把前面稀释十倍的样品赋值为10000个拷贝,100倍的赋值为1000个拷贝依次类推把10000倍的赋为10等。
要注意,赋值的数目的倍数差异和你稀释的倍数是一样的,比如前面是10稀释,后面赋值也是10倍变化。
如何做标准曲线在定量实验中标准品是要和你的未知样品一起进行定量实验的,这样在实验结束,无论是标准品还是未知样品都将跑出曲线,获得Ct值。
那么我们先可以把未知样品放到一边,对于标准品来说,我们既获得了Ct值,还知道他们的拷贝数(虽然这个拷贝数是我们自己赋予的)。
这样我们可以通过标准品的Ct值和拷贝数做一条标准曲线(以拷贝数为横坐标,而Ct值为纵坐标)。
一旦作出了标准曲线,而未知样品的Ct值我们知道(通过实验求得的),这时候就在标准曲线上进行定位,就可以得到未知样品的拷贝数了。
事实上,操作起来没有那么复杂,你只需要告诉软件你的哪个孔是标准品,哪个是未知样品,以及标准品的拷贝数等必要信息,软件会自动帮你把标准曲线和未知样品的拷贝数计算出来。
举例来说如何进行设置先进入软件,在板设置中选择所放样品的位置,并标上unknow或standard等信息。
标准曲线制作方法
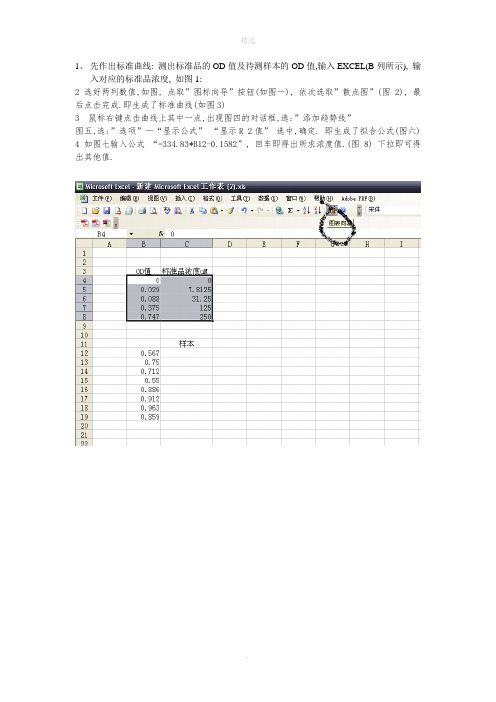
1、先作出标准曲线: 测出标准品的OD值及待测样本的OD值,输入EXCEL(B列所示), 输
入对应的标准品浓度, 如图1:
2 选好两列数值,如图, 点取”图标向导”按钮(如图一), 依次选取”散点图”(图2), 最后点击完成.即生成了标准曲线(如图3)
3 鼠标右键点击曲线上其中一点,出现图四的对话框,选:”添加趋势线”
图五,选:”选项”—“显示公式”“显示R 2值”选中,确定. 即生成了拟合公式(图六) 4 如图七输入公式“=334.83*B12-0.1582”, 回车即得出所求浓度值.(图8) 下拉即可得出其他值.
感谢您的支持与配合,我们会努力把内容做得更好!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精选
、做标准曲线样品检测时有几个问题需要注意
1、样品的浓度等指标是根据标准曲线计算出来的,所以首先要把做标准曲线看作是比做正式实验还要重要的一件事,否则后面的实验结果无从谈起。
2、设置标准曲线样品的标准浓度范围要有一个比较大的跨度,并且要能涵盖你所要检测实验样品的浓度,即样品的浓度要在标准曲线浓度范围之内,包括上限和下限。
而对于呈S型的标准曲线,尽量要使实验样品的浓度在中间坡度最陡段,即曲线几乎成直线的范围内。
3、最好采用倍比稀释法配制标准曲线中的标准样品浓度,这样就能够保证标准样品的浓度不会出现较大的偏离。
4、检测标准样品时,应按浓度递增顺序进行,以减少高浓度对低浓度的影响,提高准确性。
5、标准曲线的样品数一般为7个点,但至少要保证有5个点。
6、做出的标准曲线相关系数因实验要求不同而有所变动,但一般来说,相关系数R至少要大于0.98,对于有些实验,至少要0.99甚至是0.999.
感谢您的支持与配合,我们会努力把内容做得更好!
.。
