第一节元素周期表
合集下载
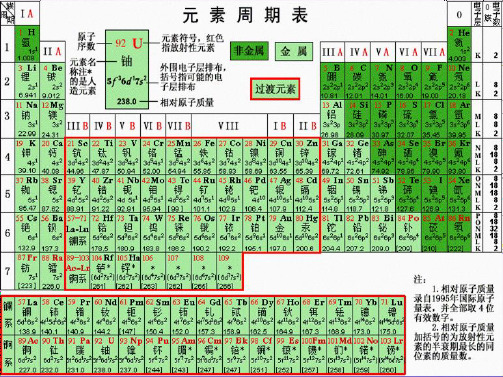
元素周期表

a m种 b. ⅢA至ⅦA和X 族的相邻元素,原子序数相差下一周期的元素种数。 至 和O族的相邻元素 原子序数相差下一周期的元素种数。 a 族的相邻元素,
X
m种 n种
则b=a+n
0
IA
第一周期 第二周期 第三周期
1H 3Li
bY
n种
则b=a+m
bY
IIA 相差25 相差1 相差 相差
4Be
IIIA IVA VA VIA VIIA 2He 2
(1)、同周期IIA、IIIA元素原子序数的关系 、同周期 、 元素原子序数的关系
除相同长周期第Ⅱ 族 族元素的原子序数相差11或 外 除相同长周期第ⅡA族、ⅢA族元素的原子序数相差 或25外,其余原子序数相差均 族元素的原子序数相差 为1。 。
(2)、同主族相邻元素原子序数的关系 、
ⅢA~ⅦA a.ⅠA和ⅡA相邻元素,原子序数相差上一周期的元素种数。 元素种类 Ⅰ 和 相邻元素, 元素种类 相邻元素 原子序数相差上一周期的元素种数。 ⅠA~ⅡA
周期:电子层数相同,原子序数从左到右依次增大。 周期:电子层数相同,原子序数从左到右依次增大。
一、元素周期表结构: 元素周期表结构:
族:最外层电子数相同,原子序数从上到下依次增 最外层电子数相同, 大。
锕系。 锕系。 注意:1.IIIB有两个系:镧系、 注意: 有两个系:镧系、 有两个系 2.从IIIB到IIB共10个纵行的元素称过渡元素, 从 个纵行的元素称过渡元素, 到 共 个纵行的元素称过渡元素 这些元素都是金属,又称过渡金属。 这些元素都是金属,又称过渡金属。 0
元 素 周 期 表
1、周期: 周期: 周期表中,把电子层数目相同的元素, 原子序数递 周期表中,把电子层数目相同的元素,按原子序数递 增的顺序从左到右排成横行,形成一个周期 周期。 增的顺序从左到右排成横行,形成一个周期。 ①七个横行,七个周期。其中:三个短周期(1、2、 七个横行,七个周期。其中:三个短周期( ),三个长周期 三个长周期( ),一个不完全周期 一个不完全周期( 3),三个长周期(4、5、6),一个不完全周期(7) ②每一周期元素电子层数相同,从左到右原子序数递 每一周期元素电子层数相同, 增。 ③周期序数=电子层数 周期序数=
X
m种 n种
则b=a+n
0
IA
第一周期 第二周期 第三周期
1H 3Li
bY
n种
则b=a+m
bY
IIA 相差25 相差1 相差 相差
4Be
IIIA IVA VA VIA VIIA 2He 2
(1)、同周期IIA、IIIA元素原子序数的关系 、同周期 、 元素原子序数的关系
除相同长周期第Ⅱ 族 族元素的原子序数相差11或 外 除相同长周期第ⅡA族、ⅢA族元素的原子序数相差 或25外,其余原子序数相差均 族元素的原子序数相差 为1。 。
(2)、同主族相邻元素原子序数的关系 、
ⅢA~ⅦA a.ⅠA和ⅡA相邻元素,原子序数相差上一周期的元素种数。 元素种类 Ⅰ 和 相邻元素, 元素种类 相邻元素 原子序数相差上一周期的元素种数。 ⅠA~ⅡA
周期:电子层数相同,原子序数从左到右依次增大。 周期:电子层数相同,原子序数从左到右依次增大。
一、元素周期表结构: 元素周期表结构:
族:最外层电子数相同,原子序数从上到下依次增 最外层电子数相同, 大。
锕系。 锕系。 注意:1.IIIB有两个系:镧系、 注意: 有两个系:镧系、 有两个系 2.从IIIB到IIB共10个纵行的元素称过渡元素, 从 个纵行的元素称过渡元素, 到 共 个纵行的元素称过渡元素 这些元素都是金属,又称过渡金属。 这些元素都是金属,又称过渡金属。 0
元 素 周 期 表
1、周期: 周期: 周期表中,把电子层数目相同的元素, 原子序数递 周期表中,把电子层数目相同的元素,按原子序数递 增的顺序从左到右排成横行,形成一个周期 周期。 增的顺序从左到右排成横行,形成一个周期。 ①七个横行,七个周期。其中:三个短周期(1、2、 七个横行,七个周期。其中:三个短周期( ),三个长周期 三个长周期( ),一个不完全周期 一个不完全周期( 3),三个长周期(4、5、6),一个不完全周期(7) ②每一周期元素电子层数相同,从左到右原子序数递 每一周期元素电子层数相同, 增。 ③周期序数=电子层数 周期序数=
化学必修元素周期表ppt课件

ppt课件.
41
总结:
碱金属的原子结构
Li Na K Rb Cs
1.相似性:
最外层上都只 有一个电子
化学性质相似
1) 都易失电子表现强还 原性
2) 化合物中均为+1价
核电荷数
2.递变性: 电子层数
原子半径
核对最 外层电 子的引 力
失电 子能 力
还原 性
金 属 性
(电子层数的影响大于核电荷数的影响)
很好 逐渐增大(K特殊) 单质的熔沸点逐渐降低
ppt课件.
40
通过比较碱金属单质与氧气、水的反应, 我们可以看出,元素性质与原子结构有密 切关系,主要与原子核外电子的排布,特 别是 最外层电子数 有关。原子结构相 似的一族元素,它们在化学性质上表现出
相似性 和递变性 。
在元素周期表中,同主族元素从上到下原 子核外电子层数依次 增多 ,原子半径逐 渐 增大 ,失电子能力逐渐 增强 ,金 属性逐渐 增强 。
通过大量实验和研究,人们得出了如下结论:
碱金属元素原子的最外层都有1个电子,它们的化学性
质彼此相似 ,它们都能与 水 等非金属单质以及氧气 反应,表现出金属性(还原性).
4Li+O2=2Li2O
2Na+O2=Na2O2 2Na+2H2O=2NaOH +H2↑
2K+2H2O=2KOH +H2↑
上述反应的产物中,碱金属元素的化合价都是 +1 。
49
卤族元素: 氟(F)
F +9 2 7
氯(Cl)
Cl + 1 7 2 8 7
溴(Br)
Br +35 2 8 18 7
碘(I)
I +53 2 8 1818 7
第一节 元素周期表(人教版)必修二
• 特性:HF能与SiO2反应,储存是用塑料容器
Page 29
卤素单质与水的反应
2F2+2H2O = 4HF+O2 (特例) Cl2 +H2O = HCl+HClO
Br2+ H2O = HBr+HBrO
反 应 越 来 越 难 以 发 生
Page 30
卤素单质与金属的反应
与钠的反应 2Na+Cl2=2NaCl 与铁的反应 2Fe+3Cl2=2FeCl3 Fe+I2=FeI2 与铜的反应 Cu+Cl2=CuCl2 Cu+Br2=CuBr2
反应条件(F2 → I2)
所需条件越来越高。
生成的氢化物的稳定性(F2→I2)
氢化物的稳定性越来越差。
Page 28
氢化物性质的递变规律
• 酸性:HF<HCl<HBr<HI • 热稳定性: HF>HCl>HBr>HI • 沸点:HF>HI>HBr>HCl
• 还原性:HI>HBr>HCl>HF
Page 41
2.3 卤素单质的物理性质
溴的物理性质:
常温下,是深红棕色液体
易挥发,溴蒸气为红棕色,有刺激性气味
密度比水,大在水中的溶解度不大
溴的保存:
密闭保存,加水液封,盛溴的试剂瓶不可 选用橡胶塞。
Page 42
碘的物理性质: 碘是一种紫黑色固体 具升华性质,碘的蒸气呈紫色 固态物质不经过转变成液态而直接变成气态 的现象) 碘(I2)遇淀粉变蓝色 溴和碘易溶于有机溶剂
Page 23
碱金属物理性质的相似性与递变性
(1)相似性
①除Cs外,其余的都呈银白色; ②碱金属都比较柔软,有延展性; ③密度较小; ④熔、沸点较低; ⑤导热、导电的性能都很强。
Page 29
卤素单质与水的反应
2F2+2H2O = 4HF+O2 (特例) Cl2 +H2O = HCl+HClO
Br2+ H2O = HBr+HBrO
反 应 越 来 越 难 以 发 生
Page 30
卤素单质与金属的反应
与钠的反应 2Na+Cl2=2NaCl 与铁的反应 2Fe+3Cl2=2FeCl3 Fe+I2=FeI2 与铜的反应 Cu+Cl2=CuCl2 Cu+Br2=CuBr2
反应条件(F2 → I2)
所需条件越来越高。
生成的氢化物的稳定性(F2→I2)
氢化物的稳定性越来越差。
Page 28
氢化物性质的递变规律
• 酸性:HF<HCl<HBr<HI • 热稳定性: HF>HCl>HBr>HI • 沸点:HF>HI>HBr>HCl
• 还原性:HI>HBr>HCl>HF
Page 41
2.3 卤素单质的物理性质
溴的物理性质:
常温下,是深红棕色液体
易挥发,溴蒸气为红棕色,有刺激性气味
密度比水,大在水中的溶解度不大
溴的保存:
密闭保存,加水液封,盛溴的试剂瓶不可 选用橡胶塞。
Page 42
碘的物理性质: 碘是一种紫黑色固体 具升华性质,碘的蒸气呈紫色 固态物质不经过转变成液态而直接变成气态 的现象) 碘(I2)遇淀粉变蓝色 溴和碘易溶于有机溶剂
Page 23
碱金属物理性质的相似性与递变性
(1)相似性
①除Cs外,其余的都呈银白色; ②碱金属都比较柔软,有延展性; ③密度较小; ④熔、沸点较低; ⑤导热、导电的性能都很强。
第一节元素周期表

【解析】选C。本题考查对元素周期表的认识,第1周期只有两
种元素,故A项错。2号元素位于元素周期表中的最后一列,故B
项错。10号元素为稀有气体元素,其下面必为18号稀有气体元
素,故D项错。
类型 二
元素周期表的应用 )
【典例】(2013·聊城高一检测)下列说法正确的是( A.原子序数之差为2的两种元素不可能位于同一主族 B.D-核外有36个电子,则元素D位于第4周期第ⅦA族
二、现行元素周期表的编排原则
周期表 中的顺序给元素编号。 1.原子序数:按照元素在_______ 2.原子序数与原子结构之间的关系: 核电荷数 质子数 核外电子数 。 原子序数=_________=_______=___________
电子层数 原子序数
最外层电子数
电子层数
三、元素周期表的结构 1.周期(横行): 7 个横行,即有__ 7 个周期。 (1)数目:元素周期表有__
C.位于同一主族相邻的甲乙两种元素,甲的原子序数为x,则乙 的原子序数可能为x+4
D.位于同一周期的甲乙两种元素,甲位于ⅠA族,原子序数为x,
乙位于ⅢA族,则乙原子序数可能为x+19
【解题指南】解答本题要注意以下3点: (1)第1~7周期分别含有2、8、8、18、18、32、32种元素,同 一主族两种元素的原子序数的差值为上列数值或连续几个数值 之和。 (2)不同周期ⅠA族与ⅢA族之间相隔的元素数量不一定相同。
(3)简单阴离子的核外电子与同周期的稀有气体相同。
【解析】选B。氢和锂两种元素的原子序数之差为2,却同位于 第ⅠA族,A错误;简单阴离子的核外电子与同周期的稀有气体相 同,D-核外有36个电子,即与第4周期的0族元素Kr处于同一周期, 且D比Kr少一个电子,即在第ⅦA族,B正确;甲乙同主族,根据元
第一节元素周期表(共40张PPT)
第ⅦA 族
与水缓慢反应
(2)原子结构特点 Cl2+H2O=HCl+HClO
静置后,液体分为两层。
通一过个以 12上C相质比量较同×,1点/思12考:钠和钾最的外性质层有 7个电子
静置后,液体分为两层。
和递变性。 (氧化性:Cl2 >I2)
核电荷数依次增多
不同点: 电子层数依次增多 上层无色,下层分别呈橙红色、紫红色
第一章 物质结构、元素周期律
第一节 元素周期表 一、元素周期表的结构
原子序数:依原子核电荷数由小到大的顺序给元素编号,这种
编号叫原子序数。
原子序数=核电荷数=质子数=核外电子数 (一)元素周期表的编排原则
1、横行: 把电子层数相同的各种元素按原子序数递增顺序
从左到右排列。
2、纵行: 把最外层电子数相同的各种元素按电子层数递增顺序 从上而下排成。
性逐渐增强,非金属性逐渐减弱。
2. 元素性质与原子结构有有密切的关系,主要与原子
核外的排布,特别是最外层电子数有关。原子结构
相似的一族元素,它们在化学性质上表现出相似性 和递变性。
1、砹(At)原子序数85,与F、Cl、Br、I同族,推测砹或
砹的化合物不可能具有的性质是( B)
A、砹易溶于某些有机溶剂 B、砹能与水剧烈反应
应越来越
,剧生烈成的氧化物越来越
。
最高复价杂氧化物对应水化物的碱性越来越 。
强
讨论1:Li与K 应如何保存? Li封存于固体石蜡中, 少量K保存于煤油中。
讨论2:碱金属与盐酸: 2R+2H+= 2R++H2 ↑ 讨论3:碱金属与盐溶液: 先与水反应
讨论4:Li+、Na+、K+、Rb+、Cs+也具有强还原性吗? 没有。 有较弱的氧化性。 氧化性: Li+ > Na+ > K+ > Rb+ > Cs+
第一节:元素周期表1

课堂练习:
练习册P3页:课内巩固
基础训练
思考:
我们把几种元素排成同一个主族的依据是?
最外层电子数相同,化学性质相近。 结论: 元素的性质与元素原子的结构密切相关!
元素在周期表中的位置 原子结构 (层数和最外 层电子数) 元素性质
一、碱金属元素(第ⅠA族)——Li Na K Rb Cs(Fr)
递变性:从Li→Cs(随着碱金属核电荷数的增加), 相似性:碱金属都是银白色金属(除铯外),柔软,密度 碱金属的密度逐渐↑(钾例外), 较小,熔点较低,导电、导热性和延展性。 熔、沸点 变 性
Li
Na
电子层数 ↑
原子半径 ↑ 原子核对最外层电子的吸引力 ↓
失电子能力 ↑ 金属性(还原性) ↑
X、Y 、Z是周期表中相邻的三种短周期元素,原 子序数依次增大。X和Y同周期,Y和Z同主族, 三种元素原子的最外层电子数之和为17,核内 质子数之和为31,则X、Y、Z分别是?
答案:N、 O、 S 思路:★先把三者的相对位置表示出来; ★同主族元素最外层电子数相同, 则可设最外 层电子数为a来求解。 ★再根据原子核外电子数=质子数这一规律
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
6
55
56
5771
72
73
74
75
76
77
78
79
80
81
82
83
84
85
人教版高中化学必修二第一章第一节 《元素周期表 》课件(共15张PPT)
B.原子的核外电子数
C.原子核内的质子数
√D.原子的中子数
1.原子序数为 x 的元素位于第IA族,那么原子序 数为 x+2 的元素肯定不会在( )
√ A.第 IA 族 B.第ⅢB族 C.第ⅢA族 D.0族
【提示】若x为氢元素,则A正确;若x为锂或钠, 则C正确;若x在第4、5、6、7周期,则B项正确。 故答案为D。
3.第ⅠA族和0族元素的原子序数
4.每周期元素的种数
一、元素周期表的结构 “三短”“四长”;“七主”“七副”“0族和Ⅷ族” 二、元素原子结构与其在周期表中位置的关系.
周期序数=电子层数 主族序数=最外层电子数
原子序数
核外电子排布
周期表中位置
1.不能作为元素周期表中元素排列顺序的依据是
A.原子的核电荷数
螺旋式元素周期表
金字塔式元素周期表
1869年,俄国化学家门捷列夫将 元素按照相对原子质量由小到大 依次排列,制出了第一张元素周 期表,这就是现代元素周期表的 雏形。
第一章 物质结构 元素周期律
第一节 元素周期表
【思考与交流】
周期表的结构
阅读教材P4、5页并结合周期表,讨论以下问题
1.元素周期表的编排原则是什么?周期表有多 少横行,多少纵行,多少族?
A.若X是氢,则Y是氦
√C.若X是氟,则W是硫
B.若Y是氦,则Z是钠 D.若Y是氟,则Z是铝
例.已知某主族元素的原子结构示意图如下,判断 其位于第几周期,第几族?
【提示】X为第4周期,第ⅠA族;Y为第5周期,第 ⅦA族。
【记一记】
周期表的结构
1.原子序数=核电荷数=质子数=核外电子数
2.周期序数=电子层数 主族序数=最外层电子数
化学必修二元素周期表
本节要点
A
了解族与周期,掌握原子序数 与原子结构关系
掌握碱金属、卤素的结构特点、
B
化学性质、物理性质相似性、
递变性、特殊性
C
掌握原子的结构
D
熟练计算A、Z、N
E
熟练掌握同位素、元素、核素 的区别与联系
F
熟练掌握10电子、18电子微 粒
通式:2R + 2 H2O = 2 ROH + H2↑
板书
递变性(Li-Cs):
1
2
3
4
5
失e-能力增强
与氧气反应越来 越剧烈,产物越
来越复杂
与水或酸反应剧 烈程度增强
碱性增强:
LiOH<NaOH< 还原性(金属性)
KOH<RbOH<
增强
CsOH
6
板书
小试牛刀
C 下列关于铯及其化合物的说法中,不正确的是( )
第一章 物质结构 元 素周期律
单击此处添加副标题
第一节 元素周 期表
汇报日期
元素周期表
A
元素周期表
B
元素周期表的编制
C
发明人:俄国化学家——门捷列夫 (按相对原子质量从小到大)
D
现行:按核电荷数从小到大(原 子核所带正电荷数)
原子序数与原子结构关系:
E
原子序数=核电荷数=质子数=核
F
外电子数
板书
1. 氢氧化铯是一种强碱,易溶于水 2. 铯与水反应十分剧烈,甚至发生爆炸 3. 碳酸铯用酒精灯加热可以生成氧化铯和CO2 4. 硫酸铯、碳酸铯、硝酸铯都是易溶于水
卤族元素——F Cl Br I (第VIIA族)
+9 2 7
第一节元素周期表
例:Cl元素相对原子质量的计算 同位素的相对原 同位素 子质量(Mi)
35 17 37 17
丰度(ai) 75.77%
24.23%
Cl Cl
34.969
36.966
Cl元素相对原子质量=M1×a1 + M2×a2
= 34.969×75.77% + 36.966×24.23% = 35.453 Cl元素近似相对原子质量= A1×a1 + A2×a2 = 35×75.77% + 37×24.23% = 35.485
Rb
Cs
与H2O反应
剧烈, 生成H2
更剧烈, 轻微的爆 遇水立即 遇水立即 炸,生成 燃烧,爆 燃烧,爆 生成H2 H2 炸 炸
结论
同一主族,自上而下,金属性增强。
(2)递变性:与氧气、与水反应的剧烈程度有所不 同;在同一族中,自上而下反应的剧烈程度逐渐增大 .
③碱金属物理性质
元素 名称 锂 钠 钾 铷 铯 元素 符号 核电 荷数 颜色和状态 密度 g/cm3 0.534 0.97 0.86 1.532 1.879 熔点 O C 沸点 O C
随着核电荷数的增加,原子半径 递增 试从卤素的原子结构讨论它们的化学性质
②卤素的化学性质
1)卤素与金属反应
2Na+X2=2NaX
X=F、Cl、Br、I
2)卤素与氢气反应
名称
F2 Cl2 Br2 I2
反应条件
冷暗处爆炸 光照或点燃 高温 高温、持续加热 缓慢进行
方程式
H2+F2====2HF H2+Cl2=====2HCl H2+Br2======2HBr H2+I2======2HI
人教版高一化学必修一第一章第一节元素周期表 课件(共20张ppt)
A.原子核内质子数 B.原子核内中子 C.原子核外电子数
3.现行元素周期表中已经列出了112种元素,其中元素种类最多的周
期是?
C
A.第4周期
B.第5周期
C.第6周期
D.第7周期
2024/1/20
16
判断下列说法是否正确
1、短周期元素全是主族元素 错,还有0族元素
2、短周期元素共有20种元素 错,短周期包括1、2、3周期,共18种元素
——32 种
主族 共 7 个主族,包括短周期和长周期元素
副族 共 7 个副族,只包括在长周期中
族
(16个) 第VIII族 包括第8、9、10 纵行
0族
稀有气体元素
2024/1/20
18
练习
推算原子序数为6,13,34,53,88,82的元素在周期表中的位置。
第6号元素: 6-2=4
第二周期第ⅣA 族。
2023最新整理收集 do something
第一节 元素周期表
化学 必修2
第一课时
元素周期表
2
1
2019年被联合国批准为“国际化学元素周 期表年”。2019年是国际纯粹与应用化学联合 会IUPAC成立100周年,同时也是化学元素周期 表发明150周年。
俄国科学家门捷列夫
2024/1/20
2
一、元素周期表的发展史
3、过渡元素全是长周期元素 正确,过渡元素还全是金属元素
4、过渡元素全是副族元素
错,还有第VIII族元素
2024/1/20
17
课堂小结:
短周期
周期
(7个) 长周期
第 1周期 第 2周期
第 3周期 第 4周期
第 5周期 第 6周期 第 7周期
3.现行元素周期表中已经列出了112种元素,其中元素种类最多的周
期是?
C
A.第4周期
B.第5周期
C.第6周期
D.第7周期
2024/1/20
16
判断下列说法是否正确
1、短周期元素全是主族元素 错,还有0族元素
2、短周期元素共有20种元素 错,短周期包括1、2、3周期,共18种元素
——32 种
主族 共 7 个主族,包括短周期和长周期元素
副族 共 7 个副族,只包括在长周期中
族
(16个) 第VIII族 包括第8、9、10 纵行
0族
稀有气体元素
2024/1/20
18
练习
推算原子序数为6,13,34,53,88,82的元素在周期表中的位置。
第6号元素: 6-2=4
第二周期第ⅣA 族。
2023最新整理收集 do something
第一节 元素周期表
化学 必修2
第一课时
元素周期表
2
1
2019年被联合国批准为“国际化学元素周 期表年”。2019年是国际纯粹与应用化学联合 会IUPAC成立100周年,同时也是化学元素周期 表发明150周年。
俄国科学家门捷列夫
2024/1/20
2
一、元素周期表的发展史
3、过渡元素全是长周期元素 正确,过渡元素还全是金属元素
4、过渡元素全是副族元素
错,还有第VIII族元素
2024/1/20
17
课堂小结:
短周期
周期
(7个) 长周期
第 1周期 第 2周期
第 3周期 第 4周期
第 5周期 第 6周期 第 7周期
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
B 主族
C 副族
D Ⅷ族
9、现行的元素周期表已列出112种元素,其 中元素种类最多的周期是第六七周期 ,元素
种类最多的族是 第一主族 ,。0族
10、已知某主族元素的原子结构示意图如下, 判断其位于第几周期,第几族?
第四周期第 IA族
第五周期第ⅦA族
元素周期表中,周期用纯数字表示,族用“Ⅰ~Ⅶ ”和“A” 和“B”表示。“ A”代表主族,“ B”代表副族。如:“ N”
(118)
2、族:
周期表中,最外层电子数相同的元素,按电子层 数递增的顺序从上到下排成纵行,形成一个族。
①18个纵行, 16族。其中:七主族,用 A 表示ⅠA→ⅦA, 七副族,用 B 表示( ⅠB→ⅦB ),一个第Ⅷ族( 3个纵 行),一个零族
②每一主族的元素最外层电子数相等,从上到下电子层数 增加 。
①七个横行,七个周期。其中:三个短周期 1、2、3 , 三个长周期 4、5、6 (7) ②每一周期元素电子层数相同,从左到右原子序数递增。
③周期序数 = 电子层数
类别 短周期
长周期 不完全
周期
周期数
1 2 3 4 5 6
7
包括元 素种数
2 8 8 18 18 32
32
稀有气体元素原 子序数
2 10 18 36 54 86
28-14=14
第四周期第Ⅵ A 族。 第五周期第Ⅶ A 族。 第七周期第Ⅱ A 族。 第六周期第Ⅳ A 族。
13、下列各表为周期表的一部分(表中为 原子序数),其中正确的是( D )
A.
2 34
B.
11
19
2 10 11 18 19
C.
D.
6
67
11 12 13
14
24
31 32
14、在短周期元素中,原子最外电子层只
行,也就是有 __七__个周期,短周期指 一、二、三 周
期,长周期 四五六七
周期。元素周期表有
__十__八__个纵行,分为 十__六_个族,其中 _七___个主族, _七__
个副族, _一__个第Ⅷ族, _一___个0族,0族即是稀有气体
元素。由短周期和长周期共同构成的 主族和零族 。
6.写出下列元素在周期表中的位置
③主族族序数= 最外层电子数
1、主族元素在周期表中所处的位置,取决于该元素的
A、最外层电子数和原子量 B、原子量和核外电子数
D
C、次外层电子数和电子层数
D、电子层数和最外层电子数
2、下列叙述错误的是 A
A、把最外层电子数相同的元素按电子层数递增排成 8行 B、主族元素在周期表中的位置决定于该元素原子的电 子层数和最外层电子数 C、元素周期表是元素周期律的具体表现形式 D、把电子层数相同的各元素按原子数递增排成七个横 行
所在的位置为 第二周期第ⅤA族 。
11、1989 年,IUPAC 建议用 1—18列代替原主族、副族
等。根据规定,下列说法不正确的是( C )
A 第15列为ⅤA族
B 第2列中无非金属元素
C 16、17列都是非金属元素
D 第十八列元素的单质都是气体
一些族的别称
碱金属:ⅠA族除 H元素外 碱土金属:ⅡA族 卤族:ⅦA族 氧族:ⅥA族 稀有气体: 0族……
Na
Cl
Fe
Na 第三周期第ⅠA族 Cl 第三周期第ⅦA族
Fe 第四周期第Ⅷ族
7、在周期表中,第三、四、五、六周期元素的 数目分别是( B )
A 8,18,32,32 B 8,18,18,32 C 8,18,18,18 D 8,8,18,18
8、由短周期和长周期元素共同组成的族可能是
( AB )
A 0族
3、具有真正意义上的元素周期表是有哪位化学家发( A )
A.门捷列夫(俄国) B.纽兰兹(英国)
C.迈尔(德国)
D.尚古多(法国)
4、不能作为元素周期表中元素排列顺序的依据的( D )
A.原子的核电荷数
B .原子的核外电子数
C.原子的质子数 D.原子的中子数
5、请仔细观察元素周期表,你可以发现其中有 __七___个横
成 纵行
,这样得到的一个表,叫做元
素周期表。
元二、素元周素期周表期的表的结结构构
周期(7个) 元 (7个横行) 素 周 期 表
族(16个) (18个纵行)
短周期( 3个) 长周期( 4个)
主族ⅠA-ⅦA
副族ⅠB-ⅦB 第Ⅷ族 三个纵行 0族
1、周期:
周期表中,把电子层数目相同的元素,按原子序 数递增的顺序从左到右排成横行,形成一个周期。
第一章 物质结构 元素周期律第节 元素周期表 第一课时 ·周期表结构
2019年3月12日星期二
高一化学备课组
一、元素周期表的编排原则
根据元素周期律,把已知的一百多种元
素中 电子层数目相同 的各种元素,按原
子序数递增的顺序从左到右排成 横行 ,
再把不同横行中 最外电子层的电子数相同
的元素按电子层数递增的顺序由上而下排
12
推算原子序数为6,13,34,53,88,82的
元素在周期表中的位置。
第6号元素: 6-2=4
第二周期第Ⅳ A 族。
第13号元素: 13-10=3
第三周期第Ⅲ A 族。
第34号元素: 34-18=16 第53号元素: 53-36=17 第88号元素: 88-86 =2 第82号元素: 82-54 =28
2019年3月12日星期二
高一化学备课组
碱金属元素单质: Rb
二、元素的性质与原子结构 查阅元素周期表填写P5表格,从中发现碱金 属的原子结构有何共同点?
①相同点:碱金属元素原子结构的 最外层电子数 相同, 都为 1个 。
②递变性:从 Li→Cs,碱金属元素 的原子结构中, 电子层数 依次 增多。
有1个或2个电子的元素是 ( D )
A.金属元素 B.稀有气体元素 C.非金属元素 D.无法确定为哪一类元素
15、元素X的原子获得3个电子或元素Y的原子 失去2个电子后,它们的电子层结构与氖原 子的电子层结构相同。X、Y两种元素的单 质在高温下得到的化合物的化学式为
Mg3__N__2_(___氮___化___镁___)__ ,元素X在周期表中是第 ____族。元素Y在周期表中位于第____周期。
16. A、B、C是周期表中相邻的三种元素,其中 A、 B是同周期, B、C是同主族。此三种元素原子最外层 电子数之和为 17,质子数之和为 31,则A、B、C分别 为什么元素?
7N 8O 14P 16S
A 是氮元素 B 是氧元素 C 是硫元素
第一章 物质结构 元素周期律
第一节 元素周期表 第二课时·碱金属&卤族元素
