高考化学一轮复习 第7周 第2天 Fe2+和Fe3+的检验及“铁三角”转化天天练(含解析)鲁科版
第三章第二节铁及其化合物考点Fe2+、Fe3+的检验铁及其化合物的转化关系-课件新高考化学一轮复习

C.若滤出的固体中只有铜,则溶液中一定含有的阳离子是 Fe3+和 Fe2+,一
定不含 Cu2+
D.若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是 Fe2+,一定
不含 Cu2+和 Fe3+
解析:氧化性 Fe3+>Cu2+>Fe2+,加入铁粉后有固体剩余,Fe3+一定不存 在;若剩余固体全部都是 Cu,溶液中还可能有 Cu2+,也可能恰好被完全 置换;若剩余固体是 Cu 和 Fe,则溶液中不可能有 Cu2+和 Fe3+。 答案:D
(1)Fe 只具有还原性,可以被氧化剂氧化 ①与弱氧化剂反应 Fe 能被 S、Fe3+、Cu2+、H+等弱氧化剂氧化为 Fe2+,如 Fe+2Fe3+===3Fe2+。 ②与强氧化剂反应 Fe 能被 Cl2、HNO3 等强氧化剂氧化为 Fe3+。
(2)Fe2+既具有氧化性又具有还原性,以还原性为主 ①与氧化剂反应 当 Fe2+遇到强氧化剂(如 H2O2、Cl2、HNO3、酸性 KMnO4 溶液)时,被氧化 为 Fe3+,如 2Fe2++H2O2+2H+===2Fe3++2H2O。 ②与还原剂反应 当 Fe2+遇到 C、Al、Zn、CO 等还原剂时,可以被还原为 Fe,如 Fe2++ Zn===Zn2++Fe。 (3)Fe3+具有较强的氧化性,可被还原为 Fe2+或 Fe ①Fe3+被 C、CO、Al 等还原为 Fe,如 Fe2O3+2Al=高==温==2Fe+Al2O3。 ②Fe3+被 Fe、Cu、I-、H2S 等还原为 Fe2+,如 2Fe3++Cu===2Fe2++Cu2+, 2Fe3++H2S===2Fe2++S↓+2H+。
FeCl2(aq) FeCl3(aq)
加过量铁粉后过滤
立谁志不是 向事前业看的,大谁门就,会工面作临是许登多门困入难室。的旅程。
第16讲 铁盐、亚铁盐及相互转化-2024年高考化学大一轮复习课件(新教材)

Zn、Al等 活泼金属
Fe2+
强氧化剂 Cl2、Br2、O3、HNO3、浓H2SO4等
KMnO4、Ca(ClO)2、Na2O2、H2O2、HClO等
Fe3+
已知还原性: > S2— I-> Fe2+ > Br- > Cl-
写出下列反应离子方程式。
①少量Cl2与FeBr2(aq) Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
(3)赤血盐{K3[+F3e(CN)6]}:(铁氰化钾)
红色晶体,能溶于水,常用于检验Fe2+,生成蓝色沉淀。
+2 +3
K+ +Fe2++[Fe(CN)6]3- = KFe[Fe(CN)6]↓
+6
蓝色沉淀
(4)高铁酸钾(K2FeO4):
暗紫色晶体,具有强氧化性,可用作水体的杀菌、消毒剂或高容量电池材料。
④还原剂:
Fe2+
③强氧化剂 ④ 还原剂
Fe3+
如:Fe、Cu、I-、S2-、H2S、SO2等 2Fe3++ 2I- = 2Fe2++ I2
红褐色沉淀Fe(OH)3可能掩盖了白色沉淀Mg(OH)2,不合理。
E.用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2 Cl-也能使KMnO4溶液褪色,所以不合理
➢ Fe2+、Fe3+的检验
C 4.以下实验能证明某溶液中不含Fe3+而含有Fe2+的是
A.滴入KSCN溶液,不显红色 无法证明Fe2+是否存在 B.滴加足量氯水,再加KSCN溶液,显红色
知识梳理
含有Fe2+的溶液呈浅绿色,Fe2+既有_氧__化_ 性,又有_还__原性,
高考化学一轮复习第7周第2天Fe2+和Fe3+的检验及“铁三角”转化天天练(含解析)鲁科版

第2天Fe2+和Fe3+的检验及“铁三角”转化(本栏目内容,在学生用书中以独立形式分册装订!) [概念辨析] 判断正误(正确的打“√”,错误的打“×”)(1)配制FeCl3溶液时一般要加盐酸,增加其酸性。
(×)(2)在FeCl2溶液中通入Cl2,可以观察到溶液颜色的变化。
(√)(3)铁与硝酸反应的产物仅是Fe(NO3)3。
(×)(4)Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液显红色。
(√)(5)FeCl2溶液蒸干灼烧后,得到FeCl2固体。
(×)(6)将FeCl3饱和溶液滴入NaOH溶液中,可制备Fe(OH)3胶体。
(×)(7)向硫酸亚铁溶液中滴入几滴双氧水,Fe2+既显氧化性又显还原性。
(×)(8)将铁钉放入氯化铁溶液中,将会有Fe2+生成。
(√)1.将铁屑溶于过量盐酸后,再加入下列物质,不会有三价铁生成的是 ( )A.硫酸B.氯水C.硝酸锌D.溴水解析:Fe与非氧化性酸作用生成Fe2+,当Fe2+一旦遇强氧化剂便容易转变为Fe3+。
B 项,氯水中有Cl2、HClO等强氧化剂,将Fe2+氧化为Fe3+,B项错误;C项,硝酸锌加入到Fe2+的酸性溶液中,相当于Fe2++H++NO-3,Fe2+立即被酸化的NO-3氧化生成Fe3+,C项错误;溴水可氧化Fe2+生成Fe3+,D项错误。
答案: A2.为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是( )A.④ B.③C.③④ D.①②③④⑤解析:实验③中溶液应变为浅蓝色;实验④与Fe3+的性质无关。
答案: C3.将1.12 g铁粉加入25 mL 2 mol/L氯化铁溶液中充分反应后,结果是( )A.铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变B.往溶液中滴入无色KSCN溶液,溶液变红色C.Fe2+和Fe3+物质的量之比为5∶1D.氧化产物和还原产物的物质的量之比为2∶5解析:铁和氯化铁的物质的量分别是0.02 mol、0.05 mol。
2024届高考一轮复习化学教案(人教版):铁盐、亚铁盐及相互转化

第16讲铁盐、亚铁盐及相互转化[复习目标] 1.掌握Fe2+和Fe3+的检验方法。
2.掌握铁盐、亚铁盐的性质,能实现Fe2+和Fe3+的转化。
考点一铁盐、亚铁盐的性质与检验1.铁盐与亚铁盐亚铁盐(Fe2+) 铁盐(Fe3+) 颜色浅绿色(溶液) 黄色(溶液)氧化性与还原性既有氧化性,又有还原性,以还原性为主,如在酸性条件下能被H2O2、NO-3氧化,反应的离子方程式分别为2Fe2++H2O2+2H+===2Fe3++2H2O、3Fe2++4H++NO-3===3Fe3++NO↑+2H2O一般表现为氧化性,如能溶解铜,反应的离子方程式为2Fe3++Cu===Cu2++2Fe2+水解性水解呈酸性极易水解,只存在于酸性较强的溶液中2.其他常见铁盐(1)绿矾(FeSO4·7H2O):一种重要的还原剂,可用作补血剂及植物的补铁剂。
(2)铁铵矾[NH4Fe(SO4)2·12H2O]:无色晶体,易溶于水,常用作化学分析试剂、药物和织物媒染剂。
(3)赤血盐{K3[Fe(CN)6]}:红色晶体,能溶于水,常用于检验Fe2+,生成蓝色沉淀。
(4)高铁酸钾(K2FeO4):暗紫色晶体,具有强氧化性,可用作水体的杀菌、消毒剂或高容量电池材料。
3.Fe2+和Fe3+的检验(1)(2)(3)含Fe 2+、Fe 3+的混合溶液中Fe 2+、Fe 3+的检验 混合溶液――――――→滴加KSCN 溶液溶液变红色,说明含有Fe 3+。
混合溶液――――→滴加酸性KMnO 4溶液酸性KMnO 4溶液紫红色褪去,说明含有Fe 2+。
1.氢氧化铁与HI 溶液仅能发生中和反应( )2.中性溶液中可能大量存在Fe 3+、Cl -、K +、SO 2-4( )3.酸性条件下H 2O 2氧化Fe 2+的离子方程式为2Fe 2++H 2O 2+2H +===2Fe 3++2H 2O( )4.将Fe(NO 3)2样品溶于稀H 2SO 4后,滴加KSCN 溶液,溶液变红,则Fe(NO 3)2晶体已氧化变质( )5.用酸性高锰酸钾溶液检验FeCl 3溶液中是否含有FeCl 2( )答案 1.× 2.× 3.√ 4.× 5.×一、铁盐、亚铁盐的性质1.铁及其化合物是中学化学中一类重要的物质。
高考过关知识点3铁三角的转化及其应用

高考过关知识点3 “铁三角”的转化及其应用Fe 2+、Fe 3+的常用检验方法(1)Fe 2+的检验――→KSCN 溶液无现象――→滴加氯水溶液变红色,证明含有Fe 2+。
――→产生白色絮状沉淀,迅速变成灰绿色,最终变为红褐色,证明有Fe 2+。
(2)Fe 3+的检验――→KSCN 溶液溶液变红色,证明含有Fe 3+。
――→产生红褐色沉淀,证明有Fe 3+存在。
(3)含Fe 2+、Fe 3+的混合溶液中Fe 3+、Fe 2+的检验①Fe 3+的检验――→KSCN 溶液溶液变红色,说明含有Fe 3+。
②Fe 2+的检验a ――→滴加酸性4溶液酸性KMnO 4溶液紫红色退去,说明可能含有Fe 2+。
b ――→3[Fe (CN )6]溶液生成蓝色沉淀,说明含Fe 2+。
1.“铁三角”中的转化关系2.三个应用(1)离子共存分析Fe 2+、Fe 3+因氧化还原反应不能共存的离子或分子:①Fe 2+――→不共存NO -3(H +)、ClO -、MnO -4、H 2O 2、Cl 2、Br 2、Cr 2O 2-7等。
②Fe 3+――→不共存S 2-、I -、SO 2-3、HS -、HSO -3、H 2SO 3、H 2S 等。
(2)常见的离子除杂方法加少量Fe ,防止Fe 2+被氧化;加少量相应的酸,防止Fe 2+水解 │加少量相应的酸,防止Fe 3+水解[对点训练1] (2017·长沙模拟)在Fe 2(SO 4)3溶液中,加入a g 铜,完全溶解后,再加b g 铁,充分反应后得到c g 残余固体,且a >c ,则下列说法正确的是( )A .残余固体是铜和铁B .最后得到的溶液中一定含有Cu 2+C .将残余固体加入稀硫酸中,有气泡产生D .最后得到的溶液中可能含有Fe 3+B [因为a >c ,说明b g 铁完全反应,溶液中含Cu 2+、Fe 2+,不含Fe 3+。
][对点训练2] (2017·绵阳模拟)25 ℃时,下列各组离子在指定溶液中一定能大量共存的是( )A .pH =13的溶液:Fe 2+、NH +4、NO -3、SO 2-4B .含0.1 mol/L Fe 3+的溶液:NH +4、Na +、Cl -、SO 2-3C .滴入使甲基橙试剂变红色的溶液:NO -3、Fe 2+、Cl -、K +D .pH =1的溶液中:Fe 3+、Fe 2+、SO 2-4、Cl -D [A 项,pH =13为碱性,Fe 2+、NH +4不能大量共存;B 项,Fe 3+氧化SO 2-3;C 项,溶液为酸性,NO -3氧化Fe 2+。
第07讲 铁及其化合物(讲)-2023年高考化学一轮复习讲练测(解析版)

第07讲铁及其化合物1.能从物质类别和铁元素化合价的角度认识铁及其化合物的性质,理清铁元素不同价态之间的转化关系,增强证据推理与模型认知的能力。
2.会设计实验制备氢氧化亚铁,检验Fe3+,探究Fe3+、Fe2+的氧化性与还原性,增强科学探究与创新意识。
【核心素养分析】1.宏观辨识与微观探析:认识铁及其化合物的性质及应用,能以“铁三角”转化关系理解变价元素的转化条件。
2.科学态度与社会责任:利用铁及其化合物的性质,科学认识铁及其化合物的提纯和制备工艺流程,形成严谨求实的科学态度和崇尚真理的意识。
3.科学探究与创新意识:能提出有价值的氢氧化亚铁及其他铁的化合物的制备方案,并进行实验探究。
知识点一铁及其重要化合物的性质1.铁铁位于元素周期表中第4周期Ⅷ族,是一种应用最广泛的过渡金属元素;铁元素是一种典型的变价金属元素。
(1)结构(2)铁的物理性质银白色固体,熔点较高,具有良好的导热、导电、延展性,能被磁铁吸引。
(3)铁的化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
①与非金属单质的反应与O 2反应常温铁锈(成分为Fe 2O 3·x H 2O)点燃3Fe +2O 2=====点燃Fe 3O 4与Cl 2反应点燃2Fe +3Cl 2=====点燃2FeCl 3与S 、I 2反应Fe +S=====△FeS 、Fe +I 2=====△FeI 2②与水的反应常温下铁与水不反应,在高温条件下与水蒸气反应:3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
③与酸的反应④与某些盐溶液反应Fe +Cu 2+===Fe 2++Cu 、Fe +2Fe 3+===3Fe 2+【归纳总结】①Fe 与Cl 2反应无论用量多少都生成FeCl 3,而Fe 与盐酸反应生成FeCl 2。
②铁在潮湿的空气中生成的铁锈的主要成分是Fe 2O 3,而铁在纯氧中燃烧的产物是Fe 3O 4。
③铁与一般氧化剂(如S 、HCl 、FeCl 3、CuSO 4、I 2等)反应时被氧化为Fe 2+,铁与强氧化剂(如Cl 2、Br 2、HNO 3、浓H 2SO 4等)反应时被氧化为Fe 3+。
Fe2+和Fe3+相互转化的实验报告

Fe2+和Fe3+相互转化的实验报告【实验名称】Fe2+和Fe3+的相互转化【实验目的】1、优选适宜的试剂,设计实验方案,实现Fe2+和Fe3+的相互转化。
2、学会用化学方法鉴定Fe3+,鉴别Fe2+和Fe3+。
3、通过交流、讨论等方法,学会评价不同的实验方案。
【实验原理】失电子,被氧化,加较强氧化剂Fe2+ Fe3+得电子,被还原,加较强还原剂【实验仪器】试管、滴管【实验药品】铁粉、FeSO4溶液、FeCl3溶液、KSCN溶液、维生素C、双氧水、淀粉碘化钾试纸、酸性高锰酸钾溶液。
【实验操作】Fe3+→Fe2+的方案(1)取少量的FeCl3溶液于试管中,加入铁粉,溶液由黄色变为浅绿色,说明Fe粉可以还原Fe3+。
(2)用玻璃棒蘸取FeCl3溶液点在淀粉碘化钾试纸上,试纸变蓝色,说明I—可以还原Fe3+。
(3)取少量的FeCl3溶液于试管中,加入维生素C粉末,溶液由黄色变为浅绿色,说明Fe粉可以还原Fe3+。
Fe2+→Fe3+的方案(1)取少量的FeCl2溶液于试管中,滴加KSCN溶液,溶液呈无色,再加入H2O2,溶液呈血红色。
说明H2O2可以氧化Fe2+(2)向盛有5mL FeCl3溶液的试管中,加入几滴盐酸酸化,并加入足量的铁粉,振荡。
充分反应后,取上层清夜,滴入几滴KSCN 溶液,观察现象。
然后加入几滴酸性高锰酸钾溶液,观察实验现象。
【实验现象】.【实验结论及分析】【实验中异常现象及讨论】1、上述实验中Fe3+转化为Fe2+所需时间较长,注意控制时间以防Fe3+转化不完全,而使溶液出现红色。
2、为了给学生有较好的视觉效果,即现象由产生血红色到血红色消失最后又重新恢复血红色,使学生加深对Fe3+与Fe2+相互转化的认识,在实验中宜采用的氧化试剂用硝酸作氧化剂,在本实验中,不能取得理想的课堂效果。
若使用浓硝酸,也需用刚开启的浓硝酸,且使用的量也不少。
所以建议为酸性高锰酸钾或新制的氯水,不宜采用硝酸。
高考化学重难点复习教案金属及其重要化合物铁及其重要化合物之“铁三角”的转化、应用及Fe2+、Fe3+的检验
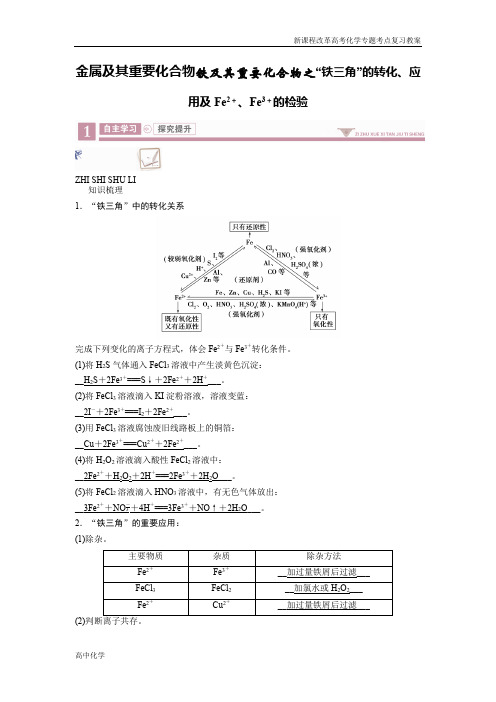
金属及其重要化合物铁及其重要化合物之“铁三角”的转化、应用及Fe2+、Fe3+的检验ZHI SHI SHU LI知识梳理1.“铁三角”中的转化关系完成下列变化的离子方程式,体会Fe2+与Fe3+转化条件。
(1)将H2S气体通入FeCl3溶液中产生淡黄色沉淀:__H2S+2Fe3+===S↓+2Fe2++2H+___。
(2)将FeCl3溶液滴入KI淀粉溶液,溶液变蓝:__2I-+2Fe3+===I2+2Fe2+___。
(3)用FeCl3溶液腐蚀废旧线路板上的铜箔:__Cu+2Fe3+===Cu2++2Fe2+___。
(4)将H2O2溶液滴入酸性FeCl2溶液中:__2Fe2++H2O2+2H+===2Fe3++2H2O___。
(5)将FeCl2溶液滴入HNO3溶液中,有无色气体放出:__3Fe2++NO-3+4H+===3Fe3++NO↑+2H2O___。
2.“铁三角”的重要应用:(1)除杂。
(2)Fe 2+不共存NO -3(H +)、ClO -、MnO -4(H +) Fe 3+不共存S 2-、I -、SO 2-3Fe 2+、Fe 3+不共存HCO -3、CO 2-3等发生水解相互促进(3)盐溶液的配制与保存。
(4)物质的制备。
3.Fe 2+、Fe 3+的检验的常用方法:(1)Fe 2+检验。
①样品溶液――→滴加KSCN 溶液无现象――→滴加氯水溶液变红色,证明含有Fe 2+。
反应的离子方程式:__Cl 2+2Fe 2+===2Cl -+2Fe 3+___ __Fe 3++3SCN-Fe(SCN)3___。
②样品溶液――→滴加K 3[Fe (CN )6](铁氰化钾)溶液产生蓝色沉淀Fe 3[Fe(CN)6]2,证明含有Fe 2+。
反应的离子方程式为:__3Fe 2++2[Fe(CN)6]3-===Fe 3[Fe(CN)6]2↓___。
③样品溶液――→加入氢氧化钠溶液产生白色絮状沉淀,迅速变成灰绿色,最终变为红褐色,证明有Fe 2+。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第2天Fe2+和Fe3+的检验及“铁三角”转化
(本栏目内容,在学生用书中以独立形式分册装订!) [概念辨析] 判断正误(正确的打“√”,错误的打“×”)
(1)配制FeCl3溶液时一般要加盐酸,增加其酸性。
(×)
(2)在FeCl2溶液中通入Cl2,可以观察到溶液颜色的变化。
(√)
(3)铁与硝酸反应的产物仅是Fe(NO3)3。
(×)
(4)Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液显红色。
(√)
(5)FeCl2溶液蒸干灼烧后,得到FeCl2固体。
(×)
(6)将FeCl3饱和溶液滴入NaOH溶液中,可制备Fe(OH)3胶体。
(×)
(7)向硫酸亚铁溶液中滴入几滴双氧水,Fe2+既显氧化性又显还原性。
(×)
(8)将铁钉放入氯化铁溶液中,将会有Fe2+生成。
(√)
1.将铁屑溶于过量盐酸后,再加入下列物质,不会有三价铁生成的是 ( )
A.硫酸B.氯水
C.硝酸锌D.溴水
解析:Fe与非氧化性酸作用生成Fe2+,当Fe2+一旦遇强氧化剂便容易转变为Fe3+。
B 项,氯水中有Cl2、HClO等强氧化剂,将Fe2+氧化为Fe3+,B项错误;C项,硝酸锌加入到Fe2+的酸性溶液中,相当于Fe2++H++NO-3,Fe2+立即被酸化的NO-3氧化生成Fe3+,C项错误;溴水可氧化Fe2+生成Fe3+,D项错误。
答案: A
2.为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是( )
A.④ B.③
C.③④ D.①②③④⑤
解析:实验③中溶液应变为浅蓝色;实验④与Fe3+的性质无关。
答案: C
3.将1.12 g铁粉加入25 mL 2 mol/L氯化铁溶液中充分反应后,结果是( )
A.铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变
B.往溶液中滴入无色KSCN溶液,溶液变红色
C.Fe2+和Fe3+物质的量之比为5∶1
D.氧化产物和还原产物的物质的量之比为2∶5
解析:铁和氯化铁的物质的量分别是0.02 mol、0.05 mol。
根据方程式Fe+2Fe3+===3Fe2+可知铁离子是过量的,剩余0.01 mol铁离子,生成0.06 mol亚铁离子,所以正确的答案选B。
答案: B
4.向含有FeCl3和BaCl2的酸性溶液中通入足量的SO2,有白色沉淀生成,过滤后向滤液中滴入KSCN溶液时,无明显现象,由此得出的正确结论是( )
A.白色沉淀是FeSO3
B.白色沉淀是BaSO3和BaSO4的混合物
C.白色沉淀是BaSO4
D.FeCl3已全部被SO2氧化成FeCl2
解析:2Fe3++SO2+2H2O===2Fe2++SO2-4+4H+,由于SO2过量溶液中无Fe3+;又SO2-4+Ba2+===BaSO4↓,而BaSO3在酸性环境不能生成,所以白色沉淀为BaSO4。
答案: C
5.下列有关实验操作、现象和解释或结论都正确的是( )
中是否含有Fe3+,只要溶液中有还原性物质,都能使酸性高锰酸钾溶液退色,B项错误;钝化也属于化学变化,C项错误;加氯水后,可以把Fe2+氧化为Fe3+,D项正确。
答案: D
6.在FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
A.加入KSCN溶液一定不变红色
B.溶液中一定含Fe2+
C.溶液中一定含Cu2+
D.剩余固体中一定含Cu
解析:铁粉与FeCl3、CuCl2的反应依次为:
2Fe3++Fe===3Fe2+
Cu2++Fe===Fe2++Cu
充分反应后的固体可能为Cu或Fe和Cu的混合物,又由于2Fe3++Cu===2Fe2++Cu2+,所以无论反应后的固体为Cu还是Fe和Cu的混合物,Fe3+一定不存在,A对;由以上分析知B、D均对;若反应后固体为Cu和Fe的混合物,溶液一定无Cu2+,C错。
答案: C
7.某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示。
则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
A.1∶1∶1 B.1∶3∶1
C.3∶3∶8 D.1∶1∶4
解析:据氧化性由强到弱的顺序HNO3>Fe3+>Cu2+,可知随铁粉的增加,反应的方程式分别为:
4HNO3(稀)+Fe===Fe(NO3)3+NO↑+2H2O
4 mol 1 mol 1 mol
2Fe(NO3)3+Fe===3Fe(NO3)2
2 mol 1 mol
3 mol
Cu(NO3)2+Fe===Fe(NO3)2+Cu
1 mol 1 mol 1 mol
所以原溶液中,Fe(NO3)3、Cu(NO3)2、HNO3的物质的量之比为:(2 mol-1 mol)∶1 mol∶4 mol=1∶1∶4。
答案: D
8.氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
回答下列问题:
(1)操作Ⅰ的名称是________;操作Ⅱ的名称是________;操作Ⅱ的方法为
________________________________________________________________________。
(2)请完成生成FeCO3沉淀的离子方程式:
________________________________________________________________________ ________________________________________________________________________。
解析:(1)从流程图中可知经操作Ⅰ后得到滤渣,故该操作是过滤;操作Ⅱ是在得到FeCO3沉淀后进行的,故该操作是洗涤;洗涤的具体操作为在漏斗中加入适量蒸馏水浸没沉淀,让蒸馏水自然流下,重复数次。
(2)从流程图中分析,生成FeCO3沉淀的离子反应为Fe2++2HCO-
3===FeCO3↓+CO2↑+H2O。
答案:(1)过滤洗涤在漏斗中加入适量蒸馏水浸没沉淀,让蒸馏水自然流下,重复数次
(2)Fe2++2HCO-3===FeCO3↓+CO2↑+H2O。
