新型抗血小板药物临床运用
抗血小板药的临床应用

抗⾎⼩板药的临床应⽤抗⾎⼩板药的临床应⽤⼀、动脉⾎栓形成的危害性动脉⾎栓形成主要发⽣在动脉粥样硬化的基础上,动脉⾎管⾎栓形成在临床上可导致⼼绞痛、⼼肌梗死、缺⾎性脑卒中和周围⾎管闭塞症等常见多发病。
⼼脑⾎管栓塞是常见的病死原因,在我国⼈⼝的死因中约占半数。
⼆、⾎⼩板激活和动脉⾎栓形成⾎⼩板是由巨核细胞⽣成的⾎液中3种有形成分之⼀。
⾎⼩板在初期⽌⾎作⽤中占有重要地位。
正常⾎管内⽪细胞有抗⾎栓形成作⽤,⾎管受损破裂后⾎⼩板可黏附聚集于⾎管裂⼝处,形成⽌⾎栓⼦⽽达到初期⽌⾎。
在动脉粥样硬化时,由于斑块破溃从⽽激活⾎⼩板,⾎⼩板在破溃处黏附、聚集,并可黏附⽩细胞形成⽩⾊⾎栓。
因此,⽩⾊⾎栓和⽌⾎栓⼦的形成机制是相似的,不同之处是⽩⾊⾎栓发⽣于内⽪受损但⾎管未破裂,⽽⽌⾎栓⼦是形成于⾎管裂⼝处。
⾎⼩板黏附是通过其膜糖蛋⽩Ⅰb与⾎管性⾎友病因⼦(vWF)结合,进⽽与内⽪下组织结合⽽发⽣的。
激活的⾎⼩板膜糖蛋⽩IIb和IIIa形成复合体,通过纤维蛋⽩原与另⼀⾎⼩板的膜糖蛋⽩IIb/IIIa 复合体结合⽽出现⾎⼩板聚集体。
激活的⾎⼩板还释放多种活性物质,如ADP,TXA2,PF3等,可促进聚集体进⼀步发展,增⼤并且为凝⾎过程提供反应平台。
粥样硬化斑块和⽩⾊⾎栓使⾎管腔狭窄并影响⾎流,从⽽在局部可使⽣成的凝⾎酶积蓄达到有效浓度,使纤维蛋⽩原转变为纤维蛋⽩,并⽹络红细胞等形成红⾊⾎栓。
因此,动脉⾎栓的结构特点是⽩⾊⾎栓的头部和红⾊⾎栓的尾部。
从动脉⾎栓的形成过程可见,⾎⼩板的激活是动脉⾎栓形成的始动物,若能控制⾎⼩板不被激活即可阻⽌或延缓动脉⾎栓的形成。
三、抗⾎⼩板药的作⽤机制60年代初发现⼆磷酸腺苷(ADP)可以引起⾎⼩板聚集,因此建⽴了⽐浊法测定⾎⼩板聚集性,为体外分析⾎⼩板功能开辟了新途径。
当时,发现了不少可以促进⾎⼩板聚集的物质,如肾上腺素、凝⾎酶、⾎清素(5羟⾊胺)和胶原等。
随后,由于分⼦⽣物学、分⼦免疫学的发展,对⾎⼩板黏附聚集机制有了深⼊的了解。
抗血小板药物临床应用进展

TRITON
年龄≥75或体 重<60kg
16% 4%
既往卒中 /TIA
80%
GRACE
36% 64%
年龄≥75或体 重<60kg或 既往卒中
/TIA
TRITON-TIMI 38研究将许多出血风险较高的患者排除在外, 因此在真实世界,上述高危患者的出血风险要远远大于该研 究所观察到的出血风险
1. Antman EM. Oral presentation at AHA 2007. Available at: . Accessed 17 December 2008; 2. GRACE databases (1999–2007). Data on file.
既往卒中/TIA的患者服用Prasugrel的临床净结果有害*, 而年龄≥75岁和体重< 60 kg的患者无临床净获益*
有卒中/TIA病史 是 否
Pint = 0.006
危险 (%)
+ 54
-16
年龄
≥75岁 <75岁
体重 <60 kg ≥60 kg
合计
0.5 Prasugrel更优
*全因死亡、MI、卒中和非CABG相关的TIMI严重出血的复合终点
高负荷剂量氯吡格雷(600mg)可更迅速 抑制血小板聚集
103 名 NSTE ACS患者随机接受300, 600 or 900 mg氯吡格雷治疗
50
5 mol/L ADP
40
30
20
* *
*
*
*
*
900 mg 600 mg
300 mg
血小板聚集抑制率 (%)
10
0 0
*p<0.05 vs 300 mg
抗血小板药物在肿瘤临床治疗中的作用及其研究进展

抗血小板药物在肿瘤临床治疗中的作用及其研究进展
随着肿瘤治疗技术的不断发展,抗血小板药物在肿瘤临床治疗中的作用受到了越来越多的关注。
血小板在肿瘤发生和发展过程中扮演着重要角色,因此影响血小板功能的药物成为了肿瘤治疗领域的研究热点之一。
本文将就抗血小板药物在肿瘤临床治疗中的作用及其研究进展进行介绍。
一、抗血小板药物在肿瘤临床治疗中的作用
1. 抑制肿瘤转移和侵袭:肿瘤细胞转移和侵袭是肿瘤发展的重要环节,而血小板对肿瘤细胞的转移和侵袭起着重要作用。
抗血小板药物的使用可以有效的抑制肿瘤细胞的转移和侵袭,从而延缓肿瘤的发展。
2. 增强肿瘤放疗和化疗效果:研究表明,抗血小板药物可以增强肿瘤放疗和化疗的疗效。
由于肿瘤组织内血管的异常增生和血小板的异常聚集,使得肿瘤组织的血液灌注不足,从而导致放疗和化疗药物难以有效的到达肿瘤组织。
而抗血小板药物可以通过抑制血小板的聚集和血管生成,从而增加肿瘤组织的血液供应,增强放疗和化疗的疗效。
3. 减轻肿瘤相关的血栓并发症:肿瘤患者常常伴有血栓形成的并发症,而血小板在血栓形成过程中起着重要作用。
抗血小板药物可以有效的减轻肿瘤患者的血栓并发症,改善患者的生存质量。
二、抗血小板药物在肿瘤临床治疗中的研究进展
1. 抗血小板药物与肿瘤微环境的关系:近年来的研究发现,血小板在肿瘤微环境的形成和发展中起着关键作用。
抗血小板药物可以通过影响肿瘤微环境的形成,从而抑制肿瘤的发展。
研究抗血小板药物与肿瘤微环境的关系对于肿瘤治疗具有重要的意义。
抗血小板药物防止血小板凝聚预防血栓形成

抗血小板药物防止血小板凝聚预防血栓形成血栓是一种常见的心血管疾病,严重威胁人类健康。
为了预防血栓形成,医学界发展了许多方法和药物。
其中,抗血小板药物是一类重要的药物,在防止血小板凝聚和血栓形成方面发挥重要作用。
一、抗血小板药物的定义及作用机制抗血小板药物是一类可以抑制血小板凝聚和血栓形成的药物。
在很多心血管疾病的治疗中,抗血小板药物被广泛应用。
其主要作用机制是通过选择性抑制血小板上的特定细胞表面受体或酶的活性,降低血小板聚集,从而防止血栓形成。
二、常见的抗血小板药物1. 阿司匹林阿司匹林是一种经典的抗血小板药物,被广泛应用于心血管疾病的预防和治疗。
其通过抑制血小板上的一个酶——环氧化酶,从而干扰血小板合成一种化学物质,阻碍血小板的凝聚。
2. 氯吡格雷氯吡格雷是另一种常见的抗血小板药物,被广泛用于冠心病和其他血栓形成风险较高的患者。
它通过抑制血小板上一种叫做ADP受体的结合,从而阻断凝集信号传导,达到抗血小板的目的。
3. 替格瑞洛替格瑞洛是最近发展起来的一种新型抗血小板药物。
它通过选择性抑制血小板上的P2Y12受体,从而阻碍ADP的结合,抑制血小板的凝聚。
三、抗血小板药物的使用注意事项1. 个体化用药:不同患者的血栓风险不同,应根据患者的具体情况选择合适的抗血小板药物和剂量。
2. 合理用药时间:抗血小板药物通常需要长期服用,但应注意遵循医生的指导和剂量,避免过度使用。
3. 注意副作用:抗血小板药物有一定的出血风险,应密切观察患者的病情和用药反应,及时调整治疗方案。
四、抗血小板药物的临床应用1. 心脑血管疾病的预防和治疗:抗血小板药物是冠心病、心肌梗死、脑卒中等心脑血管疾病常规的预防和治疗药物。
2. 血栓阻塞的急救:抗血小板药物也可以用于急性心肌梗死、危及生命的血栓性疾病的急救处理,以快速恢复血流和防止血栓扩大。
3. 术后抗凝:在一些大型手术后,为了防止血栓形成,临床常规使用抗血小板药物来避免并发症的发生。
常用6种抗血小板药物机制、临床应用及注意事项
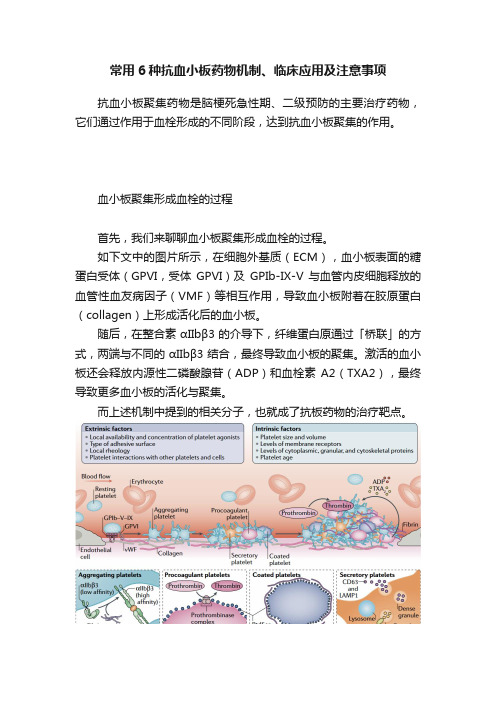
常用6种抗血小板药物机制、临床应用及注意事项抗血小板聚集药物是脑梗死急性期、二级预防的主要治疗药物,它们通过作用于血栓形成的不同阶段,达到抗血小板聚集的作用。
血小板聚集形成血栓的过程首先,我们来聊聊血小板聚集形成血栓的过程。
如下文中的图片所示,在细胞外基质(ECM),血小板表面的糖蛋白受体(GPVI,受体GPVI)及GPIb-IX-V 与血管内皮细胞释放的血管性血友病因子(VMF)等相互作用,导致血小板附着在胶原蛋白(collagen)上形成活化后的血小板。
随后,在整合素αIIbβ3 的介导下,纤维蛋白原通过「桥联」的方式,两端与不同的αIIbβ3 结合,最终导致血小板的聚集。
激活的血小板还会释放内源性二磷酸腺苷(ADP)和血栓素A2(TXA2),最终导致更多血小板的活化与聚集。
而上述机制中提到的相关分子,也就成了抗板药物的治疗靶点。
图 1. 血小板聚集形成血栓的过程不同抗血小板聚集药物作用机制接下来,我们看一下不同抗血小板聚集药物的作用靶点及机制。
图 2. 不同抗血小板聚集药物作用靶点及机制6 种抗血小板聚集药物作用特点1. 阿司匹林1)机制:作为最经典的抗血小板药物,阿司匹林可以不可逆的抑制血小板环氧化酶(COX-1),导致TXA2 生成减少,从而抑制血小板的聚集。
2)起效时间:阿司匹林的达峰时间约为0.3~2 小时,清除半衰期与剂量相关;肠溶片较普通片吸收时间可延长 3~6 小时。
因此,快速起效时可选择嚼服。
3)功能恢复时间:由于阿司匹林不可逆的抑制环氧化酶活性,因此,血小板功能的恢复需要等待血小板的再生,即完全停药后7~10 天。
4)代谢途径:阿司匹林经由肾脏代谢,因此,使用时需考虑肾功能情况。
禁用于合并氨甲蝶呤时,可能会减少其肾清除。
5)合并用药:同样作用于水杨酸的NSAID,如布洛芬等,合并时也需要谨慎。
此外,促进尿酸排泄的药物,如苯磺唑酮等,也可能需要谨慎。
6)注意事项:阿司匹林还可能导致支气管痉挛并引起哮喘发作,因此,也需要考虑患者是否合并哮喘。
抗血小板药物的临床应用汇总

二磷酸腺苷P2Y12受体抑制剂
ADP P2Y12受体抑制剂
二磷酸腺苷(ADP)存在于血小板细胞的高密度颗粒内,当血小板发生聚 集反应时ADP被释放,并与血小板膜上的ADP受体对血小板的形状及动力学 产生影响,最终结果为加速血小板的聚集。 血小板含有三种ADP受体:P2Y1、P2Y12和P2X1。 ADP与P2Y1 受体结合后,P2Y1受体与Gq蛋白藕连,激活磷酯酶C导致 Ca2+从细胞外流入细胞内,细胞内Ca2+浓度的升高激活了蛋白激酶C引起血 小板变形和聚集。
环氧酶抑制剂
阿司匹林的药代动力学: ➢口服后经胃肠道完全吸收,之后迅速降解为主要代谢产物水杨酸。 ➢阿司匹林和水杨酸血药浓度的达峰时间分别为10-20分钟和0.3-2小时。二 者均能与血浆蛋白紧密结合并分布于全身,起到全面的抗血小板聚集作用。 ➢水杨酸主要经肝脏代谢,由于肝酶代谢能力有限,水杨酸的清除为剂量依 赖性,因此清除半衰期可从低剂量的2-3小时到高剂量的15小时。 ➢水杨酸及其代谢产物主要从肾脏排泄。
环氧酶抑制剂
阿司匹林的不良反应: ➢常见胃肠道反应,如腹痛、腹泻、恶心、呕吐等。 ➢可加剧出血风险,如牙龈出血、鼻出血、皮下瘀点、瘀斑及消化道出血如 便血、黑便。 ➢小剂量阿司匹林长期应用能减少尿酸排泄,增加血尿酸水平,对易感者可 引起痛风发作。 ➢少见特异体质患者出现荨麻疹、黏膜充血、哮喘等过敏反应,严重者可危 及生命。
抗血小板药物的临床应用汇总
前言
血小板在血液循环中主要参与止血过程,同时血小板还贮存和分泌血 管活性胺类,吞噬异性颗粒、病毒和细菌等,还可能参与炎症反应及血管 通透性或张力的改变及免疫过程。
正常血液循环中的血小板不黏附在血管内皮上,而当血管壁损伤时血 小板可与内皮破损后暴露的胶原纤维等物质接触,血小板互相聚集(第一 相聚集),并释放出二磷酸腺苷(ADP),它使更多的血小板发生更致密 的聚集(第二相聚集),形成牢固而不能解聚的团块,即血栓。
抗血小板药物临床应用现状及展望
抗血小板药物临床应用现状及展望2004年世界卫生组织(WHO)公布的全球死因排序中,缺血性心脏病和缺血性脑卒中居前两位,动脉粥样硬化、斑块破裂、血栓形成是心脑血管事件发生的直接原因,而血栓性疾病已成为人类健康的第一杀手,抗血小板治疗是预防血栓性疾病的主要手段之一,合理应用抗血小板药物的成为研究热点,本文试从其临床应用现状及展望等方面加以阐述。
1 血小板激活与血栓形成作为外周血的三种有形成分之一,血小板的基本生理功能包括黏附、变形、聚集、释放和分泌颗粒内容物(如ADP,5-HT)等。
静息状态的血小板转变为生理功能的状态即为血小板的激活。
血小板激活后能提供磷脂表面,加速血液凝固,最终纤维蛋白包绕血小板聚集体形成血栓。
1. 1 血小板黏附血管内膜内皮细胞损伤暴露了内皮下的胶原纤维,血小板膜表面的糖蛋白受体(GPⅠb-Ⅸ-Ⅴ)通过与已黏附在胶原纤维表面上的vWF结合从而黏附在受损内皮表面。
此外,血小板也可直接通过胶原受体与胶原纤维结合。
1.2 血小板激活、释放在来自红细胞的ADP和已形成的起始凝血酶诱导下,黏附后的血小板被激活,释放α颗粒和δ颗粒(致密颗粒),其中α颗粒又可释放纤维蛋白原、纤维连接蛋白、凝血因子V (FV)、vWF、血小板β2球蛋白(β2TG)、血小板衍生生长因(PDGF)、血小板第4 因子(PF4)和转化生长因子等活性物质,δ颗粒可释放ADP、ATP、血栓烷A2(TX A2)、Ca2+、组胺、5-HT及肾上腺素等活性物质。
1.3 血小板聚集在ADP、肾上腺素、凝血酶、胶原纤维等诱导下,血小板膜糖蛋白GPⅡb/Ⅲa受体形成,血小板之间通过GPⅡb/Ⅲa受体与纤维蛋白原相互连接,形成可逆性的血小板聚集体。
1.4 血栓形成血小板的膜磷脂(PF3)提供凝血反应表面,加速凝血酶原酶和凝血酶(FⅡa)的形成,后者可进一步使血小板聚集,变为不可逆性血小板聚集体,在整个血小板聚集体中,凝血酶将纤维蛋白原转化为纤维蛋白,从而使血小板紧紧交织在一起,逐渐形成血栓。
抗血小板药物及临床应用
血栓形成定义
循环血液中的有形成分在心脏或血管内形成 异常血凝块的过程,生成的血凝块即血栓。 血栓局部脱落流至前方血管内堵塞部分或全 部管腔,导致血栓栓塞。
血栓组成成分:血细胞 纤维蛋白
动脉血栓
高流速下形成,主要由血小板聚合物、微纤维包 裹组成,也称为白色血栓。
静脉血栓
血流淤滞区形成,由散在或夹杂的纤维蛋白和大 量的红细胞组成,血小板含量相对较少,也称为 红色血栓。
血小板生理特性
—— 聚集
粘连蛋白介导的血小板之间的粘附反应
血小板 +
血小板 GPIIb/IIIa
Ca2+ 粘连蛋白
粘连蛋白
血小板 GPIIb/IIIa
诱导剂:ADP、Adr、TXA2、AA、Thr、Coll
(二)聚集:血小板相互粘连的现象。
血小板生理特性
—— 释放
血小板释放颗粒内容物和活化中产生 的代谢物:
1、二磷酸腺苷(ADP) 2、血栓烷A2 (TXA2 ) 3、 5-羟色胺(5-HT) 4、组胺 5、切应力的改变 6、部分前列腺素(PG) 7、其它因素
抑制血小板聚集因素
1、cAMP(环磷酸腺苷) 2、部分前列腺素(如PGI2) 3、ADP、TXA2、5-HT抑制剂等
目前临床常用的抗血小板药物
血小板结构
外周区:合酸性粘多糖、糖蛋白,可特异吸附血浆蛋 白,与粘附、聚集有关
溶胶凝胶区:相当于胞浆,含微丝、微管 细胞器区:包括多种颗粒,与分泌、释放有关
致密颗粒(含ADP、ATP、5-HT、CA等) α颗粒(β-TG、PF4、凝血因子I等) 溶酶体(含水解酶) 线粒体(ATP代谢库) 小管系统:致密小管(AA代谢部位) 开放小管(物质交换通道)
抗血小板使用方案
抗血小板使用方案引言血小板是血液中一种重要的细胞成分,主要起到止血和血栓形成的作用。
然而,在某些情况下,血小板的过度活化和聚集可能会导致血栓形成的风险增加。
为了预防和治疗与血小板相关的疾病,抗血小板药物成为重要的治疗手段。
本文将介绍几种常见的抗血小板药物的使用方案。
抗血小板药物概述抗血小板药物通过不同的机制抑制血小板的活化和聚集,从而达到减少血栓形成的目的。
常用的抗血小板药物包括阿司匹林、氯吡格雷和替格瑞洛等。
阿司匹林阿司匹林是一种广泛使用的抗血小板药物。
它通过抑制血小板中的环氧化酶,阻断花生四烯酸代谢途径,从而抑制血小板聚集。
阿司匹林常用于预防心脏病和脑卒中等血栓相关疾病的发生。
氯吡格雷氯吡格雷是另一种常用的抗血小板药物。
它通过抑制ADP受体,阻断ADP在血小板上的作用,从而抑制血小板聚集。
氯吡格雷常用于治疗冠心病和外周血管疾病等。
替格瑞洛替格瑞洛是一种新型的抗血小板药物。
它通过特异性P2Y12受体拮抗作用,阻断ADP与P2Y12受体的结合,从而减少血小板聚集。
替格瑞洛常用于治疗急性冠状动脉综合症和经皮冠状动脉介入术后的血栓预防。
抗血小板使用方案阿司匹林使用方案1.成人常规剂量:每日口服75-325毫克。
2.心脏病及脑卒中高风险人群常规剂量:每日口服75-100毫克。
3.心脏病及脑卒中高风险人群中度剂量:每日口服160-325毫克。
4.长期服用:根据医生的指导,在服用阿司匹林的过程中要进行定期的肝肾功能检查。
氯吡格雷使用方案1.成人常规剂量:每日口服75毫克。
2.高风险人群剂量:首次口服300毫克,之后维持每日口服75毫克。
3.使用期限:对于冠心病和外周血管疾病患者,氯吡格雷的使用期限一般在1年至终身,根据患者的具体情况进行决定。
替格瑞洛使用方案1.成人常规剂量:首次口服180毫克,之后每日口服90毫克。
2.急性冠状动脉综合症患者:使用替格瑞洛前要先行阿司匹林负荷剂量治疗。
3.长期服用:替格瑞洛一般在病情稳定后,按照医生的指导长期口服。
抗血小板药适应症及使用说明
抗血小板药适应症及使用说明抗血小板药物是一类常用于预防和治疗血液循环系统疾病的药物,其主要作用是抑制血小板的聚集和凝集,进而减少血栓形成的风险。
在临床上,抗血小板药物广泛应用于心脑血管疾病的治疗和预防,如冠心病、脑血栓等疾病。
在本文中,我们将介绍抗血小板药物的适应症及使用说明,以帮助读者更好地了解和正确使用这类药物。
一、抗血小板药物的适应症1. 预防心肌梗死和心血管死亡:抗血小板药物如阿司匹林广泛用于冠心病患者,可减少心肌梗死和心血管死亡的风险。
2. 预防脑血栓形成:对于有缺血性脑卒中病史的患者,抗血小板药物的使用能够减少脑血栓形成的风险。
3. 预防血栓性静脉炎和静脉血栓栓塞:抗血小板药物可用于减少手术后和长期卧床患者出现血栓形成的可能性。
4. 预防带原者心绞痛:某些患者在运动或其他诱发因素下出现心绞痛,使用抗血小板药物可减轻症状并预防心肌梗死。
5. 防治外周动脉疾病:使用抗血小板药物可预防外周动脉疾病患者下肢缺血和静脉炎症的发生。
二、抗血小板药物的使用说明1. 用药方法:抗血小板药物通常以口服形式使用,可根据医嘱每日一次或两次。
有些药物需特殊剂型如咀嚼片或肠溶片,须根据药品说明书正确使用。
2. 用量选择:具体用量应根据患者的病情、年龄、体重和合并症等因素进行调整。
一般而言,常用的阿司匹林剂量为75-300毫克/日。
3. 注意禁忌症:抗血小板药物存在一些禁忌症,如严重肝肾功能不全、溃疡病或出血性疾病、妊娠和哺乳期等,患者应谨慎使用或避免使用。
4. 注意副作用:使用抗血小板药物可能会引起一些不良反应,如胃肠道不适、出血倾向、头痛等。
患者在用药期间应密切关注自身反应,如出现异常情况应及时就医。
5. 贯彻医嘱:患者在使用抗血小板药物时必须严格按照医嘱进行用药,不可随意增减用药剂量或停药。
如有要求更改用药方案,应及时咨询医生并遵循专业建议。
6. 药物相互作用:抗血小板药物与其他药物可能存在相互作用,如华法林、非甾体抗炎药等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Vivienne个人读书笔记
ACS患者PCI术后心血管死亡及再发心梗的时间及临床特点观察研究
ACS (STEMI 或 UA/NSTEMI)并计划实施的PCI
阿司匹林 双 盲 N= 13,608 中到高危UA或者NSTEMI患者10074例 STEMI患者3534例
普拉格雷
负荷剂量60mg 10mg/d 维持1年
Vivienne个人读书笔记
普拉格雷
N (%)
146 (2.4) 85 (1.4) 21 (0.4) 64 (1.1) 19 (0.3) 303 (5.0) 244 (4.0) 24 (13.4)
氯吡格雷
Hazard ratio (95% CI)
1.32 (1.03-1.68) 1.52 (1.08-2.13) 4.19 (1.58-11.11) 1.25 (0.87-1.81) 1.12 (0.58-2.15) 1.31. (1.11-1.56) 1.34 (1.11-1.63) 4.73 (1.90-11.82)
18
Vivienne个人读书笔记
不同P2Y12受体拮抗剂代谢途径
替格瑞洛 普拉格雷 氯吡格雷
活性物质 中间代谢产物
无需体内生物转化
前体药物
替格瑞洛 普拉格雷 氯吡格雷
CYP依赖性氧化作用 CYP3A4/5 CYP2B6 CYP2C19 CYP2C9 酯酶水解作用 CYP2D6
结合 血小板 P2Y12
氯吡格雷
S
OCH3
N Cl
II期研 究阶段
Elinogrel
2009
第三代: 普拉格雷
O CH 3 O O S N F
2011
替格瑞洛
7
Ueno M, et al. J Atheroscler Thromb 2011;18:431-42. Joshi RR, et al. Platelets. 2013 Oct 10. [Epub ahead of print]
P<0.0001 P<0.0001 P<0.0001
血小板聚集抑制率( %)
78.0
P=0.0021
79.4
与氯吡格雷相比,替格瑞 洛快速、强效、一致抑制 血小板聚集
68.4
替格瑞洛(n=28)
48.2
P=0.0396
8.0 9.8
25.0
27.4
26.0
24h P2Y12反应单 位<240的患者比 例:替格瑞洛组 100%,氯吡格雷 组仅75.9%
4
Vivienne个人读书笔记
P2Y12 受体拮抗剂 • 普拉格雷 • 替格瑞洛 • 坎格瑞洛 • Elinogrel 蛋白酶激活受体1拮抗剂 • Vorapaxar
5
Vivienne个人读书笔记
不同P2Y12受体拮抗剂的药理特性
特性 P2Y12受体 结合可逆性 给药方式 给药频率 氯吡格雷 不可逆 口服 每日一次 普拉格雷 不可逆 口服 每日一次 替格瑞洛 可逆 口服 每日两次 坎格瑞洛 可逆 静脉 静脉推注+输注 Elinogrel 可逆 静脉和口服 静脉推注+ 口服每日两次
普拉格雷显著增加出血风险
Endpoint
Non CABG-related TIMI Major bleeding Life-threatening Fatala Nonfatal Intracranial Major or Minor TIMI bleeding Bleeding requiring transfusion CABG-related TIMI Major bleeding
氯吡格雷(n=29)
-4.4
替格瑞洛与P2Y12受体可逆性结合
ADP
P2Y12 受体
ADP 与受体结合并激活受体
构象变化,信号传导
替格瑞洛结合在ADP囊袋旁
ADP 可逆性的与受体结合, 但没有构象改变或信号传导
分离后受体完好无损
18
van Giezen JJ et al. J Thromb Haemost 2009;7:1556–1565
氯吡格雷l(%)
N=6795 781(12.1) 150 (2.4) 620(9.5) 60(1.0)
Hazard Ratio for Prasugrel (95% CI)
p-value
0.81(0.73-0.90) 0.89(0.70-1.12) 0.76(0.67-0.85) 1.02(0.71-1.45)
P2Y12 受体拮抗剂 • 普拉格雷 • 替格瑞洛 • 坎格瑞洛 • Elinogrel 蛋白酶激活受体1拮抗剂 • Vorapaxar
9
Vivienne个人读书笔记
普拉格雷:新型噻吩并吡啶类P2Y12拮抗剂
氯吡格雷需要2步代谢
普拉格雷仅需1步代谢,起效更快
10
10
TRITON TIMI-38 ACS患者中比较普拉格雷和氯吡格雷
Vivienne个人读书笔记
常见抗血小板药物的分类
抑制血小板花生四烯酸代谢药
• 环氧化酶抑制剂—阿司匹林
影响环核苷酸代谢药
• 磷酸二酯酶抑制剂--双嘧达莫、西洛他唑
作用于血小板膜特异激动剂和受体的药物
• 血小板糖蛋白复合物IIb/IIIa 受体拮抗剂:替罗非班
• P2Y12 受体拮抗剂 :氯吡格雷,普拉格雷,替格瑞洛 • 蛋白酶激活受体1拮抗剂:Vorapaxar
Vivienne个人读书笔记
终 点 事 件 发 生 率 ( )
主要疗效终点
关键安全性终点
Wiviott SD et al. N Engl J Med 2007; 357: 2001-15
%
•主要疗效终点:CV死亡、非致命性MI、非致命性卒中复合终点 •关键安全性终点:非CABG相关TIMI主要出血
12
新型抗血小板药物的临床运用
1
Vivienne个人读书笔记
血栓形成过程:血小板粘附——血小板激活——血小板聚集
2
Franchi F, et al. Nat Rev Cardiol.2015;12:30-47.
Vivienne个人读书笔记
新型抗血小板药物的治疗靶点
3
Franchi F, et al. Nat Rev Cardiol.2015;12:30-47.
TRILOGY-ACS
ACCOAST
普拉格雷较氯吡格雷获益明显: • STEMI患者,糖尿病患者,反复缺 血事件的人群 普拉格雷治疗中不受到影响的因素: CYP基因多态性或者PPI联用的影响
Franchi F, et al. Nat Rev Cardiol.2015;12:30-47.
普拉格雷较氯吡格雷获益不明显: 老年(年龄≥75岁),低体重(<60KG),
氯吡格雷
负荷剂量 300mg 75mg/d 维持1年
中位治疗时间12个月
主要终点:心血管死亡、心肌梗死、卒中 次要终点:支架内血栓 心血管死亡、心肌梗死、卒中、再缺血
11
Wiviott SD et al, N Engl J Med 2007;357:2001
普拉格雷显著降低主要疗效终点发生率, 同时增加非CABG相关TIMI主要出血
TRITON–TIMI 38研究的疗效终点
Vivienne个人读书笔记
普拉格雷组与氯吡格雷组相比,显著降低心血管死亡、心肌梗死和非致死 性脑卒中的复合终点;但心血管死亡率和非致死性卒中两组间无明显差异。
普拉格雷(%)
N=6813 CV death, nonfatal MI, or nonfatal stroke CV death Nonfatal MI Nonfatal Stroke 643(9.9) 133 (2.1) 475(7.3) 61(1.0)
普拉格雷较之氯吡格雷无益甚至有害 有卒中或者TIA病史
15
Vivienne个人读书笔记
普拉格雷目前循证证据和运用
• 普拉格雷(60mg负荷,10mg维持剂量)的适应症为接受PCI的ACS。除非接 受急诊PCI的STEMI患者,其余情况仅冠脉解剖结构明确后使用。 • 普拉格雷不推荐在未进行侵入性治疗的ACS患者中,不推荐用于接受PCI的稳 定性冠心病患者。 • 普拉格雷的禁忌症是有卒中病史或TIA病史,出血高危人群。 • 大于75岁的患者,不推荐使用普拉格雷,除非高危ACS。 • 欧洲药物协会推荐5mg剂量。FDA推荐标准10mg剂量。但两个协会均推荐在 低体重(<60KG)人群减量到5mg。 • 接受氯吡格雷预处理患者可以替换为普拉格雷,可提高血小板抑制率。通常使 用60mg负荷剂量普拉格雷。从替格瑞洛更换到普拉格雷可能因为药物相互作 用带来急性(24h-48h)血小板反应性升高。这种换药所引起的血小板反应性 增高,可以通过负荷普拉格雷60mg进行缓解,1周内缓解。 • 因为普拉格雷不可逆结合P2Y12受体,因此外科手术术前需停药7-10天。
7
Vivienne个人读书笔记
新型P2Y12受体拮抗剂作用机制
直接起效: 不经过代谢直接结合 替格瑞洛 坎格瑞洛 前体药物: 需要经过肝酶代谢为活性药物 氯吡格雷 普拉格雷
8
Franchi F, et al. Nat Rev Cardiol.2015;12:30-47.
Vivienne个人读书笔记
Vivienne个人读书笔记
普拉格雷目前循证证据和运用
试验 TRITON-TIMI 38 入组人群 13608例进行PCI 的ACS患者 9326例药物治疗 的NSTE-ACS患 者 4033例预备进行 血管造影的 NSTEMI患者 治疗组 阿司匹林+普拉格雷 VS 阿司匹林+氯吡格 雷 阿司匹林+普拉格雷 VS 阿司匹林+氯吡格 雷 普拉格雷30mg预处理 VS 安慰剂 主要终点 14.5个月内心血管死亡、非 致死性心梗、非致死性卒中 17个月内小于75岁患者的心 血管死亡、心梗或者卒中 7天内心血管死亡、心梗、 卒中、GP IIb/IIIa阻滞剂的 未使用或紧急血运重建或血 小板糖蛋白IIb/IIIa受体拮抗 剂(GPI)救助治疗 结果 9.9% VS 12.1% HR=0.81 (0.73-0.90) P<0.001 13.9% VS 16.0% HR=0.91 (0.791.05) P=0.21 10.0% VS 9.8% HR=1.02( 0.841.25) P=0.81
