化学反应的速率方程课件分解
ch11.1化学反应的速率及速率方程

动力学认为: 需一定的T,p和催化剂 点火,加温或催化剂
§11.1. 化学反应的速率及速率方程
主要内容 反应速率的定义 反应速率的实验测定 化学反应的速率方程
一. 反应速率的定义
3. 用生成物的生成速率或反应物的消耗速率代表反应速率
在反应过程中,反应物不断消耗,生成物不断生成,我们可 用某时刻某一种反应物的消耗速率或某一种生成物的生成速率代 表整个反应该时刻的反应速率。 对于化学反应 aA + bB → lL + mM
dc A A 的消耗速率 A dt dc B B 的消耗速率 B dt
1 d [ N 2 ] 1 d [ H 2 ] 1 d [ NH 3 ] or 1 dt 3 dt 2 dt “[ ]”亦表示浓度与“c”相同。
二. 反应速率的实验测定
随着反应的进行,反应物的浓度不断减少,产物的浓度不断 增大。测出各不同时刻各物质的浓度,绘制如下的 c-t 曲线。
c-t 曲线上各点的斜率即为各时刻的瞬时速率。
c~t 曲线称为动力学曲线。因此
测定反应速率等价于测定不同时 刻的各物质的浓度。 实验测定反应速率有两种方法: ⑴ 化学法:用化学分析方法测 不同时刻各物质浓度 绘 c-t 曲线 各时刻的反应速率
动力学曲线
⑵ 物理方法:利用物理手段,测定不同时刻与物质浓度呈 线性关系的物理量,从而确定反应速率。 通常利用的物理量有:压力、体积、电导率等。物理法的特 点是迅速方便,可以在不终止反应的情况下进行连续测定,并可 进行自动记录。 由于物理法不是直接测定浓度,所以要首先明确所测的物理 量与物质的浓度之间是否有直线关系。
化学反应的速率方程

四、反应分子数 基元反应
反应速率 r
反应分子数
单分子反应 双分子反应 三分子反应
A P AB P 2A B P
k1 A k2 AB
k3 A B
2
强调: 在基元反应中才有反应分子数;反应分子 数只可能是简单的正整数1,2或3。
五、化学反应速率方程的一般形式, 反应级数
3.反应机理又称为反应历程。在总反应中,连续或同
时发生的所有基元反应称为反应机理。
例: (1) H2 I2 2HI
(2) H2 Cl2 2HCl
Cl2 M0 2Cl M0
Cl H2 HCl H
H Cl2 HCl Cl
2Cl M0 Cl2 M0
x
d[P] d[A] k1 (a x) k1 ' x r dt dt
5. 用气体组分的分压表示的速率方程
反应: aA→产物 反应级数为n
dcA n kc A为消耗速率: A dt
dpA n k p pA dt
恒容,A为理想气体时:pA=cART
dpA dcA n n n RT k p pA k p cA RT dt dt dcA n 1 n k p RT c A dt
§11.3 化学反应的速率方程
一、速率方程又称动力学方程
例如:
r dx / dt
r k[A]
a ln k1t ax
二、 基元反应和非基元反应
1.基元反应 如果一个化学反应,反应物分子在碰撞 中相互作用直接转化为生成物分子,这种反应称为基 元反应。
2.非基元反应 总反应。
由两个或两个以上基元反应所组成的
化学课件第四章、化学反应速率
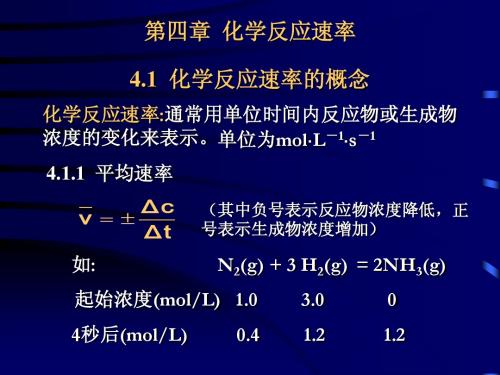
1 1 v = vNH3 = vH2 = vN2 = 0.15mol⋅L−1 ⋅ S−1 2 3
4.1.2 瞬时速率(即时速率) 瞬时速率(即时速率) 瞬时速率: 化学反应进行到某一时刻的速率. 瞬时速率: 化学反应进行到某一时刻的速率.
ν = κ ⋅ c (A)⋅ c (B)
a b
k称为速率常数,其数值为在一定条件(温度、 称为速率常数,其数值为在一定条件(温度、 催化剂) 当各反应物浓度均为1mol· 催化剂)下,当各反应物浓度均为1mol·L-1时的化 学反应速率。 值决定于反应的本性和反应温度, 学反应速率。k值决定于反应的本性和反应温度, 与反应物浓度无关。 值一般都由实验测定。 与反应物浓度无关。k值一般都由实验测定。 (a+b)称为反应总级数 (a+b)称为反应总级数
说明: (1)速率常数 的单位与反应总级数有关: 说明: (1)速率常数k的单位与反应总级数有关: 速率常数k a+b 0 1 2 反应总级数 0级 一级 二级 k的单位 mol·L mol·L-1 · S-1 S -1 L · mol-1 · S-1
(2) a+b称为反应总级数, a为反应物A的级数,b a+b称为反应总级数 a为反应物 的级数,b 称为反应总级数, 为反应物A 为反应物B的级数. 为反应物B的级数.
∆c dc v = ±lim = ± t dt ∆t→ ∆ 0
对任一化学反应: 对任一化学反应:
−ν A ⋅ A−νB ⋅ B = + Y ⋅Y +νΖ ⋅ Z ν 1 dc(A) 1 dc(B) 1 dc(Y) 1 dc(Z) v= = = = ν A dt νB dt νY dt νZ dt
大学无机化学课件03化学反应速率

反应速率越大。
26
反应进程势能图
1.ΔH = E正 – E逆
2. 微观可逆性原理
27
实验活化能
❖ 反应物分子须经过一个活化中间状态才能 转化为产物,该中间状态即活化分子。
❖ 由普通反应物分子转变为活化分子需吸收 的能量即活化能Ea。
❖ 根据活化能的大小,和反应能量变化曲线, 可以知道反应是吸热的还是放热的,以及 反应速率的相对快慢。
30
3.3 浓度对反应速率的影响
一、基元反应、简单反应与复合反应
➢ 基元反应(elementary reaction) :反应物分子一步 作用直接转化成产物的反应。由一个基元反应构 成的化学反应称为简单反应。 例:N2O4 = 2NO2 是基元反应,也是简单反应。
➢ 非基元反应:由两个或两个以上基元反应组成的 化学反应,又称复合反应(complex reaction) 、 总反应(overall reaction)。
2. 当具有足够能量的分子以适当的空间取向靠近 时,要进行化学键重排,能量重新分配,形成 一个过渡状态的活化配合物。
3. 过渡状态的活化配合物是一种不稳定状态。 可形成生成物,也可回到反应物。
23
3.2 反应速率理论简介
二、过渡态理论
如: A+ B-C [A…B…C] = A-B +C 反应物 活化配合物 产物
化学反应涉及两个基本问题: ①反应的方向和限度: 反应热力学
反应是否自发,自发的方向和程度 ②反应的速率和具体步骤: 反应动力学
研究途径和速率问题
3
研究反应速率的意义
反应速率
快 ,如爆炸反应,中和反应。 慢,金属的锈蚀,食品的腐烂,
第五讲-化学动力学——化学反应速率、反应机理PPT课件

在化学反应中,某物质的浓度(物质的量浓度)
随时间的变化率称反应速率。反应速率只能为正 值,且并非矢量。
1、平均速率
用单位时间内,反应物浓度的减少或生成物浓度
的增加来表示。
=
c
t
当△c为反应物浓度的变化时,取负号;△c为生
成物浓度的变化时,取正号
只能描述在一定时间间隔内反应速率的大致情况
-
在活着的有机物体内,有一部分碳元素为稳定同 位素碳-12,还有一小部分是放射性同位素碳-14。 生物活着时通过呼吸来补充碳-14,而当某种植 物或动物死亡后,其体内的碳-14就开始衰变 (一级反应),但稳定同位素碳-12的含量不会 变。在已知碳-14衰变速度的前提下(碳-14的半 衰期为5730年),可以通过测量样品中的碳-14 衰变的程度来计算出样品的年代。
-
25
一、化学反应速率
1、浓度对反应速率的影响
(5)一级反应及其特点
凡反应速率与反应物浓度一次方成正比的反应, 称为一级反应,其速率方程可表示为:
积分上式可得:
当上式t =可0表时示,为c =:c0(起始浓度),则B = lnc0。故
或
或
-
26
一、化学反应速率
1、浓度对反应速率的影响
4
一、化学反应速率
(一)反应速率及其表示方法
2、瞬时速率
若将观察的时间间隔△t缩短,它的极限是△t 0 , 此时的速率即为某一时刻的真实速率—— 瞬时速 率:
对于下面的反应来说,a A+ b B = g G+ h H 其反应速率可用下列任一表示方法表示:
-
5
一、化学反应速率
(一)反应速率及其表示方法
在基元步骤中,发生反应所需的最少分子数目称 为反应分子数。根据反应分子数可将反应区分为 单分子反应、双分子反应和三分子反应三种,如:
化学动力学-反应速率方程的积分形式PPT课件

二级反应(A)的特征
NH4CNO (NH2 )2CO
kA 5.88 102 dm3 mol1 min1
二级反应(n=2)(second order reactions):
aA bB pP D : vA kAcAcB
a=b,cA0 ≠ cB0
vA kA (cA0 x)(cB0 x)
cA0 2kA
零级反应(n=0)(zero order reactions):
常见的零级反应有表面催化反应和酶催化反应, 这时反应物总是过量的,反应速率决定于固体 催化剂的有效表面活性位或酶的浓度。
2NH3 W催化剂N2+3H2
零级反应(n=0): cA0 cA x kAt
例:超声波下,水 与四氯化碳反应。
x)
反应的特征:
1 cA 对 t 作图是一条直线,斜率即kA。
kA具有浓度1·时间1的量纲,表达为L3N1T1。
半衰期与kA和cA0的乘积成反比。
1 t1/ 2 kAcA0
二级反应(n=2)(second order reactions):
常见的二级反应有乙烯、丙烯的二聚作用,乙酸乙酯 的皂化,碘化氢的热分解反应等。
aA bB pP ຫໍສະໝຸດ 五种情况A : vA kAcA2
B : vA kAcAcB
C : vA kAcAcB
a=b,cA0= cB0
a/b = cA0/ cB0
vA
dcA dt
kAcA2
cB
cB0
(cA0
cA )b a
cAb a
对于C:
A
kAcAcB
bkA a
cA2
kA cA2
vA
dcA dt
11 cA cA0 kAt
第三章化学反应速率分解

第三章化学反应速率化学动力学(chemical kinetics):研究化学反应速率的科学 .主要研究 :化学反应速率的理论反应机理影响反应速率的因素第一节化学反应速率和反应机理一化学反应速率表示方法化学反应速率(rate of a chemical reaction):衡量化学反应过程进行的快慢,即反应体系中各物质的数量随时间的变化率。
反应速率:平均速率瞬时速率过氧化氢(H2O2)水溶液的分解反应为:H2O2(aq)H2O(l) +12O2(g)I-v00.80200.400.40/20=0.020400.200.20/20=0.010600.10t /min[H 2O 2]/ (mol ⋅L -1)/(mol ⋅L -1⋅⋅min -1)800.050表7-1 H 2O 2水溶液在室温时的分解0.10/20=0.005 00.050/20=0.002 5平均速率(average rate) :瞬时速率(instantaneous rate) :令Δt 趋近于零时的速率。
通常所表示的反应速率均指瞬时速率。
tc v Δ)O H (Δ22-=tc t cd )O (H d O (H lim 2222-=∆∆-=)v反应的瞬时速率可通过作图法求得。
20min时H2O2分解的瞬时速率,A点切线的斜率,去负号即可.如合成氨的反应 :N 2 + 3H 2 ==== 2NH 3一般地,对于化学反应aA + bB = gG + hH 其反应速率定义为:tc t c t c t c νt ξVd NH d d H d d N d d d d d 1B B )(21)(31)(111322=-=-=⋅=⋅=v二 反应机理概念反应机理(reaction mechanism):就是化学反应进行的实际步骤,即实现该化学反应的各步骤的微观过程。
H 2(g)+I 2(g)2HI(g)I 2(g)2I(g)快反应)慢反应(速率控制步骤)H 2(g)+2I(g)2HI(g))2(g)2I(g)快反应(1)慢反应(速率H 2(g)+2I(g)2HI(g)(2)(一)基元反应和非基元反应(基)元反应(elementary reaction)是指反应物分子一步直接转化为产物分子的反应。
化学动力学-- 化学反应的反应速率及速率方程.ppt

反应进度(extent of reaction)
设反应为: R P
t 0 nR (0) nP (0)
t t nR (t) np (t)
nR (t) nR (0) np (t) nP (0)
d dnB B
2019-10-13
2019-10-13
平均速率
2019-10-13
瞬时速率
R P
vR
d[R ] dt
vp
d[P] dt
在浓度随时间变化的图上,在时间t 时,作交点的切线,
就得到 t 时刻的瞬时速率。显然,反应刚开始,速率大,然后 不断减小,体现了反应速率变化的实际情况。
2019-10-13
瞬时速率
第十一章 化学动力学
2019-10-13
化学热力学的研究对象和局限性
研究化学变化的方向、能达到的最大限度以及
外界条件对平衡的影响。化学热力学只能预测反应
的可能性,但无法预料反应能否发生?反应的速率
如何?反应的机理如何?例如:
rGm$ / kJ mol1
1 2
N2
3 2
H2
NH3 (g)
16.63
H2
1 2
O2
H2O(l)
237.19
热力学只能判断这两个反应都能发生,但如何使它发
生,热力学无法回答。
2019-10-13
化学动力学的研究对象
化学动力学研究化学反应的速率和反应的机理以及 温度、压力、催化剂、溶剂和光照等外界因素对反应 速率的影响,把热力学的反应可能性变为现实性。
反应速率方程中,反应物浓度项不出现, 即反应速率与反应物浓度无关,这种反应称为 零级反应。常见的零级反应有表面催化反应和 酶催化反应,这时反应物总是过量的,反应速 率决定于固体催化剂的有效表面活性位或酶的 浓度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 CA 1 t ln = ln 0.67 3300年 -4 k1 CA,0 1.2110
二级反应(second order reaction)
化学反应的速率方程
速率方程(rate equation of chemical reaction) -浓度对反应速率的影响 速率方程又称动力学方程。它表明了反应速 率与浓度等参数之间的关系或浓度等参数与 时间的关系。速率方程可表示为微分式或积 分式。
1 dc r f c v dt
微分式
1. 速率常数 k 的单位为时间的负一次方,
2. 半衰期(half-life time) t1 / 2 是一个与反应物起 始浓度无关的常数 , t1/ 2 ln 2 / k1 。
3.
ln cA 与 t 呈线性关系。
碳断代技术
14C是大气中的氮原子和宇宙射线中产
生的中子发生核反应的产物,可以认为几千 年来,14C的生成速率保持不变,并等于其衰 变速率,因此大气中14C的量处于稳态。生命 体由于新陈代谢,其体内14C/ 12C是一恒定值, 但生命体死亡后的样品中14C/ 12C不再是常数, 会因14C的不断衰变而减小。这一事实可用于 考古学中年代判定。
(2)
r k[H ][A] r k ' [A]
积分速率方程
-具有简单级数的反应
一级反应(first order reaction)
反应速率只与反应物浓度的一次方成正比 的反应称为一级反应。常见的一级反应有放射性 元素的蜕变、分子重排、五氧化二氮的分解等。
226 88
Ra
222 86
cA,0
0
cA
cA,0 cA
dcA r k1cA dt
一级反应的积分速率方程
--integral rate equation of first order reaction
不定积分式
dcA cA k1dt
定积分式
t dcA cA,0 cA 0 k1dt cA
言,p对k的影响较小,可视k为温度T的函数。
质量作用定律(law of mass action) 注意:
1. 只有基元反应严格地符合质量作用定律;对于基 元反应,反应分级数等于相应的反应计量系数绝 对值,反应级数等于反应分子数。 2. 对于总包反应,质量作用定律并不一定成立,即 使成立,反应级数与反应计量系数也不一定存在 对应关系。 3. 反应速率常数的量纲与反应级数有关。
8 0.326
12 0.222
16 0.151
一级反应的积分速率方程
0.50 0.45 0.40
c/(mg/100ml)
0.35 0.30 0.25 0.20 0.15 0.10 4 6 8 10 12 14 16
t/h
抗菌素浓度随时间的变化
一级反应的积分速率方程
-0.6 -0.8
-1.0
ln(c/mg (100mL) )
c F (t )
积分式
质量作用定律(law of mass action)
实验发现许多反应 aA+bB+ ……=gG+hH+ …… 其反应速率 r 具有以下形式:
r = k ·[A] ·[B]……
、: 反应的分级数,称反应对物质 A 为 级, 对物质 B 为 级 n = + + ……: 反应的级数。 k:反应速率常数,是温度与压力的函数。但一般而
一级反应的例子
题目:放射性 C的一级衰变的半衰期为5720年,考古 14 考察一具古尸上裹的亚麻布碎片,其 C为正常值的 67.0%,估算此尸体的埋葬时间。
14
解:
ln 2 0.693 k1 1.21104 年-1 t1/ 2 5720
CA CA 当 0.67 时 由一级反应速率方程 ln k1t 易知: CA,0 CA,0
一般的:令 y
c A,0 c A c A,0
为已作用的反应物分数
1 1 t ln k1 1 y
一级反应浓度与时间的关系
c0
ct=c0e-k1t
1/2c0
1/3c0
1/4c0
1/8c0 1/9c0 1/16c0 0
t1/2
t1/3 2t1/2
3t1/2 2t1/3
4t1/2
t
一级反应的特点
-1
-1.2
-1.4
-1 8 10 12 14 16
t/h
斜率=-0.096h-1
速率常数=0.096h-1
一级反应的半衰期(half-life time)方程
半衰期是指反应发生后,达到剩余反应物浓度 占起始反应物浓度一半所需的时间。记为t1/2 一级反应的半衰期:
CA,0 1 ln 2 t1 ln k1 0.5CA,0 k1 2
ln cA k1t 常数
cA,0 cA
ln
k1t
CA CA,0 exp(k1t )
一级反应的积分速率方程
某抗菌素在人体血液中消耗呈现简单级数的反应, 若给病人在某时刻注射后,在不同时刻t测定抗菌素 在血液中的浓度c,得到数据如下:
t/h c/(mg/100ml)
4 0.480
在速率方程中,若某一物质的浓度在反应 过程中可以认为没有变化,可并入速率常数项,这 时反应总级数可相应下降,下降后的级数称为准级 数反应。例如:
(1)
r k[A][B] r k [B]
' '
[A] [B] ( k k[A]) 准一级反应
H 为催化剂 (k ' k[H ]) 准一级反应
Rn He
4 2
r k[
226 88
Ra]
1 N 2O5 N 2O4 O2 2
r k[N 2O5 ]
一级反应的微分速率方程
---differential rate equation of first order reaction)
反应:
A P
t 0
t t
微分式
几个总包反应:
H 2 Br2 2 HBr k H 2 Br2 r HBr 1 k Br2
r k H 2 Cl2
1/ 2
H 2 Cl2 2 HCl
1/ 2
H2 I 2 2HI
r k H2 I 2
返回
准级数反应(pseudo order reaction)
