高中化学知识结构图
高中化学知识结构图

高中化学知识结构图一:物质分类变化模块。
1:物质的组成,性质,分类。
重难点知识:A:物质的分类原则(氧化物分类)。
B:纯净物与混合物的区分,性质的不同点总结。
C:化学性质与物理性质的区别,化学变化与物理变化的区别。
D:既能与酸反应又能与碱反应物质总结。
E:平均相对分子质量的求法(十字相乘法)。
F:化学反应基本类型。
G:同位素基本概念。
2:物质的量,常见化学计量。
重难点知识:A:基本概念:物质的量,摩尔质量,气体摩尔体积,物质的量的浓度及配置。
B:物质的量与阿伏加德罗常数间的换算关系,阿常数的推论总结。
C:物质的量使用时的注意事项。
D:气体摩尔体积条件状态的说明及常温常压下的推导公式。
E:配置物质的量浓度的仪器,步骤,以及与浓度的换算,误差分析。
F:平均相对分子质量求法总结。
G:质量,物质的量,微粒(分子,原子,离子)数目,气体体积(标况),物质的量浓度的关系。
3:分散系重难点知识:A:分散系的分类,特征,性质。
B:胶体性质,制备,提纯,凝聚方法。
C:关于溶解度的计算。
(晶体析出类,温度改变类)D:常见胶体及应用。
4:离子反应重难点知识:A:离子方程式的书写规则。
B:离子方程式中的过量,少量问题。
加入顺序问题。
C:离子共存的判断,包括隐含条件的应用规律。
D:电解质的概念。
E:归纳总结沉淀,弱电解质。
5:氧化还原反应:重难点知识:A:氧化还原反应的本质及特征。
B:表示方法:单线桥法,双线桥法。
C:氧化剂,还原剂,氧化产物,还原产物。
D:氧化还原反应的配平原则及步骤(重点四种题型:基本题型/脚标变化题型/歧化反应/归中反应1E:氧化还原反应的计算题。
二:金属元素模块1:碱金属元素:重难点知识:A:钠的性质,用途。
B:氧化钠,过氧化钠,碳酸钠,碳酸氢钠。
C:碱金属的性质(相似性,递变性)。
D:二氧化碳与氢氧化钠溶液反应产物的判断方法,技巧总结。
E:漂白原理总结,漂白剂分类及介绍。
F:焰色反应原理及运用。
(完整)高中化学知识结构图
决 定
外 电 子
表 律 的排
结
周布
构
期周
离 子
性期 性
晶
体
横:周期 元素种类
起止序号
n=1
2
1~2
n=2
8
短周期
3~10
元素性质
n=3
8
11~18
周
原
n=4
18
19~36
n=5
18 长周期
37~54
期 表 位
子 结 构
n=6
32
55~86
置
n=7
21 不完全周期 87~111
纵:族
主族:ⅠA~ⅦA
副族:ⅢB~ⅦB、ⅠB ⅡB
原子晶体 石墨(混合晶体)
金属晶体 大多数盐
强 碱 离子晶体 碱性氧化物 部分过氧化物
物理性质 宏观
化学性质 纯净物
单质 化合物
非金属 稀有气体
组成
分类
性质
物质 分 子
变化
原 子 微观
离 子
无机物 氢化物
氧化物
有机物
金属氢化物
酸性
非金属氢化物
碱性
成盐氧化物
两性
特殊
不成盐氧化物
含氧酸、无氧酸
酸
强酸、弱酸
电离度平衡的移动
质离 ) 水的电离平衡 H2O H++OH-
水的离子积 KW=1×10-14(25℃) 溶液的酸碱性:PH=-log[H+]
装置
离子反应
实质
发生条件 表示方式-离子方程式
盐类的水解
常见类型
非氧化还原
复分解反应 水解反应 络合反应
类型 规律(酸碱性性判断) 影响因素
人教版高中化学必修2原子的核外电子排布课件

P
+15
2 85
2021/2/4
19
第二关:画图
画出下列微粒的结构示意图。
19K 35Br 53I S2- K+
2021/2/4
20
第三关:元素推断
最外层电子数是电子层数2倍的短周期元素是:
He、C、S
内层电子数是最外层电子数2倍的元素是:
Li、P
某短周期元素的核电荷数是电子层数的5倍,其
具体示例
Mg2+ Cl-
2021/2/4
17
过关斩将
第一关 下列粒子的结构示意图正确的是( ⑦)
①Li
②Na
③Na+
④Cl
⑤Cl-
⑥K
⑦Ca2+
2021/2/4
⑧Xe
18
第三关:元素推断
最外层电子数是电子层数2倍的元素是:
He、C、S、Kr
内层电子数是最外层电子数2倍的元素是:
Li、P
某元素的核电荷数是电子层数的5倍,其质子数是最外 层电子数的3倍,该元素的原子结构示意图为
自主学习任务一
请画出元素周期表中1-18号元素原子的结 构示意图
2021/2/4
11
H
He
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
2021/2/4
12
自主学习任务二
观察稀有气体原子的核外电子的排布,你 发现了什么?
2021/2/4
13
自主学习任务二 稀有气体元素原子电子层排布
核电 元素 元素
英国物理学家 汤姆生 J.J.Thomson,1856~1940
高中化学鲁科版必修2 第1章第1节第2课时 核外电子排布 课件

[答案] (1)原子由质子、中子和电子构成。它们之间的关系 是质量数等于质子数和中子数的和,质子数等于原子核外电 子数。 (2)根据上述实验中的描述“α 粒子是一种不带电子、带有 2 个单位正电荷、质量数等于 4 的微粒”可知,在 α 粒子中有 2 个质子和 2 个中子,符号为42He2+。 (3)原子中存在原子核,且原子核只占原子体积的很小一部 分。(其他合理解释也可)
(5)某化学老师在讲卢瑟福测定实验时,设计了学生探究活
动,向圆圈 A、B、C 中投乒乓球,若 B 为标准模型,向
A、B、C 中各投入 20 次乒乓球,请回答下列问题:
①A 中没有反弹,B 中有 1 次反弹,则说明原子是什么结构? ②若 B 中有 1 次反弹,C 中有 10 次反弹,则又说明什么问题?
(4)①金原子核带正电荷。
②金原子核的质量远大于 α 粒子的质量。(写出上述两点中 的一种或者其他合理答案也可) (5)①A 中没有反弹说明没碰到质量大的物质,也就是说可能 是空心的,B 中有 1 次反弹说明碰到了质量大的物质,说明 原子不是空心的。
②B 中有 1 次反弹,C 中有 10 次反弹说明原子中质量大的 物质所占的体积很小,即原子核比原子小很多,电子的运动 空间较大。
易失去最外层电子,达到 稳定结构,其最高正价为 +m(m为最外层电子数)
得到一定数目的电子,达 到稳定结构,其最低负价 为m-8(H为m-2)
[互动讲练] (原创)下列有关原子结构的说法正确的是( B ) A.从氢元素(1号元素)到氖元素(10号元素)次外层电子数均为2 B.从钠元素(11号元素)到氩元素(18号元素)次外层电子数均为8 C.最外层电子数为2的元素原子易失电子,均具有强的还原性 D.某元素原子M层电子数比K层电子数多5个,该元素的最高正 价为+5 [解析] A项中,氢元素、氦元素只有1层电子;C项中氦元素 原 子最外层有2个电子,它是稳定结构;D项中的元素是Cl元 素, 最 高正价为+7。
人教版高中化学必修二课件第一章第二节第1课时原子核外电子的排布

解析:K层即是第一层,只有1个电子的是氢原子,A项 正确;原子M层上有电子,说明L层已排满8个电子,此时M 层上电子数为L层的4倍,为32个,与最多有2n2即18个相矛 盾,B项错误;M层、L层上的电子数均为K层上的4倍,即 为“2、8、8”电子排布,则S2-、Cl-、K+、Ca2+均满足, C项正确;氢原子的核电荷数与最外层电子数相等,D项正 确。
名师点睛:判断10电子微粒的方法:
10电子微粒是高考的热点,因此高一就要夯实基础,但 死记硬背不利于知识的灵活应用。以下是快速确定10电子微 粒的有效方法。
(1)
(2)H+电子数为零,故与其他粒子结合,原粒子的电子 数不增也不减。则:
变式应用 2.下列微粒中,核外电子数相同的是( )
解析:F-中含10个e-,Na+中含10个e-,Ne中含10个e -,K+中含18个e-,⑤为Mg2+,含10个e-。故①②③⑤中 电子数相同。
(7)电子层数和最外层电子数相等的原子是H、Be、Al。 (8)电子层数是最外层电子数2倍的原子是Li、Ca。 (9)最外层电子数是电子层数2倍的原子是He、C、S。 (10)最外层电子数是电子层数3倍的原子是O。
变式应用
1.已知A、B、C三种元素的原子中,质子数为A<B< C,且都小于18,A元素的原子最外层电子数是次外层电子 数的2倍;B元素的原子核外M层电子数是L层电子数的一半; C元素的原子次外层电子数比最外层电子数多1个。试推断:
3.下列各原子结构示意图中所表示的核外电子排布正确的 是( ) C
一、原子核外电子排布规律 (2011年山东临沂模拟)下列说法中肯定错误的是( ) A.某原子K层上只有一个电子 B.某原子M层上电子数为L层上电子数的4倍 C.某离子M层上和L层上的电子数均为K层的4倍 D.某原子的核电荷数与最外层电子数相等
2020-2021学年高中化学新鲁科版必修第二册 第1章第1节原子结构与元素性质第2课时课件

关键能力·合作学习
知识点一 核外电子排布规律 1.核外电子排布规律解读 (1)“一低” 电子首先排布在能量最低的电子层里。排满能量低的电子层,再排能量高的电 子层。 (2)“两不超” 各电子层电子不超过2n2个;最外层电子不超过8个(第一层为最外层时不超过2 个)。
2.核外电子排布的表示方法 (1)原子结构示意图:为了形象表示原子核外电子分层排布的情况而采用的直观 图示。如氯原子结构示意图为
【母题追问】(1)X元素的原子最外层电子数是次外层电子数的2倍,则该元素的 原子核内质子数是多少? 提示:K层为次外层时,X元素的原子最外层电子数为2×2=4<8;L层为次外层时,X元 素的原子最外层电子数为8×2=16>8,不可能,故X元素的原子核外电子数为2+4=6, 即质子数为6。
(2)当第n电子层作为原子的最外层时,其最多容纳的电子数与(n-1)层相同;当第 n电子层作为原子的次外层时,其最多容纳的电子数比(n-1)层最多容纳的电子数 多10个。则n层是K层~N层中的哪一层? 提示:根据核外电子排布规律可知,当n为最外层时,最多可容纳8个电子,则第(n1)层最多也可容纳8个电子,故(n-1)层为次外层时,n层应为M层;当n层为次外层 时,其最多可容纳的电子数比(n-1)层多10个,则证明n层最多可容纳18个电子,也 应为M层。
原子类别 稀有气体
金属元素 原子
非金属 元素原子
与元素性质的关系 最外层电子数为8(He为2), 结构稳定,性质不活泼
最外层电子数一般小于4, 较易失去电子
最外层电子数一般大于或 等于4,较易获得电子,形成 8电子稳定结构
与元素化合价的关系
原子结构为稳定结构,常见 化合价为零
易失去最外层电子,达到 稳定结构,其最高正价为 +m(m为最外层电子数)
_新教材高中化学第四章物质结构元素周期律第一节第一课时原子结构核素课件新人教版必修第一册

→F-:
。
[名师点拨] (1)最外层电子数排满 8 个(He 为 2 个)形成稳定结构,不易得失电子、化学性 质稳定。 (2)原子核外电子排布规律是相互联系、相互制约的,不能孤立地理解或应用其 中一部分。如 M 层不是最外层时,其容纳的电子数最多为 18 个,当 M 层为最外 层时,其容纳的电子数最多为 8 个。 (3)原子形成离子时,核外电子数发生变化,但核内质子数不变。
提示:Na+
与稀有气体 Ne 的核外电子排布相同;Cl-
与稀有气
体 Ar 的核外电子排布相同。
1.电子层 在含有多个电子的原子中,电子分别在能量不同的区域内运动。我们把不同的区
域简化为不连续的壳层,也称作电子层。
2.核外电子的分层排布 在多电子原子中,电子的能量是不相同的。能量较低的,通常在离核较近的区域
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第一课时 原子结构 核素
[素养发展目标]
1.从微观视角认识原子的构成,了解元素、核素、同位素的含义。 2.了解原子核外电子排布规律,能画出 1~20 号元素的原子结构示意图,能根据
原子的结构特征确定元素,促进宏观辨识与微观探析化学核心素养的发展。
解析:4200Ca 和4220Ca 是质子数相同、中子数不同的两种核素,二者互为同位素,不 属于同素异形体。
答案:B
3.(1)下列原子:162C、174N、11H、2113Na、21H、4200Ca、4109K、31H、164C 中,元素有________ 种,核素有________种,互为同位素的有________。 (2)18O2 与 16O2,二者的关系是________(填“互为同位素”“互为同素异形体”或 “属于同一种物质”)。 解析:(1)题目提供的 9 种原子共 9 种核素,6 种元素,其中11H、21H、31H,126C、164C 分别互为同位素。 (2)18O2 和 16O2 是分子,属于同一种物质。 答案:(1)6 9 11H、21H、31H;126C、146C (2)属于同一种物质
(完整)高中化学知识结构图

或 4OH-—4e H2O+O2↑
金属电极做阳极,电极本身被氧化 M-n氧e→化 Mn+
第三部分:元素化合物转化关系
Na2S C2H5ONa
Na2O
NaOH
NaCl
Na
Na2O2
Na2CO3
NaCl
CH3COONa
NaHCO3
N2 Mg3N2
CO2 MgO
H2O Mg(OH)2
X2 MgX2
煅烧
O2 Mg
Ⅷ族
0族
比较
类型
构成晶体微粒
形成晶体作用力
熔沸点
硬度
物 理
导电性
性 质
传热性
延展性
溶解性
典型实例
离子晶体 阴、阳离子
离子键 较高
硬而脆 不良 水熔溶融液.导电
不. 良 不良 易溶于极性溶剂
NaCl,KBr
原子晶体 原子 共价键 很高 大
绝缘体(半导体) 不良 不良
不溶于任何溶剂 单质:金刚石、SiC、
H2O MgO
Mg(OH)2
H2O MgCO3
△
HCl
△
Cl2
HCl NaOH H2O HCl
或
电解
CO2 OH-
HCl
MgCl2
Mg(HCO3)2
CaCl2 HCl Cl2 或 HCl
Na2CO3 HCl
CaCO3
HCl CO2
CO2+H2O
△
O2 Ca
CaO H2O
H3PO4 Ca(OH)2
CaHPO4
CaC2
Ca(OH)2
CaO
非金属:按照化合价寻找各类物质,主要有氢化物、
单质、氧化物、含氧酸、及其盐
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
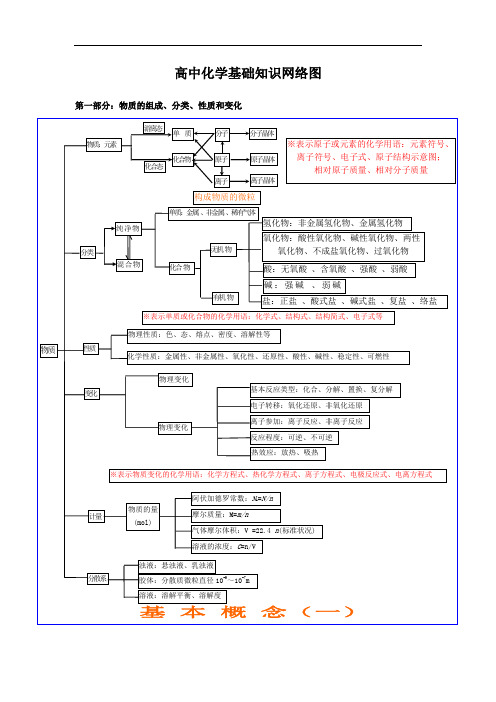
高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化
大纲要求(1)了解分子、原子、离子等概念的含义。
了解原子团的定义。
(2)理解物理变化与化学变化的区别与联系。
(3)理解混合物和纯净物、单质和化合物、金属和非金属的概念。
(4)理解酸、碱、盐、氧化物的概念及其相互联系。
第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)大纲要求
物质结构和元素周期律
(1)了解元素、核素和同位素的含义。
(2)了解原子构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
(3)了解原子核外电子排布。
(4)掌握元素周期律的实质。
了解元素周期表(长式)的结构(周期、族)及其应用。
(5)以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
(6)以IA和VIIA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
(7)了解金属、非金属在元素周期表中的位置及其性质递变的规律。
(8)了解化学键的定义。
了解离子键、共价键的形成。
化学反应与能量
(1)了解氧化还原反应的本质是电子的转移。
了解常见的氧化还原反应。
掌握常见氧化还原反应的配平和相关计算。
(2)了解化学反应中能量转化的原因,能说出常见的能量转化形式。
(3)了解化学能与热能的相互转化。
了解吸热反应、放热反应、反应热等概念。
(4)了解热化学方程式的含义。
(5)了解能源是人类生存和社会发展的重要基础。
了解化学在解决能源危机中的重要作用。
(6)了解焓变与反应热的含义。
了解△H=H(反应产物)—H(反应物)表达式的含义。
(7)理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。
(8)了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
了解常见化学电源的种类及其工作原理。
(9)理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。
化学反应速率和化学平衡
(1)了解化学反应速率的概念、反应速率的定量表示方法。
(2)了解催化剂在生产、生活和科学研究领域中的重大作用。
(3)了解化学反应的可逆性。
(4)了解化学平衡建立的过程。
了解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算。
(5)理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能用相关理论解释其一般规律。
(6)了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。
电解质溶液
(1)了解电解质的概念。
了解强电解质和弱电解质的概念。
(2)了解电解质在水溶液中的电离,以及电解质溶液的导电性。
(3)了解弱电解质在水溶液中的电离平衡。
(4)了解水的电离,离子积常数。
(5)了解溶液pH的定义。
了解测定溶液pH的方法,能进行pH的简单计算。
(6)了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。
(7)了解离子反应的概念、离子反应发生的条件。
了解常见离子的检验方法。
(8)了解难溶电解质的溶解平衡。
了解溶度积的含义及其表达式,能进行相关的计算。
大纲要求
常见无机物及其应用。
1.常见金属元素(如Na、Al、Fe、Cu等)
(1)了解常见金属的活动顺序。
(2)了解常见金属及其重要化合物的主要性质及其应用。
(3)了解合金的概念及其重要应用。
2.常见非金属元素(如H、C、N、O、Si、S、Cl等)
(1)了解常见非金属单质及其重要化合物的主要性质及应用。
(2)了解常见非金属单质及其重要化合物对环境质量的影响。
3.以上各部分知识的综合应用。
常见有机物及其应用
1.了解有机化合物中碳的成键特征。
2.了解甲烷、乙烯、苯等有机化合物的主要性质。
3.了解乙烯、氯乙烯、苯的衍生物等在化工生产中的重要作用。
4.了解乙醇、乙酸的组成和主要性质及重要应用。
5.了解糖类、油脂、蛋白质的组成和主要性质及重要应用。
6.了解常见高分子材料的合成反应及重要应用。
7.以上各部分知识的综合运用
有机化学
有机抓住
官能团的性质
烃 烃的衍生物
糖
蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH )
高分子化合物
链烃
(脂肪烃)
环烃
饱和链烃 烷烃:C n H 2n+2(n ≥1)R —CH 3
不饱和链烃
烯烃:C n H 2n (n ≥2) R —CH=CH 2
二烯烃:C n H 2n-2(n ≥4)R —CH=CH —CH=CH 2
炔烃:C n H 2n-2(n ≥2) R —C ≡CH
环烷烃C n H 2n (n ≥3)
芳香烃(苯和苯的同系物)C n H 2n-6(n ≥6) 天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质
R
卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH 醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n-6O (n ≥2)
OH
羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH
醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R ’
酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n ≥2)R —COOR ’ 硝基化合物(官能团—NO 2)R —NO 2 胺(官能团—NH 2)R —NH 2
单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构)
二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构) 多糖:淀粉、纤维素(C 6H 12O 6)n (n 值不同)
合成高分子
合成塑料
合成橡胶
合成纤维
有
机化合物。
