气体摩尔质量及阿伏伽德罗定律
气体摩尔体积完整版本

A.质量为12 g
B.物质的量为6 mol
C.体积为22.4 L
D.分子数为6.02×1023
6.(1)CO2的摩尔质量为 44 g.mol-1 ;88g CO2的物质的量
为 2 mol
,所含二氧化碳分子数为1.204×1024
,
在标准状况下的体积约为 44.8 L
。
(2)在标准状况下:①2g H2 ②1.12L Cl2 ③0.8mol HCl ④分子 数为3.01×1023的CO2
一、知识 回顾
质量
m
↓ ↓ 摩尔质量
阿伏加德罗常数
物质的量
÷M
n
×M
×NA ÷N
微粒数
N
A÷ρ ×ρ?Fra bibliotekV气体体积 (标准状况)
第三课时 气体摩尔体积
内容
一、知识回顾 二、影响物质体积大小的因素 三、阿伏伽德罗定律 四、气体摩尔体积
表一 1 mol 不同固体和液体的体积
1 mol 不同固体和液体的体积
1mol
50
受温度和压强影响
1mol H2O(l)
二、影响物质体积大小的因素
影响1mol不同气体体积的因素主要是:粒子间距
受温度和压强影响 1、温度:当其他条件不变,温度升高,气体体积增大 2、压强:当其他条件不变,压强升高,气体体积减小
如果温度和压强一定,则粒子间的距离一定, 体积也就一定。
三、阿伏伽德罗定律
当堂检测:
1.四种因素:①温度和压强 ②所含微粒数 ③微粒本身大小
④微粒间的距离,其中对气态物质体积有显著影响的是 ( D )
A.②③④
B.②④
C.①③④
D.①②④
2.下列有关气体体积的叙述中,正确的是 ( D ) A.一定温度和压强下,各种气态物质体积的大小由构成
物质的量及其阿伏伽德罗常数
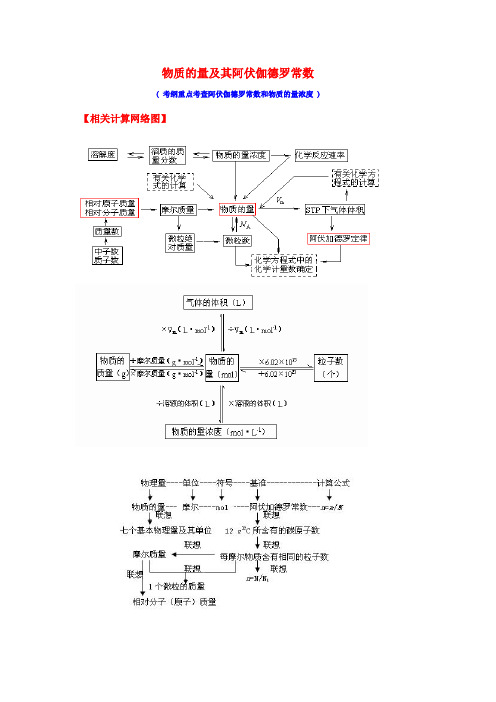
物质的量及其阿伏伽德罗常数( 考纲重点考查阿伏伽德罗常数和物质的量浓度 )【相关计算网络图】【知识点梳理】一、物质的量:1﹑物质的量(n):表示物质含指定粒子多少的物理量注:专有名词,表示微观粒子单位:摩尔(mol),简称为摩规定0.012kg12C中所含碳原子数为1mol阿伏加德罗常数N A =6.02×1023mol-1计算公式:n=N/ N A2﹑摩尔质量(M):单位物质的量的物质所具有的质量单位:g/mol 或 g﹒mol-1计算公式:M=m/n二、阿伏伽德罗常数(一)阿伏加德罗定律(1)在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子(2)注意:①使用范围:气体;②使用条件:同温、同压、同体积;③特例:气体摩尔体积(3)推论:用n表示物质的量,V表示体积,P表示压强,M表示摩尔质量(式量),ρ表示密度。
(注意语言表达)①同温同压:V1/V2 = n1/n2 = N1/N2②同温同体积:P1/P2 = n1/n2 = N1/N2③同温同压:ρ1/ρ2 = M1/M2④同温同压同质量:V1/V2 = M1/M2⑤同温同压同体积:m1/m2 = M1/M2(二)阿伏伽德罗常数的考查方式1,考查物质的状态考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H2O、SO3、CCl4、苯、辛烷等,要清醒地看到气体摩尔体积适用的对象是气体,对非气态物质不适用。
因此,要掌握常见物质的状态,在常见有机物中C≤4的烃、CH3Cl、甲醛为气态,其它一般为非气体。
2,考查气体摩尔体积应用条件气体摩尔体积适用于0℃、1.01×105Pa,而在许多考题中常给出非标准状况如:常温常压;在25℃、1.01×105Pa时等,要注意气体摩尔体积适用的条件。
另外,要明确物质的质量或物质的量与状态无关,因此,这时的判断不涉及22.4L/mol。
“如常温常压下,1 mol 氦气含有的核外电子数为2N A”这句话是正确的。
摩尔质量与阿伏伽德罗常数的公式

物质的量=粒子数/阿伏伽德罗常数:n=N/NA物质的量=物质的质量/摩尔质量:n=m/M物质的量=气体的体积/气体摩尔体积:n=V/Vₘ所以,N/NA=m/M=V/Vₘ=n。
物质的量——n,物质的质量——m。
摩尔质量——M,粒子数(微粒的个数)——N。
阿伏伽德罗常数——NA,气体的体积——V。
气体摩尔体积——Vₘ——L/mol——22.4L/mol。
扩展资料:一、阿伏加德罗常数NA原以0.012kgC-1所含的碳原子数作基准,其原近似值为6.0221367×10²³mol⁻¹。
1mol的任何物质所含有的该物质的微粒数叫阿伏伽德罗常数,精确值为NA=6.02214076×10²³,单位为1/mol。
1、1mol任何微粒的粒子数为阿伏伽德罗常数,其不因温度压强等条件的改变而改变。
2、应用阿伏伽德罗定律及理论时要满足:物质在所给温度及压强下为气体。
2018年11月16日,国际计量大会通过决议,1摩尔被定义为“精确包含6.02214076×10^23个原子或分子等基本单元的系统的物质的量”。
与此同时修改了阿伏伽德罗常数为6.02214076×10^23。
二、与粒子数的关系n=N/NA,满足上述关系的粒子是构成物质的基本粒子(如分子、原子、离子、质子、中子、电子)或它们的特定组合.如:1molCaCl₂与阿伏加德罗常数相等的粒子是CaCl₂粒子,其中Ca²⁺为1mol、Cl⁻为2mol,阴阳离子之和为3mol或原子数为3mol.在使用摩尔表示物质的量时,应该用化学式指明粒子的种类,而不使用该粒子的中文名称。
例如说“1mol氧”,是指1mol氧原子,还是指1mol氧分子,含义就不明确。
又如说“1mol碳原子”,是指1molC-12,还是指1molC-13,含义也不明确。
粒子集体中可以是原子、分子,也可以是离子、质子、中子、电子等。
气体摩尔质量

V(H 2 ) =2(a-b)L
或 V(H 2 ) =
V(O 2 ) =(a-b)L
2 aL 或 V(H 2 ) =bL 3 1 1 V(O 2 ) = aL 或 V(CO2 ) = bL 3 2
V(O 2 ) =(a-b)L V(H 2 ) =a-(a-b)=b(L)
(2)当 H2 过量时,O2 全部参加反应
a a ,而 1mol 气体的质量即摩尔质量为 ·NA, b b a 22.4bc ·NA),体积为 ,故选 A. b a NA
cg 该气体的物质量的量为 c÷( 答案:A 例5
下列说法正确的是 ( ) A.1mol 任何气体的体积都约是 22.4L 5 B.20℃,1.0×10 Pa,同体积的 O2,CO2 含有相同的分子数 C.1mol 气态物质,当体积为 22.4L 时,该气体一定处于标准状况 D.2mol 气体体积约为 44.8L 解析:A 中缺少标准状况的条件;B 根据阿伏加德罗定律,同温同压下,同体积的任何气体 都含有相同的数目的分子,故 B 正确;C 中,1mol 气态物质在非标准状况时,体积也 有可能等于 22.4L;D 中缺少标准状况条件.故选 B. 答案:B
=
������ ������������
= c×V
1、物质的量 (
n
12
)
⑴定义:用 0.012 kg C 中所含的原子数目作为标准来衡量其它微粒体积所含微粒数目的物 理量 单位:mol ) 基本公式: n =
N NA
2、阿伏伽德罗常数 ( NA
⑴定义:1 mol 任何微粒的个数 数值上等于 0.012 kg 单位: mol
△
B+2C+2D.测得
例4
将 1.5g 两种金属的混合物粉末与足量的稀盐酸反应,反应完全后,得到标准状况下 的氢气 1.12L,则两种金属可能是 ( ) A.Mg 和 Cu B.Zn 和 Cu C.Al 和 Fe D.Mg 和 Al + 分析 先电荷守恒法(得失电子数相等):金属单质失去的电子被盐酸中的 H 得到后变成 H2, + n(H2)=0.05mol,得到 0.1mole .再利用扩大法:H 得电子数变为 1mol 时混合金属应为 15g.再利用极值法:每一金属失去 1mole 各需质量是 Mg:12g Zn:32.5g Al:9g Fe:28g Cu 不与盐酸反应可认为>15g.最后用平均值法:A、C 符合
高一上-阿伏伽德罗定律

阿伏伽德罗定律【知识梳理】1. 阿伏伽德罗定律是指:“在相同的温度和压强下,相同体积的任何气体分子数相同。
”由阿伏伽德罗定律可以推导出同温同压下:a. 同体积的两种气体的质量与式量关系为_______________________b. 两种气体的体积与物质的量关系为___________________________c. 两种气体等质量时,体积与其式量关系为_____________________d. 两种气体密度与其式量关系为_____________________2. 由于气体的摩尔质量在数值上等于气体的________,所以求算气体摩尔质量有如下几种方法:(1)根据摩尔质量定义求算:M=__________。
(2)根据标准状况下气体的密度求算:M=__________。
ρρ=D。
(3)根据两种气体的相对密度(用D表示)求证:M1/M2=12【基础训练】1. 在同温同压下,两种物质的量相同的气体必然()A. 体积均为22.4LB. 具有相同的体积C. 含有相同的质量D. 含有相同的原子数2. N A表示阿伏伽德罗常数,以下说法正确的是()A. 常温常压下,16g氧气中含有氧原子的数目为N AB. 25℃时,压强为1.01×105Pa时,11.2L氮气所含的原子数目为N AC. 标准状况下,11.2L汽油所含的分子数为0.5N AD. 标准状况下,11.2L H2O中含有0.5N A个氧原子3. 一种黄棕色气体X,其体积为20mL,完全分解后生成10mL氯气和20mL氧气(同温同压下测定),判断X为三原子分子的依据是()A. 质量守恒定律和阿伏伽德罗定律B. 能量守恒定律C. 质量守恒原理D. 阿伏伽德罗定律4. 在一定温度和压强下,1体积X2气体与3体积Y2气体化合生成2体积气体化合物,则该化合物的化学式为()A. XY3B. XYC. X3YD. X2Y35. 混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为0.821g/L,则混合气体中N2和CH4的体积比为()A. 1:1B. 1:4C. 4:1D. 1:26. 标准状况下,某气体280mL 的质量是0.55g ,则该气体的相对分子质量是( )A. 19.6B. 154C. 22D. 447. 一只集气瓶(带玻璃片),充满氧气后质量为112g ,充满二氧化碳后质量为118g ,充满某气体后质量为110g ,则该气体的摩尔质量是( )A. 44g/molB. 32g/molC. 60g/molD. 28g/mol8. 由两种金属组成的混合物2.8g ,与足量的盐酸反应生成氢气的体积为2.24L (标准状况),则该混合物的组成不可能是( )A. Al 和FeB. Mg 和ZnC. Mg 和AlD. Mg 和Cu9. 加热分解5g 某固体化合物得到A 气体0.7L (标准状况)和4g 残渣,A 的相对分子质量是______。
高考化学复习专题一:化学计量在实验中的应用总结归纳

精心整理专题一:化学计量在实验中的应用知识点一:物质的量、摩尔质量以及阿伏伽德罗常数(考点,易错点)1.物质的量(n)是表示含有一定数目粒子的集体的物理量。
(注意任何粒子)2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔。
(注意任何粒子)3.阿伏加德罗常数:把6.02 X1023mol-1叫作阿伏加德罗常数。
(注意单位)4.物质的量=物质所含微粒数目/阿伏加德罗常数 n =N/N A5.摩尔质量(M)(1) 定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol 或 g.mol-1(3)6.物质的量=物质的质量/摩尔质量 ( n = m/M )例1:列说法中正确的是()A.H2的摩尔质量是2 gB.1 mol氧的质量是C.氧气的摩尔质量是32 g·mol-1D.2 g H2含6.02×10变式练习1.标准状况下有①0.112 L水②0.5N A个HCl氦气⑥6.02×10232.含0.4 mol Al2(SO4)3的溶液中,含、“<”或“=”)3.(1)1 mol_______________________个氢原子。
(2)水所含氢原子数相同。
4. 5 K下呈现超导性。
据报道,该晶体的化学式为Na0.35CoO2·12.2 g该晶体中含氧原子数__________,氢原5.用N A()。
A2N AB.28 g2N AC.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6N AD.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2N A知识点二:气体摩尔体积与阿伏伽德罗定律(考点,重点,易错点)1.气体摩尔体积(Vm)(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.(2)单位:L/mol2.物质的量=气体的体积/气体摩尔体积n=V/Vm3.标准状况下, Vm = 22.4 L/mol4. 阿伏加德罗定律:同温同压下,相同的任何气体,含有数目的分子(或气体的物质的量相同)。
阿伏伽德罗定律及其推论

m=ρV
m1 M 1 m2 M2
例5. 化合物A是一种不稳定的物质,它的分子组成 可用OxFy表示。10 mL A气体能分解生成15 mL O2和10 mL F2(同温、同压下)。
[解析]
⑤SO2
V1 n1 T 、P相同: V2 n 2
m n M
例2. 在两个密闭容器中,分别充有质量相同的甲、 乙两种气体,若两容器的温度和压强均相同, 且甲的密度大于乙的密度,则下列说法正确 的是(
B )
A. 甲的分子数比乙的分子数多 B. 甲的物质的量比乙的物质的量少 C. 甲的摩尔体积比乙的摩尔体积小 D. 甲的相对分子质量比乙的相对分子质量小
例8. 在标准状况下, 11.2 L CO和CO2混合气体的
质量为20.4 g,则混合气体中CO和CO2的体
1 : 4 ,质量比为_______ 7 : 44 。 积比为__________
[解析] 标准状况下,Vm = 22.4 L· mol-1
V 11.2L n 0.5mol 1 Vm 22.4L mol
O3F2 (1)A的化学式是________
推断理由是
阿伏加德罗定律和质量守恒定律 ______________________________________ 。
V n 1 1 [解析] T、P相同: V2 n 2
10mL
A = O2 + F2
15mL
10mL
例6、同温同压下,某容器充满O2重116 g,若充满
气体摩尔体积及阿伏伽德罗定律和物质的量浓度计算

单位:L/mol 定义:1摩尔任何气体在标准状况下的体积都约为22.4升 符号:Vₘ 适用范围:适用于气体,不适用于液体、固体
计算公式:V=n×Vm 解释:V表示气体的摩尔体积,n表示物质的量,Vm表示摩尔体积常数 适用范围:适用于标准状况下的气体,不适用于非气体物质 注意事项:计算时需注意单位换算,如体积单位为升,物质的量单位为摩尔
物质的量浓度与阿伏伽德罗定律之间存在 密切关系,可以通过阿伏伽德罗定律推导 出来。
阿伏伽德罗定律表明,在等温、等压条 件下,气体的体积与物质的量成正比, 因此物质的量浓度与阿伏伽德罗定律之 间存在反比关系。
汇报人:XX
之间的距离。
添加标题
计算气体分子的平 均摩尔质量:利用 阿伏伽德罗定律可 以计算气体的平均 摩尔质量,这对于 确定气体的化学性 质和物理性质非常
重要。
添加标题
PART THREE
物质的量浓度是指单位体积溶 液中所含溶质的物质的量
常用单位为mol/L或mol/m³
计算公式为:c = n/V,其中n 为溶质的物质的量,V为溶液 的体积
添加标题
添加标题
添加标题
添加标题
适用于理想气体,不适用于真实气 体。
适用于温度和压强不变的情况。
物质的量与微粒数的关系:n = N/NA
物质的量与质量的关系:m = n*M
物质的量浓度与物质的量之间 的关系:c = n/V
气体摩尔体积与阿伏伽德罗定 律的关系:V = n*Vm
计算气体分子数: 利用阿伏伽德罗 定律可以计算一 定体积的气体所 含的分子数。
适用于标准状况下的气体
适用于气体物质,不适用于液体或 固体
添加标题
添加标题
适用于气体混合物
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
气体摩尔质量及阿伏伽德罗定律
1、气体摩尔体积
定义:单位物质的量的_____所占的______。
符号:Vm
单位:L/mol
公式:n=V/Vm
(3)气体摩尔体积不仅适用于纯净气体,也适用于混合气体。
(4)特例:在标准状况下,气体摩尔体积约为22.4L/mol,因此我们认为
22.4L/mol是在特定条件下的气体摩尔体积。
【归纳】1.决定各种物质体积大小的因素有三种,即微粒数、微粒间的距离和微粒的大小。
2.如果物质所含的微粒数相等,(1)当微粒间距很小时(如固、液态物质),微粒的大小是决定物体体积大小的主要因素。
(2)当微粒间距较大时(如气态物质),决定物质体积的主要因素是微粒间的距离。
练习1、下列说法中有无错误?为什么?
(1)1mol氢气的体积大约是22.4L。
(2)在标准状况下,18g水的体积大约等于22.4L。
(3)在标准状况下,22g二氧化碳的体积大约是22.4L。
(4)在0℃、100kPa下,1mol氯气的体积是22.4L。
(5)在标准状况下,22.4L氧气和22.4L二氧化碳的物质的量相等。
重点:阿伏伽德罗定律
1、定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
2、应用阿伏加德罗定律时要注意三点:
(1)适用范围:气体。
(2)简单地说,就是四个“同”:
同温、同压(即相同状况)、同体积、同分子数(或同物质的量)。
(3)气体摩尔体积是阿伏加德罗定律的特例。
练习2、下列说法是否正确?
1.同温同压下,1L氯化氢和1L水的物质的量相同。
2.同温同压下,1gH2和16gO2的体积相同。
3.20℃,1.01×102kPa时,1mol任何气体的体积都约是22.4L。
练习3、在标准状况下:
①0.5molO2占有的体积是多少?
②44.8LH2的物质的量是多少?
③14gCO的体积是多少?
④33.6LN2中含有的N2分子数是多少?
阿伏伽德罗定律的重要推论
相同条件结论
公式语言表达
同温同压(T、p相同)V1/V2 = n1/n2 同温、同压下,气体的体积与物质
的量成正比。
同温同压(T、p相同)p1/p2=M1/M2 同温、同压下,气体的密度与其相
对分子质量成正比。
同温同体积(T、V相同)P1/P2=n1/n2 同温、同体积的气体,其压强与物
质的量成正比。
【小结】
练习4、在标准状况下,多少克氧气的体积与4g氢气的体积相等?
【小结】物质的量相等的气体占有的体积相等。
若以W表示质量,
练习5、在标准状况下,相同质量的下列气体,占有体积由大到小的顺序是_______。
①Cl2、③N2、②H2、④CO2、⑤O2
【小结】在同温同压下,气体体积之比等于物质的量之比。
相同质量的物质,摩尔质量越大,物质的量越少。
所以同温同压下,质量相同的气体,体积与摩尔质量成反比。
【总结】本节重点:
1.正确理解气体摩尔体积并进行简单计算。
2.能运用阿伏加德罗定律分析、比较气体体积。
注意:
1.气体摩尔体积应记作约22.4L/mol.
2.使用22.4L/mol进行换算时,必须是标准状况。
3.阿伏加德罗定律只运于气体,且在同温同压下比较。
随堂练习:
【练习1】l.某气态氢化物H2R在标准状况下密度为1.52g/L,R的相对原子质量等于多少?
2. ag某气体在标准状况下的体积是bmL,则该气体的式量为____。
【练习2】
l.0.2mol铝跟足量盐酸完全反应,计算:
(l)标准状况下生成氢气多少升?
(2)生成氯化铝多少克?
2.在标准状况下,15g一氧化碳和二氧化碳的混合气体的体积为8.8L。
计算这两种气体的质量和体积各是多少?
【小结】1.计算中时刻注意以物质的量为核心进行计算。
2.解题要规范,特别注意单位的正确使用:质量(克)←→物质的量(摩)←→气体体积(升)。
注意:左右(不同物质)单位要对应,上下(同一物质)单位要一致。
