必修二有机化学方程式
必修二 有机化学 方程式总结

乙烯与HX:C2H4+HX催CH3CH2X
乙烯与H2O:C2H4+H2O催CH3CH2OH
乙烯的加聚:nC2H4催[CH2-CH2]n
苯的燃烧: +15O2点12CO2+6H2O
苯的溴代:+Br2Br
苯的硝化:+HNO3浓硫酸50-60℃NO2+H2O
苯的磺化:+H2SO4(浓)70-80℃SO3H +H2O
乙醇与HX:C2H5OH+HX C2H5OX+H2O
乙酸与钠:2CH3COOH+Na 2CH3COONa+H2O
乙酸与NaOH:CH3COOH+NaOH CH3COONa+H2O
乙酸Na2CO3:CH3COOH+Na2CO3CH3COONa+H2O+CO2
乙醇与乙酸:CH3COOH+C2ห้องสมุดไป่ตู้5OH浓硫酸△CH3COOC2H5+H2O
必修二
甲烷和Cl2:CH4+Cl2CH3Cl+HCl
CH3Cl+Cl2CH2Cl2+HCl
CH2Cl2+Cl2CHCl3+HCl
CHCl3+Cl2CCl4+HCl
甲烷燃烧:CH4+2O2点CO2+2H2O
甲烷分解:CH41000℃C+2H2
乙烯燃烧:C2H4+3O2点2CO2+2H2O
乙烯与Br2:C2H4+Br2C2H4Br2
苯与H2:+3H2Ni△
乙醇和钠:2C2H5OH+2Na 2CH3COONa+H2
高中化学全部化学方程式汇总(有机和无机)

高中化学全部化学方程式汇总(有机和无机)【注意】以下是有机和无机化学方程式的汇总,请按需使用或参考。
为了排版整洁,请在使用时进行适当的调整和修改。
一、有机化学方程式1. 碳氢化合物反应方程式1.1 烷烃燃烧反应:CnH2n+2 + (n + (n/2 + 1)/2)O2 → nCO2 + (n + (n/2 - 1)/2)H2O1.2 烯烃燃烧反应:CnH2n + (n + n/2)O2 → nCO2 + nH2O1.3 异构烷烃燃烧反应:CnH2n + (n + n/2)O2 → nCO2 + nH2O2. 醇类反应方程式2.1 醇的燃烧反应:CnH2n+1OH + (n + (n+1)/2)O2 → nCO2 + (n+1)H2O2.2 醇的脱水反应:CnH2n+1OH → CnH2n + H2O3. 酚类反应方程式3.1 酚的燃烧反应:C6H6O + 15/2O2 → 6CO2 + 3H2O 3.2 酚的酸碱中和反应:C6H6O + NaOH → C6H5ONa + H2O 4. 酯类反应方程式4.1 酯的酸水解反应:RCOOR' + H2O → RCOOH + R'OH 4.2 酯的碱水解反应:RCOOR' + NaOH → RCOONa + R'OH 5. 醛和酮类反应方程式5.1 氧化性还原反应:RCHO + [O] → RCOOH5.2 醛的酸碱反应:RCHO + NaOH → RCOONa + H2O 6. 醚类反应方程式6.1 醚的加热裂解反应:ROR' → R'H + R'OH6.2 醚的酸水解反应:ROR' + H2O → ROH + R'OH7. 脂肪酸类反应方程式7.1 脂肪酸的酸碱反应:RCOOH + NaOH → RCOONa + H2O7.2 脂肪酸的酯化反应:RCOOH + R'OH → RCOOR' + H2O二、无机化学方程式1. 钠和氧的反应方程式4Na + O2 → 2Na2O2. 钙和水的反应方程式Ca + 2H2O → Ca(OH)2 + H23. 硝酸和铜的反应方程式Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O 4. 二氧化碳和水的反应方程式CO2 + H2O → H2CO35. 硝酸和氢氧化钠的反应方程式2NaOH + HNO3 → NaNO3 + H2O6. 硫化氢和氯的反应方程式H2S + Cl2 → 2HCl + S7. 氧化锌和硫酸的反应方程式ZnO + H2SO4 → ZnSO4 + H2O8. 氯气和钾溶液的反应方程式Cl2 + 2KOH → KCl + KClO + H2O9. 溴和钾的反应方程式2K + Br2 → 2KBr10. 硫和氧的反应方程式S + O2 → SO2以上是高中化学的部分有机和无机方程式的汇总,希望能对你的学习有所帮助。
必修二有机物化学方程式

必修二有机物化学方程式有机物化学方程式1.甲烷燃烧CH+2O→CO+2HO(条件为点燃) 24222.甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH→C+2H(条件为高温高压,催化剂)243.甲烷和氯气发生取代反应CH+Cl→CHCl+HCl CHCl+Cl→CHCl+HCl 2324322CHCl+Cl→CHCl+HCl CHCl+Cl→CCl+HCl (条件都为光照。
)42323224.实验室制甲烷CHCOONa+NaOH→NaCO+CH(条件是CaO 加热)42335.乙烯燃烧CH=CH+3O→2CO+2HO(条件为点燃)222226.乙烯和溴水CH=CH+Br→CHBr-CHBr 222227.乙烯和水CH=CH+HO→CH3CH2OH (条件为催化剂)2228.乙烯和氯化氢CH=CH+HCl→CH-CHCl 22329.乙烯和氢气CH=CH+H→CH-CH (条件为催化剂)3223210.乙烯聚合nCH=CH→-[-CH-CH-]n-(条件为催化剂)222211.氯乙烯聚合nCH=CHCl→-[-CH-CHCl-]-(条件为催化剂)n2212.实验室制乙烯CHCHOH→CH=CH↑+HO (条件为加热,浓HSO)422232213.乙炔燃烧CH+3O→2CO+HO (条件为点燃)2222214.乙炔和溴水CH+2Br→CHBr 42222215.乙炔和氯化氢两步反应:CH+HCl→CHCl--------CHCl+HCl→CHCl 2 2232324216.乙炔和氢气两步反应:CH+H→CH →CH+2H→CH (条件为催化6422222222剂)17.实验室制乙炔CaC+2HO→Ca(OH)+CH↑2222218.以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
CaCO === CaO + CO 2CaO+5C===2CaC+CO 2223CaC+2HO→CH+Ca(OH)C+HO===CO+H-----高温2222222CH+H→CH----乙炔加成生成乙烯CH可聚合42224 2219.苯燃烧2CH+15O→12CO+6HO (条件为点燃)2262620.苯和液溴的取代CH+Br→CHBr+HBr 5666221.苯和浓硫酸浓硝酸CH+HNO→CHNO+HO (条件为浓硫酸)265623622.苯和氢气C6H6+3H2→C6H12 (条件为催化剂)23.乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃)24.乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)25.乙醇发生消去反应的方程式CH3CH2OH→CH2=CH2+H2O (条件为浓硫酸170摄氏度)26.两分子乙醇发生分子间脱水2CH3CH2OH→CH3CH2OCH2CH3+H2O (条件为催化剂浓硫酸140摄氏度) 27.乙醇和乙酸发生酯化反应的方程式CH3COOH+C2H5OH→CH3COOC2H5+H2O28.乙酸和镁Mg+2CH3COOH→(CH3COO)2Mg+H22Ca+H2O )2CH3COOH+CaO→(CH3CH2 乙酸和氧化钙29.30.乙酸和氢氧化钠CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH31.乙酸和碳酸钠Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑32.甲醛和新制的氢氧化铜HCHO+4Cu(OH)2→2Cu2O+CO2↑+5H2O33.乙醛和新制的氢氧化铜CH3CHO+2CU(OH)2=CH3COOH+CU2O+2H2O34.乙醛氧化为乙酸2CH3CHO+O2→2CH3COOH(条件为催化剂或加温)一.烯烃是指含有C=C键的碳氢化合物。
高中化学必修一二化学方程式汇总

高中化学必修一二化学方程式汇总一、必修一化学方程式1. 钠及其化合物- 钠与氧气常温反应:4Na + O_{2}=2Na_{2}O- 钠在氧气中燃烧:2Na + O_{2}{点燃}{=!=!=}Na_{2}O_{2}- 钠与水反应:2Na + 2H_{2}O = 2NaOH+ H_{2}↑- 过氧化钠与水反应:2Na_{2}O_{2}+2H_{2}O = 4NaOH + O_{2}↑- 过氧化钠与二氧化碳反应:2Na_{2}O_{2}+2CO_{2}=2Na_{2}CO_{3}+O_{2} - 向碳酸钠溶液中滴加少量盐酸:Na_{2}CO_{3}+HCl = NaHCO_{3}+NaCl - 向碳酸钠溶液中滴加过量盐酸:Na_{2}CO_{3}+2HCl = 2NaCl +H_{2}O+CO_{2}↑- 碳酸氢钠受热分解:2NaHCO_{3}{}{=!=!=}Na_{2}CO_{3}+H_{2}O + CO_{2}↑- 碳酸氢钠与氢氧化钠反应:NaHCO_{3}+NaOH = Na_{2}CO_{3}+H_{2}O2. 铝及其化合物- 铝与氧气反应:4Al + 3O_{2}=2Al_{2}O_{3}- 铝与盐酸反应:2Al+6HCl = 2AlCl_{3}+3H_{2}↑- 铝与氢氧化钠溶液反应:2Al + 2NaOH+2H_{2}O = 2NaAlO_{2}+3H_{2}↑ - 氧化铝与盐酸反应:Al_{2}O_{3}+6HCl = 2AlCl_{3}+3H_{2}O- 氧化铝与氢氧化钠溶液反应:Al_{2}O_{3}+2NaOH = 2NaAlO_{2}+H_{2}O - 氢氧化铝的制备(向氯化铝溶液中滴加氨水):AlCl_{3}+3NH_{3}· H_{2}O = Al(OH)_{3}↓+3NH_{4}Cl- 氢氧化铝与盐酸反应:Al(OH)_{3}+3HCl = AlCl_{3}+3H_{2}O- 氢氧化铝与氢氧化钠溶液反应:Al(OH)_{3}+NaOH = NaAlO_{2}+2H_{2}O3. 铁及其化合物- 铁与氧气反应:3Fe + 2O_{2}{点燃}{=!=!=}Fe_{3}O_{4}- 铁与氯气反应:2Fe+3Cl_{2}{点燃}{=!=!=}2FeCl_{3}- 铁与盐酸反应:Fe + 2HCl = FeCl_{2}+H_{2}↑- 铁与硫酸铜溶液反应:Fe + CuSO_{4}=FeSO_{4}+Cu- 氯化亚铁与氯气反应:2FeCl_{2}+Cl_{2}=2FeCl_{3}- 氯化铁与铁反应:2FeCl_{3}+Fe = 3FeCl_{2}- 氯化铁与铜反应:2FeCl_{3}+Cu = 2FeCl_{2}+CuCl_{2}4. 硅及其化合物- 硅与氧气反应:Si + O_{2}{}{=!=!=}SiO_{2}- 硅与氢氧化钠溶液反应:Si + 2NaOH + H_{2}O=Na_{2}SiO_{3}+2H_{2}↑ - 二氧化硅与氢氧化钠溶液反应:SiO_{2}+2NaOH = Na_{2}SiO_{3}+H_{2}O - 二氧化硅与氢氟酸反应:SiO_{2}+4HF = SiF_{4}↑+2H_{2}O- 硅酸的制备(硅酸钠溶液与盐酸反应):Na_{2}SiO_{3}+2HCl =H_{2}SiO_{3}↓+2NaCl5. 氯及其化合物- 氯气与金属铁反应:2Fe + 3Cl_{2}{点燃}{=!=!=}2FeCl_{3}- 氯气与金属铜反应:Cu+Cl_{2}{点燃}{=!=!=}CuCl_{2}- 氯气与氢气反应:H_{2}+Cl_{2}{点燃}{=!=!=}2HCl- 氯气与水反应:Cl_{2}+H_{2}O = HCl + HClO- 次氯酸光照分解:2HClO{光照}{=!=!=}2HCl+O_{2}↑- 氯气与氢氧化钠溶液反应:Cl_{2}+2NaOH = NaCl + NaClO + H_{2}O- 氯气与氢氧化钙反应制漂白粉:2Cl_{2}+2Ca(OH)_{2}=CaCl_{2}+Ca(ClO)_{2}+2H_{2}O6. 硫及其化合物- 硫与氧气反应:S+O_{2}{点燃}{=!=!=}SO_{2}- 二氧化硫与水反应:SO_{2}+H_{2}O = H_{2}SO_{3}- 二氧化硫与氧气反应:2SO_{2}+O_{2}{催化剂}{underset{}{⇌}}2SO_{3} - 三氧化硫与水反应:SO_{3}+H_{2}O = H_{2}SO_{4}- 铜与浓硫酸反应:Cu + 2H_{2}SO_{4}(浓){}{=!=!=}CuSO_{4}+SO_{2}↑+2H_{2}O- 碳与浓硫酸反应:C + 2H_{2}SO_{4}(浓){}{=!=!=}CO_{2}↑+2SO_{2}↑+2H_{2}O7. 氮及其化合物- 氮气与氧气反应:N_{2}+O_{2}{放电或高温}{=!=!=}2NO- 一氧化氮与氧气反应:2NO+O_{2}=2NO_{2}- 二氧化氮与水反应:3NO_{2}+H_{2}O = 2HNO_{3}+NO- 工业合成氨:N_{2}+3H_{2}{催化剂}{underset{高温高压}{⇌}}2NH_{3}- 氨气与水反应:NH_{3}+H_{2}O = NH_{3}· H_{2}O- 氨气与氯化氢反应:NH_{3}+HCl = NH_{4}Cl- 氯化铵受热分解:NH_{4}Cl{}{=!=!=}NH_{3}↑+HCl↑- 碳酸氢铵受热分解:NH_{4}HCO_{3}{}{=!=!=}NH_{3}↑+H_{2}O↑+CO_{2}↑- 硝酸铵与氢氧化钠反应:NH_{4}NO_{3}+NaOH{}{=!=!=}NH_{3}↑+NaNO_{3}+H_{2}O- 铜与稀硝酸反应:3Cu + 8HNO_{3}(稀)=3Cu(NO_{3})_{2}+2NO↑+4H_{2}O- 铜与浓硝酸反应:Cu + 4HNO_{3}(浓)=Cu(NO_{3})_{2}+2NO_{2}↑+2H_{2}O二、必修二化学方程式1. 元素周期律相关反应(以碱金属和卤素为例)- 锂与氧气反应:4Li + O_{2}=2Li_{2}O- 钾与水反应:2K+2H_{2}O = 2KOH + H_{2}↑- 氯气与溴化钠溶液反应:Cl_{2}+2NaBr = 2NaCl+Br_{2}- 溴与碘化钾溶液反应:Br_{2}+2KI = 2KBr+I_{2}2. 化学反应与能量- 氢气燃烧:2H_{2}+O_{2}{点燃}{=!=!=}2H_{2}O(放热反应)- 碳酸钙受热分解:CaCO_{3}{}{=!=!=}CaO + CO_{2}↑(吸热反应)3. 有机化学基础(必修部分)- 甲烷燃烧:CH_{4}+2O_{2}{点燃}{=!=!=}CO_{2}+2H_{2}O- 甲烷与氯气发生取代反应(以一氯取代为例):CH_{4}+Cl_{2}{光照}{=!=!=}CH_{3}Cl+HCl- 乙烯燃烧:C_{2}H_{4}+3O_{2}{点燃}{=!=!=}2CO_{2}+2H_{2}O- 乙烯与溴水反应:C_{2}H_{4}+Br_{2}to C_{2}H_{4}Br_{2}- 乙烯与水加成反应:C_{2}H_{4}+H_{2}O{催化剂}{to}C_{2}H_{5}OH- 苯燃烧:2C_{6}H_{6}+15O_{2}{点燃}{=!=!=}12CO_{2}+6H_{2}O- 苯与液溴反应:C_{6}H_{6}+Br_{2}{FeBr_{3}}{=!=!=}C_{6}H_{5}Br+HBr - 乙醇燃烧:C_{2}H_{5}OH + 3O_{2}{点燃}{=!=!=}2CO_{2}+3H_{2}O - 乙醇与钠反应:2C_{2}H_{5}OH + 2Nato 2C_{2}H_{5}ONa+H_{2}↑- 乙醇的催化氧化:2C_{2}H_{5}OH + O_{2}{Cu或Ag}{underset{}{to}}2CH_{3}CHO + 2H_{2}O- 乙酸与乙醇的酯化反应:CH_{3}COOH+C_{2}H_{5}OH{浓硫酸}{underset{}{⇌}}CH_{3}COOC_{2}H_{5}+H_{2}O。
必修二有机化学方程式
1、实验制取实验室制甲烷CH3COONa+NaOH Na2CO3+CH4(乙酸钠,醋酸钠)浓H2SO4实验室制乙烯CH3CH2OH CH2=CH2↑+H2O(乙醇)实验室制乙炔CaC2+2H2O Ca(OH)2+C2H2↑(碳化钙)催化剂工业制取乙醇:C2H4+H20 CH3CH2OH2、氧化反应:点燃甲烷燃烧CH4+2O2CO2+2H2O点燃乙烯燃烧CH2=CH2+3O22CO2+2H2O点燃乙炔燃烧C2H2+3O22CO2+H2O 燃烧点燃苯燃烧2C6H6+15O212CO2+6H2O点燃乙醇完全燃烧的方程式C2H5OH+3O22CO2+3H2O乙醇的催化氧化的方程式2CH3CH2OH+O22CH3CHO+2H2O甲烷和氯气发生取代反应光照CH4+Cl2CH3Cl+HCl光照CH3Cl+Cl2CH2Cl2+HCl光照CH2Cl2+Cl2CHCl3+HCl光照CHCl3+Cl2CCl4+HCl(注:反应物是卤素单质的蒸汽)苯和浓硫酸浓硝酸C6H6+HNO3C6H5NO2+H2O(硝基苯)FeBr3苯与溴在FeBr3催化作用下反应C6H6+Br2C6H5Br+HBr浓硫酸乙酸乙酯的水解:CH3COOC2H5+H2O CH3COOH+C2H5OH (注:苯的同系物也可以发生取代反应)4、加成反应:乙烯和溴水CH2=CH2+Br2CH2Br-CH2Br催化剂乙烯和水CH2=CH2+H20 加热加压CH3CH2OH催化剂乙烯和氯化氢CH2=H2+HCl CH3-CH2Cl乙烯和氢气CH2=CH2+H2CH3-CH3苯和氢气C6H6+3H2C6H12催化剂乙烯聚合nCH2=CH2-[-CH2-CH2-]n- (条件为催化剂)催化剂氯乙烯聚合nCH2=CHCl -[-CH2-CHCl-]n- (条件为催化剂)6、酯化反应:浓硫酸乙醇乙酸反应的方程式CH3CH2OH+CH3COOH CH3COOC2H5 +H2O (酸脱羟基,醇脱氢)(乙酸乙酯)7、补充:乙醇与钠反应2C2H5OH+2Na 2C2H5ONa+H2↑。
必修一、必修二化学方程式汇总

高中化学(人教版)必修一、必修二相关化学方程式汇总必修一1、硫酸根离子的检验:先加HCl酸化---BaCl2+Na2SO4====BaSO4↓+2NaCl2、碳酸根离子的检验:CaCl2+Na2CO3=====CaCO3↓+2NaCl碳酸钠与盐酸反应:Na2CO3+2HCl=====2NaCl+H2O+CO2↑3、2Na+O2Na2O2钠与氧气反应:4Na+O2====2Na2O7、过氧化钠与水反应:2Na2O2+2H2O====4NaOH+O2↑8、过氧化钠与二氧化碳反应:2Na2O2+2CO2====2Na2CO3+O29、钠与水反应:2Na+2H2O====2NaOH+H2↑10、铁与水蒸气反应:3Fe+4H2O(g)====F3O4+4H2↑11、Mg与HCl反应:Mg+2HCl===MgCl2+H2↑12、Al与HCl反应:2Al+6HCl===2AlCl3+3H2↑铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O====2NaAlO2+3H2↑13、氧化钙与水反应:CaO+H2O====Ca(OH)214、氧化铁与盐酸反应:Fe2O3+6HCl=====2FeCl3+3H2O15、氧化铝与盐酸反应:Al2O3+6HCl=====2AlCl3+3H2O16、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH=====2NaAlO2+ H2O17、氯化铝与氢氧化钠溶液反应:AlCl3+3NaOH=====Al(OH)3↓+3NaCl氢氧化铝与氢氧化钠溶液反应:Al(OH)3+NaOH====NaAlO2+2H2O18、偏铝酸钠与盐酸的反应:NaAlO2+HCl+H2O=====Al(OH)3↓+NaClAl(OH)3+3HCl====AlCl3+3H2O19、硫酸亚铁与氢氧化钠溶液反应:FeSO4+2NaOH====Fe(OH)2↓+Na2SO4氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2+2H2O+O2====4Fe(OH)320、氢氧化铁加热分解:2Fe(OH)3Fe2O3+3H2O氢氧化铝加热分解:2Al(OH)3Al2O3+3H2O21、实验室制取氢氧化铝:Al2(SO4)3+6NH3·H2O====2Al(OH)3↓+3(NH4)2SO422、氯化铁与氢氧化钠溶液反应:FeCl3+3NaOH=====Fe(OH)3↓+3NaCl23、三氯化铁溶液与铁粉反应:2FeCl3+Fe====3FeCl224、氯化亚铁中通入氯气:2FeCl2+Cl2=====2FeCl325、Si+2NaOH+H2O====Na2SiO3+2H2↑高温电炉26、硅单质的实验室制法粗硅的制取:SiO2+2CSi+2CO粗硅转变为纯硅:(石英沙)(焦碳)(粗硅)S(i粗)+2Cl2SiCl4SiCl4+2H2高温S(i纯)+4HCl 27、二氧化硅与氢氟酸反应:SiO2+4HF====SiF4↑+2H2O(雕刻玻璃)硅单质与氢氟酸反应:Si+4HF====SiF4↑+2H2↑28、二氧化硅与氧化钙高温反应:SiO2+CaO 高温CaSiO329、二氧化硅与氢氧化钠溶液反应:SiO2+2NaOH====Na2SiO3+H2O30、往硅酸钠溶液中通入二氧化碳:Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓31、硅酸钠与盐酸反应:Na2SiO3+2HCl===2NaCl+H2SiO3↓32、氯气与金属铁反应:2Fe+3Cl2点燃2FeCl333、氯气与金属铜反应:Cu+Cl2点燃CuCl234、氯气与金属钠反应:2Na+Cl2点燃2NaCl35、氯气与水反应:Cl2+H2O====HCl+HClO光照36、次氯酸光照分解:2HClO2HCl+O2↑37、氯气与氢氧化钠溶液反应:Cl2+2NaOH=====NaCl+NaClO+H2O38、氯气与消石灰反应:2Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O39、盐酸与硝酸银溶液反应:HCl+AgNO3====AgCl↓+HNO340、漂白粉长期置露在空气中:Ca(ClO)2+H2O+CO2====CaCO3↓+2HClO41、二氧化硫与水反应:SO2+H2O===H2SO3放电42、氮气与氧气在放电下反应:N2+O22NO43、一氧化氮与氧气反应:2NO+O2====2NO244、二氧化氮与水反应:3NO2+H2O====2HNO3+NO催化剂45、二氧化硫与氧气在催化剂的作用下反应:2SO2+O22SO346、三氧化硫与水反应:SO3+H2O====H2SO447、浓硫酸与铜反应:Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑48、浓硫酸与木炭反应:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O49、浓硝酸与铜反应:Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O50、稀硝酸与铜反应:3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O51、氨水受热分解:NH3·H2ONH3↑+H2O52、氨气与氯化氢反应:NH3+HCl====NH4Cl(白烟)53、氯化铵受热分解:NH4ClNH3↑+HCl↑54、碳酸氢氨受热分解:NH4HCO3NH3↑+H2O↑+CO2↑55、硝酸铵与氢氧化钠反应:NH4NO3+NaOHNH3↑+NaNO3+H2O56、氨气的实验室制取:2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑点燃57、氯气与氢气反应:Cl2+H22HCl58、硫酸铵与氢氧化钠反应:(NH4)2SO4+2NaOH2NH3↑+Na2SO4+2H2O59、SO2+CaO====CaSO360、SO2+2NaOH====Na2SO3+H2O61、SO2+Ca(OH)2====CaSO3↓+H2O62、SO2和氯气1:1混合漂白能力消失SO2+Cl2+2H2O====2HCl +H2SO463、SO2+2H2S====3S+2H2O64、NO、NO2的回收:NO2+NO+2NaOH====2NaNO2+H2O必修二第一章物质结构元素周期律1、Li与O2反应(点燃):4Li+O22Li2ONa与O2反应(点燃):2Na+O2Na2O2Na与H2O反应:2Na+2H2O===2NaOH+H2↑K与H2O反应:2K+2H2O===2KOH+H2↑2、卤素单质F2、Cl2、Br2、I2与氢气反应:F2+H2===2HFCl2+H2===2HClBr2+H2===2BrI2+H2===2HI3、卤素单质间的置换反应:(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:①Cl2+2NaBr===Br2+2NaCl②Cl2+2NaI===I2+2NaCl(2)溴水与碘化钠溶液反应:Br2+2NaI===I2+2NaBr4、Mg与H2O反应:Mg+2H2OMg(OH)2+H2↑5、用电子式表示下列物质:NaClKOHHClH2ONH3CH4Na2ONa2O2NaOH第二章化学反应与能量1、Ba(OH)2?8H2O与NH4Cl的反应:Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O2、原电池原理典型的原电池(Zn-Cu原电池)负极(锌):Zn-2e-===Zn2+(氧化反应)正极(铜):2H++2e-===H2↑(还原反应)电子流动方向:由锌经过外电路流向铜。
必修二有机化学方程式

必修二有机化学方程式有机化学是一门研究有机化合物结构和性质的学科。
有机化合物是指含碳元素的化合物,其中也包括含碳氢元素的化合物。
在有机化学的学习中,掌握各种有机化合物的官能团、结构、性质和反应机理是至关重要的。
其中,有机化学方程式是表达有机化合物反应的重要手段。
有机化学方程式可以用来表达有机化合物的合成、分解、氧化、还原等反应过程。
在书写有机化学方程式时,需要注意以下几点:1、遵守原子经济性原则:即反应物中的原子应该尽可能地转化为目标产物,避免浪费和污染。
2、正确表示电子转移和氧化态:在有机化合物中,碳原子的氧化态通常用“-”表示,而氢原子的氧化态则用“+”表示。
3、表明反应条件:反应条件对于反应的进行和产物的生成都至关重要,因此需要在方程式中注明。
4、书写正确的有机化合物结构:在方程式中,需要准确地表示反应物和产物的结构,这有助于理解反应机理和性质。
下面列举一些常见的有机化学方程式:1、烷烃的燃烧反应:CH4 + 2O2 → CO2 + 2H2O2、烷烃的卤化反应:CH4 + Cl2 → CH3Cl + HCl3、烯烃的加成反应:CH2=CH2 + H2 → CH3-CH34、炔烃的加成反应:HC≡CH + 2H2 → CH2=CH-CH35、醇的氧化反应:R-CH2OH + PCC → R-CO-R + HCP6、醛的还原反应:R-CHO + H2 → R-CH2-OH7、羧酸的酯化反应:R-COOH + R′-OH → R-COO-R′ + H2O 8、酰胺的水解反应:R-CONH-R′ + H2O → R-COOH + R′-NH2以上是有机化学方程式的一些例子,掌握这些方程式对于理解有机化合物的结构和性质非常重要。
通过学习有机化学方程式,我们可以更好地了解有机化合物的合成、转化和分解过程,为后续深入学习有机化学奠定基础。
高中化学必修二方程式总结高中化学必修二方程式是化学学习中的重要内容,它们是描述化学反应的语言。
必修二有机化学方程式归纳+答案

必修二有机化学方程式归纳一.写出下列反应的方程式(除燃烧外,有机物必须用结构简式表示)1.甲烷与氯气混合光照CH 4+Cl 2 CH 3Cl+HCl CH 3Cl+Cl 2 CH 2Cl 2+HClCH 2Cl 2+Cl 2 CHCl 3+HCl CHCl 3+Cl 2 CCl 4+HCl2.乙烯通入溴水(或通入溴的CCl 4溶液)中CH 2 = CH 2 + Br 2 CH 2BrCH 2Br3.乙烯与水反应 CH 2 = CH 2 + H 2O CH 3CH 2OH4.乙烯与溴化氢反应CH 2 = CH 2 + HBr CH 3CH 2Br5.乙炔与氯化氢反应生成氯乙烯CH ≡CH + HCl H 2C = CHCl6.苯和浓硝酸反应 + HO -NO 2 NO 2 +H 2O7.苯和液溴反应+ Br 2 Br + HBr8.苯和氢气反应+ 3H 2 9.某烃燃烧 CxHy+(x+y/4)O 2 xCO 2+y/2H 2O10.乙醇与钠反应2C 2H 5OH+2Na 2CH 3COONa+H 2↑11.乙醇催化氧化2CH 3CH 2OH+O 2 2CH 3CHO+2H 2O 12.乙醛氧化成乙酸2CH 3CHO + O 2 2CH 3COOH13.银镜反应 CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O 光照 光照 光照 光照 催化剂 催化剂 催化剂浓H 2SO 450-60℃ Fe 催化剂 加热、加压点燃 Cu △催化剂水浴加热14.乙醛与新制氢氧化铜反应 CH 3CHO+2Cu(OH)2+NaOH CH 3COONa+Cu 2O ↓+2H 2O15.乙酸与钠反应2CH 3COOH+2Na CH 3COONa+H 2↑16.乙酸与碳酸钠反应2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑17.乙酸与氢氧化铜反应2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O18.乙酸与乙醇酯化反应 CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3+H 2O 19.乙酸乙酯在酸性条件下水解CH 3COOC 2H 5+H 2O ⇋ CH 3COOH+ C 2H 5OH 20.乙酸乙酯在碱性条件下水解 CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH 21.硬脂酸甘油酯与烧碱混合加热C 17H 35COO-CH 2 CH 2-OH C 17H 35COO-CH +3NaOH 3 C 17H 35COONa+CH-OH C 17H 35COO-CH 2 CH 2-OH水浴加热 催化剂 △稀硫酸 △△△。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
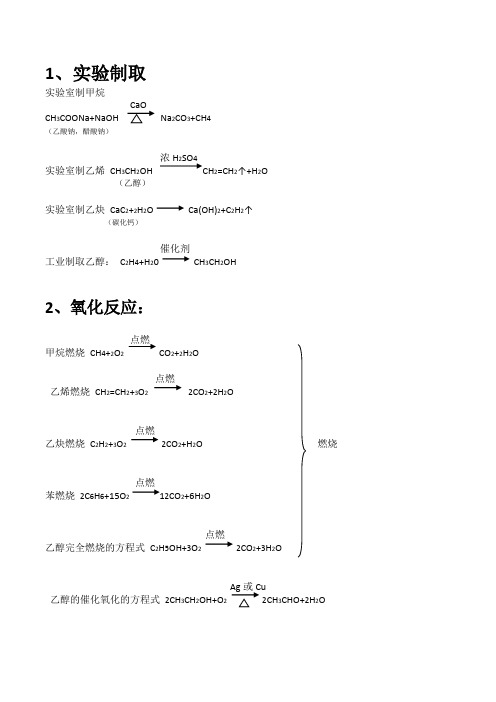
1、实验制取
实验室制甲烷
CH3COONa+NaOH Na2CO3+CH4
(乙酸钠,醋酸钠)
浓H2SO4
实验室制乙烯CH3CH2OH CH2=CH2↑+H2O
(乙醇)
实验室制乙炔CaC2+2H2O Ca(OH)2+C2H2↑
(碳化钙)
催化剂
工业制取乙醇:C2H4+H20 CH3CH2OH
2、氧化反应:
点燃
甲烷燃烧CH4+2O2CO2+2H2O
点燃
乙烯燃烧CH2=CH2+3O22CO2+2H2O
点燃
乙炔燃烧C2H2+3O22CO2+H2O 燃烧
点燃
苯燃烧2C6H6+15O212CO2+6H2O
点燃
乙醇完全燃烧的方程式C2H5OH+3O22CO2+3H2O
乙醇的催化氧化的方程式2CH3CH2OH+O22CH3CHO+2H2O
甲烷和氯气发生取代反应
光照
CH4+Cl2CH3Cl+HCl
光照
CH3Cl+Cl2CH2Cl2+HCl
光照
CH2Cl2+Cl2CHCl3+HCl
光照
CHCl3+Cl2CCl4+HCl
(注:反应物是卤素单质的蒸汽)
苯和浓硫酸浓硝酸C6H6+HNO3C6H5NO2+H2O
(硝基苯)
FeBr3
苯与溴在FeBr3催化作用下反应C6H6+Br2C6H5Br+HBr
浓硫酸
乙酸乙酯的水解:CH3COOC2H5+H2O CH3COOH+C2H5OH (注:苯的同系物也可以发生取代反应)
4、加成反应:
乙烯和溴水CH2=CH2+Br2CH2Br-CH2Br
催化剂
乙烯和水CH2=CH2+H20 加热加压CH3CH2OH
催化剂
乙烯和氯化氢CH
2=H2+HCl CH3-CH2Cl
乙烯和氢气CH2=CH2+H2CH3-CH3
苯和氢气C6H6+3H2C6H12
催化剂
乙烯聚合nCH2=CH2-[-CH2-CH2-]n- (条件为催化剂)
催化剂
氯乙烯聚合nCH2=CHCl -[-CH2-CHCl-]n- (条件为催化剂)
6、酯化反应:
浓硫酸
乙醇乙酸反应的方程式CH
3CH2OH+CH3COOH CH3COOC2H5 +H2O (酸脱羟基,醇脱氢)
(乙酸乙酯)
7、补充:
乙醇与钠反应2C2H5OH+2Na 2C2H5ONa+H2↑。
