有机质谱中的裂解反应
长链羰基化合物的质谱裂解规律及其分子式的计算

长链羰基化合物的质谱裂解规律及其分子式的计算长链羰基化合物是一类含有羰基官能团的有机化合物,其分子中碳原子数量较多,通常大于10个。
由于长链羰基化合物的碳框架较长,质谱裂解规律相对较为复杂。
本文将从两个方面探讨长链羰基化合物的质谱裂解规律和分子式的计算。
一、长链羰基化合物的质谱裂解规律1.α-断裂:长链羰基化合物的质谱中常见的裂解方式是α-断裂,即在羰基中心的碳原子处发生断裂。
在α-断裂过程中,生成的离子中带正电荷的碳原子成为裂解质子,而带负电荷的碳原子成为负离子。
α-断裂路径主要是通过产生酮基离子([R-CO]+•)或羧酸酐离子([RCO-OH]-•)。
2.β-断裂:在长链羰基化合物中,β-断裂是指在羰基官能团的相邻碳原子上发生的断裂。
β-断裂产物通常是醇或羧酸。
3.边链骨架断裂:在长链羰基化合物中,还会出现边链骨架断裂。
这种断裂通常发生在侧链上,产生离子中的侧链辛基碳离子或酮离子。
4.串联反应:长链羰基化合物的质谱裂解中还可能发生串联反应。
串联反应是指离子的一个断裂会引起另一个断裂,生成多个碎片离子。
这种反应机制在长链羰基化合物的质谱中较为常见。
其次,通过观察质谱图中的裂解质子离子峰([M-H]+)和其他离子峰,可以推导出化合物分子中不同官能团的存在。
例如,通过观察[RCO-OH]-•离子可以推测出羧酸官能团的存在。
最后,计算长链羰基化合物的官能团数目,并结合已知的官能团的相对分子质量,可以计算出分子式。
例如,如果已知羟基的相对分子质量为17,羧酸官能团的相对分子质量为45,那么测得有3个羧酸官能团和2个羟基官能团的化合物的分子质量为3×45+2×17=149、通过推测出的分子中的碳原子数量和测得的分子质量,可以计算出其分子式。
综上所述,长链羰基化合物的质谱裂解规律相对复杂,常见的裂解方式有α-断裂、β-断裂、边链骨架断裂和串联反应。
通过质谱图中的峰值,可以推导出长链羰基化合物的分子式。
第二章 有机质谱3-裂解反应+非氢重排
R
+
H2C
+ NHR' + OH(R' ) + SH(R' )
R
CH2
R
+
H2C
R
CH2 + O + S
R
+
H2C
R R
R+ + R+ +
OR' SR'
or or
R' R'
+ +
1. 偶电子规律
OE+ ·→ OE+ ·, OE+ ·→ EE+ EE+ → EE+ , EE+ → OE+ · ?
如何识别质谱图中的的OE+·?
不含氮的化合物, m/z 为偶数的离子是奇电子离子 在质谱图中, 奇电子离子并不多见, 但重要.
2. 烃类化合物的裂解规律:
烃类化合物的裂解优先生成稳定的正碳离子
+
re
CO2 + C6H5NH C2H5
+
m/z = 121
+ re RCH2O CH2O CH2R'
CH2O + RCH2O
CH2R'
+
re与氢的重排类似,反应过程中迁移的是一种基团,而不是氢自由基 消去反应中消去的是小分子或自由基碎片。
2. 苯基迁移
O SCH3
O S
+
有机质谱中的裂解反应

2. 重排裂解 ① 麦氏重排(自由基引发的重排反应):具有γ-H的侧链苯、烯烃、
环氧化合物、醛、酮等经过六元环过渡态使γ-H转移到带有正电荷的原 子上,同时在α 、β 原子间发生裂解,这种重排称为麦克拉夫悌重排裂解。
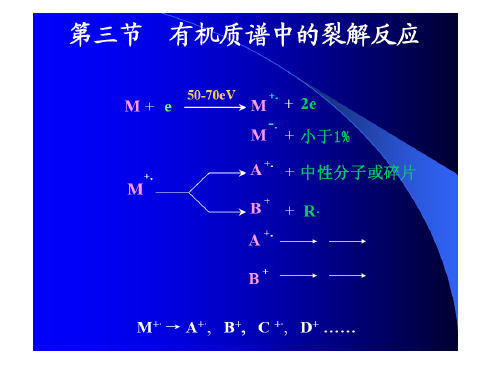
第二章 有机质谱
2.3 有机质谱中的裂解反应
一、有机质谱裂解反应机理 二、有机化合物的一般裂解规律
一、有机质谱裂解反应机理
裂解方式:1. 简单裂解 2. 重排开裂
1. 简单裂解 电荷-自由基定位理论:分子离子中电荷或自由基定位在分子的
某个特定位置上(首先先确定这个特定位置),然后以一个电子或 电子对的转移来“引发”裂解。单电子转移发生的裂解称为均裂, 双电子转移发生的裂解称为异裂。
+ O = CH2
+
R2
α
CH2 = O
R2 + R1
α
+ OH
H
N
R2
+
+
+ OH
α
R1
H N = CH2 + R2 +
H
α
CH2
=
N +
R2 + R1
② 异裂—正电荷引发裂解—i 裂解
正电荷引发的i断裂反应:是由正电荷引发的碎裂过程,它涉及两个 电子的转移,动力来自于电荷的诱导。
R1
酮:
均裂
异裂
① 均裂—自由基引发裂解—α裂解
自由基引发的ɑ断裂反应:动力来自自由基强烈的电子配对倾向。该 反应由自由基中心提供一个电子与邻接的原子形成一个新键,而邻 接原子的另一个化学键则发生断裂。下面列举几种含n、π电子化合 物发生ɑ断裂反应的情况:
质谱的原理和图谱的分析

◎分子中含2 Br,
(a+b)2, M : M+2 : M+4≈1 : 2 :1
◎分子中含1Cl 和1Br
4:1
(a1+b1) (a2+b2),
M : M+2 : M+4≈3 :
(3a+b)(a+b)=3实a用2文+档4ab+b2
查Beynon表 法
C H N O m/z M+1 M+2
理论计算值,会出现不符合N律和不符合UN的一般规律。
(3) 场致离(FI)和场解吸 ( FD )
场致离(field ionization, FI) •气态样品分子在在强电场(107-108V/cm)的作用下 发生电离。 •要求样品分子处于气态, 灵敏度不高, 应用逐渐减少.
场解吸 (field desorption, FD ) • 样品不需汽化, 将样品吸附在作为场离子发射体的金 属丝上, 送入离子源, 然后通以微弱电流, 使样品分子从 发射体上解吸下来, 并扩散至高场强的场发射区, 进行离 子化.
实用文档
■ 含重同位素(如 Cl, Br)的样品
35Cl : 37Cl = 100 : 32.5 ≈3 : 1; 79Br : 81Br = 100 : 98≈1 :
◎分子中含1 Cl, ◎分子中含2 Cl, ◎分子中含1 Br,
(a+b)1, M : M+2≈3 : 1 (a+b)2, M : M+2 : M+4≈9 : 6 :1 (a+b)1, M : M+2≈1 : 1
实用文档
(5)电喷雾电离(ESI) 样品溶液在电场的作用下形成带高度电荷的雾状小 液滴,在向质量分析器移动的过程中,液滴因溶剂 不断挥发而缩小,导致表面电荷密度不断增大,当 电荷之间的排斥力足以克服液滴的表面张力时,液 滴发生裂分,如此反复进行,最后得到带单电荷或 多电荷的离子。
有机质谱中的裂解反应

4. 羰基化合物的裂解
自由基引发的均裂及正电荷诱导的异裂。 自由基引发的均裂及正电荷诱导的异裂。
5. 逆 Diels-Alder 反应( retro- Diels-Alder ) 反应(
6. 氢的重排反应
1) Mclafferty 重排 )
2)自由基引发或正电荷诱导,经过四、五、六元环过渡氢的重排 )自由基引发或正电荷诱导,经过四、
正癸烷
100 % O F BASE PEAK 90 80
m/z=43 C3 C4 m/z=57
n-Hexadecane
70 60 50 40 m/z=29 C2 30 20 10 m/z=85 C6 99 169 183 197 C7 113 127 141 155 C8 C C C1 1 C1 2 C1 3 C1 4 10 9 C5 m/z=71
异裂
半异裂: 半异裂: X
Y
X+ . Y
X+
+
.Y
简单开裂从裂解机制可分为以下主要三种: 简单开裂从裂解机制可分为以下主要三种: (1) α-裂解 ) 裂解 由自由基引发的、由自由基重新组成新键而在α 由自由基引发的、由自由基重新组成新键而在α位导致碎裂的过程称为α 裂解 位导致碎裂的过程称为α-裂解。 碎裂的过程称为 裂解。
各类有机化合物的质谱
1. 烷烃
直链烷烃: )显示弱的分子离子峰。 直链烷烃:1)显示弱的分子离子峰。 2)由一系列峰簇组成,峰簇之间差14个单位。 )由一系列峰簇组成,峰簇之间差 个单位 个单位。 (29、43、57、71、85、99…) 、 、 、 、 、 ) 3)各峰簇的顶端形成一平滑曲线,最高点在C3或C4。 )各峰簇的顶端形成一平滑曲线,最高点在 4)比 M+. 峰质量数低的下一个峰簇顶点是 M-29。 ) - 。 而有甲基分枝的烷烃将有 M-15,这是直链烷烃 - , 与带有甲基分枝的烷烃相区别的重要标志。 与带有甲基分枝的烷烃相区别的重要标志。
质谱裂解机理中的特征裂解方式

质谱裂解机理中的特征裂解方式有机质谱中的裂解是极其复杂的,但是通过对其质谱裂解方式和机理的探讨研究,我们可以发现有一些特征结构裂解方式在有机质谱的裂解中是普遍存在的,是世界上的大量质谱学家通过对大量的有机质谱裂解方式进行观察、研究后的概括性总结。
所以其具有很重要的参考价值和应用价值,所以在有机质谱解析过程中,必须予以遵循,如此方能得到合理的质谱裂解方式和解析结果。
通过概括总结我们发现有机质谱中大部分化合物具有以下几种特征裂解方式:α裂解、苄基裂解、烯丙基裂解、麦氏重排裂解、DRA 裂解(逆狄尔斯阿尔德反应),几种特征裂解方式的强弱顺序如下:苄基裂解>α裂解、i 裂解>麦氏重排裂解、DRA 裂解>烯丙基裂解当然这种顺序不是一成不变的,随着化合物的结构发生改变,这些特征裂解方式的顺序有可能会发生改变,有机化合物质谱裂解大致可以分为两类α裂解(均裂)、β裂解,我们上面所讲的苄基裂解、烯丙基裂解、麦氏重排裂解、DRA 裂解都属于β裂解。
下面我们对几种特征裂解方式做以说明。
1、特征裂解方式一、α裂解α裂解是指凡具有C-X 单键基团和C=X 双键基团(其中X=C 、O 、S 、Cl 等)的有机分子,与该基团原子相连接的单键、称之为α键,在电子轰击条件下,该键很容易断裂因而称之为α断裂。
断键时成键的两个原子各自收回一个电子,这是由游离基中心引发的反应,原动力来自游离基的电子强烈配对倾向,所以α断裂属于均裂。
其裂解的机理及通式如下: I 饱和中心R 2C YR +H 2CCH2+ II 不饱和杂原子R RCY +几类化合物的α裂解 (1)H 3CCH 2OH 3H 2COH + (2)H 3CH 2C H 2CCH 3H 2COH 2CCH 3+3(3)CH 3OαO+H 2C CH 3(4)H NOCH 3O αH NO+OCH 3引发α断裂的倾向是由游离基中心给电子的能力决定的,一般来讲N>S 、O 、π、烷基>Cl 、Br>H ,同时α断裂遵循最大烷基游离基丢失的原则。
有机物质谱裂解

H C 2 C H H
正丁醇以上的直链伯醇容易产生 M-46 峰,这个链烯离子还 会继续脱去乙烯而产生一系列M-(18+28n)峰,n=1,2,3…。
H O
H C 2 H C 2 C H 2 H C H R H
H ( H O + C H = C H ) 2 2 2 C H 2 = C H R
O CH 3
m / z 1 2 2
m / z 9 1
m / z 7 7
m / z 6 5
烷基侧链上如有γ—H时,可发生McLafferty重排:
O O
+
CH 2 H
CH 2 m / z 9 2
m / z 1 2 2
烷基苯胺中氮原子可有效地使正离子稳定化。
H N C H H N
+ C H 3
C H 3
C H = C H C H CH CH 2 3 2 2
CH C H C H = C H C H 3 2 2 2+ m / z 4 1
由于生成的正离子很稳定,因此在质谱图中 m/z41 是基峰。当烯 烃的碳链增长时,β-键断裂生成一系列通式为CnH2n-1的碎片离子。
5.5.4 Random重排
在烷、烯和一些芳烃中,Random重排是十分常见的。如:
C H = O H 2 m / z 3 1 C H = C H C H O H 2
H
C H = C H C H = O H 2 2 m / z 5 7
2.脂环醇
OH H
H OH
-H2O m/z82 -H
或 m/z82
OH
OH CH3 -C3H7 OH
质谱的原理和图谱的分析

(4)快原子轰击(fast atom bombardment, FAB) • 用高能量的快速Ar原子束轰击样品分子(用液体基质 负载样品并涂敷在靶上,常用基质有甘油、间硝基苄 醇、二乙醇胺等),使之离子化。 • FAB灵敏度高,适用于对热不稳定、极性强的分子, 如肽、蛋白质、金属有机物等。 • 样品分子常以质子化的[M+H]+离子出现 • 基质分子会产生干扰峰。
(3) 场致离(FI)和场解吸 ( FD )
场致离(field ionization, FI) •气态样品分子在在强电场(107-108V/cm)的作用下 发生电离。 •要求样品分子处于气态, 灵敏度不高, 应用逐渐减少.
场解吸 (field desorption, FD )
• 样品不需汽化, 将样品吸附在作为场离子发射体的金属 丝上, 送入离子源, 然后通以微弱电流, 使样品分子从发 射体上解吸下来, 并扩散至高场强的场发射区, 进行离子 化.
于表观质量m*(跨2~3质量单位)处记录下来,其m/z 一般不为整数。 m*=m22/m1 在质谱中,m*可提供前体离子和子离子之间的关系。
离子在离子源的运动时间约106s数量级, 寿命小于 106s的离子在离子源内进一步裂解。离子从离子源到 达检测器的时间约为105s数量级,离子寿命大于105s, 足以到达检测器。寿命在106s到 105s的离子可产生亚 稳离子。
例:化合物的质谱图如下,推导其分子式
164:166=1:1, 164-85 = 79 (Br),
164: 166≈1 : 1, 分子中含有1Br, 不含氮或含偶数氮
m/z: 85 (49) , 86 (3.2), 87 (0.11)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
α
α
CH2 = O
R2 + R1
醇:
+ OH
+ + OH
α
胺:
R1 H N + R2
R1
H N = CH2 + R2 +
α
H CH2 = N +
R2 + R1
② 异裂—正电荷引发裂解—i 裂解
正电荷引发的i断裂反应:是由正电荷引发的碎裂过程,它涉及两个 电子的转移,动力来自于电荷的诱导。
R1
酮:
R2
C
O
+
i
R1
+
+ R2
C
O
氯代物:
+ Cl
i
+ (CH3)2CH + CH2 = C l
酯:
+ O O i + +
O C O
i断裂与α 断裂小结
1、杂原子为单键时,i断裂和α 断裂所引起的断键位置是不同的。杂 原子为重键时,i断裂并不导致重建的断裂。 2、产物的电荷稳定通常比游离基稳定更重要,因此不同的物质断键
R
C O
a
R
C
a
R'
R . + 'R C
O+
2. 烃类化合物的裂解规律 烃类化合物的裂解优先失去大的基团生成稳定的正碳离子
+ CH2 > H2C CH + + + + + CH2 > CR3 >CHR2>CH2R >CH3
m/z = 91, tropylium
H2C CH
+ CH2
m/z = 41
CH3(CH2)nCH3 C6H5CH2(CH2)n CH3
均裂
异裂
① 均裂—自由基引发裂解—α 裂解
自由基引发的ɑ断裂反应:动力来自自由基强烈的电子配对倾向。该 反应由自由基中心提供一个电子与邻接的原子形成一个新键,而邻 接原子的另一个化学键则发生断裂。下面列举几种含 n、π电子化合
物发生ɑ断裂反应的情况:
α
醚:
R1 + O R2
R1
+ O = CH2 + R2
② 四、五、六元环过度氢重排(自由基或正电荷引发的重排反应)
③ 逆Diels-Alder反应 (RDA) (自由基引发的重排反应)
二、有机化合物的一般裂解规律
1. 偶电子规律 OE+ ·→ OE+ ·, OE+ ·→ EE+ EE+ → EE+ , EE+ → OE + ·?
如何识别质谱图中的的OE+· ? 不含氮的化合物, m/z 为偶数的离子是奇电子离子 在质谱图中, 奇电子离子并不多见, 但重要
方式可能不同。
3、奇电子离子无论是发生i断裂和α 断裂,一定产生一个偶电子离子 和一个中性自由基,而偶电子离子不发生α 断裂,发生i断裂时,
占优势的是产生另一个偶电子离子和一个中性分子。
2. 重排裂解
① 麦氏重排(自由基引发的重排反应):具有γ -H的侧链苯、烯烃、
环氧化合物、醛、酮等经过六元环过渡态使 γ -H转移到带有正电荷的原 子上,同时在α 、β 原子间发生裂解,这种重排称为麦克拉夫悌重排裂解。
+ SH(R' ) i i
R' R'
R+ + OR' or R' + R+ + SR' or R' +
+ OR + SR
4.羰基化合物的裂解
O+
R C O R C
.
a
H +.
R . + HC
O+
a
O R' . O+
OH +.
O C R . + 'R O C R. + H
O+ O+
第二章 有机质谱
2.3 有机质谱中的裂解反应
一、有机质谱裂解反应机理 二、有机化合物的一般裂解规律
一、有机质谱裂解反应机理
裂解方式:1. 简单裂解 2. 重排开裂
1. 简单裂解 电荷-自由基定位理论:分子离子中电荷或自由基定位在分子的
某个特定位置上(首先先确定这个特定位置),然后以一个电子或 电子对的转移来“引发”裂解。单电子转移发43或57 是基峰 m/z 91是基峰
3.含杂原子化合物的裂解(羰基化合物除外)
R R R R R
CH 2 CH 2 CH 2 + O + S
+ OH(R' )
+ NHR'
R + R + R +
H2C H2C H2C
+ NHR' + OH(R' ) + SH(R' )
