芳香烃的分类和命名
合集下载
5.芳香烃

H2SO4 (浓) 95℃
CH3
>
NO2
NO2
>
30℃
NO2
+ HO-NO2
58%
+
CH3
38%
反应历程
硝鎓离子的生成: HO
NO2+ +
NO2 +2 H2SO4
H NO2 HSO4-
H3O+ + NO2+ + HSO4NO2 + H2SO4
Step 1:硝鎓离子进攻
Step 2: 失去质子
3.磺化:与浓硫酸在一定温度下发生反应。
该类基团为致钝基团,即含有此类定位基团的芳环在 进行二元取代时,反应的活性降低。(不容易进行反应)
该类基团及活性次序为:
+ N(CH3)3 > NO2 > CN > SO3H >
O CH >
O C OH > CCl3
该类基团特征是含有不饱和键或具有吸电子能力。 卤素取代基,致钝但属于邻对位定位基
5.6.2. 定位规律的解释
OH
SO3H
CHO
COOH
Cl
NH2
OH
NO2
对氯苯酚
对氨基苯磺酸 对羟基苯甲醛 对硝基苯甲酸
5.4 单环芳烃的物理性质
1.苯及其同系物一般是无色液体,不溶于水,可溶于 乙醇、乙醚等有机溶剂中,比重比水轻,一般在 0.86~0.9之间;
2.在苯的同系物中,每增加一个CH2,沸点平均升高
25~30℃,含同数碳原子的各种异构体,其沸点相差
第五章
5.1 5.2 5.3 5.4 5.5 5.6 5.7 5.8 5.9
芳香烃
芳香烃的分类及命名 苯的结构 单环芳烃及其衍生物的命名 单环芳烃的物理性质 单环芳烃的化学性质 苯环的亲电取代定位效应 稠环芳烃 芳香性和休克尔规则 几种重要的单环芳烃
芳香烃总论

第八讲:芳香烃
(四)熔点 在同分异构体中,结构对称的异构体具有较高的熔点。邻、间、对二 甲苯的熔点分别为 -25.5℃、-47.9℃ 和 13.3℃,可用低温结晶的方法
使对二甲苯分离出来。
第八讲:芳香烃
四、苯及同系物的化学性质
总体情况:苯环具有芳香性,它有特殊的稳定性,没有典型的碳碳双 键的性质,不易加成和氧化。同时苯环上的π 电子云暴露在苯环平面的
3=358.8KJ/mol,实际上苯的氢化热是208.4KJ/mol,比预计的数值低 150.4KJ/mol。 1,4-加成产物 说明苯分子具有较低的内能,分子稳定,是一种具有特殊稳定性的物质。
1,2-加成反应进程 1,4-加成反应进程 1,2-加成和 1,4-加成反应进程中的位能曲线图
1,2-加成产物 H
第八讲:芳香烃
由于烷基是供电子基团,已取代后芳环上电子云密度增大,
使得亲电取代反应更容易继续进行,最后甚至可以全部取代。
第八讲:芳香烃
四、苯及同系物的化学性质
※傅—克酰基化反应:在路易斯酸(氯化铝)催化下,芳烃与酰基化 试剂生成芳酮是傅—克酰基化反应。
酰基化试剂:酰卤、酸酐、羧酸
O
+
O C CH3
(二)Diels-Alder反应(合成环状化合物,获诺贝尔化学奖) 二、苯的电子结构
CHO (二)现代苯分子结构的价键理论观点 苯 + CHO 100% 100oC 结论:苯分子中,每个碳原子都采用 sp 杂化方式分别与 1个氢原子、 O O 2个碳原子形成σ键。6个碳原子除了通过 6个σ键连接成环外,每个碳原
1-甲基-4-丙基-2-异丙基苯 4-丙基-2-异丙基甲苯
1-甲基-3-乙基苯 3-乙基甲苯
有机化学第七章芳香烃

C H 2 C H 3 +H B r
7 6 %
注意: A、催化剂: a、路易斯酸 无水AlCl3 、SbCl5 、
FeCl3 、FeBr3 、ZnCl2 etc b、强酸 HCl 、HF、 H2SO4 、H3PO4 c、中性分子 BF3
芳环上的H原子可以被卤素、硝基、磺酸 基、烷基等取代。
1、卤代反响:芳环上的H原子被X原子所取 代的反响叫卤代反响。当有催化剂Fe或卤化铁时, 苯与X2作用生成卤苯。
+ Cl2 + Br2
Fe 或 FeCl3 55~60℃
Fe 或 FeBr3 55~60℃
+ 2Cl2 Fe 或 FeCl3
Cl
+ HCl
H
120°
H
0.1397nm
H
正六边形结构 所有的原子共平面
120°
0.1397nm
C-C 键长均为0.1397nm
H
H
C-H键长均为0.110nm
0.110nmH
所有键角都为120°
上述特征是共轭体系的特征。 所以,凯库勒构造式并未真正反映出苯的真 实构造,它存在缺陷。随着有机化学理论和技 术的开展,对苯的构造提出了许多新的观点, 如共振构造式、分子轨道理论、杂化理论等。 下面介绍杂化理论对苯构造的解释。
〔2〕按照凯库勒构造 式,苯的邻二取代物应有
X
两种异构体,但实际上只
X
X
有一种异构体。
X
〔3〕苯环有单、双键,苯环不是正六边形。
在一般情况下,碳碳双键为0.134nm , 碳 碳单键为0.154nm。即单键、双键的键长不相等。 但根据现代物理方法测定结果说明:
A、所有碳碳键的键长均为0.139nm,即平均化。 B、碳碳键的键角为120°,即SP2杂化。 C、所有C、H原子位于同一平面。
芳香烃的分类和命名

NHCOCH3 HNO3
SO3H
NHCOCH3 NO2
SO3H
4. 傅-克(Friedel-Crafts)反应 1)傅-克烷基化反应
+ CH3CH2Cl
AlCl3 0~5oC
CH2CH3 + HCl
反应机理
CH3CH2Cl + AlCl3
CH3CH2+ + H
+
CH2CH3 + AlCl4-
CH3CH2+ + AlCl4H
H
H
sp2 Csp2 , C-C键和C-H键; p轨道, 键 ;
H
H 电子云分布在平面上下;环闭共轭
H
H
体系;能量降低稳定、键长平均化。
2
E
1
2
3
三个成键轨道叠
加; 电子云均匀
分布。碳碳键长
均等。稳定。
苯的离域能= 2(+2)+4(+)-(6+6)= 2
...... 其它贡献小的极限结构
氢化热 kJ/mol
2)间位定位基( Ⅱ类定位基)
__+NR3 __NO2 __CF3 __CCl3 __CR __COOH __COOR
O
致钝的间位定位基。
__CN
__SO3H
__CHO
• 取代基分类的结构和电子效应
[邻对位定位基]
(1) 含有未共用电子对的原子与芳环成键,形成大键 ;
(2) 含有电子的基团,例如: C C
HO
2-氨基-5-羟基苯甲醛
SO3H
3-硝基-2-氯苯磺酸
苯基:
C6H5- ph-
2. 多环芳烃
5[2]芳香烃
![5[2]芳香烃](https://img.taocdn.com/s3/m/56aa32220722192e4536f6c6.png)
CH3 C H (70%)
CH3
练习: 练习:
+ (CH3)2CHCH2Cl
AlCl3
•醇和烯烃也能作烷基化剂。为什么? 醇和烯烃也能作烷基化剂。为什么? 醇和烯烃也能作烷基化剂
5.Friedel-Crafts酰基化反应 酰基化反应
等作用下,苯与酰卤或酸酐应, 在 AlCl3 等作用下,苯与酰卤或酸酐应, 在苯环上引入酰基: 在苯环上引入酰基:
CH3 CHCH3 H + Cl AlCl3 快 CHCH3 + HCl + AlCl3 CH3
失去质子,生成烷基苯: 第三步 失去质子,生成烷基苯:
H
+ CH3CH2CH2Cl
AlCl3 0°C
CH(CH3)2 (70%)
+ (30%)
(CH2)2CH3
H CH3 C CH2 H (30%)
重排
甲苯
氯苯 联苯
苯系芳烃 芳烃
多环芳烃
稠环芳烃
萘 蒽
非苯芳烃
二、芳烃的异构 当芳环侧链上的C原子为 个以上时 当芳环侧链上的 原子为3个以上时, 原子为 个以上时, 产生构造异构 构造异构。 产生构造异构。
C H 2C H 2C H 3
C H 3C H C H 3
丙苯
异丙苯
当苯环上连有2个以上的取代基时, 当苯环上连有 个以上的取代基时, 个以上的取代基时 则产生位置异构 二取代苯有3个异构体 位置异构。 个异构体。 则产生位置异构。 二取代苯有 个异构体。
不 反 应或 难 反 应
Ar
NH2 + AlCl3
Ar
NH2 AlCl3
• 芳环上酰基化反应的应用: 芳环上酰基化反应的应用: 制备直链烷烃: 制备直链烷烃
芳香烃的命名和结构
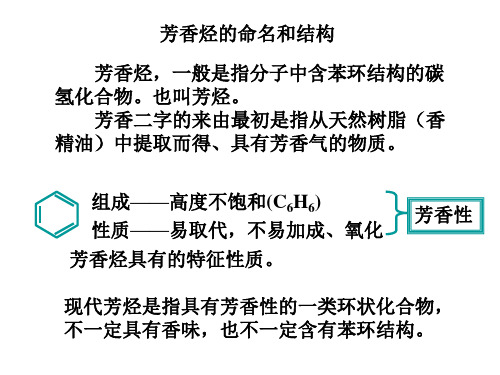
造式。
HH
苯的凯库勒式结构 H
H 简写
HH
苯的二元取代凯库勒式结构
Cl Cl
Cl
2、苯分子的结构
实验测定:平面分子,完全对称 每一个C—C键长:0.140nm 每一个键角:1200
离域使分 闭合离域大键
子内能降
低,使体 系趋于平
-
均化,更 共轭体系
1s
1s
稳定。
C
C
1s C 苯的键 C 1s
C
芳香烃的分类
单环芳烃
–CH3 –CH=CH2
多环芳烃
多苯 代脂
-CH2-
联环
稠环
非苯芳烃
-
环戊二烯 负离子
一、单环芳烃的命名
1 以苯为母体,支 链作取代基,遵循 编号原则。
CH3
CH2CH3
CH(CH3)2
甲苯
乙苯
异丙(基)苯
CH2–CH2–CH3 3 2–CH3 1–CH3
1,2-二甲基-3-丙基苯
C
1s
1s
3、苯的稳定性 从氢化热看
H2
H=_119.5KJ / mol
3H2
H=_208.5KJ/ mol
H苯 理=3x119.5=358.5KJ / mol
H苯 实=208.5KJ / mol
苯环的离域能(共振能) 358.5
-208.5=150.7
kJ·mol-1
凡共轭体系用传统的价键都无 法准确表示。
苯乙烯
CCH
苯乙炔
COOH 苯甲酸
CH3 CH3
–CH2–CH2–CH–CH–CH3 1 2 34 5
最先碰面原则
3,4-二甲基-1-苯基戊烷
芳香烃ppt课件
两种办法:
a.加热,将反应温度控制在100℃以上,使生成的水
沸腾离开反应体系,达到降低产物浓度;
b.使用发烟硫酸,使生成的水与发烟硫酸中的三氧
化硫结合形成硫酸,从而降低产物浓度。
亲电取代反应—傅氏反应
烷基化 酰基化
烷基化:(卤代烷烃、烯烃、醇作为烷基化试剂 )
1)卤代烷 为烷基化 试剂
无水
CH 3C2H C2H ClAl3C lCH 3C2H C + 2H Al4Cl H
酰基化反应 在苯环中引入酰基 只能生成一元取代产物
烷基碳原子数大于2的反应中 要异构化
酰基的结构不变,不重排
烷基化反应可逆
酰基化反应不可逆
相同点:若苯环上连有强吸电子基团时,傅克反应就不会发生
B、加成反应
+ H2 Ni、加压
加热
Cl + Cl2 50 0C Cl
Cl
Cl Cl
Cl
C、氧化反应(重点)
5 6
4 3
7 8
2 1
SO3H
4-硝基-1-萘磺酸
8 7
6 5
SO 3H
1 2
3
4
α-萘磺酸
CH3
5 6
4 3
7 8
2 OH
1
5-甲基-2-萘酚
四 单环芳烃 1)苯的结构
Ph—, Ar—
CH2
苄基
2)单环芳烃的性质 ①休克尔规则 从结构上来说,具有芳香性的物质必须有一个 环闭的共轭体系,共轭体系中的原子在一个平 面上,在这个平面的上下两侧有环状离域的π 电子云,而且组成该π电子云的P电子数必须 合乎4n+2 规则,(n为0,1,2,3…整数)。
CH3
芳香烃—芳香烃的分类、命名(有机化学课件)
苯乙烯
1,2-二苯乙烯
2,3-二甲基-1-苯基-1-己烯
芳烃的命名 2.芳烃的命名
(5)苯环上连接的两个取代烷基不同时,以苯为母体,选取最简单烷基碳原子 作为1位,然后将其它烷基的位次按尽可能小的方向对苯环编号。 例
间甲异丙苯 1-甲基-3-异丙苯
对甲乙苯 1-甲基-4-乙苯
芳烃的命名 3.苯衍生物的命名
芳基 :Ar-
苯基 : C6H5-或 Ph-
苄基:
-CH2- 或BzB-Z-
芳烃的命名 2.芳烃的命名
(1)以苯环为母体,称为某烷基苯。 例
异丙基苯
叔丁基苯
硝基苯
氯苯
芳烃的命名 2.芳烃的命名
(2)当苯环上连有两个或两个以上取代基时,可用阿拉伯数字或邻、间、对等 字样表示。
例
邻二甲苯 1,2-二甲苯
—COOH>—SO3H>—COOR>—CONH2>—CN>—CHO>—COR>—OH>—NH2 >—R>—X>—NO2
芳烃的命名 3.苯衍生物的命名
例
NO2 -CH3
邻硝基甲苯
OH
-NH2 间氨基苯酚
小结
100% 80 % 60 % 40 % 20 %
100%
80 % 60 % 40 % 20 %
首先要选好母体,使母体编号最小。 如何选择母体?
-NO2,-X,-R
苯作母体
例
-NO2
-Cl
-NH2,-OH,-CN,-CHO,-COOH,-SO3H
官能团作母体
例
-NH2
ห้องสมุดไป่ตู้
-SO3H
硝基苯
氯苯
苯胺
苯磺磺酸酸
芳烃的命名 3.苯衍生物的命名
第四章 环烃-芳香烃
CH2Cl2
CHCl3
+2
AlCl3
CH2
CH
二苯甲烷
三苯甲烷
+3
AlCl3
Cl CCl4 + (过量)
AlCl3
C
三苯基氯化甲烷
b. 傅氏酰基化反应
芳烃在无水AlCl3催化下可同酰卤或酸酐反应, 生成芳酮。
+ CH3C O Cl
O O O
AlCl3
AlCl3
C O
CH3 + HCl
CH3 +
CH3 C CH3 C
CH3 CH=CH 2 C CH CH2 CH =CH2 CH3 C CH2 CH3
苯乙烯
苯乙炔
3-苯基丙烯
2-甲基-2苯基丁烷
苯的衍生物: 当苯环上连有-NO2,-X等基团时,则以苯环为母体,叫 做” 某某苯”。
CH2CH2CH3 CH3 正丙苯 甲苯
NO2 硝基苯 氯苯
Cl
当苯环上连有 -COOH , -SO3H , -NH2 , -OH , -CHO , -CH=CH2 或较复杂-R等基团时,基团为母体,则把苯环作为 取代基,叫做”苯某某”。 CH3CH2CHCH2CHCH3
120
0
120 0
H
120 0
H
0.1396 nm
H H
H
苯 的 分 子 模 型
H
H
H
H
H
由于六个碳原子 完全等同,所以大π H 键电子云在六个碳原 子之间均匀分布,即 电子云分布完全平均 化,因此碳-碳键长完 全相等,不存在单双 键之分。由于苯环共 轭大π键的高度离域, 使分子能量大大降低, 因此苯环具有高度的 稳定性。
CHCl3
+2
AlCl3
CH2
CH
二苯甲烷
三苯甲烷
+3
AlCl3
Cl CCl4 + (过量)
AlCl3
C
三苯基氯化甲烷
b. 傅氏酰基化反应
芳烃在无水AlCl3催化下可同酰卤或酸酐反应, 生成芳酮。
+ CH3C O Cl
O O O
AlCl3
AlCl3
C O
CH3 + HCl
CH3 +
CH3 C CH3 C
CH3 CH=CH 2 C CH CH2 CH =CH2 CH3 C CH2 CH3
苯乙烯
苯乙炔
3-苯基丙烯
2-甲基-2苯基丁烷
苯的衍生物: 当苯环上连有-NO2,-X等基团时,则以苯环为母体,叫 做” 某某苯”。
CH2CH2CH3 CH3 正丙苯 甲苯
NO2 硝基苯 氯苯
Cl
当苯环上连有 -COOH , -SO3H , -NH2 , -OH , -CHO , -CH=CH2 或较复杂-R等基团时,基团为母体,则把苯环作为 取代基,叫做”苯某某”。 CH3CH2CHCH2CHCH3
120
0
120 0
H
120 0
H
0.1396 nm
H H
H
苯 的 分 子 模 型
H
H
H
H
H
由于六个碳原子 完全等同,所以大π H 键电子云在六个碳原 子之间均匀分布,即 电子云分布完全平均 化,因此碳-碳键长完 全相等,不存在单双 键之分。由于苯环共 轭大π键的高度离域, 使分子能量大大降低, 因此苯环具有高度的 稳定性。
芳香烃
近代物理方法测定苯结构
(1)共平面性: 6个碳组成一个平面正六边形,6个氢与6个碳都在 同一个平面上
0.139nm
(2)所有键角都是120° (3)碳-碳键长为0.139nm
120°
H
H
苯的邻位二元取代物
Br C H H C C C H C C Br H
H H C C C Br C C C Br H
O + 4CO2 + 4H2O
O 顺丁烯二酸酐
五、苯环亲电取代反应定位规律
1.定位规律:
取代基的定位效应:一元取代苯进行芳香亲电取代时, 已有基团对后进入基团进入苯环的位臵产生制约作用
(1)定位基
定位基:原有的取代基
苯环上新导入取代基位臵主要与原有取代基性质有关
定位作用:原有取代基的作用 以致决定着新的取代基进入苯环的位臵
环戊二烯负离子
分子中不含有苯环,具有类似苯环结构和性质的烃
3. 芳烃命名
(1)一取代苯
• 烃基的碳链较长或烃链上含有多个苯环时 一般把苯作取代基,烃作母体
CH3 CH3 CH3CH2CH2-CH—CH-CH2
C H
三苯甲烷
2,3-二甲基-1-苯基己烷
② 苯与烯、炔相连时 习惯上把苯作取代基,不饱和烃作母体
-CH=CH2 苯乙烯(或乙烯苯) -C≡CH 苯乙炔
(2).苯环上有多个取代基
① 苯环有两个取代基,用邻、间、对命名
CH3
CH3 CH3
CH3
CH3
CH3
邻-二甲苯 O-(Ortho)
间-二甲苯 M-(Meta)
对-二甲苯
(P-dimethylbenzene)
(O-dimethylbenzene) (M-dimethylbenzene)
