一次性使用桡动脉压迫止血器产品技术要求hengyi
桡动脉压迫止血器产品技术要求dimake
桡动脉压迫止血器
适用范围:经皮介入手术后,对患者的桡动脉穿刺部位进行临时性压迫止血。
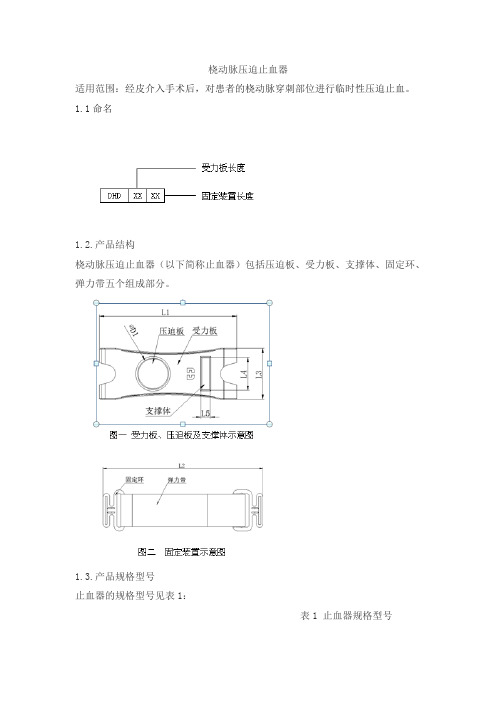
1.1命名
1.2.产品结构
桡动脉压迫止血器(以下简称止血器)包括压迫板、受力板、支撑体、固定环、弹力带五个组成部分。
1.3.产品规格型号
止血器的规格型号见表1:
表1 止血器规格型号
2.1外观
各组件应清洁、无杂质、无加工缺陷和表面缺陷。
2.2 各组件尺寸及允差
表2 各组件尺寸及允差
2.3 连接强度
弹力带的粘合力应能承受水平方向15N的静态拉力,持续15s,不得出现断裂或脱落现象。
2.4 环氧乙烷残留量
止血器经环氧乙烷灭菌,环氧乙烷残留量应≤10μg /g。
2.5 生物学性能
止血器经环氧乙烷灭菌后,应无菌。
桡动脉压迫止血带产品技术要求龙脉

桡动脉压迫止血带组成:产品包括止血带和充气装置两个部件,止血带主要由主体、压迫气囊、魔术贴、气管、检验气囊、衬板和气阀组成。
充气装置主要由充气推杆、充气筒、胶塞、充气针、针帽组成。
适用范围:桡动脉压迫止血带是用于桡动脉穿刺介入手术后,对穿刺介入部位进行临时压迫止血的辅助性装置。
1.1命名1.2 规格型号DP-RT-011.3 结构组成产品包括止血带和充气装置两个部件,如下图所示1.4制作材料桡动脉压迫止血带制作材料见下表:2.1 物理性能2.1.1 外观:(1)各组件应清洁光滑、色泽均匀、无明显异物;(2)各组件应无明显波纹、凝胶、麻点,不得有大面积缺损、堵塞等加工缺陷;(3)止血带应具有良好的透明度,能够看到标记点及内表面;(4)充气装置标尺的分度容量线及计量数字印刷应完整,字迹清楚,充气装置的外套应有透明度,能看到基准线。
推杆推、拉应顺畅。
2.1.2 尺寸和规格:尺寸和规格应符合下表要求2.1.3 撕脱力:解开腕带魔术贴时所需的撕脱力≤20N,且魔术贴与主体不分离。
2.1.4 松脱力:腕带魔术贴贴合时所需的松脱力≥35N,且魔术贴与主体不分离。
2.1.5 气管及连接处性能:气管本身、气管与气囊连接处不得有漏气裂缝,充气后不得从气管及连接处迅速漏气。
2.1.6 气路通透性:充气装置能够插入气阀,可充气。
2.1.7 气密性:充气20mL,8小时后剩余气体不少于12mL。
2.1.8 气阀与检验气囊连接强度:气阀与检验气囊连接强度≥15N。
2.1.9 充气装置性能:抽拉顺畅能够实现充气功能。
2.2 化学性能(仅适用于止血带压迫气囊部位)2.2.1重金属含量:浸取液与同批空白対照液对照,铅、锌、锡、铁的总含量应≤5ug/mL,镉含量应≤0.1ug/mL。
2.2.2 酸碱度:浸提液的pH值与同批空白对照液对照,pH值之差应不大于1.5。
2.2.3易氧化物:易氧化物浸取液与等体积的同批空白对照液相比,0.002mol/L 的高锰酸钾溶液消耗量之差应≤2.0mL。
桡动脉止血器在介入术后的应用

桡动脉止血器在介入术后的应用梁嫦珠;何丽琴【期刊名称】《当代护士(学术版)》【年(卷),期】2006(000)005【摘要】随着当前心脏介入检查和治疗的普及,常规采取弹性绷带压迫穿刺部位已为人们所熟悉。
随着医疗器械产品不断更新、完善,自2005年以来我科采取一种专用于经桡动脉穿刺的冠脉造影和介入治疗后的一种桡动脉止血器,效果满意。
1产品介绍桡动脉止血器是由TE R LU M O TR公司生产的,命名为TRB and的桡动脉穿刺点压迫止血器,是由特殊的高分子材料制作而成,手感舒适、柔软。
外观透明清亮,长为22cm,宽为4cm,内固定一方形3cm×3cm的密封塑料小气袋,小气袋连1小导管,感应气囊通过小导管附带在塑料小气袋;外固定1个5cm×4cm质料稍硬微弯护手环(起防止血器移位的作用);桡动脉止血器两远端内外面紧连能互扣的尼龙褡扣。
另配1仅带针栓专用的20m l注射器。
2使用方法操作者把鞘管拔除后,迅速用塑料小气袋直接贴在穿刺部位,环绕扣好,即用专用注射器通过感应气囊注入约6~15m l的气体,感应气囊有足够饱胀感,询问病人的舒适度,观察5~10m in,力度能触到桡动脉搏动又能达到止血目的,局部皮温、颜色正常为宜。
以后每30m in 加强观察局部和全身情况1次。
当压迫6~8h后,可用专用注射器先抽出2~5m l 气体,床边观察3~5...【总页数】1页(P38-38)【作者】梁嫦珠;何丽琴【作者单位】广东省暨南大学医学院第三附属医院,广东,珠海,519000;广东省暨南大学医学院第三附属医院,广东,珠海,519000【正文语种】中文【中图分类】R473.5【相关文献】1.常规加压法和桡动脉止血器法在经桡动脉径路介入术后止血中的疗效观察 [J], 方玉强;杨成明;王旭开;曾春雨;王红勇;陈乔2.经桡动脉路径心脏介入术后缩短止血器压迫时间对病人桡动脉并发症的影响 [J], 张倩;郑雪梅;周芳;张文;于涛;3.经桡动脉路径心脏介入术后缩短止血器压迫时间对病人桡动脉并发症的影响 [J], 张倩;郑雪梅;周芳;张文;于涛4.改良螺旋式桡动脉止血器在经桡动脉行冠状动脉介入术后护理中的应用 [J], 赵文欣;程艳娜;刘继军;丁小勇5.旋压式桡动脉止血器在经桡动脉径路冠脉介入术后压迫止血效果分析 [J], 张明亮;于海波;张立敏;李志;李大鹏;王环宇因版权原因,仅展示原文概要,查看原文内容请购买。
TR Band桡动脉压迫器压迫止血的临床应用和护理

TR Band桡动脉压迫器压迫止血的临床应用和护理
赵晓清;刘峻兰
【期刊名称】《中国社区医师(医学专业)》
【年(卷),期】2010(012)003
【摘要】目的:探讨TR Band桡动脉压迫器压迫止血的临床应用及护理.方法:回顾性总结经桡动脉途径行冠状动脉介入治疗60例患者术后用TR Band桡动脉压迫器进行压迫止血的护理经验.结果:60例患者均止血成功,2例出现穿刺局部皮下血肿,4例出现手部肿胀,3例前臂以下瘀斑,余无其他并发症的发生.结论:TRBand桡动脉压迫器用于桡动脉介入治疗术后止血具有安全、操作简便、调节性强、止血效果好、并发症少等特点.
【总页数】1页(P141)
【作者】赵晓清;刘峻兰
【作者单位】337000,江西萍乡市人民医院心血管内科;337000,江西萍乡市人民医院心血管内科
【正文语种】中文
【相关文献】
1.经桡动脉行冠状动脉介入术后应用TR Band止血器压迫止血的护理 [J], 田芳;孙红梅;陈海君;陈璨
2.TR-Band止血器在经桡动脉径路冠状动脉介入术后局部压迫止血中的应用 [J], 高萍;瞿惠娟;李林;牛娟;宋瑰琦
3.经桡动脉行PCI后应用TR Band止血气囊压迫止血时间观察和护理 [J], 王肖群
4.TR Band和YM-RAO-1229压迫止血器在经桡动脉介入术后的止血效果比较[J], 龚东;马英东;李凌;韩春丽;吴关玲;陈剑
5.TR Band桡动脉压迫器压迫止血的临床应用和护理 [J], 赵晓清;刘峻兰
因版权原因,仅展示原文概要,查看原文内容请购买。
一次性使用动脉压迫止血器产品注册技术审查指导原则

一次性使用动脉压迫止血器产品注册技术审察指导原则(征采建议稿)一、序言本指导原则旨在给出一次性使用动脉压迫止血器(以下简称“动脉压迫止血器”)产品注册系统的、拥有指导意义的指南性文件,一方面有益于审评人员对动脉压迫止血器上市前的安全性和有效性进行正确、高效的评论,另一方面有利于指导公司规范产品的研究开发和生产管理。
本指导原则系对动脉压迫止血器产品的一般要求,申请人 / 生产公司应依照详细产品的特征对注册申报资料的内容进行充分和细化。
申请人 / 生产公司还应依照详细产品的特征确立此中的详细内容能否合用,若不合用,需详尽论述其原由及相应的科学依照。
本指导原则是对申请人/ 生产公司和审评人员的指导性文件,但不包含注册审批所波及的行政事项,亦不作为法例强迫履行,假若有能够知足有关法例要求的其余方法,也可以采纳,可是需要供给详尽的研究资料和考证资料,还应遵循有关法例。
本指导原则是在现行法例和标准系统,以及目前认知水平下拟订的,跟着法例和标准的不停完美,以及科学技术的不停发展,本指导原则有关内容也将进行合时的调整。
二、合用范围本指导原则合用于医疗器材分类目录 (2002-08-28) 本产品属于分类编号 6854“手术室、抢救室、诊断室设施及用具”中“手术及抢救装置”的“各样气压、电动气压止血带”以及按《医疗器材分类规则》(国家食品药品监察管理总局令第 15 号)及附件(2015-07-14 )本产品属于“接触人体器材”中“无源医疗器材”中的“其余无源器械”,使用状态为“短期使用”中的“创伤”接触,管理类型为Ⅱ类的动脉压迫止血器。
本指导原则不合用于电动气压止血器产品。
三、技术审察重点(一)产品名称要求产品的名称依据产品的作用部位、作用成效进行命名,且该类产品为一次性使用、无菌形式供给,所以名称一般为:一次性使用动脉压迫止血器、一次性使用股动脉压迫止血器、一次性使用桡动脉压迫止血器等。
(二)产品的构造和构成本指导原则中所述动脉压迫止血器产品分为气囊式和非气囊式两种。
改良绷带加压法在桡动脉介入中压迫止血的应用

改良绷带加压法在桡动脉介入中压迫止血的应用胡荣红;叶佩军【摘要】目的探讨改良绷带加压法在桡动脉介入中压迫止血的应用价值.方法选择2012年1月-2013年5月在某三级医院经桡动脉行冠脉介入诊疗的患者191例.随机分为两组,改良绷带组108例,专用止血器组83例.比较两组患者桡动脉介入术后加压包扎的并发症及舒适度情况.结果改良绷带加压组与专用止血器组患者的性别、年龄、高血压、糖尿病、桡动脉穿刺史及经皮冠脉介入治疗(PCI)例数比较,差异无统计学意义(P>0.05).与专用止血器组患者比较,改良绷带组患者穿刺处出血、周围青紫及皮肤破损移位发生率无统计学差异(P>0.05);但在手肿胀、麻木、压迫处疼痛改良绷带组患者发生率低于专用止血器组患者(P <0.05),同时改良绷带组患者舒适度良好的百分比高于专用止血器组患者(P <0.05).结论改良绷带加压法相对于专用止血器法具有并发症更少、舒适度好且价格便宜等优点,值得临床推广.【期刊名称】《安徽医药》【年(卷),期】2014(018)003【总页数】3页(P536-538)【关键词】绷带;桡动脉介入;止血器;并发症【作者】胡荣红;叶佩军【作者单位】安徽省池州市人民医院介入导管室,安徽,池州,247000;安徽省池州市人民医院介入导管室,安徽,池州,247000【正文语种】中文1.1 临床资料选择2012年1月—2013年5月在我院经桡动脉行冠脉介入诊断和治疗的患者191例,其中男121例,女70例。
年龄39~78岁,平均(64.3±10.7)岁。
随机将患者分为两组:改良绷带组108例,经桡动脉行冠脉造影术的60例,冠脉介入48例;专用止血器组83例,经桡动脉冠脉造影46例,冠脉介入37例。
两组患者手术操作均采用桡动脉径路,由同一组医师完成。
改良绷带组与专用止血器组患者的性别、年龄、高血压、糖尿病、桡动脉穿刺史及经皮冠脉介入治疗(PCI)例数比较,差异无统计学意义(P>0.05,见表1)。
17一次性使用动脉压迫止血器产品注册技术审查指导原则(征求意见稿)
17一次性使用动脉压迫止血器产品注册技术审查指导原则(征求意见稿)-标准化文件发布号:(9456-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII一次性使用动脉压迫止血器产品注册技术审查指导原则(征求意见稿)一、前言本指导原则旨在给出一次性使用动脉压迫止血器(以下简称“动脉压迫止血器”)产品注册系统的、具有指导意义的指南性文件,一方面有利于审评人员对动脉压迫止血器上市前的安全性和有效性进行准确、高效的评价,另一方面有利于指导企业规范产品的研究开发和生产管理。
本指导原则系对动脉压迫止血器产品的一般要求,申请人/生产企业应依据具体产品的特性对注册申报资料的内容进行充实和细化。
申请人/生产企业还应依据具体产品的特性确定其中的具体内容是否适用,若不适用,需详细阐述其理由及相应的科学依据。
本指导原则是对申请人/生产企业和审评人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其它方法,也可以采用,但是需要提供详细的研究资料和验证资料,还应遵循相关法规。
本指导原则是在现行法规和标准体系,以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
二、适用范围本指导原则适用于医疗器械分类目录 (2002-08-28)本产品属于分类编号6854“手术室、急救室、诊疗室设备及器具”中“手术及急救装置”的“各种气压、电动气压止血带”以及按《医疗器械分类规则》(国家食品药品监督管理总局令第15号)及附件(2015-07-14)本产品属于“接触人体器械”中“无源医疗器械”中的“其它无源器械”,使用状态为“短期使用”中的“创伤”接触,管理类别为Ⅱ类的动脉压迫止血器。
本指导原则不适用于电动气压止血器产品。
三、技术审查要点(一)产品名称要求产品的名称根据产品的作用部位、作用效果进行命名,且该类产品为一次性使用、无菌形式提供,所以名称一般为:一次性使用动脉压迫止血器、一次性使用股动脉压迫止血器、一次性使用桡动脉压迫止血器等。
一次性使用桡动脉止血器产品技术要求tongjihengyuan
一次性使用桡动脉止血器适用范围:经皮介入手术后,对患者的桡动脉穿刺部位进行压迫止血。
1.1 组成止血器由旋杆、中心杆、滚珠、支撑板、压脚和绑带组成,其结构如图1所示:1. 旋杆2.中心杆3.滚珠4.支撑板5.绑带6.压脚图1桡动脉止血器结构图1.2 材料止血器材料采用高分子材料,具体见下表1:表 11.3 规格及尺寸规格:CR型(成人型),关键尺寸见表2表2 关键结构尺寸单位:mm2.1 物理要求2.1.1 外观止血器表面应清洁无杂质,无加工缺陷和表面缺陷。
2.1.2 绑带粘扣剥离强度按附录A.3.1试验时,剥离强度应大于12N。
2.1.3 绑带粘扣剪切强度按附录A.3.2试验时,剪切强度应大于100N。
2.1.4 旋杆旋转进程及范围产品加工成型后,中心杆进程应为(1.3±0.2)㎜/周,旋动最大距离应为23.5±2㎜。
注:旋动最大距离应为中心杆从旋杆脱离时的距离。
2.1.5 连接强度支撑板与绑带之间的连接处应能承受15N的静态轴向拉力,持续15s不脱开。
2.2 化学要求2.2.1 引言本产品临床使用过程中,不与人体皮肤直接接触。
但为保证产品使用的安全性,只对压脚作化学要求。
2.2.2 还原物质检验液与空白液所消耗的高锰酸钾(0.002mol/L)的体积之差不超过2.0mL。
2.2.3 酸碱度检验液与同批空白液对照,pH值之差不得超过1.5。
2.2.4 蒸发残渣50mL检验液中,不挥发物总重量不得超过2mg。
2.2.5 环氧乙烷残留量环氧乙烷灭菌处理后,环氧乙烷残留量不大于10µg/g。
2.3 无菌经环氧乙烷灭菌后,应无菌。
桡动脉压迫止血器产品技术要求tiandihexie
桡动脉压迫止血器适用范围:适用于经皮介入术后,桡动脉穿刺处的压迫止血。
1.1 组成桡动脉压迫止血器由旋杆、中心杆、椭圆压脚、支撑板和绑带组成,其结构如图1所示:1.旋杆2.中心杆3..椭圆压脚4.支撑板5.绑带图1桡动脉压迫止血器结构图1.2 材料桡动脉压迫止血器材料采用高分子材料,具体见下表1:表 11.3 尺寸表2 关键结构尺寸单位:mm2.1 外观桡动脉压迫止血器表面应清洁无杂质,无加工缺陷和表面缺陷。
2.2 绑带粘扣剥离强度按附录A.3.1试验时,剥离强度应大于12N。
2.3 绑带粘扣剪切强度按附录A.3.2试验时,剪切强度应大于100N。
2.4 旋杆旋转进程及范围产品加工成型后,旋杆进程应为3㎜±0.3㎜/周,旋动最大距离应为21.5㎜±2㎜。
2.5 连接强度支撑板与绑带之间的连接处应能承受15N的静态轴向拉力,持续15s不脱开。
2.6 尺寸桡动脉压迫止血器尺寸应符合表2的规定,椭圆压脚的长轴和短轴尺寸公差应在±1mm以内,旋杆的螺距的尺寸公差应在±0.3mm以内,旋杆有效螺纹长度和支撑板螺纹深度尺寸公差应在±1mm以内。
2.7化学要求2.7.1 引言本产品临床使用过程中,不与人体皮肤直接接触。
但为保证产品使用的安全性,只对椭圆压脚作化学要求。
2.7.2 还原物质检验液与空白液所消耗的高锰酸钾(0.002mol/L)的体积之差不超过2.0mL。
2.7.3 酸碱度检验液与同批空白液对照,pH值之差不得超过1.5。
2.7.4 蒸发残渣50mL检验液中,不挥发物总重量不得超过2mg。
2.8 环氧乙烷残留量环氧乙烷灭菌处理后,环氧乙烷残留量不大于10µg/g。
2.9 无菌经环氧乙烷灭菌后,应无菌。
桡动脉压迫止血器压迫止血的临床应用及护理
桡动脉压迫止血器压迫止血的临床应用及护理【摘要】目的探讨tr band桡动脉压迫器压迫止血的临床应用及护理。
方法总结经桡动脉途径行冠状动脉介入治疗120例患者术后应用tr band桡动脉压迫器进行压迫止血的护理经验。
结果 3例出现穿刺局部皮下血肿,4例患者有少量渗血及时加压处理无继续出血发生,1例周围皮肤出现水泡,2例前臂以下有瘀斑,120例患者均止血成功,无严重心脏事件、桡动脉闭塞、手部缺血及桡动脉搏动消失等并发症的发生。
结论 tr band桡动脉压迫器用于桡动脉介入治疗术后止血具有安全、操作简便、可调节性强、止血效果好、并发症少等特点。
【关键词】桡动脉;压迫止血器;护理文章编号:1004-7484(2013)-10-5851-01近年来经桡动脉行冠心病介入诊疗已被广泛应用于临床,它具有损伤小、恢复快、住院时间短、周围血管并发症少等优点[1]术后无需卧床、可立即止血压迫且迷走反射少、局部出血少.早期采用绷带加压包扎及弹力绷带包扎对桡动脉穿刺点进行止血,病人易出现局部出血、皮下血肿、包扎远端指端发绀肿胀麻木等并发症,发生率高且不易发现[2]2010年1-10月我科120例患者经桡动脉行冠脉介入诊疗术后应用动脉压迫止血器(由日本泰尔茂公司生产提供tr-band压迫止血器)止血,临床效果满意,现报告如下。
1 资料与方法1.1 一般资料 2010年1月——2010年10月收治经桡动脉穿刺行冠状动脉介入治疗患者120例,男87例,女33例平均年龄56岁,行冠脉支架术37例,冠状动脉造影显示正常22例,所有患者术前检查凝血止血功能均正常、桡动脉搏动良好,allen试验阳性。
术后均使用桡动脉压迫止血器(tr band)止血。
1.2 方法术毕退出动脉鞘管2-3cm,立即采用桡动脉压迫器(tr band)使位于压缩球囊中心的绿色标记对准穿刺点,用可调节型的粘扣将带子固定在手腕上,用配套的注射器,通过附带导管注入空气使气囊膨胀,(标准空气容积13ml,最大容积18ml)再退出全部鞘管观察是否出血,如有出血,再注入少许气体止血,注气一般不超过18ml,同时询问患者舒适度,无特殊不适即可。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一次性使用桡动脉压迫止血器
适用范围:该产品适用于经股、桡动脉介入手术后,动脉穿刺点闭合止血时使用。
1.1 产品型号划分的说明
1.2 型号规格见表1
表1 规格型号
1.4 产品组成材料
一次性使用桡动脉压迫止血器所采用材料是的硅胶、聚丙烯、聚氨酯、聚碳酸酯、聚氯乙烯医用高分子材料。
具体如下表:
表2 产品组成组件材料列表
2.1 物理要求
2.1.1 外观
2.1.1.1压迫止血器各部件外观应整洁、光滑、色泽均匀。
不得有严重划痕、毛刺、锋棱、裂纹等缺陷。
2.1.1.2腕带表面应不得有破损、污迹。
2.1.2 各部件尺寸见表3
表3 尺寸
2.1.3压迫止血器与充气装置配合
充气装置与压迫止血器的充气管路配合时,插拔顺畅、配合紧密。
2.1.4 密封性
压迫止血器的压迫球囊、充气管路(含单向充气阀),以及压迫球囊与充气管路之间无漏气现象。
2.1.5 连接强度
压迫球囊与腕带,充气管路与压迫球囊,充气管路的气管与单向阀之间的连接处应能承受20N的静态轴向拉力,持续15s不得断裂和脱落。
2.1.6 压迫球囊最大承压力
压迫球囊最大承压力在1ATM情况下,应无破裂。
2.1.7 压迫球囊充气量与压强
压迫球囊充气量25mL时,气囊膨胀时产生的压强应大于0.3ATM,且不超过1ATM。
2.1.8 耐久性
向压迫止血器中注入20mL气体,经过12小时后,压迫止血器应无泄漏现象。
2.1.9充气装置性能
2.1.9.1 外观
2.1.9.1.1在300 lx-700 lx的照度下,充气装置的外观清洁、无微粒和异物。
2.1.9.1.2充气装置不得有毛边、毛刺、塑流、缺损等缺陷。
2.1.9.1.3充气装置外套应有足够的透明度,能清晰地看到基准线。
2.1.9.1.4充气装置内表面(包括橡胶活塞),不得有明显可见的润滑剂汇聚的要求。
2.1.9.2 标尺
2.1.9.2.1充气装置的标尺有一个或一个以上的标尺,标尺应符合表4的规定。
表4 公称容量及对应要求
2.1.9.2.2充气装置允许在公称容量标尺外延长附加标尺,其延长的附加标尺与公称容量标尺应加以区别,其区别方法如:
a)把公称容量的计量数字用圆圈圈起来;
b)附加标尺的计量数字用更小的计量数字来表示;
c)附加标尺的分度容量线用更短的刻度线表示;
d)附加标尺长度的垂直线用虚线表示。
2.1.9.3 标尺的刻度容量线
2.1.9.
3.1标尺应按表4规定的分度值表明刻度容量线。
2.1.9.
3.2标尺零位线的印刷位置应与外套封底的内边缘线相切,当推杆完全推入充气装置外套封底端时零位线应与活塞上的基准线重合,其误差必须在最小分度间隔的四分之一范围以内。
2.1.9.
3.3刻度容量线应在零位线至总容量刻度容量线之间,沿充气外套长轴均匀分隔。
2.1.9.
3.4当充气装置保持垂直位置时,所有等长的刻度容量线的一端应在垂直方向上相互对齐。
2.1.9.
3.5次刻度容量线长度约为主刻度容量线的二分之一。
2.1.9.4 标尺的印刷
2.1.9.4.1标尺应印在外套卷边短轴的任意一侧。
2.1.9.4.2标尺的分度容量线及计量数字印刷应完整,字迹清楚,线条清晰,粗细均匀。
2.1.9.5 充气装置外套
2.1.9.5.1充气装置外套的最大可用容量的长度至少比公称容量长度长10%。
2.1.9.5.2充气装置外套开口处应有卷边,以确保充气装置任意放置在与水平成10°夹角的平面上时不得转过180°。
2.1.9.6 活塞
2.1.9.6.1活塞应无胶丝、胶屑、外来杂质、喷霜。
2.1.9.6.2活塞与充气装置外套的配合,当充气装置注入水后,保持垂直时,推杆不得因其自身重量而移动。
2.1.9.7 器身密合性
2.1.9.7.1将充气装置外套吸入公称容量的水,用表4规定的轴向压力及侧向力,对推杆作用30s,充气装置外套与活塞接触的部位不得有漏液现象。
2.1.9.7.2在88kPa负压作用下保持60s±5s,充气装置外套与活塞接触部位不得产生漏气现象,且活塞与推杆不得脱离。
2.1.9.8 容量允差
小于二分之一公称容量和大于(含等于)二分之一公称容量的最大允差应符合表4中的有关规定。
2.2 化学要求
2.2.1 还原物质
按GB/T 14233.1-2008中5.2.2方法检验时,检验液与空白液所消耗的
)=0.002mol/L]的体积之差不超过2.0mL。
高锰酸钾溶液[c(KMnO
4
2.2.2 重金属
按GB/T 14233.1-2008中5.9.1方法检验时,符合下列要求:检验液中钡、铬、铜、铅、锡的总含量应不超过1µg/mL;镉的含量应不超过0.1µg/mL。
2.2.3 酸碱度
按GB/T 14233.1-2008中5.4.1检验时,检验液与同批空白液作对照,pH值之差不得超过1.0。
2.2.4 蒸发残渣
按GB/T 14233.1-2008中5.5方法检验时,检验液中蒸发残渣的量不得超过5.0mg/50mL。
2.2.5 紫外吸光度
按GB/T 14233.1-2008中5.7方法检验时,检验液在250-320nm范围内的紫外吸光度应不大于0.3。
2.2.6 环氧乙烷残留量
按GB/T 14233.1-2008规定方法进行检验时,每套产品上的环氧乙烷灭菌残留量应不大于10µg/g。
2.3 生物要求
2.3.1 无菌
一次性使用桡动脉压迫止血器经环氧乙烷灭菌方法处理后,应无菌。
2.3.2 细菌内毒素
细菌内毒素限量应小于20EU/套。
