融合蛋白标签
FLAG标签融合蛋白纯化试剂盒使用说明书
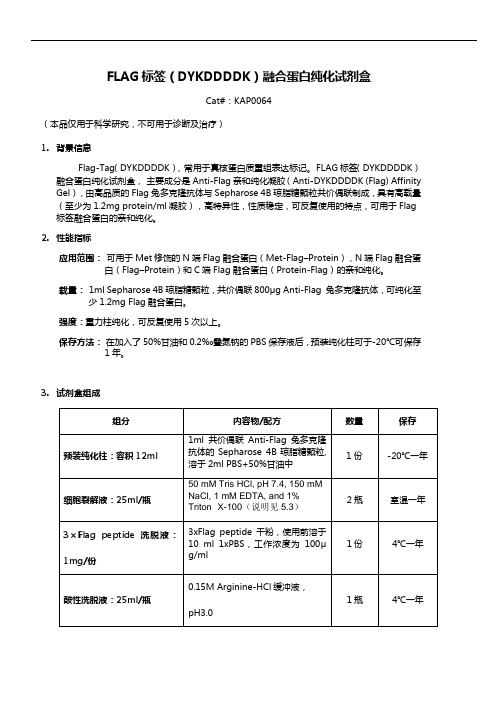
FLAG标签(DYKDDDDK)融合蛋白纯化试剂盒Cat#:KAP0064(本品仅用于科学研究,不可用于诊断及治疗)1.背景信息Flag-Tag(DYKDDDDK),常用于真核蛋白质重组表达标记。
FLAG标签(DYKDDDDK)融合蛋白纯化试剂盒,主要成分是Anti-Flag亲和纯化凝胶(Anti-DYKDDDDK (Flag) Affinity Gel),由高品质的Flag兔多克隆抗体与Sepharose 4B琼脂糖颗粒共价偶联制成,具有高载量(至少为1.2mg protein/ml凝胶),高特异性,性质稳定,可反复使用的特点,可用于Flag 标签融合蛋白的亲和纯化。
2.性能指标应用范围:可用于Met修饰的N端Flag融合蛋白(Met-Flag–Protein),N端Flag融合蛋白(Flag–Protein)和C端Flag融合蛋白(Protein-Flag)的亲和纯化。
载量:1ml Sepharose 4B琼脂糖颗粒,共价偶联800μg Anti-Flag 兔多克隆抗体,可纯化至少1.2mg Flag融合蛋白。
强度:重力柱纯化,可反复使用5次以上。
保存方法:在加入了50%甘油和0.2‰叠氮钠的PBS保存液后,预装纯化柱可于-20℃可保存1年。
3.试剂盒组成50 mM Tris HCl, pH 7.4, 150 mMNaCl, 1 mM EDTA, and 1%Triton X-100(说明见5.3)4.使用方法4.1细胞裂解液制备4.1.1悬浮细胞和半贴壁细胞从细胞培养瓶上吹下来后放入离心管中,1000rpm离心5分钟。
贴壁细胞用细胞刮子轻轻从瓶壁上刮下来,放入离心管中1000rpm离心5分钟。
4.1.2预冷的PBS工作液重悬细胞,1000rpm离心3min,弃上清。
重复一次。
4.1.3根据细胞的量加入相应体积的细胞裂解液,反复吹打后冰上放置10-20min,让细胞充分裂解。
4.1.4用超声破碎仪将细胞裂解液超声,直至细胞裂解液透明,不再粘稠。
关于标签抗体的详细攻略

关于标签抗体你知道多少在生物技术中,人们常利用DNA重组技术构建包含目的基因以及表位标记的融合蛋白,即标签融合蛋白,再利用能特异性识别该标签的抗体对其进行鉴定与纯化。
整个反应的原理是基于抗原-抗体反应,标签抗体可以高度特异地结合对应的标签融合蛋白。
融合标签分类●大的蛋白质分子:GST(谷胱甘肽巯基转移酶)、SPA(葡萄球菌蛋白A)、GFP(绿色荧光蛋白)等。
使用时会增加目标蛋白的溶解性,但在蛋白结晶和抗体生产的过程中,标签必须去除。
●小的多肽标签:6×His(六聚组氨酸)、HA(流感病毒血凝素表位)、c-myc(人c-myc蛋白表位)、Flag(专为蛋白纯化和检测设计的八肽)等。
多数情况下由于多肽标签相对较小,对融合蛋白质结构影响小,不需要从融合蛋白质中切除,因而多肽标签较蛋白质标签更为常用。
常用的标签Flag标签-抗Flag标签抗体Flag标签是由八个亲水氨基酸构成的一段寡肽,序列为Asp-Tyr-Lys-Asp-Asp-Asp-Asp-Lys,可用于蛋白纯化及检测。
Flag标签可位于蛋白质的C端或N端,该系统已广泛应用于各种细胞类型,包括细菌、酵母和哺乳动物细胞等,相应的Flag标签抗体也被广泛应用。
由于Flag标签系统的纯化条件是非变性的,因此可以纯化所有有活性的融合蛋白。
Flag标签可以通过加入肠激酶处理去除,肠激酶专一识别该肽序列C末端的5个氨基酸残基。
Flag抗体可以用于检测和Flag标签融合表达蛋白的表达、细胞内定位,以及纯化、定性或定量检测Flag融合表达蛋白等。
His标签-抗His标签抗体His-tag由人工合成的组氨酸首尾相连构成,通常由6个氨基酸(HHHHHH)组成,也有3个和8个的情况。
另外,也存在一种由19个组氨酸构成的天然多聚组氨酸标签(HAT-tag)。
His融合标签与其他标签相比有很多明显优势,是目前用于纯化的融合标签中使用最为广泛的一种。
利用His标签可以建立一个基于融合蛋白的高效检测和纯化系统。
基因克隆载体上的各种常用蛋白标签
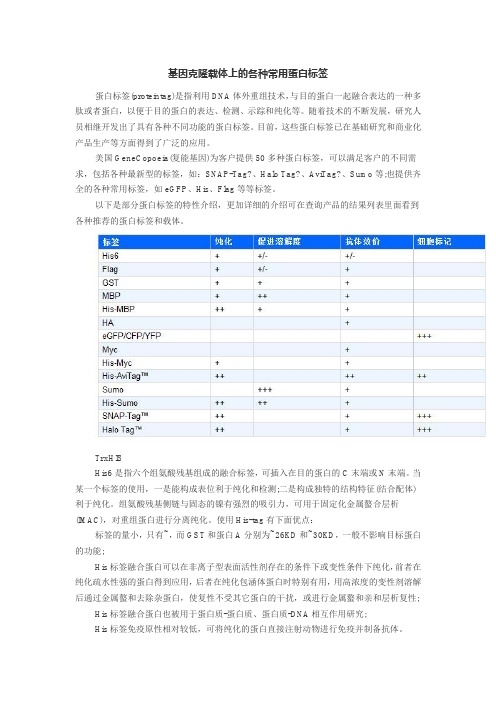
基因克隆载体上的各种常用蛋白标签蛋白标签(proteintag)是指利用DNA体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和纯化等。
随着技术的不断发展,研究人员相继开发出了具有各种不同功能的蛋白标签。
目前,这些蛋白标签已在基础研究和商业化产品生产等方面得到了广泛的应用。
美国GeneCopoeia(复能基因)为客户提供50多种蛋白标签,可以满足客户的不同需求,包括各种最新型的标签,如:SNAP-Tag?、Halo Tag?、AviTag?、Sumo等;也提供齐全的各种常用标签,如eGFP、His、Flag等等标签。
以下是部分蛋白标签的特性介绍,更加详细的介绍可在查询产品的结果列表里面看到各种推荐的蛋白标签和载体。
TrxHISHis6是指六个组氨酸残基组成的融合标签,可插入在目的蛋白的C末端或N末端。
当某一个标签的使用,一是能构成表位利于纯化和检测;二是构成独特的结构特征(结合配体)利于纯化。
组氨酸残基侧链与固态的镍有强烈的吸引力,可用于固定化金属螯合层析(IMAC),对重组蛋白进行分离纯化。
使用His-tag有下面优点:标签的量小,只有~,而GST和蛋白A分别为~26KD和~30KD,一般不影响目标蛋白的功能;His标签融合蛋白可以在非离子型表面活性剂存在的条件下或变性条件下纯化,前者在纯化疏水性强的蛋白得到应用,后者在纯化包涵体蛋白时特别有用,用高浓度的变性剂溶解后通过金属螯和去除杂蛋白,使复性不受其它蛋白的干扰,或进行金属螯和亲和层析复性;His标签融合蛋白也被用于蛋白质-蛋白质、蛋白质-DNA相互作用研究;His标签免疫原性相对较低,可将纯化的蛋白直接注射动物进行免疫并制备抗体。
可应用于多种表达系统,纯化的条件温和;可以和其它的亲和标签一起构建双亲和标签。
Flag标签蛋白Flag标签蛋白为编码8个氨基酸的亲水性多肽(DYKDDDDK),同时载体中构建的Kozak序列使得带有FLAG的融合蛋白在真核表达系统中表达效率更高。
师姐,到底要加啥蛋白标签?加N端还是C端?

师姐,到底要加啥蛋白标签?加N端还是C端?我叫林平之,是莫愁师姐的师弟,最近我要做CoIP,好烦呢!为了便宜,鲁老板让我用蛋白标签,但是应该怎么用呢?莫愁:首先,你要确定需要融合表达的标签是什么,不同的蛋白标签,用处是不一样的。
最常见的就是:His-Tag,Flag-Tag,GST-Tag,HA-Tag,Myc-Tag,GFP,SUMO等等。
GST-Tag是比较大的片段,主要用于GST的Pulldown,也就是用带有GST抗体的柱子,将与含有GST标记的蛋白相互作用的蛋白拉下来。
(好吧说得好拗口)大分子的标签,还有GFP蛋白,GFP基本上也是用于检测蛋白表达的,融合GFP后,可以通过GFP的荧光显示蛋白表达情况。
SUMO标签也是一种大分子标签,SUMO标签可以作为重组蛋白表达的融合标签和分子伴侣,不但可以进一步提高融合蛋白的表达量,且具有抗蛋白酶水解以及促进靶蛋白正确折叠,提高重组蛋白可溶性等功能。
但是蛋白标签越大,会造成的对蛋白质本身的功能影响就越大,所以大分子标签一般只用于检测或者蛋白纯化等。
His-Tag,Flag-Tag,HA-Tag,Myc-Tag这些分子标签的分子量都很小,只有几个氨基酸,有很多商品化的抗体,用这些Taq主要是用来节省成本,也节约大家制备单抗所需要的时间。
这些标签就是在CoIP上是最常用的。
小林子:师姐,我还遇到了一个最简单,但是又最复杂的问题,这标签……到底是要加在头上,还是尾巴上呢?莫愁:这个问题提的好呢……到底是把蛋白标签放到N端还是放到C端?我们要一分为二来看这个问题:首先如果把蛋白标签放到N端,对于一些比较难表达的和蛋白太小容易被降解的蛋白,我们可以利用N端的蛋白标签。
它可以保证蛋白的稳定性,同时不会对外源蛋白的免疫原性造成很大的影响,这种方法比较适合用于表位筛选。
但,凡事也有两面性,如果你要做的是分泌蛋白的话,会有这样的问题,在蛋白分泌到高尔基体的过程中,蛋白N端的信号肽,会被酶切掉……这样,你标签要是装在N端,就基本白瞎了。
蛋白标签-基因克隆载体上的蛋白标签-齐全的各种常用标签

蛋白标签-基因克隆载体上的蛋白标签-齐全的各种常用标签蛋白标签蛋白标签(proteintag)是指利用DNA体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和纯化等。
蛋白表达载体按照表达宿主的不同新推出3类,分别为表达宿主为大肠杆菌,哺乳动物细胞的,以及慢病毒载体。
除了必要的复制和筛选的元件,协助表达和翻译的元件外,本文将各类载体分别按照功能标签的不同确定种类并将个标签的功能初步介绍如下:His6:His6是指六个组氨酸残基组成的融合标签,可插入在目的蛋白的C末端或N末端。
当某一个标签的使用,一是能构成表位利于纯化和检测;二是构成独特的结构特征(结合配体)利于纯化。
组氨酸残基侧链与固态的镍有强烈的吸引力,可用于固定化金属螯合层析(IMAC),对重组蛋白进行分离纯化。
使用His-tag有下面优点:1.标签的分子量小,只有~0.84KD,而GST和蛋白A分别为~26KD和~30KD,一般不影响目标蛋白的功能;2.His标签融合蛋白可以在非离子型表面活性剂存在的条件下或变性条件下纯化,前者在纯化疏水性强的蛋白得到应用,后者在纯化包涵体蛋白时特别有用,用高浓度的变性剂溶解后通过金属螯和亲和层析去除杂蛋白,使复性不受其它蛋白的干扰,或进行金属螯和亲和层析复性;3.His标签融合蛋白也被用于蛋白质-蛋白质、蛋白质-DNA相互作用研究;4.His标签免疫原性相对较低,可将纯化的蛋白直接注射动物进行免疫制备抗体;5.可应用于多种表达系统,纯化的条件温和;6.可以和其它的亲和标签一起构建双亲和标签。
Flag:Flag标签蛋白为编码8个氨基酸的亲水性多肽(DYKDDDDK),同时载体中构建的Kozak序列使得带有FLAG的融合蛋白在真核表达系统中表达效率更高。
FLAG作为标签蛋白,其融合表达目的蛋白后具有以下优点:1.FLAG作为融合表达标签,其通常不会与目的蛋白相互作用并且通常不会影响目的蛋白的功能、性质,这样就有利用研究人员对融合蛋白进行下游研究。
GFP标签融合蛋白亲和凝胶使用说明书

Anti-GFP亲和凝胶Cat#:IP0057(本品仅用于科学研究,不可用于诊断及治疗)1.背景信息GFP,绿色荧光蛋白(Green fluorescent protein),来源于维多利亚多管发光水母,由约238个氨基酸组成,从蓝光到紫外线都能使其激发出绿色萤光。
GFP常用于真核蛋白质重组表达标记。
Anti -GFP亲和凝胶,由高品质的GFP鼠单克隆抗体与Sepharose 4B琼脂糖颗粒共价偶联制成,具有高载量(至少为1.2mg protein/ml凝胶),高特异性,性质稳定,可反复使用的特点,可用于GFP标签融合蛋白的免疫(共)沉淀检测。
2.性能指标应用范围:可用于N端GFP融合蛋白(GFP–Protein)和C端GFP融合蛋白(Protein-GFP)的免疫(共)沉淀。
载量:1ml Sepharose 4B琼脂糖颗粒,共价偶联800μg Anti-GFP 鼠单克隆抗体,可沉淀至少1.2mg GFP融合蛋白。
成分:共价偶联Anti-GFP 鼠单克隆抗体的Sepharose 4B琼脂糖颗粒, 1ml溶于2ml PBS+50%甘油中。
保存方法:在加入了50%甘油和0.2‰叠氮钠的PBS保存液中,-20℃可保存1年。
3.使用方法3.1细胞裂解液制备3.1.1悬浮细胞和半贴壁细胞从细胞培养瓶上吹下来后放入离心管中,1000rpm离心5分钟。
贴壁细胞用细胞刮子轻轻从瓶壁上刮下来,放入离心管中1000rpm离心5分钟。
3.1.2预冷的PBS(pH7.2)重悬细胞,1000rpm离心3min,弃上清。
重复一次。
3.1.3根据细胞的量加入相应体积的细胞裂解液(推荐配方见5.3),反复吹打后冰上放置10-20min,让细胞充分裂解。
3.1.4用超声破碎仪将细胞裂解液超声,直至细胞裂解液透明,不再粘稠。
冰上放置30min之后,12000rpm,4℃离心10min。
取上清,冷冻保存。
3.2装柱及孵育3.2.1根据使用目的选用重力柱或离心管,移入适量亲和凝胶。
基因克隆载体上的各种常用蛋白标签
基因克隆载体上的各种常用蛋白标签蛋白标签proteintag是指利用DNA体外重组技术;与目的蛋白一起融合表达的一种多肽或者蛋白;以便于目的蛋白的表达、检测、示踪和纯化等..随着技术的不断发展;研究人员相继开发出了具有各种不同功能的蛋白标签..目前;这些蛋白标签已在基础研究和商业化产品生产等方面得到了广泛的应用..美国GeneCopoeia复能基因为客户提供50多种蛋白标签;可以满足客户的不同需求;包括各种最新型的标签;如:SNAP-Tag 、Halo Tag 、AviTag 、Sumo等;也提供齐全的各种常用标签;如eGFP、His、Flag等等标签..以下是部分蛋白标签的特性介绍;更加详细的介绍可在查询产品的结果列表里面看到各种推荐的蛋白标签和载体..TrxHISHis6是指六个组氨酸残基组成的融合标签;可插入在目的蛋白的C末端或N末端..当某一个标签的使用;一是能构成表位利于纯化和检测;二是构成独特的结构特征结合配体利于纯化..组氨酸残基侧链与固态的镍有强烈的吸引力;可用于固定化金属螯合层析IMAC;对重组蛋白进行分离纯化..使用His-tag有下面优点:标签的量小;只有~0.84KD;而GST和蛋白A分别为~26KD和~30KD;一般不影响目标蛋白的功能;His标签融合蛋白可以在非离子型表面活性剂存在的条件下或变性条件下纯化;前者在纯化疏水性强的蛋白得到应用;后者在纯化包涵体蛋白时特别有用;用高浓度的变性剂溶解后通过金属螯和去除杂蛋白;使复性不受其它蛋白的干扰;或进行金属螯和亲和层析复性;His标签融合蛋白也被用于蛋白质-蛋白质、蛋白质-DNA相互作用研究;His标签免疫原性相对较低;可将纯化的蛋白直接注射动物进行免疫并制备抗体..可应用于多种表达系统;纯化的条件温和;可以和其它的亲和标签一起构建双亲和标签..Flag标签蛋白Flag标签蛋白为编码8个氨基酸的亲水性多肽DYKDDDDK;同时载体中构建的Kozak序列使得带有FLAG的融合蛋白在真核表达系统中表达效率更高.. FLAG作为标签蛋白;其融合表达目的蛋白后具有以下优点:FLAG作为融合表达标签;其通常不会与目的蛋白相互作用并且通常不会影响目的蛋白的功能、性质;这样就有利用研究人员对融合蛋白进行下游研究..融合FLAG的目的蛋白;可以直接通过FLAG进行亲和层析;此层析为非变性纯化;可以纯化有活性的融合蛋白;并且纯化效率高..FLAG作为标签蛋白;其可以被抗FLAG的抗体识别;这样就方便通过Western Blot、ELISA等方法对含有FLAG的融合蛋白进行检测、鉴定..融合在N端的FLAG;其可以被肠激酶切除DDDK;从而得到特异的目的蛋白..因此现FLAG标签已广泛的应用于蛋白表达、纯化、鉴定、功能研究及其蛋白相互作用等相关领域..MBP麦芽糖结合蛋白MBP麦芽糖结合蛋白标签蛋白大小为40kDa;由大肠杆菌K12的malE基因编码..MBP可增加在细菌中过量表达的融合蛋白的溶解性;尤其是真核蛋白..MBP标签可通过免疫分析很方便地检测..有必要用位点专一的蛋白酶切割标签..如果蛋白在细菌中表达;MBP可以融合在蛋白的N端或C 端.. 纯化:融合蛋白可通过交联淀粉亲和层析一步纯化..结合的融合蛋白可用10mM麦芽糖在生理缓冲液中进行洗脱..结合亲和力在微摩尔范围..一些融合蛋白在0.2% Triton X-100或0.25% Tween 20存在下不能有效结合;而其他融合蛋白则不受影响.. 缓冲条件为pH7.0到8.5;盐浓度可高达1M;但不能使用变性剂..如果要去除MBP融合部分;可用位点特异性蛋白酶切除..检测:可用MBP抗体或表达的目的蛋白特异性抗体检测..GST谷胱甘肽巯基转移酶GST谷胱甘肽巯基转移酶标签蛋白本身是一个在解毒过程中起到重要作用的转移酶;它的天然大小为26KD..将它应用在原核表达的原因大致有两个;一个是因为它是一个高度可溶的蛋白;希望可以利用它增加外源蛋白的可溶性;另一个是它可以在大肠杆菌中大量表达;起到提高表达量的作用..GST融合表达系统广泛应用于各种融合蛋白的表达;可以在大肠杆菌和酵母菌等宿主细胞中表达..结合的融合蛋白在非变性条件下用10mM 还原型谷胱甘肽洗脱..在大多数情况下;融合蛋白在水溶液中是可溶的;并形成二体..GST标签可用酶学分析或免疫分析很方便的检测..标签有助于保护重组蛋白免受胞外蛋白酶的降解并提高其稳定性.. 在大多数情况下GST融合蛋白是完全或部分可溶的..纯化:该表达系统表达的GST标签蛋白可直接从细菌裂解液中利用含有还原型谷胱甘肽琼脂糖凝胶Glutathione sepharose亲和树脂进行纯化..GST标签蛋白可在温和、非变性条件下洗脱;因此保留了蛋白的抗原性和生物活性..GST在变性条件下会失去对谷胱甘肽树脂的结合能力;因此不能在纯化缓冲液中加入强变性剂如:盐酸胍或尿素等..如果要去除GST融合部分;可用位点特异性蛋白酶切除..检测:可用GST抗体或表达的目的蛋白特异性抗体检测..HAHA标签蛋白;标签序列YPYDVPDYA;源于流感病毒的红细胞凝集素表面抗原决定簇;9个氨基酸;对外源靶蛋白的空间结构影响小; 容易构建成标签蛋白融合到N端或者C端..易于用Anti-HA抗体检测和ELISA检测..c-MycC-Myc 标签蛋白;是一个含11个氨基酸的小标签;标签序列Glu-Gln-Lys-Leu-Ile- Ser-Glu-Glu-Asp-Leu;这11个氨基酸作为抗原表位表达在不同的蛋白质框架中仍可识别其相应抗体..C-Myc tag已成功应用在 Western-blot杂交技术、免疫沉淀和流式细胞计量术中; 可用于检测重组蛋白质在靶细胞中的表达..eGFPeGFP标签蛋白;是增强型绿色荧光蛋白eGFP;激发波长为488nm;发射波长为507nm;其是由野生型绿色荧光蛋白GFP通过氨基酸突变和密码子优化而来的..相对于GFP;eGFP荧光强度更强、荧光性质更稳定..同时载体中构建的Kozak序列使得含有eGFP的融合蛋白在真核表达系统中表达效率更高.. eGFP作为标签蛋白;其融合表达目的蛋白后具有以下优点:不用破碎组织细胞和不加任何底物;直接通过荧光显微镜就能在活细胞中发出绿色荧光;实时显示目的基因的表达情况;而且荧光性质稳定;被誉为活细胞探针..其自发荧光;不需用目的基因的抗体或原位杂交技术就可推知目的基因在细胞中的定位等情况..同时细胞内的其它产物不会干扰标签蛋白检测;从而使其检测更显得快速、简便、灵敏度高而且重现性..其低消耗、高灵敏度检测;十分适用于高通量的药物筛选..因此现eGFP 表达标签被广泛地应用于基团表达调控、转基因功能研究、蛋白在细胞中的功能定位、迁移变化及药物筛选等方面..此外由我公司提供的IRES双顺反子载体;可同目的基因共表达eGFP;用于目的基因的体内蛋白示踪研究..eYFPeYFP标签蛋白为增强型黄绿色荧光蛋白eYFP;激发波长为513nm;发射波长为527nm;其是由野生型黄绿色荧光蛋白YFP通过氨基酸突变和密码子优化而来的..相对于YFP;eYFP荧光强度更强、荧光性质更稳定..同时载体中构建的Kozak序列使得含有eYFP的融合蛋白在真核表达系统中表达效率更高.. eYFP作为标签蛋白;其融合表达目的蛋白后具有以下优点:不用破碎组织细胞和不加任何底物;直接通过荧光显微镜就能在活细胞中发出绿色荧光;实时显示目的基因的表达情况;而且荧光性质稳定;被誉为活细胞探针..其自发荧光;不需用目的基因的抗体或原位杂交技术就可推知目的基因在细胞中的定位等情况..同时细胞内的其它产物不会干扰标签蛋白检测;从而使其检测更显得快速、简便、灵敏度高而且重现性..其低消耗、高灵敏度检测;十分适用于高通量的药物筛选..因此现eYFP 表达标签被广泛的应用与基团表达调控、转基因功能研究、蛋白在细胞中的功能定位、迁移变化及药物筛选等方面..此外由我公司提供的IRES双顺反子载体;可同目的基因共表达eYFP;用于目的基因的体内蛋白示踪研究..eCFPeCFP标签蛋白为增强型青色荧光蛋白eCFP;激发波长为433nm或453nm;发射波长为475nm或501nm;其是由野生型青色荧光蛋白CFP通过氨基酸突变和密码子优化而来的..相对于CFP;eCFP荧光强度更强、荧光性质更稳定..同时载体中构建的Kozak序列使得含有eCFP的融合蛋白在真核表达系统中表达效率更高.. eCFP作为标签蛋白;其融合表达目的蛋白后具有以下优点:不用破碎组织细胞和不加任何底物;直接通过荧光显微镜就能在活细胞中发出绿色荧光;实时显示目的基因的表达情况;而且荧光性质稳定;被誉为活细胞探针..其自发荧光;不需用目的基因的抗体或原位杂交技术就可推知目的基因在细胞中的定位等情况..同时细胞内的其它产物不会干扰标签蛋白检测;从而使其检测更显得快速、简便、灵敏度高而且重现性..其低消耗、高灵敏度检测;十分适用于高通量的药物筛选..因此现eCFP 表达标签被广泛的应用与基团表达调控、转基因功能研究、蛋白在细胞中的功能定位、迁移变化及药物筛选等方面..Avi TagAviTag标签蛋白是一个15 个氨基酸的短肽;具有一个单生物素化赖氨酸位点;与已知天然可生物素化序列完全不同;可以加在目标蛋白的N端和C端..融合表达后;可被生物素连接酶生物素化;为了纯化重组蛋白选用低亲和性的单体抗生物素蛋白或抗生物素蛋白衍生物;除了用于蛋白质分离纯化;还用于蛋白质相互作用研究..Avi Tag标签系统具有以下几大优点:无论在体外或者体内;几乎所有的蛋白都可以在一个独特的Avi Tag 位点轻易且有效地被生物素化;生物素化是通过酶和底物的反应来实现;反应条件相当温和而且标记的专一性极高;生物素Avi Tag只有15个氨基酸;对蛋白空间结构的影响非常小..SNAP-TagSNAP-Tag是新一代的蛋白标签技术;不仅专一性极高而且稳定;最大的优点是适用于多种环境下的蛋白质检测与纯化;如活细胞内、溶液中、或固态相如SDS-PAGE gels等..SNAP-Tag是从人的O6-甲基鸟嘌呤-DNA甲基转移O6-alkylguanine-DNA- alkyltransferase获得..无论体内还是体外;SNAP-Tag都能与底物高特异性地共价结合;使蛋白标记上生物素或荧光基团如荧光素和若丹明..SNAP所带的活性巯基位点接受了苯甲基鸟嘌呤所携带的侧链苯甲基基团;释放出了鸟嘌呤..这种新的硫醚键共价结合使SNAP所带的目的蛋白携带上了苯甲基基团所带的标记物..苯甲基鸟嘌呤在生化条件下稳定;并且没有其他蛋白会和这类物质作用;所以SNAP标签反应是高特异的..检测:生物素或各种颜色荧光的底物如荧光素、若丹明可渗透进入细胞;方便快捷地进行活细胞内SNAP-Tag融合蛋白的标记与检测..它们也可特异性地标记大肠杆菌;酵母和哺乳动物等细胞抽提液或已经纯化的蛋白液中的SNAP-tag融合蛋白..将纯化的或未纯化的SNAP-Tag融合蛋白与表面固定了苯甲基鸟嘌呤的基质混合;蛋白即可特异与底物作用;形成共价键;融合蛋白间接被固定在了基质表面上;可以达到更方便快捷地研究蛋白功能或纯化蛋白的目的..Halo TagHaloTag 标签蛋白是一种脱卤素酶的遗传修饰衍生物;可与多种合成的HaloTag 配基有效地共价结合..这个分子量为33KDa的单体蛋白能融合在重组蛋白的N端或C 端;并在原核和真核系统中表达..HaloTag 配基是小分子化学物;能够在体外或体内与HaloTag 蛋白共价结合..这些配基由两个关键组分组成:1一个通用的HaloTag 反应联结子;结合HaloTag 蛋白;2一个功能基团;例如荧光染料或亲和媒介..能够共价和特异性结合多种合成的报告基团和亲和配基的特性;使得HaloTag 蛋白能够用于检测和亲和结合或固相化固定目的蛋白..SUMOSUMO标签蛋白是一种小分子泛素样修饰蛋白Small ubiquitin-like modifier;是泛素ubiquitin类多肽链超家族的重要成员之一..在一级结构上;SUMO与泛素只有18%的同源性;然而两者的三级结构及其生物学功能却十分相似..研究发现SUMO可以作为重组蛋白表达的融合标签和分子伴侣;不但可以进一步提高融合蛋白的表达量;且具有抗蛋白酶水解以及促进靶蛋白正确折叠;提高重组蛋白可溶性等功能..此外SUMO还有一项重要的应用;就是可用于完整地切除标签蛋白;得到天然蛋白..因为SUMO蛋白水解酶我公司可提供能识别完整的SUMO标签蛋白序列;并能高效地把SUMO从融合蛋白上切割下来..切除SUMO后;经过亲和层析;去除标签蛋白部分;就得到和天然蛋白一样的重组蛋白..所以SUMO标签也常用于和其他标签一起应用;作为特异酶切水解位点..荧光素酶Luciferase荧光素酶不是标签蛋白;但是由我公司提供的IRES载体;可同目的基因共表达萤火虫荧光素酶基因;用于目的基因的体内蛋白示踪研究..荧光素酶Luciferase能催化荧光素氧化;在氧化的过程中;发出生物荧光;然后通过荧光测定仪或液闪测定仪就可以测定荧光素氧化过程中释放的生物荧光..荧光素酶的优势在于发生物荧光;无需激发;无本底的影响;所以相关线性程度高;而且萤火虫荧光素酶在一般细胞中不会出现;荧光素酶分析的灵敏度很高;也容易操作;生物荧光的测定用简单的手动或全自动的微孔板化学发光检测仪都可以用;适合高通量筛选..。
优质原创总结 NusA标签 MBP标签 融合标签蛋白纯化原理及优缺点
融合MBP蛋白的纯化(双标签:MBP-His6)
更多蛋白表达/蛋白纯化相关原理/实验流程及FAQ请访问: /topics/dan-bai-biao-da.html 我们会不断的更新补充最全面、专业的蛋白表达相关知识, 欢迎收藏!
谢谢大家
融合NusA 和 MBP蛋白纯化
融合NusA和MBP蛋白纯化
定义
A
B
原理
方法
C
D
问题
NusA
NusA(antitermination protein
残基数:495
分子量: 54.87KDa
不具有独立的纯化标签功能,所以要与其它标签如His标签联用
关于NusA
NusA的 氨基酸序列
NusA的运用的优点和缺点
NusA标签的去除
NusA标签的去除 (TEV)
双标签融合蛋白NusA与His 6的纯化(试剂)
双标签融合蛋白NusA与His 6的纯化(流程)
双标签融合蛋白NusA与His 的纯化(分析)
6
MBP
麦芽糖结合蛋白(maltose binding protein. MBP)
关于MBP
关于MBP
MBP标签运用的优缺点
融合MBP蛋白的纯化(流程)
融合MBP蛋白的纯化(试剂)
融合MBP蛋白的纯化(MBP-RACK1蛋白多步纯化-亲和)
融合MBP蛋白的纯化(MBP-RACK1蛋白多步纯化-离子)
融合MBP蛋白的纯化(MBP-RACK1蛋白多步纯化-分子筛)
融合MBP蛋白的纯化(双标签:MBP-His6)
mbp标签注意事项
mbp标签注意事项
MBP标签(麦芽糖结合蛋白标签)在蛋白质纯化中具有广泛的应用,以下是使用MBP标签时需要注意的事项:
1. 功能及分类:MBP是一个大标签,分子量大小在40kDa以上,由大肠杆菌K12的malE基因编码。
它可增加目标蛋白在细菌中的溶解性,尤其是真核蛋白,也可以增加融合蛋白表达量。
2. 结合与洗脱:MBP可以和交联淀粉亲和树脂结合,结合的融合蛋白可用10-20mM麦芽糖在温和条件下洗脱,得到高纯度、高浓度目标蛋白。
3. 标签的序列:MBP序列有两种形式,一种N端含有信号肽,适用于毒性蛋白的表达纯化,一般融合在N端;一种不含信号肽序列,可融合在N端或C端,多融合在N端。
4. 其他注意事项:
MBP标签的使用可以增加目标蛋白的产量和纯度,但在某些情况下,MBP标签可能导致蛋白质的构象变化或影响其功能。
因此,在使用MBP标签之前,建议进行充分的文献调研和实验验证。
MBP标签的添加可能会影响某些蛋白质的结晶,因此在蛋白质结晶实验中使用MBP标签时需要特别注意。
在使用MBP标签进行蛋白质纯化时,建议使用专门针对MBP标签的商业化的纯化试剂和树脂,以确保最佳的纯化效果。
MBP标签的使用可能会增加蛋白质的免疫原性,因此在用于制备治疗性蛋白质或抗体时需要特别注意。
总之,使用MBP标签时需要注意以上事项,以确保蛋白质纯化的成功和实验结果的可靠性。
在使用之前,建议查阅相关文献和资料,或咨询专业人士的建议和意见。
His标签融合蛋白
默克生命科学服务热线:400 820 8872 bioteam@
高纯度包涵体的制备 以下操作可用于任何 BugBuster®系列产品抽提的包涵体纯化。 1. 如可溶蛋白抽提步骤1-4进行操作。 2. 将步骤“4”所得到的沉淀重悬于BugBuster(货号70584),BugBuster的量与当初重悬细胞糊的体积相同。
重复两次。再次重悬,于4℃,16,000g离心15分钟并去除上清。 7. 重悬最终的沉淀(即纯化的包涵体)于选定的缓冲液,最好是能与后续纯化方法兼容的缓冲液。包涵体可以
重悬于Novagen的蛋白重折叠试剂盒(货号70123)中的1×溶解缓冲液(参考操作手册TB234)或其它变性 剂。不溶的His•Tag®融合蛋白可以用含有变性剂的1×结合缓冲液重悬用于His•Bind®纯化(IDA或NTA)。
产品使用说明书
His·Tag 融合蛋白纯化操作手册
*建议同时参考本说明书英文原文(说明书编号TB273)。
采用 pET 系统进行原核蛋白表达,蛋白的表达量达到 20mg/100ml 培养物并不是困难的事。 在大肠杆菌中表达的目的蛋白,其可溶性(可溶蛋白或包涵体)、细胞定位(细胞质、细胞周 质、培养基上清),都会对后续的纯化策略造成影响。我们建议研究者在蛋白表达后,首先进 行目的蛋白的细胞定位(请参考 pET 系统操作手册);在进行大量纯化之前,小量纯化蛋 白,摸索确定适合于具体蛋白的纯化条件,也是值得推荐的好方法。外源蛋白在大肠杆菌中表 达,可能以可溶形式存在,也可能以包涵体形式存在。尤其在高水平表达的条件下,更容易形 成包涵体。包涵体的形成与外源蛋白本身性质、载体、宿主菌、以及表达水平都有关系,可以 通过选择不同表达载体和 E.coli 宿主菌组合,摸索生长条件和适宜诱导条件,达到优化蛋白表 达的目的。His·Tag®融合蛋白,可以在天然条件或变性条件下用 NTA His·Bind 树脂或 IDA His·Bind 树脂进行纯化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
在蛋白质功能及结构研究过程中,研究的首要任务就是利用多种方法获得纯化的具有完整结构及生物学功能并能够正确折叠的高度纯化蛋白质。
除了蛋白质的研究,具有特定生物活性的高价值蛋白质的生产也需要对蛋白质产品进行纯化。
因此,科研人员和工业生产往往大量采用多种多样的表达系统来获得高表达的蛋白质,对其纯化后进行研究或加工,这些表达系统包括原核表达系统、酵母菌表达系统、昆虫动物细胞表达系统、真核细胞表达系统等。
如何将系统中表达的目标蛋白质与其他蛋白分离,一直是表达纯化中的一个重点。
为了克服从复杂样品中纯化单一蛋白质这种困难,科学家利用生物物质,特别是酶和抗体等蛋白质,具有识别某种特定物质并与该物质分子特异性结合的能力,利用生物分子间的这种特异性结合能力而形成的亲和纯化技术。
亲和标签纯化技术已广泛应用于蛋白质,特别是重组蛋白的分离纯化中。
在重组蛋白的亲和纯化中,利用基因工程技术,将经过改造优化的亲和标签与目标蛋白融合表达,通过一步简单快速的亲和层析,直接获得纯度较高的重组融合蛋白,已成为重组蛋白纯化的一个通用方法,具有结合特异性高、纯化步骤简便、纯化条件温和、适用性广泛等优点,为蛋白质的有效纯化提供了一条解决的途径,广泛应用于蛋白质结构与功能的研究及重组蛋白纯化工艺的开发中。
自从20世纪70年代中期融合标签技术出现以来,亲和标签已成为一种重组蛋白纯化十分有效的工具,具有结合特异性高、纯化条件温和、纯化步骤简便、适用性广泛等显著优势。
通常,亲和标签定义为对特定的生物或化学配基具有高度亲和力的一段氨基酸序列。
到目前为止,已经出现了种类众多、功能各异、用途多样的亲和标签,极大地促进了对重组蛋白的有效纯化。
根据自身分子量大小的不同,亲和标签可以分为两大类:一类是结合固定化配基的短肽标签,如His-tag、FLAG-tag、Strep-tag U等;另一类是识别小分子配基的蛋白标签,如GST MBP等。
短肽标签:His-tag : His标签是目前高通量蛋白纯化最普遍使用的亲和标签,广泛用于多种重组蛋白在各种表达系统的表达与纯化中。
His标签一般为5~15个组氨酸,被认为是重组蛋白纯化的首选标签,具有以下优点:(1)位于目标蛋白N端的His 标签与细菌的转录翻译机制相互兼容,利于蛋白的表达;(2)His标签几乎不影响目标蛋白的理化性质;(3)His标签很小,不会改变目标蛋白的可溶性;(4)His标签在目标蛋白结晶后对蛋白结构几乎没有影响;(5)采用固定化金属离子亲和层析纯化His标签融合蛋白时,其操作非常简便。
基于上述优点,几乎所有的大型结构基因组研究中心都把纯化His标签融合蛋白的固定化金属离子亲和层析(immobilized metal-ion affinity chromatography ,IMAC 作为主要的蛋白纯化方法。
然而,并不是所有的蛋白质都可以与His标签融合后,采用固定化金属离子亲和层析分离纯化。
宿主蛋白中含有半胱氨酸及天然发生的组氨酸丰富区域,在固定化金属离子亲和层析时可能会导致其他蛋白的非特异性结合;目标蛋白含有金属离子,一般也不米用His标签与固定化金属离子亲和层析。
FLAG-tag:除了His标签外,另一个广泛使用的小分子短肽标签是FLAG标签。
FLAG标签是由8个氨基酸(DYKDDDDK&成的一个短肽,分子量很小,因而不会遮盖融合蛋白中其他的蛋白表位与结构域,也不会改变融合蛋白的功能、分泌或运输。
该标签具有天然的亲水特性,很容易定位于融合蛋白的表面,便于利用抗体检测;同时含有一个肠激酶切割位点(DDDK,可以利用肠激酶切除标签。
FLAG S签有3个特异性的单克隆抗体,分别为M1单抗、M2单抗、M5单抗。
FLAG 短肽合成成本较高,不适用于大规模纯化,且需要额外步骤除去结合在层析介质上的短肽。
Strep-tag n:与His-tag、FLAG-tag 相似,Strep-tag U 也是一个小分子的短肽标签,广泛用于多种目标蛋白在原核表达系统、哺乳动物细胞表达系统等的表达与纯化中。
在自然界中,链霉亲和素(streptavid in )与生物素(biot in )之间存在着非常强烈的非共价相互作用,其生物学上的解离常数极低;即使生物素与其他蛋白质共价结合之后,两者仍可以相互作用。
基于这两者之间的强烈相互作用,运用一系列蛋白质工程手段,通过对短肽文库的筛选,第一个链霉亲和素结合肽应运而生,即Strep-tag,极大地方便了重组蛋白的一步快速亲和纯化。
然而,Strep-tag与链霉亲和素结合时需要一个自由的羧基末端,因而该标签只能位于目标蛋白的C端,限制了它的应用范围。
在Strep-tag的基础上,通过对合成短肽的筛选,获得了一个与其相似、由8个氨基酸(WSHPQF E K&成的链霉亲和素结合肽,即Strep-tag n,可以位于融合蛋白的任意位置,从而弥补了Strep-tag的不足。
同时,通过对链霉亲和素特定氨基酸的定向突变,获得了与Strep-tag U具有更高亲和力的亲和介质Strep-tact in ,在Strep-tag U融合蛋白的亲和纯化中表现出良好的纯化效果,且蛋白质产量较高,所需成本适中。
Strep-tag U系统的纯化条件比较宽泛,在普通缓冲液下就可与strep-Tactin层析介质结合,使用2.5mmol/L的脱硫生物素就可将Strep-tag U融合蛋白洗脱下来,螯合剂、去污剂、还原剂及高达1mol/L的盐均可加入到缓冲液中。
此外,Strep-tag U在纯化过程中不依赖金属离子,十分适合含金属离子蛋白质的纯化。
蛋白标签:GST GST标签由211个氨基酸组成,大小约为26kDa,是目前广泛用于重组蛋白融合表达与亲和纯化的一种蛋白标签。
大量的表达实验发现,外源蛋白在大肠杆菌表达系统中过量表达时,常会以包涵体的形式形成不溶性的聚合体,大大降低了可溶性重组蛋白的产量,增加了后续蛋白分离纯化的难度。
然而,在融合GST 标签进行原核表达的过程中发现,原本用于亲和纯化的GST标签能在一定程度上增大融合蛋白的可溶性,使融合蛋白以可溶形式存在于细胞质中,不仅促进了目标蛋白的正确折叠,提高了蛋白产量,而且有助于后续的蛋白纯化。
除了增大融合蛋白的可溶性之外,GST标签还具有高效的翻译起始、纯化条件温和、亲和树脂成本相对低廉等显著优点,成为重组蛋白融合表达经常使用的亲和标签。
MBP MBP标签由大肠杆菌K12的malE基因编码的396个氨基酸组成,大小约为40kDa,是除了GST标签之外又一个很好的增大融合蛋白可溶性的蛋白标签。
MBP 标签能够增大在原核表达系统中过量表达的融合蛋白的可溶性,提高其表达量,已在多个表达实验中得到确认。
研究发现,当改变MBP “开放”与“关闭”构象之间的平衡时,MBP增大融合蛋白可溶性的能力将受到明显影响,表明MBP增大融合蛋白可溶性的特性是由其“开放”构象所介导;同时,对MBP配基结合间隙中保守的疏水性氨基酸残基进行定向突变,MBP S现出相似的表型,表明这个配基结合间隙在MBP增大融合蛋白可溶性的机制中具有一定的作用。
然而,从蛋白纯化的角度来看,MBPg签并不是一个最有效的亲和标签;在某些情况下,MBP标签并不能特异性地与亲和树脂有效结合,亲和层析后融合蛋白的纯度也并不合适。
自从上世纪70年代中期亲和标签融合技术出现以来,多种多样的短肽或蛋白亲和标签极大地方便了外源表达重组蛋白的分离与蛋白质复合体的纯化,已成为蛋白质研究领域不可或缺的工具。
一般而言,一个完美的亲和标签应该具备以下特性:(1)能够用于纯化任何表达宿主或表达系统所表达的重组蛋白;(2)可以位于目标蛋白的任意位置而不影响其结构;(3)增大目标蛋白的可溶性,促进其正确折叠,提高蛋白表达量;(4)便于重组蛋白的检测。
目前,商品化的亲和标签已具备其中诸多特性,但性能更加优越、纯化效果更加显著的亲和标签仍需不断寻找与开发。
重组蛋白表达技术现已经广泛应用于生物学各个具体领域。
特别是体内功能研究和蛋白质的大规模生产都需要应用重组蛋白表达载体。
美国GeneCopoeia的蛋白表达载体按照表达宿主的不同新推出3类,分别为表达宿主为大肠杆菌,哺乳动物细胞的,以及慢病毒载体,宿主可以为哺乳动物细胞和原代细胞。
除了必要的复制和筛选的元件,协助表达和翻译的元件外,本文将各类载体分别按照功能标签的不同确定种类并将个标签的功能初步介绍如下:His6:His6是指六个组氨酸残基组成的融合标签,可插入在目的蛋白的C末端或N 末端。
当某一个标签的使用,一是能构成表位利于纯化和检测;二是构成独特的结构特征(结合配体)利于纯化。
组氨酸残基侧链与固态的镍有强烈的吸引力,可用于固定化金属螯合层析(IMAC),对重组蛋白进行分离纯化。
使用His-tag 有下面优点:1. 标签的分子量小,只有~0.84KD,而GST和蛋白A分别为~26KD和~30KD 一般不影响目标蛋白的功能;2. His 标签融合蛋白可以在非离子型表面活性剂存在的条件下或变性条件下纯化,前者在纯化疏水性强的蛋白得到应用,后者在纯化包涵体蛋白时特别有用,用高浓度的变性剂溶解后通过金属螯和亲和层析去除杂蛋白,使复性不受其它蛋白的干扰,或进行金属螯和亲和层析复性;3. His标签融合蛋白也被用于蛋白质-蛋白质、蛋白质-DNA相互作用研究;4. His 标签免疫原性相对较低,可将纯化的蛋白直接注射动物进行免疫制备抗体;5. 可应用于多种表达系统,纯化的条件温和;6. 可以和其它的亲和标签一起构建双亲和标签。
Flag:Flag标签蛋白为编码8个氨基酸的亲水性多肽(DYKDDDD K同时载体中构建的Kozak序列使得带有FLAG的融合蛋白在真核表达系统中表达效率更高。
FLAG作为标签蛋白,其融合表达目的蛋白后具有以下优点:1. FLAG 作为融合表达标签,其通常不会与目的蛋白相互作用并且通常不会影响目的蛋白的功能、性质,这样就有利用研究人员对融合蛋白进行下游研究2. 融合FLAG的目的蛋白,可以直接通过FLAG进行亲和层析,此层析为非变性纯化,可以纯化有活性的融合蛋白,并且纯化效率高。
3. FLAG作为标签蛋白,其可以被抗FLAG的抗体识别,这样就方便通过Western Blot、ELISA等方法对含有FLAG的融合蛋白进行检测、鉴定。
4•融合在N端的FLAG其可以被肠激酶切除(DDDK,从而得到特异的目的蛋白。
因此现FLAG标签已广泛的应用于蛋白表达、纯化、鉴定、功能研究及其蛋白相互作用等相关领域。
MBP:MBP(麦芽糖结合蛋白)标签蛋白大小为40kDa,由大肠杆菌K12的malE基因编码。
MBP可增加在细菌中过量表达的融合蛋白的溶解性,尤其是真核蛋白。
