农药登记原药全组分分析试验指南
化药原药构成
际存在形式表示,同时标注有效部分和配对反离子含量。
含相关杂质的产品应规定其最高含量,以质量分数表示。
●
5.4其他限制性组分含量
含安全剂、稳定剂、增效剂等其他限制性组分的产品,其含量应由标明含量和允许波动范围组成, 允许波动范围参照化学农药制剂要求。
●
5.5酸度、碱度或pH范围
酸度或碱度以硫酸或氢氧化钠质量分数表示,不考虑其实际存在形式。
●
(2)若有效成分以某种盐(如草甘膦钠盐)的形式存在时,还应给出相应衍生物的识别资料。
2.生产工艺 2.1原材料描述
参与反应的化合物和主要溶剂化学名称、美国化学文摘登录号(CAS号)、技术规格、来源等。
●
2.2化学反应方程式
2.3生产工艺说明
按照实际生产作业单元依次描述。
2.4生产工艺流程图
2.5生产装置工艺流程图及描述
●
7.产品安全数据单
●
8.参考资料等
应说明出处。
●
产品 化学 ①
1.有效成分和安全剂、稳定剂 、增效剂等其他限制性组分的 识别
(1)有效成分和安全剂、稳定剂、增效剂等其他限制性组分的通用名称、国际标准化组织(ISO) 批准的名称和其他国际组织及国家通用名称、化学名称、美国化学文摘登录号(CAS号)、国际农 药分析协作委员会(CIPAC)数字代码、开发号、分子式、结构式、异构体组成、相对分子质量或分 子质量范围(注明计算所用国际相对原子质量表的发布时间);
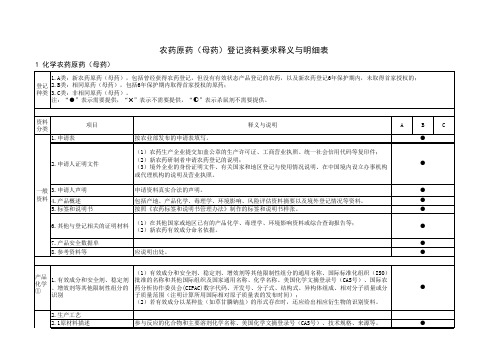
注:“●”表示需要提供,“✖”表示不需要提供,“◐”表示杀鼠剂不需要提供。
资料 分类
1.申请表
项目
按农业部发布的申请表填写。
释义与说明
A
B
C
●
2.申请人证明文件
农药GLP实验室的标准与执行

如何申请OECD GLP 认证
? 对检查的回应与整改: 一般与检察官确认提交整改报告的时间 整改计划: 落实 提交整改报告和证据
第三方GLP实验室介绍
? 大型综合性CRO: SGS、Intertek、Eurofins等综合性机构, 跨越各个行业,以认证和检测为主,也开 展GLP研究 Charles River,Covance, Battelle和 Harlan等专注于医药、医疗器械、生命科 学、生物技术以及农药等行业,开展研发 、安全性评价以及临床研究
GLP
ISO 17025 质量 控制 登记
R&D 研发项目 验收
安全性 评价
GLP 与其它实验室质量体系
? ISO 9001:
• 标准操作程序 • 管理者责任 • 文件与数据控制 • 采购品控制 • 测量与检测设备 • 原因分析 • 内部质量审核 • 改正与预防 • 人员培训 • 质量手册 • 质量方针 • 合同评审 • 客户关怀
? GLP: ISO/IEC 17025的要求基础上增加了
• 项目负责人 (主要研究者) • 项目计划 • 项目的实施 • 试验体系设施 • 独立的QA系统 • 被试物与对照物的 特征描述 • 主进度表 • 档案(forever) •针对项目的检查 •针对过程的检查
委托方与GLP实验室
? 如何选择GLP实验室: 技术能力:仪器设备/ 实验方法 经验技能: 数据质量: 报告时间: 客户服务: 价格:
epaoppts830全部部分835oecd全部欧盟部分2011年中期全部中国农业部全部分析方法开发与验证农药工业化学品以及食品安全检测glp和分析技术培训咨询oecdglp系列文件oecdglp准则1997质量保证和glp1992供应商对glp准则的遵循1992glp准则在田间试验中的应用1992glp准则在短期试验中的应用1993oecdglp系列文件研究主任在glp试验中的作用和责任1993准备glp检查报告的指南199510
卫生用农药制剂登记资料要求释义与明细表

注解:①产品中有效成分含量(X,%或g/100mL,20℃±2℃)范围要求。
X≤2.5 ±15%X(适用于乳油、悬浮剂、可溶液剂等均匀制剂)±25%X(适用于颗粒剂、水分散粒剂等非均匀制剂)2.5<X≤10 ±10%X10<X≤25 ±6%X25<X≤50 ±5%XX>50 ±2.5%或2.5g/100mL②热储稳定性的一般试验条件为(54±2)℃,2周。
替代的条件是:(50±2)℃,4周;(45±2)℃,6周;(40±2)℃,8周;(35±2)℃,12周;(30±2)℃,18周。
如选择替代条件应说明理由。
③结冻和融化稳定性试验一般应在(-10±2)℃和(20±2)℃之间做4个循环,每个循环为结冻18小时,融化6小时。
④如含量低于1%的卫生用农药制剂涉及到异构体拆分,在对产品中有效成分的鉴别试验(包括异构体的鉴别)做出说明的情况下,可以不提供相应的异构体拆分方法和方法验证报告,但提交的资料中应包含下列内容:-当产品中有效成分含量是指某一特定异构体时,有效成分含量应当是总含量乘以所使用原药或母药中有效异构体比例系数;-当有效成分由一个以上异构体按不同比例组成时,应规定总含量以及不同异构体所占的比例;-鉴别试验中应说明原药或母药中异构体的比例范围以及原药或母药异构体的拆分方法和色谱图。
⑤按照《农药登记管理办法》第十六条规定,应当在中国境内完成。
⑥卫生用农药根据剂型不同,应提供相应的毒理学试验资料,具体要求如下:a 蚊香、电热蚊香片:急性吸入毒性;b 气雾剂:急性吸入毒性、眼睛刺激性、皮肤刺激性;c 电热蚊香液:急性经口毒性、急性经皮毒性、急性吸入毒性;d 驱避剂:急性经口毒性、急性经皮毒性、急性吸入毒性、眼睛刺激性、多次皮肤刺激性和致敏性试验;e 其他剂型:急性经口毒性、急性经皮毒性、急性吸入毒性、眼睛刺激性、皮肤刺激性和致敏性试验。
农药分析实验报告

一、实验目的1. 熟悉农药样品的前处理方法。
2. 掌握气相色谱-质谱联用法(GC-MS)在农药分析中的应用。
3. 学习农药残留量的测定方法。
二、实验原理农药残留是指农药在施用后,残存于植物、土壤、水体和空气中的微量物质。
农药残留量测定是保障农产品质量安全的重要手段。
本实验采用气相色谱-质谱联用法(GC-MS)对农药残留量进行测定。
气相色谱-质谱联用法(GC-MS)是一种高效、灵敏、准确的分析方法,具有分离度高、灵敏度高、选择性好、检测范围广等优点。
农药样品经前处理后,进入气相色谱柱,经过柱分离,再进入质谱仪进行质谱分析,根据保留时间和质谱图进行定性定量分析。
三、实验仪器与试剂仪器:1. 气相色谱仪(GC)2. 质谱仪(MS)3. 真空泵4. 热脱附仪5. 电子天平6. 氮吹仪7. 混合气体发生器试剂:1. 农药标准品:乙酰甲胺磷、乐果、敌敌畏等2. 农药样品3. 丙酮、甲醇、正己烷等有机溶剂4. 硅胶、无水硫酸钠等吸附剂四、实验步骤1. 样品前处理:1.1 称取适量农药样品于50 mL具塞离心管中。
1.2 加入10 mL丙酮,涡旋振荡2分钟。
1.3 加入1 g无水硫酸钠,涡旋振荡2分钟。
1.4 5000 r/min离心5分钟。
1.5 吸取上清液于另一个50 mL具塞离心管中,加入10 mL正己烷,涡旋振荡2分钟。
1.6 5000 r/min离心5分钟。
1.7 吸取上清液于另一个50 mL具塞离心管中,加入1 g无水硫酸钠,涡旋振荡2分钟。
1.8 5000 r/min离心5分钟。
1.9 将离心管中的有机相转移至10 mL具塞离心管中,氮吹仪吹至近干。
1.10 加入1 mL正己烷,涡旋振荡2分钟。
1.11 5000 r/min离心5分钟。
1.12 吸取上清液于自动进样瓶中,待测。
2. 标准溶液配制:1.1 准确称取一定量的农药标准品,用丙酮溶解,配制成1000 μg/mL的标准储备液。
1.2 根据需要,用丙酮将标准储备液稀释成不同浓度的标准溶液。
农药登记残留试验区域指南

农药登记残留试验区域指南
本指南依据《农药管理条例》和《农药登记资料要求》,综合考虑气候条件、土壤类型、作物布局、耕作制度、栽培方式和种植规模等因素,科学划分农药登记残留田间试验的区域,明确不同作物农药残留田间试验的点数和分布,用于指导农药登记申请人按规定的区域和点数,委托开展农药登记残留试验,确保农药残留试验资料的科学性和代表性。
一、适用范围
本指南适用于农药登记申请人按规定的区域和点数委托开展农药登记残留试验。
二、试验区域划分
本指南将全国划分为9个农药残留田间试验区域,分别用阿拉伯数字表示。
代表的具体区域如下:
1区:内蒙古、辽宁、吉林、黑龙江;
2区:山西、陕西、甘肃、宁夏、新疆;3区:北京、天津、河北;
4区:山东、河南;
5区:上海、江苏、浙江、安徽;
6区:江西、湖北、湖南;
7区:广西、重庆、四川、贵州、云南;8区:福建、广东、海南;
9区:西藏、青海。
三、主要农作物农药残留田间试验的布局要求
可选点中选择。
2蔬菜
3水果
备注:草莓应全部在设施栽培方式下进行残留试验。
4坚果
5糖料作物
6油料作物
7饮料作物
8食用菌
9其他
四、试验地点选择要求
1.农药登记残留试验点的选择和布置,应符合《农药登记资料要求》规定。
2.残留试验应涵盖作物主产区和主要栽培方式。
若某区域只布置1个试验点,应考虑当地主要栽培方式;若布置2个及以上试验点时,应兼顾不同栽培方式和不同省份。
3.对于《农药登记资料要求》中未规定残留试验点数的作物,一般应进行4点以上试验。
在提交登记申请资料时,应说明试验地点的确定理由并提供相关依据。
[医疗药品管控]农药登记毒理学试验方法
![[医疗药品管控]农药登记毒理学试验方法](https://img.taocdn.com/s3/m/5db34e8977232f60dccca1b6.png)
(医疗药品管理)农药登记毒理学试验方法中华人民共和国国家标准GB15670-1995农药登记毒理学试验方法ToxicologicaltestmethodsofPesticidesforregistration1主题内容和适用范围本标准规定了农药登记毒理学试验的方法、条件的基本要求。
本标准适用于为农药登记而进行的毒理学试验。
2急性经口毒性试验2.1目的求出试验农药对试验动物的半数致死剂量(LD50);通过观察急性毒性效应的临床表现,初步估测毒作用的靶器官和可能的毒作用机理;为亚慢性、慢性和其他毒性试验的剂量水平设计提供参考;为急性毒性分级和制定安全防护措施提供依据。
2.2试验农药原药和制剂。
2.3试验动物2.3.1主要选用品系、遗传背景明确的初年大鼠。
各剂量组内同性别动物体重差异应小于平均体重的10%,组间同性别动物体重均值差异应小于5%。
2.3.2每壹剂量组的大鼠8~10只(雌雄各半),试验前要对动物观察壹周,确认健康后,方可使用。
2.4剂量分组2.4.1至少应设4~5个剂量组,各剂量组之间要有适当的剂量间距。
以便各组出现不同程度的毒性效应(死亡率),求得剂量效应曲线及LD50。
2.4.2如剂量达5000mg/kg体重之上,动物仍不出现死亡,则不需要进行更高剂量的试验。
2.5给药方法及观察时间2.5.1动物给药前应隔夜禁食但不禁水,称重后,壹次灌胃给药,给药后至少间隔2h进食。
2.5.2灌胃量大鼠按100g体重给1mL,小鼠按20g体重给0.4mL计算,灌胃可用水溶液、油溶液或悬液。
2.5.3给药后立即观察且记录动物的中毒表现,症状出现和消失的时间及死亡时间。
给药当日应连续观察,其后,每日至少观察2次,观察期为14d。
如于给药96h后出现迟发性新效应,则应延长观察期至3周或4周。
2.6观察指标2.6.1中毒症状全面观察中毒的发生、发展过程和规律以及中毒特点和毒作用的靶器官。
观察的系统包括:a.中枢神经系统和神经肌肉系统:体位异常、叫声异常、不安、呆滞、痉挛、抽搐麻痹、运动失调、对外反应过敏或迟钝;b.植物神经系统:瞳孔扩大或缩小、流涎或流泪;c.呼吸系统:鼻孔流液、鼻翼煽动、呼吸深缓、呼吸过速、蜂腰;d.泌尿生殖系统:会阴部污秽、有分泌物、阴道或乳房肿胀;e.皮肤和毛:皮肤充血、紫绀、被毛蓬松、污秽;f.眼:眼球突出、结膜充血、角膜混浊;g.消化系统:腹泄、厌食。
农业农村部农药检定所发布《农药登记残留试验区域指南》
浙 湖 四 海 3.对 于 《农药 登记 资料 要求 》 中未规定 残 留试
本指 南将 全
国划 分 为
9个
农
药
残
留
田
间江试南验 、
● ,
区川、 南●, 验
点
数
的
作
物
,
一
般
应
进
行
4点
以上 试验
。在 提 交
域 ,分别 用阿 拉伯 数字表示 。代表 的具体 区域 安 如下贵: l 区: 内蒙 古 、辽宁 、吉林 、黑龙江 ; 徽 州
登记 申请资 料时 ,应 说 明试 验地 点 的确 定理 由并提 供相 关依 据 。
一Z
^ 、
南
生 态 环 境 部 发 布 土壤 和 沉 积 物 氨 基 甲酸 酯 类 农 药 的 测 定
柱后 衍生 一高效液相色谱法 等 四项 国家环境保护标 准
(农药检 (残 留 ) (2018]18号 )
为贯 彻 《中华 人 民共 和 国环境 保 护法 》 ,保护
生 态环 境 ,保 障人体 健康 ,规 范生态 环境监 测工 作 ,
生 态 环 境 部 发布 《土壤 和 沉 积物 氨 基 甲酸 酯 类 农
药 的测 定 柱后 衍 生 一高 效 液相 色 谱 法 》等 四项 标
准 为 国家环境 1 个试 验 点 ,应 考虑 当地 主 要
本 指 南适 用于 农药 登 记 申请 人按 规定 的 区域和 栽 培方 式 ;若 布置 2 个及 以上试 验点 时 ,应 兼顾 不
点数委 托开 展农药 登记残 留试验 。
同栽培 方 式和 不 同省份 。
试 验 区域划 分
料要 求》,综合 考虑 气候条 件 、土壤类 型 、作 物布 局 、
农药登记范本管理规定
农药登记资料规定第一章总则1.1 为规范农药登记工作,保证农药产品质量,促进农业发展,保护生态环境,根据《农药管理条例》(以下简称“《条例》”)和《农药管理条例实施办法》的有关规定,制定本农药登记资料规定(以下简称“规定”)。
1.2 本规定适用于在我国境内生产(包括原药生产、制剂加工和分装)和从境外进口农药产品的登记。
1.3 申请人应当符合《条例》的要求。
境外申请人应当在我国境内设有依法登记的办事处或代理机构。
1.4 新农药、新制剂产品登记分为田间试验、临时登记和正式登记三个阶段。
1.5 申请农药登记应当按照本规定提供登记资料和农药样品。
1.5.1 申请新农药临时登记或正式登记,应当提供有效成分纯品或标准品2克,有效成分重要代谢物、相关杂质标准品0.5克,原药100克(毫升),制剂250克(毫升)。
1.5.2 进行药效、残留、毒性、环境等农药登记试验的样品应当是成熟定型的试验产品,并经省级以上法定质量检测机构检测合格。
境内产品由申请人所在辖区的省级农业行政主管部门所属的农药检定机构(以下简称省级农药检定机构)封样,境外产品由农业部农药检定所封样。
1.5.3 申报的资料应当完整、规范,数据应当真实、有效。
申请表、产品摘要资料和产品安全数据单(MSDS)应当提供电子文本。
1.5.3.1 农药药效、残留、毒理学、环境影响和原药全组分分析等登记试验资料应当由农业部公告具有相应资质的农药登记试验单位出具;农药产品质量检测报告应当由省级以上法定质量检测机构出具。
1.5.3.2 境外试验资料应当由农业部确认的机构出具,并附中文摘要资料。
1.5.3.3 农药登记的室外试验应当根据产品登记使用范围的分布情况,选择有代表性的地区进行。
1.5.3.4 引用文献资料应当注明著作名称、刊物名称及卷、期、页等。
1.5.3.5 产品对人畜、作物、环境影响等可能产生危害的,申请人应当提供危害控制措施的资料。
1.6 申请人应当对所提供登记资料的真实性和不侵犯他人知识产权作出书面声明,并承诺对可能构成的侵权后果负责。
农药登记田间药效试验区域指南
附件7
农药登记田间药效试验区域指南
根据我国主要农作物种植区域布局和病虫草害发生规律,制定本指南。
指南未包含的作物、病虫草害及一些特殊药剂,可根据作物种植区域,在全国选择有代表性的地点进行药效试验。
因病虫草害发生情况、自然灾害等原因,无法按本指南推荐的区域开展药效试验的,申请人可根据实际情况进行调整,并在申请登记时作出说明。
1 粮食作物
1.1 水稻
注:表格中数字代表试验点数,下同。
1.2 小麦
1.3 玉米
1.4 马铃薯
2 经济作物
2.1 棉花
2.2 烟草
2.3 甘蔗
2.4 茶树
3 油料作物
3.1大豆
3.2 花生
3.3 油菜
4 蔬菜
5
果树
5.1 苹果
5.2 柑橘
5.3 梨树
5.4 葡萄。
农药产品登记分类,田间药效以及制剂残留试验
一:农药产品登记分类新农药:是指含有的有效成分尚未在我国批准登记的国内外农药原药和制剂。
新制剂:是指含有的有效成分与已登记的相同,而剂型,含量(配比)尚未在我国登记过的制剂。
新制剂包括新剂型,剂型微小优化,新混配制剂,新含量制剂,新药肥混配制剂,新渗透剂(或增效剂)与农药混配制剂。
特殊农药:主要是指卫生用农药,杀鼠剂,生物化学农药,微生物农药,植物源农药,转基因生物,天敌生物等。
特殊新农药:是指有效成分尚未在我国批准登记的国内外特殊农药原药和制剂。
相同农药产品:是指有效成分,剂型,含量等与已经登记产品相同的产品。
包括质量无明显差异的相同原药,质量无明显差异的相同制剂。
新登记使用范围和方法:是指有效成分和制剂与已登记过的相同,而使用范围和方法尚未在我国登记过。
扩大使用范围,改变使用方法和变更使用剂量农药助剂:是指除有效成分以外的任何被有意添加到农药产品中,本身不具备农药活性,但能够提高或改善,或者有助于提高或改善该产品物理,化学性质的单一组分或者多个组分的混合物。
农药剂型种类:粉剂(DP)乳油(EC),可湿性粉剂(WP), 颗粒剂(GR)悬浮剂(SC),水剂(AS),可溶粉剂(SP), 可溶粒剂(SG),可溶片剂(ST),油剂(OL),超低容量液剂(UL),烟片(FT),烟剂(FU),烟粉粒剂(FU),水乳剂(EW),微乳剂(ME),,悬乳剂(SE),微囊悬乳剂(CS), 水分散粒剂(WG), 可分散片剂(WT),可溶液剂(SL),悬浮种衣剂(FS),气雾剂(AE),蚊香(MC),电热蚊香片(MV),电热蚊香液(lv),饵剂(RB),油乳剂(OW),,细粒剂(FG),微粒剂(MG)分类:1.新农药原药登记1)原药临时登记2)原药正式登记2.新农药制剂登记1)田间试验:在提供产品化学摘要资料时需提供有效成分,原药,制剂。
毒理学资料摘要需分别提供原药和制剂的各项毒理学资料。
2)新农药制剂临时登记3)新农药制剂正式登记3.特殊新农药登记1)卫生用农药田间试验,临时登记(原药,制剂),正式登记(原药,制剂)2)杀鼠剂田间试验,临时登记(原药,制剂),正式登记(原药,制剂)3)生物化学农药田间试验,临时登记(原药,制剂),正式登记(原药,制剂)4)微生物农药田间试验,临时登记(原药,制剂),正式登记(原药,制剂)5)植物源农药4.新制剂登记1)新剂型田间试验,临时登记,正式登记2)农药剂型微小优化田间试验,临时登记,正式登记3)新混配制剂田间试验,临时登记,正式登记4)新含量制剂田间试验,临时登记,正式登记5)新药肥混配制剂田间试验,临时登记,正式登记6)新渗透剂(或增效剂)与农药混配制剂田间试验,临时登记,正式登记7)特殊新农药的新制剂登记田间试验,临时登记,正式登记5.相同农药产品登记已经正式登记的相同农药产品,其他申请人经田间试验后需直接申请正式登记。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
同、或具有较强分辨能力的方法进行结果比较来确定。通常可使 用 气 相 色 谱 - 质 谱 联 用 仪 ( GC/MS )、 液 相 色 谱 - 质 谱 联 用 仪 (LC/MS)或者二极管阵列检测器(DAD)进行测定,确认其特 异性。
3.2 线性关系 被测组分响应的线性范围,至少应不小于该组分标明浓度的 ±20%。至少测定 3 个浓度,每个浓度测定两次,应附上线性关 系图、斜率、截距和相关系数等数据。测得的斜率可证明响应与 分析物浓度之间有明显的相关性。在标明值±20%范围内,其结 果不应与线性有显著偏离,一般相关系数(r)应大于 0.997,否 则需提供如何保证方法有效性的说明。如由于特殊需要使用不成 线性响应的方法,必须做出解释。 3.3 精密度 精密度可用重复性试验进行考察。 重复性试验需至少进行 5 次样品测定,并计算相对标准偏差, 用 RSDr 表示。要求
0.1-1 <0.1
80-120 75-125
0.01-0.1 <0.01
90-110 80-120
3.5 灵敏度
灵敏度可用检出限(LOD)和定量限(LOQ)评价。分析方
法的检出限是指样品中被测组分能被检出的最低量,但并不要求
可定量检测,一般用信噪比为 3 时物质的量或浓度来表示。分析
方法的定量限是指样品中的被测组分在适当的精密度和准确度
2
3.4.1 应采用标准品对照定量法,测定 5 批次原药中有效成 分、含量≥0.1%的任何杂质和含量<0.1%的相关杂质的质量分数。 分析方法应进行确认(方法确认指南见附件 1)。
3.4.2 对于实验室自行开发的方法,应进行方法确认,包括 特异性、线性关系、精密度、准确度、灵敏度(包括检出限和定 量限,仅针对杂质)等。
1
2.6 定量分析 对农药原药中各组分含量的测定分析,一般 测定方法有:化学分析法、比色法和光谱法、薄层色谱法、气相 色谱法、高效液相色谱法等。
3 试验要求 3.1 标准品 一般应采用有证标准品并提供证书,通常应包含以下信息: 名称、纯度(包括不确定度)、来源、批号、有效期、贮存条件 等。 若采用非有证标准品,除提供上述信息外,至少应提供 2 种 定值方法。 3.2 样品 进行全组分分析试验的样品应当是申请人自行研制的成熟 定型的 5 批次有代表性的原药。 3.3. 定性分析 3.3.1 有效成分 提供原药紫外光谱、红外光谱、核磁共振谱和质谱的试验方 法、解析过程、结构式及相关谱图。 当有效成分以盐等形式存在时,应对其反荷离子进行鉴别。 3.3.2 杂质 提供原药中杂质红外光谱、核磁共振谱和质谱中至少一种定 性试验方法及色谱保留时间、解析过程、结构式、通用名称或化 学名称及相关谱图。 3.4 定量分析
农药登记原药全组分分析试验指南
1 目的和范围 为规范农药登记原药全组分分析试验,明确试验要求、报告 内容和格式等,根据《农药登记资料规定》和《农药理化分析良 好实验室规范准则》相关要求,制定本指南。 2 术语和定义 2.1 原药 在制造过程中得到有效成份及杂质组成的最终产 品,不能含有可见的外来物质和任何添加物,必要时可加入少量 的稳定剂。 2.2 相关杂质 与农药有效成分相比,农药产品在生产或贮 存过程中所含有的对人类和环境具有明显的毒害,或者对适用作 物产生药害,或引起农产品污染,或影响农药产品质量稳定性, 或引起其他不良影响的杂质。 2.3 全组分分析 原药中有效成分、含量≥0.1%的任何杂质 和含量<0.1%的相关杂质的定性和定量分析。 2.4 标准品 具有一种或多种稳定、均匀、准确的特性值, 用以校准测量装置、评价测量方法或给材料赋值的一种材料或物 质。 2.5 定性分析 对农药原药中各组分进行的鉴定分析,主要 方法有:红外光谱法、紫外光谱法、核磁共振谱法、质谱法及熔 点、沸点测定法等。
3.1 有效成分信息....................................................................................................................9 3.2 样品信息..........................................................................................................................10 3.3 标准品信息...................................................................................................................... 11 四、试验过程................................................................................................................................. 12 4.1 有效成分定性分析..........................................................................................................12
RSDr<2(1-0.5 1ogC)×0.67 ………………(1) 式中:C 为样品中待测物浓度,以小数计(如 20%,C=0.2)。 对于测定结果中的偏离数据,可用 Dixon 法或 Grubbs 法检 验,但要舍去某些结果时,必须明确指出,并应解释产生偏离的 原因。 3.4 准确度 评价方法的准确度,可采用添加回收率试验,即在已知被测
下面所列出的由质量保证部门所执行的检查已经报告给试验机构管理者及 试验项目负责人:
检查内容
QA 检查日期
报告日期 试验项目负责人 试验机构管理者
QA:打印名字 签字:
日期:
年月日
第 3 页 共 25 页
XX 原药全组分分析试验报告
试验项目编号:
目录
封面 ..................................................................................................................................................1 良好实验室规范符合性声明........................................................................................................... 2 质量保证声明................................................................................................................................... 3 一、摘要 ..........................................................................................................................................7 二、综合信息................................................................................................................................... 8 三、试验信息................................................................................................................................... 9
试验项目负责人: 签字:
日期:
年月日
试验机构管理者:(EPA 要求,是否需要)
签字:
日期:
年月日
委托方:(EPA 要求,是否需要)
签字:
日期:
年月日
第 2 页 共 25 页
XX 原药全组分分析试验报告
试验项目编号:
质量保证声明
……………..的质量保证部门在此声明:………………试验项目是遵循……. 进行的,报告内容准确反映了试验过程及结果。
3.4.3 采用国家标准、行业标准或国际农药分析协作委员会 (CIPAC)等国际通用方法的,仅需进行部分方法确认。有效成 分分析方法确认包括线性关系和精密度等,杂质分析方法确认包 括线性关系、精密度和定量限等。
3.4.4 固体不溶物、水分/干燥减量、酸(碱)度等项目的测 试参照相应标准方法进行。
3.5 质量平衡 通常情况下,当使用上述方法测得的各种组分含量的总和不 足 98%时,应采用其他可能的方法进一步鉴定分析;当各种组分 含量的总和超过 102%时,应分析原因并做出解释。 4 试验报告 按照全组分分析试验报告模板(见附件 2)进行报告撰写。 5 归档 试验计划、标准品和样品、原始数据和试验报告等应在试验 完成后及时归档。
4.1.1 红外光谱法...........................................................................................................12 4.1.1.1 试剂和仪器................................................................................................12 4.1.1.2 操作条件....................................................................................................12 4.1.1.3 测定步骤....................................................................................................12 4.1.1.4 图谱解析及结论........................................................................................12
