无机化学第八章作业参考答案
北师大《无机化学》第四版习题参考答案8

精心整理第八章水溶液8-1现需1200克80%(质量分数)的酒精作溶剂。
实验室存有浓度为70%的回收酒精和95%的酒精,应各取多少进行配置?解:令用浓度为70%的酒精X 克,95%的酒精Y 克。
(70%X+95%Y )/(X+Y )=80%①X+Y =1200②由①②得,X =720Y =4808-2(1(2(3(4解:(1所以c (2(3)(4)同理c(NH 3)=)()(233O H n NH n +=18/)28100()17/28(-+×100%=29.17% 8-3如何将25克NaCl 配制成质量分数为0.25的食盐水溶液?解:令加水X 克,依题意得0.25=25/(25+X),所以X =75克所以加水75克,使25克NaCl 配成25%的食盐水。
8-4现有100.00mLNa 2CrO 4饱和溶液119.40g ,将它蒸干后得固体23.88g ,试计算:(1)Na 2CrO 4溶解度;(2)溶质的质量分数;(3)溶液的物质的量浓度;(4)Na2CrO4的摩尔分数。
解:(1)令Na2CrO4溶解度为S所以S/(S+100)=23.88g/119.40g 所以S=25g(2)ω(Na2CrO4)=23.88g/119.40g×100%=20%(3)M(Na2CrO4)=162g/mol;molgg3)/162/(88.23--1(4)8-5在-1H2SO4g/100g (H2O8-6纯甲解:m8-7解:由解得:8-8⑴胰岛素的摩尔质量;⑵溶液蒸气压下降Δp(已知在25℃时水的饱和蒸气压为3.17kPa)。
解:(1)C=Π/RT=4.34KP a/8.314P a·L·mol-1×(273+25)K=0.00175mol·L-1摩尔质量=0.101g/0.00175mol·L-1×0.01L=5771.43g/mol(2)△P=P B*×X A=3170P a×n1/(n1+n2)≈3170P a×n1/n2=3170P a×(0.101g/5771.43g/mol)×(18g/mol)/(10×1g)=0.0998P a8-9烟草的有害成分尼古丁的实验式为C5H7N,今有496mg尼古丁溶于10.0g水中,所得溶液在101kPa下的沸点为100.17°C,求尼古丁的相对分子质量。
北师大无机化学四版习题答案8章氧化还原平衡

第8 章氧化还原8.1 用氧化数法配平下列方程式。
(1) KClO3→KClO4+KCl(2) Ca5(PO4)3F+C+SiO2→CaSiO3+CaF2+P4+CO(3) NaNO2+NH4Cl→N2+NaCl+H2O(4) K2Cr2O7+FeSO4+H2SO4→Cr2(SO4)3+Fe2(SO4)3+K2SO4+H2O(5) CsCl+Ca→CaCl2+Cs↑解:(1) KClO3→KClO4+KClKClO3:Cl(+5) +5 →+7 7-5=2 ×3KClO3:Cl(+5) +5 →-1 (-1)-5=-6 ×14 KClO3 =3KClO4 + KCl(2) Ca5(PO4)3F+C+SiO2→CaSiO3+CaF2+P4+COC :C(0)0 →+2 2-0=2 ×30Ca5(PO4)3F :P (+5) +5→0 (0-5) ×(3×4)=-60 ×14 Ca5(PO4)3F + 30C +18SiO2=18CaSiO3+2CaF2+3P4+30CO(3) NaNO2+ NH4Cl→N2+NaCl+H2ONH4Cl :N( -3) -3→0 0-(-3)=3 ×1NaNO2:N( +3) +3→0 0-(+3)=-3 ×1NaNO2+NH4Cl=N2+NaCl+H2O(4) K2Cr2O7+FeSO4+H2SO4→Cr2(SO4)3+Fe2(SO4)3+K2SO4+H2OFeSO4 :Fe(+2) +2→+3 3-2=1 ×6K2Cr2O7 :Cr(+6) +6→+3 (3-6) ×2=-6 ×1K2Cr2O7+6FeSO4+4H2SO4=Cr2(SO4)3+2Fe2(SO4)3+K2SO4+4H2O(5) CsCl +Ca → CaCl2 + Cs↑Ca :Ca(0) 0→+2 2-0=2 ×1CsCl :Cs (+10) 1→0 0-1=-1 ×22CsCl +Ca=CaCl2 + 2Cs↑将下列水溶液化学反应的方程式先改写为离子方程式,然后分解为两个半反应式8.2(l) 2H2O2=2H2O + O2(2) Cl2 + H2O =HCl + HClO(3) 3Cl2 + 6KOH =KClO3 + 5KCl+ 3H2O(4) 4KMnO4 + 10FeSO4 + 8H2SO4=2K2SO4 + 5Fe2(SO4)3 + 4MnSO4 + 8H2O(5) K2Cr2O7 + 3H2O2 + 7H2SO4=K2SO4 + Cr2(SO4)3 + 3O2 + 7H2O解:(l) H2O2→H2O + O2H2O2=O2+2H++2e-+) H2O2+2H++2e =2H2O2H2O2=2H2O + O2(2) Cl2 + H2O → HCl + HClO1/2Cl2 + e-=Cl-+) 1/2Cl2 + H2O =HClO+ H+ + e-Cl2 + H2O =H+ + C l-+ HClO(3) Cl2+ KOH → KClO3 + 5KCl+ H2O5×) 1/2 Cl2 + e-=Cl-+) 1/2Cl2 + 6OH-=ClO3-+ 3H2O+5e-3Cl2 + 6OH-=ClO3-+ 5Cl-+ 3H2O(4) KMnO4 + FeSO4 + H2SO4→K2SO4 + Fe2(SO4)3+ MnSO4 + H2OMnO4-+8H++ 5e-=Mn2++ 4H2O5×) Fe2+=Fe3++ e-MnO4-+8H++ 5e-=Mn2++ 5Fe3++4H2O(5) K2Cr2O7 + H2O2 + H2SO4→K2SO4 + Cr2(SO4)3 + O2 + H2OCr2O72-+14H++ 6e-=2 Cr3++7H2O3×) H2O2=O2 +2 H++ 2e-Cr2O72-+ 3H2O2 + 8H+=2 Cr3+ + 3O2 + 7H2O8.3用半反应式法(离子-电子法)配平下列方程式:(1) K2Cr2O7 + H2S+ H2SO4 → K2SO4 + Cr2(SO4)3 + S + H2O(2) MnO4-+ H2O2 → O2 +Mn2+(酸性溶液)(3) Zn+ NO3-+OH-→ NH3+ Zn(OH) 42-(4) Cr (OH)4-+ H2O2 → CrO42-(5) Hg+ NO3-+ H+ → Hg22++ NO解:(1) K2Cr2O7 + H2S+ H2SO4 → K2SO4 + Cr2(SO4)3 + S + H2OCr2O72-+14H++ 6e-=2 Cr3++7H2O3×) H2S =S +2 H++ 2e-Cr2O72-+3H2S+ 8H+=2 Cr3+ + 3S + 7H2O(2) MnO4-+ H2O2 → O2 +Mn2+(酸性溶液)2×) MnO4-+8H++ 5e-=Mn2++4H2O5×) H2O2=O2 +2 H++ 2e-2 MnO4-+6H++ 5H2O2 =2Mn2++5O2 +8H2O(3) Zn+ NO3-+OH-→ NH3+ Zn(OH)42-NO3-+ 6H2O+ 8e-=NH3+ 9 OH-4×) Zn+4OH-=Zn(OH)42-+ 2e-4Zn+ NO3-+7OH-+ 6H2O=NH3+ 4Zn(OH)42-(4) Cr(OH)4-+ H2O2→CrO42-3×) H2O2+ 2e-=2OH-4×) Cr(OH)4-+ 4OH-=CrO42-+ 4H2O+3e-2Cr(OH)4-+ 3H2O2+2OH-=2CrO42-+8H2O(5) Hg+ NO3-+ H+→Hg22++ NO2×) NO3-+4H++3e-=NO+2H2O3×) 2 Hg =2Hg22++2e-6Hg+ 2NO3-+ 8H+=3Hg22++ 2NO+4H2O8.4 .将下列反应设计成原电池,用标准电极电势判断标准状态下电池的正极和负极,电子传递的方向,正极和负极的电极反应,电池的电动势,写出电池符号。
《无机及分析化学》第八章课后题答案

第八章思考题与习题参考答案一、选择题1. 在给出的4个选项中,请选出1个正确答案。
(1)已知sp K (AB)=4.0×10-10;sp K (A 2B)=3.2×10-11,则两者在水中的溶解度关系为( A )A. S (AB )< S (A 2B ) B. S (AB )>S (A 2B )C. S (AB )=S (A 2 B )D. 不能确定不能确定 (2)Mg (OH )2沉淀在下列溶液中溶解度最大的是( B ) A. 纯水纯水 B. 在0.1mol ·L -1 HCl 中C. 在0.1mol ·L -1 NH 4Cl 中D. 在0.1mol ·L -1 Mg Cl 2 中(3)莫尔法测定Cl -和Ag +时,所用滴定剂分别为( B ) A. AgNO 3,Na Cl B. AgNO 3,AgNO 3C. AgNO 3,KSCN D. AgNO 3,NH 4SCN (4)用佛尔哈德法测定溶液中Cl -时,所选用的指示剂为( D ) A. K 2CrO 4 B. 荧光黄荧光黄 C. 曙红曙红 D. 铁铵矾铁铵矾(5) 佛尔哈德法测定Cl -时,溶液中没加有机溶剂,在滴定过程中使结果( A ) A. 偏低偏低 B.偏高偏高 C.无影响无影响 D. 正负误差不定正负误差不定 二、填空题2.相同温度下,HAc 在N a Ac 溶液中的解离度小于纯水中的解离度,CaCO 3在Na 2CO 3溶液中的溶解度小于其在纯水中的溶解度,这种现象可用_同离子效应__来解释。
来解释。
3.分步沉淀的次序不仅与溶度积常数及沉淀的 类型类型 有关,而且还与溶液中相应离子相应离子 浓度浓度 有关。
; 4.BaSO 4和Mg(OH)2的θsp K 分别为1.1×10-10和5.6×10-12,两者在水中溶解度为 1.05×1.05×1010-5 , 1.1×1.1×1010-4 。
无机及分析化学第八章答案
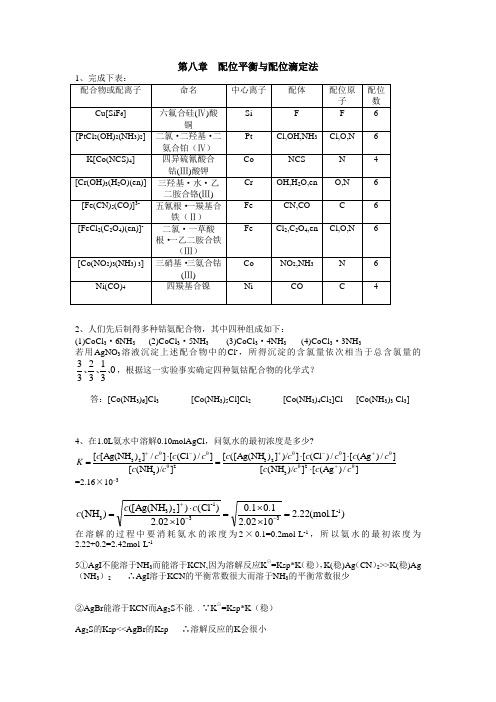
第八章 配位平衡与配位滴定法2、人们先后制得多种钴氨配合物,其中四种组成如下:(1)CoCl 3·6NH 3 (2)CoCl 3·5NH 3 (3)CoCl 3·4NH 3 (4)CoCl 3·3NH 3若用AgNO 3溶液沉淀上述配合物中的Cl -,所得沉淀的含氯量依次相当于总含氯量的0313233、、、,根据这一实验事实确定四种氨钴配合物的化学式?答:[Co(NH 3)6]Cl 3 [Co(NH 3)5Cl]Cl 2 [Co(NH 3)4Cl 2]Cl [Co(NH 3)3 Cl 3]4、在1.0L 氨水中溶解0.10molAgCl ,问氨水的最初浓度是多少?=2.16×10–3)mol.L (22.21002.21.01.01002.2)(Cl )])[Ag(NH ()(NH 1-33-1233=⨯⨯=⨯⋅=--+c c c 在溶解的过程中要消耗氨水的浓度为2×0.1=0.2mol·L -1,所以氨水的最初浓度为 2.22+0.2=2.42mol·L -15①AgI 不能溶于NH 3而能溶于KCN,因为溶解反应K ⊙=Ksp*K (稳),K(稳)Ag (CN )2>>K(稳)Ag (NH 3)2 ∴AgI 溶于KCN 的平衡常数很大而溶于NH 3的平衡常数很少②AgBr 能溶于KCN 而Ag 2S 不能,,∵K ⊙=Ksp*K (稳)Ag 2S 的Ksp<<AgBr 的Ksp ∴溶解反应的K 会很小]/)Ag ([])/(NH []/)Ag ([]/)Cl ([])/])([Ag(NH [])/(NH []/)Cl ([]/])Ag(NH [[θ2θ3θθθ232θ3θθ23c c c c c c c c c c c c c c c c K ++-+-+⋅⋅⋅=⋅=③Fe 与SCN -会生成血红色的配合物 ④略6、0. l0mol ∙L -1的AgNO 3溶液50mL ,加密度为0.932g ∙ mL -1含NH 3 18.24%的氨水30mL ,加水稀释到100mL ,求算这溶液中的Ag +浓度。
无机及分析化学第八章答案

第八章 思考题与习题8-2 判断题 (1)√ (2)× (3)√8-3 填空题(1)1.51 ,1.509,MnO 42-,Mn 3+ ; (4) 0.86±0.0592/2;(5) 5.6×104 ; (6) 高锰酸钾, 重铬酸钾, 碘量 ;(7) H 2SO 4 ,Mn 2+ , 75~85 , 自身指示剂 , 无, 红。
8-4 选择题1 A ;2 B ;3 B ;4 A ;5 B ;6 B ;7 D ; 8 D ; 9 C ; 10 C ; 11 B ; 12 D.8-5用离子电子法配平下列电极反应解 (1)MnO -4+ 2H 2O + 3e = MnO 2 +4OH - (碱性介质)(2)CrO -24+ 4H 2O + 3e = Cr(OH)3 + 5OH - (碱性介质)(3)H 2O 2+ 2H + + 2e = 2H 2O (酸性介质)(4)H 3AsO 4+ 2H + + 2e = H 3AsO 3 + H 2O (酸性介质)(5)O 2+ 2H + + 2e = H 2O 2(aq) (酸性介质)8-6计算题1.解 :(1)查表:φθ(Cl 2/Cl -)=1.358、φθ(Br 2/ Br -)=1.066、φθ(I 2/ I -)=0.536、φθ(Fe 3+/Fe 2+)=0.771、φθ(MnO 4-/Mn 2+)=1.5072解:(1) 电极反应: (+):MnO 2 + 4H + + 2e -=Mn 2+ + 2H 2O ( -):Cl 2 + 2e -= 2Cl - 或 2Cl - - 2e= Cl 2如果设计成原电池,则原电池符号为:(-)Pt | Cl 2(p 1)| Cl - (c 1)|| Mn 2+ (c 2) , H +(c 3)| MnO 2 | Pt (+)(2) 查表得:φθ(MnO 2/Mn 2+)=1.22V φθ(Cl 2/Cl -)=1.36V ,εө=φθ(MnO 2/Mn 2+)-φθ(Cl 2/Cl -)=1.22-1.36= -0.14<0,在标态下该反应不能正向自发进行。
江苏师范大学《无机化学》习题库及答案第八章 原子结构

第八章原子结构一、选择题(每题3分,共30分)1. 第四周期元素原子中未成对电子数最多可达(A)4个(B)5个(C)6个(D)7个2. 下列元素中,原子半径最接近的一组是(A)Ne,Ar,Kr,Xe;(B)Mg,Ca,Sr,Ba;(B)B,C,N,O;(D)Cr,Mn,Fe,Co。
3. 下列基态原子的电子构型中,正确的是(A)3d94s2(B)3d44s2(C)4d105s0(D)4d85s24. 具有下列电子构型的元素中,第一电离能最小的是(A)n s2n p3(B)n s2n p4(C)n s2n p5(D)n s2n p65.镧系收缩使下列各对元素中性质相似的是(A)Mn和Tc (B)Ru和Rh (C)Nd和Ta (D)Zr和Hf6. 氢原子的3d和4s能级的能量高低是:(A)3d > 4s(B)3d < 4s(C)3d = 4s(D)无3d,4s轨道,无所谓能量高低7. 下列各组元素按电负性大小排列正确的是(A)F>N>O(B)O>Cl>F(C)As>P>H(D)Cl>S>As8. 下列各对元素中,第一电子亲和能大小排列正确的是(A)O>S(B)F<C(C)Cl>Br(D)Si<P9. P区元素的电子排布特征结构是:(A) np6(B) ns2 np1~ 6(C) ns2(n-1)p6(D) ns2(n-1)d10np610、下面是一些电子的量子数,能量最高的电子是:(A) 3,0,0,–1/2(B)3,2,0,+1/2(C) 4,0,0,–1/2(D)3,1,–1,–1/2二、填空题(每空1分,共25分)1. 4P亚层中轨道的主量子数为,角量子数为,该亚层的轨道最多可以有种空间取向,最多可容纳个电子。
2. 周期表中最活泼的金属为,最活泼的非金属为。
3. 某元素基态原子失去3个电子后,3d轨道半充满,其原子序数为。
它在第周期,族,属于区元素。
4. 核外电子排布的三原则是;;。
大学无机化学第八章试题及答案解析

第八章 沉淀溶解平衡各小节目标:第一节:溶度积常数1;了解溶度积常数及其表达式,溶度积和溶解度的关系。
2:学会用溶度积原理来判断沉淀是产生、溶解还是处于平衡状态(饱和溶液),3:大致了解盐效应和同离子效应对溶解度的影响。
第二节:沉淀生成的计算利用溶度积原理掌握沉淀生成的有关计算。
(SP Q K θ>将有沉淀生成)第三节:沉淀的溶解和转化1:利用溶度积原理掌握沉淀溶解和转化的计算(SP Q K θ<沉淀溶解)2:可以判断溶液中哪种物质先沉淀。
用KSP 的表达式,计算溶液中相关离子的浓度。
习题一 选择题1. Ag 3PO 4在0.1 mol/L 的Na 3 PO 4溶液中的溶解度为( )(《无机化学例题与习题》吉大版)(已知Ag 3PO 4的K 0sp = 8.9×10-17)A. 7.16×10-5B.5.7×10-6C. 3.2×10-6D. 1.7×10-62.已知Sr 3(PO 4)2的溶解度为1.7×10-6 mol/L ,则该化合物的容度积常数为( )(《无机化学例题与习题》吉大版)A. 1.0×10-30B. 1.1×10-28C. 5.0×10-30D. 1.0×10-123.已知Zn (OH )2的容度积常数为3.0×10-17,则Zn (OH )2在水中的容度积为( )(《无机化学例题与习题》吉大版)A. 2.0×10-6mol/LB. 3.1×10-6 mol/LC. 2.0×10-9 mol/LD. 3.1×10-9 mol/L4.已知Mg(OH)2的K0sp =5.6×10-12,则其饱和溶液的pH为()(《无机化学例题与习题》吉大版)A. 3.65 B3.95 C. 10.05 D. 10.355.下列化合物中,在氨水中溶解度最小的是()(《无机化学例题与习题》吉大版)A. Ag3PO4B. AgClC. Ag BrD. AgI6.CaCO3在相同浓度的下列溶液中溶解度最大的是()(《无机化学例题与习题》吉大版)A. NH4AcB. CaCl2C. NH4ClD. Na2CO37.难溶盐Ca3(PO4)2在a mol/L Na3 PO4溶液中的溶解度s与容度积K0sp关系式中正确的是()(《无机化学例题与习题》吉大版)A. K0sp =108s5B. K0sp =(3s)3 +(2s + a)2C. K0sp = s5D. s3·(s + a)28.下列难溶盐的饱和溶液中,Ag+浓度最大和最小的一组是()(《无机化学例题与习题》吉大版)A. Ag2CrO4和AgClB. Ag2CrO4和AgSCNC. AgSCN和Ag2C2O4D. Ag2C2O4和AgSCN9. AgCl和Ag2CrO4的容度积分别为1.8×10-10和1.1×10-12,则下面叙述中正确的是()(《无机化学例题与习题》吉大版)A. AgCl与Ag2CrO4的容度积相等B. AgCl的容度积大于Ag2CrO4C. AgCl的容度积小于Ag2CrO4D. 都是难溶盐,容度积无意义10.BaSO4的相对分子质量为233,K0sp = 1.1×10-10,把1.0×10-3mol的BaSO4配成10dm3溶液,BaSO4未溶解的质量为()(《无机化学例题与习题》吉大版)A. 0.0021gB.0.021gC.0.21gD. 2.1g11.向Mg(OH)2饱和溶液中加入MgCl2,使Mg2+浓度为0.010mol/L,则该溶液的pH为()(已知Mg(OH)2的K0sp = 5.6×10-12)(《无机化学例题与习题》吉大版)A. 9.1B.9.4C. 8.4D. 4.612.在0.10 mol/LFe2+溶液中通入H2S至饱和(0.10 mol/L),欲使Fe2+不生成FeS 沉淀,溶液的pH应是()(已知FeS的K0sp =6.3×10-18;H2S的K0a1·K0a2 =1.4×10-20) (《无机化学例题与习题》吉大版)A. pH≥2.33B. pH≥3.53C. pH≤3.53D. pH≤2.3313.混合溶液中KCl,KBr,KSCN和K2CrO4浓度均为0.010 mol/L,向溶液中滴加0.010 mol/L AgNO3溶液时,最先和最后沉淀的是()(《无机化学例题与习题》吉大版)A. Ag2CrO4,AgClB. AgSCN ,AgClC. AgBr,Ag2CrO4D. AgCl,Ag2CrO414.下列叙述正确的是()(《无机化学例题与习题》吉大版)A.容度积大的难溶盐,其容度积肯定大B.向含AgCl固体的溶液中加入少量水,溶液达到平衡后,AgCl溶解度不变C.难溶电解质在纯水中溶解达到平衡时,其离子浓度的乘积为该物质的容度积D. AgCl的导电性弱,所以为弱电解质15.下列各对离子的混合溶液中均含有0.30 mol/L HCl,不能用H2S进行分离的是()(已知K0sp:PbS 8.0×10-28,Bi2S31.0×10-97,CuS 8.0×10-36,MnS 2.5×10-13,CdS 8.0×10-27,ZnS 2.5×10-22)(《无机化学例题与习题》吉大版)A.Cr3+,Pb2+B.Bi3+,Cu2+C. Mn2+,Cd2+D. Zn2+,Pb2+16.已知在Ca3(PO4)2的饱和溶液中,c (Ca2+)=2.0×10-6 mol•L-1, c (PO43-)=2.0×10-6 mol•L-1,则Ca(PO4)2的KӨSP为( )A.2.0×10-29B.3.2×10-12C.6.3×10-18D.5.1×10-2717.已知KӨsp(CaF2)=1.5×10-10, 在0.2501L mol•L-1的Ca(NO3)2溶液中能溶解CaF2( )A. 1.0×10-5gB. 3.8×10-4gC. 2.0×10-5gD. 1.0×10-4g18.已知KӨsp(Ag2SO4)=1.8×10-5, KӨsp(AgCl)=1.8×10-10, KӨsp(BaSO4)=1.8×10-10, 将等体积的0.0020 mol•L-1 Ag2SO4与2.0×10-6 mol•L-1的BaCl2的溶液混合,将会出现( )A. BaSO4沉淀B. AgCl 沉淀C. AgCl和BaSO4沉淀D.无沉淀19.下列有关分步沉淀的叙述中正确的是()A.溶度积小者一定先沉淀出来B.沉淀时所需沉淀试剂浓度小者先沉淀出来C.溶解度小的物质先沉淀出来D.被沉淀离子浓度大的先沉淀20.欲使CaCO3在水溶液中溶解度增大,可以采用的方法是().A.1.0mol•L-1 Na2CO3 B.加入2.0mol•L-1 NaOHC. 0.10mol•L-1CaCl2D.降低溶液的PH值21.向饱和AgCl溶液中加水,下列叙述中正确的是( )A. AgCl的溶解度增大 B .AgCl的溶解度、Ksp均不变C .AgCl的Ksp增大D .AgCl溶解度增大22.已知K(ZnS)=2×10-2 。
无机及分析化学第八章选择题及答案

无机及分析化学第八章选择题及答案16. Al3+与EDTA形成( C)A. 非计量化合物B. 夹心化合物C. 鳌合物D. 聚合物17. 下列几种物质中最稳定的是( A)A. [Co(en)3]Cl3B. [Co(NH3)6] (NO3)3C. [Co(NH3)6]Cl2D. Co(NO3)318. 下列配离子在强酸中能稳定存在的是(D)A. [Fe(C4)]3- B. [AlF6]3-C. [Mn(NH3)6]2+ D. [AgCl2]-13. AgNO3处理[Fe(H2O)5Cl]Br溶液,产生沉淀主要是 ( A)A. AgBrB. AgClC. AgBr和AgClD. Fe(OH)38. AgCl在1mol?L?1氨水中比在纯水中的溶解度大。
其原因是:( B )(A)盐效应(B)配位效应(C)酸效应(D)同离子效应10. 在下列浓度相同的溶液中,AgI具有最大溶解度的是:( D)A.NaCl B. AgNO3 C. NH3· HO D. KCN7. 下列物质,能在强酸中稳定存在的是 ( D )A. [Ag(S2O3)2]3- B. [Ni(NH3)6]2+C. [Fe(C2O4)3]3- D. [HgCl4]2-9. 用EDTA直接滴定有色金属离子,终点所呈现的颜色是:(D )A.指示剂-金属离子配合物的颜色 B. 游离指示剂的颜色C. EDTA-金属离配合物的颜色D. (B)和(C)的混合颜色8.下列说法何种错误(C )A.配合物的形成体(中心原子)大多是中性原子或带正电荷的离子。
B.螯合物以六员环、五员环较稳定。
C.配位数就是配位体的个数。
D.二乙二胺合铜(Ⅱ)离子比四氨合铜(Ⅱ)离子稳定。
14.在配位反应中,一种配离子可以转化成()配离子,即平衡向生成()的配离子方向移动。
( C)(A)不稳定的更难解离的(B)更稳定的更易解离的(C)更稳定的更难解离的(D)不稳定的更易解离的11、下列说法何种欠妥C(1)配合物的形成体(中心原子)大多是中性原子或带正电荷的离子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CdS的饱和溶液中有:[Cd2+][S2-]=Ksp(CdS) ∴ [Cd2+]=8.0×10-27/1.24×10-20=6.45×10-7(mol/L)
ቤተ መጻሕፍቲ ባይዱ
53解:(1) 酸性:HClO<HClO2<HClO3<HClO4. 因为中心离子从Cl(I),Cl(Ⅲ),Cl(Ⅴ)到Cl(Ⅶ)所带电荷依 次增加,半径依次减小,导致其Z/r值依次增大,而 Z/r值越大,酸性越强,所以它们的酸性依次增强。 (2) 酸性:H3PO4<H2SO4<HClO4.
因为中心离子从P(Ⅴ),S(Ⅵ)到Cl(Ⅶ)所带电荷依次增加, 半径依次减小,导致其Z/r值依次增大,而Z/r值越大, 酸性越强,所以它们的酸性依次增强。
(3) 酸性:HClO>HBrO>HIO。 因为中心离子所带电荷相同(均为+1),从Cl-I半径依次 增大,导致其Z/r值依次减小,所以酸性也依次减弱。
因平衡常数不是太大,说明上述反应可以向右进行,但 不是绝对控制步骤。而PbCO3的Ksp与Pb(OH)2的接近, 所以最终产物是碱式碳酸铅Pb2(OH)2CO3沉淀;
(3) 同理:反应 2Al3+ + 3CO32- + 6H2O == 2Al(OH)3 + 3H2CO3
[ H 2CO3 ]3 [ H 2CO3 ]3 [ H ]6 [OH ]6 K平 3 2 2 3 2 3 [ Al ] [CO3 ] [ Al 3 ]2 [CO3 ] [ H ]6 [OH ]6 (1014 )6 31 2 4 . 56 10 K sp ( K a! K a 2 )3 (1.3 10 33 ) 2 ( 4.2 10 7 5.6 1011 )3
6 KW
因平衡常数太大,说明上述反应向右进行彻底。即最终 产物为Al(OH)3沉淀和CO2气体。
20: (1)利用H3AsO4在强酸性条件下的氧化性,使 用KI-淀粉溶液做还原剂,在强酸条件下H3AsO4可以 反应产生I2,溶液变蓝。(如果用I2-OH-—淀粉液,蓝 色褪去,则H3AsO3反应)
(2)加BaCl2, 产生白色沉淀的是(NH4)2SO4,无现象 的是NH4Cl。
8题:(1)CF4因为分子结构高度对称,C-F键的键能大 ,且C的所有价轨道已用完,所以不水解;而BF3为缺电 子物质,B还有一条空的价轨道未使用,很容易接受OH 基提供的孤对电子,所以易水解,同理SiF4也易水解; (2)空气中的CO2进入试剂与Na2SiO3发生反应: Na2SiO3+CO2+H2O==H2SiO3+Na2CO3 生成的硅酸使溶 液变浑。 (3)主要是用金属或C还原后的产物会成为杂质,导致 硅和硼的纯度下降。 (4)Si单质因化学性质很稳定,遇硝酸会发生钝化而不 溶,当有HF存在时,因F-的配位性,能形成稳定的 SiF62-配离子,使Si可以溶解在HNO3+HF混合酸中。 3Si + 4HNO3 + 18HF == 3H2SiF6 + 4NO + 8H2O Si具有两性,可以与碱反应而溶解 。
(2) 达沉淀平衡时, 因CdS析出后会产生2×0.02 =0.04mol/L的H+, 而H2S解离出的H+可忽略,所以溶液
[H+]=0.30+0.04=0.34mol/L 由H2S的解离平衡可获得:
21 K K [ H S ] 1 . 43 10 20 [S 2 ] a1 a 2 2 2 1 . 24 10 [H ] 0.342
[ H 2CO3 ] [ H 2CO3 ][H ]2 [OH ]2 K平 2 2 2 [ Pb ][CO3 ] [ Pb2 ][CO3 ][H ]2 [OH ]2
2 KW
K sp K a! K a 2
(1014 ) 2 4 1 . 52 10 2.8 1016 4.2 10 7 5.6 1011
10(1)通过NaOH碱溶液,CO2被吸收
(2)同(1),也可用Ca(OH)2溶液吸收CO2
(3)把含杂质的气体通过装有连二亚硫酸钠(保险 粉)的玻璃管,O2被吸收,再通过无水CaCl2除去水。
(4)方法一:先用KMnO4溶液吸收SO2,再用醋 酸二氨亚铜溶液[Cu(NH3)2]Ac吸收CO,最后用浓 硫酸吸收水。方法二:用浓NaOH溶液吸收CO2,然 后酸化重新获得CO2气体。
第八章作业参考答案
6题:碳的价电子构型为2s22p2,可采取sp、sp2、 sp3三种杂化。因碳碳单键键能特别大(374 kJ· mol1),易形成同原子长链分子,构成种类繁多 的有机物。Si由于原子半径增大,不能形成稳定的 Si=Si双键,而以共价单键形成化合物,因较难自相 成键,所以其化合物的种类远不如碳。 由于在CO2中,通过大π键可以形成非常稳定的单 个CO2分子,所以其晶体归属于分子晶体,其熔点 低,导致在室温下为气体。而Si半径大,不能与O 形成大π键,导致单个的SiO2分子不能稳定存在, 为了分子的稳定,Si通过与O形成最多的Si-O键, 即以SiO4四面体为结构单元形成三维网状结构来达 到其稳定性,即成为原子晶体,所以其熔点非常高, 导致在常温下为固体。
(3)利用KNO2有还原性而KNO3无来进行区别,加 酸性KMnO4, 褪色的是KNO2,无现象的是KNO3。
(4)取四种溶液于四只试管中,向试管中加入酸性 KMnO4,溶液褪色说明该溶液是NO2-。另取余下三 种溶液加钼酸铵溶液,并加热,有黄色沉淀生成说明 是PO43-。另取剩下两种溶液加NaOH后用气室法检验, 产生的气体能使润湿的pH试纸变蓝,说明有碱性气体 产生,即存在NH4+。无任何现象的是NO3-。
14题: (1)反应: Ca2+ + CO32- + 2H2O == Ca(OH)2 + H2CO3
[ H 2CO3 ] [ H 2CO3 ][H ]2 [OH ]2 K平 2 2 2 [Ca ][CO3 ] [Ca 2 ][CO3 ][H ]2 [OH ]2
2 KW
K sp K a!K a 2
(1014 ) 2 7 7 . 7 10 5.5 10 6 4.2 10 7 5.6 1011
因平衡常数太小,说明上述反应难向右进行。即不能 形成Ca(OH)2沉淀,只能是CaCO3沉淀; (2) 同理:反应: Pb2+ + CO32- + 2H2O == Pb(OH)2 + H2CO3
(2) 因在酸性溶液中H2S与Fe3+会发生氧化还原反应:
40 解:以半电池I2/I-为正极,S4O62-/S2O32-为负极, 组成原电池,则总反应为:
I2 + 2S2O32- == 2I- + S4O62其平衡常数:
n[ E () E ()] 2 (0.535 0.09) lg K 15.03 0.0592 0.0592
K=1.08×1015
41解:已知[H+]=0.30mol/L;[Zn2+]=0.010mol/L; [Cd2+]=0.020mol/L; [H2S]=0.1mol/L (1) 设体系中的[S2-]=xmol/L.对于平衡: H2S == 2H+ S2-
0.1-x
0.30
x
代入平衡常数表达式: 2 2 2 [ H ] [ S ] 0 . 30 x K a1 K a 2 1.43 1020 [H 2 S ] 0.10 x x=[S2-]=1.59×10-20(mol/L) 对于CdS,其Q=0.020×1.59×10-20=3.18×10-21>Ksp 所以有CdS沉淀析出。 对于ZnS,其Q=0.010×1.59×10-20=1.59×10-22<Ksp 所以没有ZnS沉淀析出。
32解:(1) 因为在水溶液中,Cr2S3或Al2S3会发生完 全水解: Cr2S3 + 6H2O == 2Cr(OH)3 + 3H2S Al2S3 + 6H2O == 2Al(OH)3 + 3H2S H2S + 2Fe3+ == 2Fe2+ + S + 2H+ (3) 由于生成的MnS会溶于反应产生的H+中,得不到 MnS沉淀。如果溶液中含有氨水,反应产生的H+被 氨水中和,使体系保持中性或碱性,则MnS可沉淀 析出。
55解:(1)加稀HCl。 产生淡黄色沉淀和能使润湿的醋酸铅试纸 变黑的气体的是Sx2-; 产生淡黄色沉淀和能使润湿的红色布条褪 色的气体的是S2O32-; 产生能使润湿的红色布条褪色的气体的是 SO32-;
无任何现象的是SO42-。
(2)加KI-淀粉溶液,溶液变为蓝色的是 ClO-, 无任何现象的是ClO3-。
