测定试剂盒分析性能评估文件
分析性能评估资料——批间精密度

分析性能评估资料——批间精密度
1设计要求
变异系数(CV )应不大于15%。
2试验方法
用3个不同批号试剂盒,在试剂盒的剂量-反应曲线范围内,设置2个不同浓度的质控品,分别重复测定10次,计算测定结果的平均值(x )和标准差(s ),根据公式(3)得出变异系数CV ,结果应符合1的要求。
(57)
式中:
CV ——变异系数;
s ——30次测量结果的标准差;
x ——30次测量结果的平均值。
3试验结果(单位:.............)
%100/s CV ⨯=x
4试验结论
试验结果显示,三个生产批次的试剂盒在试验机型1、试验机型2及试验机型3三种全自动化学发光免疫分析仪上进行批间精密度评价,性能均能达到设计要求。
体外诊断试剂研制常用技术指标之分析性能评估

1 定量标记免疫分析方法分析性能评估的主要指标1.1 灵敏度1.1.1 分析灵敏度:试剂盒的灵敏度即最低检出量是指在统计学意义上能与零剂量区别的量。
一般用95%可信限计算:重复测定零剂量点(n≥10),计算反应量的均(x_)和标准差(SD),以x_+2SD(夹心法试剂盒)或均值x_-2SD(竞争抑制法试剂盒)的反应量计算出相应的浓度,即为该试剂盒的分析灵敏度,这是我们医疗器械注册资料所需提供的内容。
1.1.2 功能灵敏度:将低值样本倍比稀释后重复测定(n≥10),计算反应量的变异系数(CV%),CV%大于20%时所对应的剂量点,即为该试剂盒的功能灵敏度。
1.2 特异性诚如我们所认识到的,标记免疫分析是特定抗体对特定抗原的特异识别。
不同来源的抗体与结构类似物结合从而产生交叉反应是客观存在的,因此特异性检验是正确认识该试剂盒对结构类似物抗干扰能力的指标。
特异性检验通常有两种标定方法:1.2.1 交叉反应率:一定浓度的结构类似物在本试剂盒上的测定结果(物质的量)与该类似物的量的比值的百分率。
如:1 000 pmol/L的结构类似物,在某试剂盒上测定结果是5 pmol/L,其交叉反应率=5 pmol/L/ 1 000 pmol/L * 100%=0.5%。
1.2.2 实际测量值:对于不能用物质的量表示的被测物,如糖蛋白激素FSH、LH、TSH 和HCG,这4种激素具有相同的α亚单位,仅仅是α亚单位上部分氨基酸不同,实际操作中很容易产生交叉反应,而这4种激素又分别有各自的同形异构物,其量的表达方法还不能用物质的量(mol/L,ng/mL)表示,而只能借助于生物测定的活性单位(IU/L,mIU/L)表示,而每一种激素的活性单位(IU)又有完全不同的生物学意义,相互之间没有任何关联,即并且每一种激素定义的单位意义完全不同,不同来源相同质量的某一种激素的活性单位也不同,它们之间的交叉反应绝对不能用交叉反应率表示,因此往往选择实测值表示。
D-二聚体胶体金免疫层析法定量检测试剂盒性能评价

系数(相C对V%偏)差。(%)= x − X ×100 X
CV % = SD X
(3)
1.3.6 干扰实验
随机抽取同一批号 8 人份试剂,分别用 200 mg/L
胆红素、2 500 mg/L 胆固醇、2 500 mg/L 血红蛋白干
扰物质及 5 份健康人血浆,各检测 1 次,用紫外分光
每个浓度各检测 3 次,共 3 个批次 15 人份检测试剂盒,
读数,取平均值。以测定平均浓度值为 X 轴,理论浓
度值为 Y 轴,进行线性方程拟合,计算相关系数 R。
1.3.4 准确度
随机抽取同一批号的 5 人份试剂,用 D- 二聚体
纯品配制成浓度为 1.0 μg/mL 的样本进行检测,用紫
∑ 外分光光度计(分Xi别- X进)行2 读数,计算读数的平均值,按
关键词:D- 二聚体;胶体金免疫层析法;性能评价
中图分类号:Q503 文献标识码:A
Performance Evaluation of D-dimer Colloidal Gold Immunochromatography Quantitative Detection Kit
WANG Xiaoli, LI Lin (Shanghai Chemtron Biotech Co., Ltd., Shanghai 201318)
光度计分别进行读数,判断 D- 二聚体试剂盒的检测
是否会受到以上 8 种物质的干扰。
1.3.7 对比实验
对每份样本均用本试剂盒和本仪器系统与对
比南京基蛋的 D- 二聚体检测试剂盒(胶体金法)及
FIA8000 免疫定量分析仪试剂 - 仪器系统平行进行
核酸提取仪验证(模板XX人民医院)
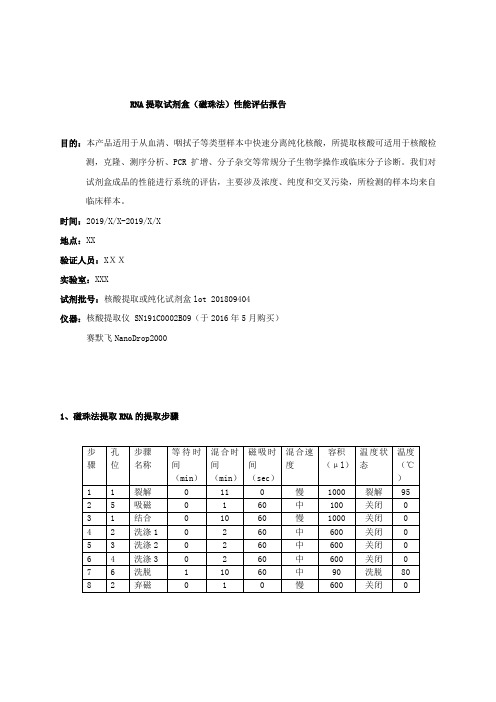
RNA提取试剂盒(磁珠法)性能评估报告目的:本产品适用于从血清、咽拭子等类型样本中快速分离纯化核酸,所提取核酸可适用于核酸检测,克隆、测序分析、PCR扩增、分子杂交等常规分子生物学操作或临床分子诊断。
我们对试剂盒成品的性能进行系统的评估,主要涉及浓度、纯度和交叉污染,所检测的样本均来自临床样本。
时间:2019/X/X-2019/X/X地点:XX验证人员:XXX实验室:XXX试剂批号:核酸提取或纯化试剂盒lot 201809404仪器:核酸提取仪 SN191C0002B09(于2016年5月购买)赛默飞NanoDrop20001、磁珠法提取RNA的提取步骤2、磁珠法提取RNA的交叉污染评估取临床检测为HCV阳性的16例血清样本以及生理盐水,分别标记为HCV+和HCV-,在96孔试剂板中的加样顺序设置为HCV+和HCV-间隔排列,每个样本进行16次重复,使用NanoDrop2000进行检测核酸浓度和纯度,测试RNA在核酸提纯仪的提纯过程中是否存在交叉污染,浓度为10Ng/ul 以下,结果为阴性。
检测结果如下所示:表1结果分析:NanoDrop2000检测结果如表1所示,16例HCV+样本的检测均为阳性,HCV-阴性样本均检测为阴性,表明RNA在核酸提纯仪中提取时不存在交叉污染,磁珠法RNA提取试剂盒和核酸提纯仪具有较好的抗交叉污染性能。
3、磁珠法提取RNA的浓度、纯度评估取临床检测为HCV阳性的32例血清样本,分别标记为1至32号,在96孔试剂板中的加样,使用赛默飞nano2000进行检测核酸浓度和纯度,检测结果如下所示:表2结果分析:NanoDrop2000检测结果如表2所示,32个样本的提取产物浓度均大于50 ng/µl,A260/A280在1.8至2.0之间,表明磁珠法提取的基因组核酸浓度、纯度均能满足生物学操作和临床诊断需要。
临床生化检验试剂盒性能评价试验线性范围试验

临床生化检验试剂盒性能评价试验线性范围试验线性范围是指在一定的浓度范围内,检测结果与样本浓度之间呈线性关系的范围。
线性范围试验的目的是确定试剂盒的线性范围及其上下限。
线性范围的确定对于准确测量样品浓度非常重要,因为如果超出了线性范围,测量结果将不准确。
试验前需要准备一系列不同浓度的样品,通常使用稀释法制作。
然后依次使用这些样品进行检测,记录每个样品的测量结果。
在绘制一个标准曲线时,可以将样品的测量结果作为纵坐标,样品的浓度作为横坐标,在纸上标出一系列点,并通过这些点拟合一条直线。
这条直线称为标准曲线。
标准曲线的斜率和截距可以反映试剂盒的灵敏度和误差。
斜率表示单位浓度变化时,测量值的变化情况,斜率越大,灵敏度越高。
截距表示零浓度时的测量值,截距越小越接近零浓度。
通过分析标准曲线的相关系数可以评估试剂盒的线性程度。
相关系数越接近1,线性程度越好。
一般认为,相关系数超过0.99,即可认为试剂盒满足线性要求。
在进行线性范围试验时需要注意以下几个方面:1.样品浓度的选择:应根据所测定物质的生理浓度范围来选择样品浓度,以保证测试的实用性。
2.样品的制备与存储:样品的制备应精确控制,避免因稀释或浓缩不准确而影响试验结果。
样品的存储应避免长时间曝光于大气中,以免发生化学反应导致样品浓度的变化。
3.试剂盒的选择:应根据所测定物质的特性和预期的分析结果,选择适宜的试剂盒进行测试。
4.试剂盒的操作:应按照试剂盒说明书的要求进行操作,严格控制操作步骤和时间,以减少试验误差产生的可能性。
5.数据处理和分析:应根据所测定物质的特性和测量结果,采用适当的统计方法进行数据处理和分析,并在数据分析报告中详细说明试验设计、方法和结果。
通过进行线性范围试验,可以确定试剂盒的线性范围及其上下限,为临床生化检验提供可靠的测试数据,为临床诊断提供准确的参考依据。
同时,线性范围试验还可以评估试剂盒的稳定性和重复性,为试剂盒的质量控制提供参考依据。
定性检测体外诊断试剂分析性能评估注册审查指导原则

定性检测体外诊断试剂分析性能评估注册审查指导原则目录一、内容概要 (1)二、适用范围 (1)1. 产品范围 (2)2. 应用领域 (3)三、基本要求 (4)1. 产品概述 (5)2. 技术要求 (6)3. 验证与确认 (8)4. 质量控制 (10)四、分析性能评估 (11)1. 基本原理 (12)2. 试验方法 (14)3. 结果判定 (16)4. 评估标准 (17)五、注册审查要点 (18)1. 申报资料要求 (19)2. 审查流程 (19)3. 审查重点 (21)一、内容概要本指导原则旨在规范和指导定性检测体外诊断试剂的分析性能评估,确保其在实际应用中的准确性和可靠性。
该指导原则涵盖了体外诊断试剂的基本要求、分析性能评估的关键要素、实验方法的选择与设计、以及评估报告的撰写等方面。
在体外诊断试剂的分析性能评估中,应充分考虑试剂的特异性、灵敏度、稳定性、可重复性等关键指标。
还应关注试剂在不同样本类型中的表现,以确保其在实际临床应用中的广泛适用性。
本指导原则强调,体外诊断试剂的分析性能评估应基于严格的实验设计和数据分析,确保评估结果的客观性和准确性。
还应对评估过程中发现的问题进行及时的跟踪和整改,以提高试剂的整体质量水平。
本指导原则旨在为定性检测体外诊断试剂的研发、注册和临床应用提供有力的技术支撑,确保其在疾病诊断和治疗中发挥最大的价值。
二、适用范围本指导原则适用于定性检测体外诊断试剂的分析性能评估注册审查。
定性检测体外诊断试剂主要包括免疫组化染色试剂、荧光定量PCR试剂盒、酶联免疫吸附试验(ELISA)试剂盒等。
本指导原则旨在为申请人提供科学、全面的分析性能评估指导,确保体外诊断试剂在注册审查过程中满足相关法规和标准要求。
本指导原则不涉及具体试剂产品的详细技术要求,但提供了评估体外诊断试剂分析性能的一般性原则和方法。
对于特定类型或特定产品的分析性能评估,应参考相关的国际标准、国家标准或行业规范。
试剂性能验证方案

准确度验证
总结词:准确度是衡量试剂性能的重 要指标,通过比较实际值与测量值之
间的差异来评估。
详细描述
1. 选择代表性样品,确保样品浓度符 合试剂盒的检测范围。
2. 根据试剂盒说明书进行操作,并记 录测量结果。
3. 将实际值与测量值进行比较,计算 偏差。
4. 分析偏差是否在可接受范围内,如 不在,需改进试剂性能。
3. 分析检测结果的变化是否在可接受范 围内,如不在,需改进试剂性能。
2. 在不同时间点(如0h、2h、4h等) 重复测量,观察检测结果的变化趋势。
详细描述
1. 选择代表性样品,按照试剂盒说明书 进行操作,并记录检测结果。
特异性验证
总结词:特异性是指试剂对目标分析物的识别能力,通过 比较不同样品之间的检测结果来评估。
精密度验证
详细描述
总结词:精密度是指测量结 果的重复性,通过多次重复
测量来评估。
01
02
03
1. 选择代表性样品,进行重 复测量,记录测量结果。
2. 分析测量结果的标准差, 判断重复性是否符合要求。
04
05
3. 如重复性不符合要求,需 改进试剂性能。
稳定性验证
总结词:稳定性是指试剂在特定条件下 的稳定性,通过观察检测结果随时间的 变化来评估。
加强数据处理能力,提高数据分析的深度 和精度,以便更准确地评估试剂性能。
拓展实验范围
建立数据库
在本次验证实验的基础上,可以进一步拓 展实验范围,研究更多方面的试剂性能, 为试剂的全面评估提供更多依据。
建议建立类似试剂性能验证的数据库,以 便于比较和分析不同试剂的性能差异,为 后续试剂选择提供参考。
THANKS
体外诊断试剂分析性能评估(与“样本”有关的文档共18张)

第七页,共18页。
不同层次的分析间精密度的意义不 尽相同, 在评价试剂盒质量时应引起质 量控制工作者的足够认识。评价分析间 精密度时, 同一样本 (如:质控血清)
在上述条件下重复测定 (一般n≥10), 测 定结果的变异系数 (CV%) 应不高于 15.0%。
第八页,共18页。
=103%
(二)回收实验的评估及数据处理方法
• 准确度 (二)回收实验的评估及数据处理方法
(1)加入体积:加入的待测物标准液体积一般在样本体积的10%以内,如果高浓度的待测物标准液不易得到, 加入体积亦不得超过原样本体积
• 精密度 的20%。
(6)计算比例系统误差:
回收率2=
=99%
• 干扰试验 (2)加入的溶剂应不影响对待测物的测定。
回收率n =
第十一页,共18页。
(3)计算平均回收率:
平均回收率 =
(4)计算每个样本回收率与平均回收率的差值: 每个样本回收率与平均回收率的差值=回收
率n-平均回收率 如差值超过±10%,应查找原因并纠正,重
新进行评估。 (5)计算比例系统误差:
比例系统误差 = |100% - 平均回收率|
第十二页,共18页。
准确度-回收实验
(一)回收实验的基本要求 1.操作者应熟悉待评价系统的操作。 2.编写系统标准操作规程,其中包括校准程序和室
内质控程序,采用合适的校准品、质控品并保持系统处 于正常状态。
3.待评价系统的处理。进行回收实验前,应该对 待评价系统进行初步评价,并且对待评价系统进行精 密度及线性评价(参考相关标准),只有在以上评价 完成并符合相关标准要求后,才可进行回收实验。
(6)结果评估: 结果至少应满足相关国际及国家标准,
