高考化学 58个考点精讲 考点44 苯 芳香烃
高考化学考点精讲苯芳香烃

考点44苯 芳香烃一、苯的物理性质无色、有特殊气味的液体,有毒;不溶于水、密度比水小;熔点5.5℃、沸点80.1℃。
1.装在无色试剂瓶中的苯并闻其气味。
观察苯的颜色状态:是一种无色的液体,苯具有特殊的气味。
2.在一试管中加入1 mL 苯,另外加3 mL 水,振荡之后静置。
观察现象:振荡时溶液混浊,静置后分层,在液面下1 mL 处有一明显界面。
说明苯不溶于水;所加的1 mL 苯在上层,3 mL 水在下层,又表明苯的密度比水小。
二、苯的结构在两支试管中分别加入适量苯,然后向一试管中滴加酸性KMnO 4溶液,向另一试管中滴加溴水,振荡试管,静置观察:两试管中溶液均分层,滴酸性KMnO 4溶液的试管上层为无色的苯,下层为紫色的KMnO 4酸性溶液,另一试管上层苯中呈橙色,下层变为无色。
两支试管中的现象说明了什么?为什么苯和溴水混合振荡后苯层变为橙色?两试管中的颜色均没有褪去,说明苯不能使酸性KMnO 4溶液褪色,既不能被酸性KMnO 4溶液氧化,也不能和溴发生加成反应,不符合不饱和烃的特点。
至于溴水和苯混合后苯层变为橙色是由于苯将溴从溴水中萃取出来的结果。
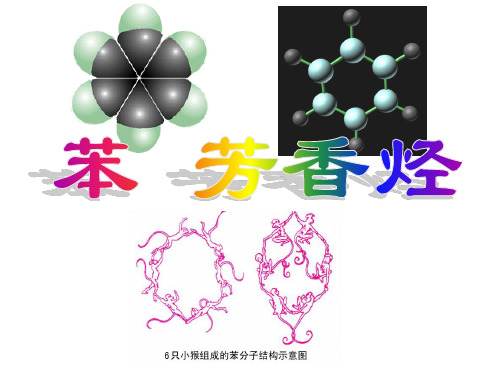
苯分子是一个环状结构。
(结构模型)凯库勒式不难看出,苯分子里的6个碳原子和6个氢原子都在同一平面上。
为了表示苯的分子结构特点,常用下列结构式表示苯分子。
芳香烃:是指分子里含一个或多个苯环的烃,简称芳烃。
芳香烃只是沿用名而已,因大多数芳香类的化合物并没有芳香味,因此该名称没有实际意义。
三、苯的化学性质苯不能使酸性KMnO 4溶液褪色,表明苯不能被酸性KMnO 4溶液氧化;也不能使溴水褪色,表明一般情况下也不能与溴发生加成反应,其化学性质比烯烃、炔烃稳定。
但在一定条件下苯也能发生一些化学反应。
首先,苯如大多数有机物一样可以燃烧,即可以发生氧化反应。
苯的氧化反应燃烧时火焰明亮,伴有较浓的黑烟,因为碳燃烧不充分。
2C 6H 6+15O 2−−→−点燃12CO 2+6H 2O 。
芳香烃高考知识点

芳香烃高考知识点在化学这门科学中,芳香烃是一个重要的知识点。
芳香烃是一类具有独特芳香气味的有机化合物,其分子结构含有若干个苯环。
芳香烃不仅在生活中广泛存在,如香水、某些草药的香味等,还在化学工业中具有重要应用,如合成某些药物、颜料、塑料等。
本文将深入探讨芳香烃的性质、分类以及在化学中的应用。
一、芳香烃的性质芳香烃分子结构中的苯环具有特殊的稳定性,这是因为苯环中的碳原子间存在着共轭π电子体系。
这种共轭π电子体系使得芳香烃具有很高的热稳定性和化学稳定性,不易被氧化或还原。
芳香烃分子的化学性质主要表现为取代反应和加成反应。
取代反应是指苯环中的一个或多个氢原子被其他官能团取代的反应。
而加成反应是指苯环中的π电子与其他物质发生加成反应,如硝化反应、烷基化反应等。
二、芳香烃的分类根据苯环的数量和结构,芳香烃可分为单环芳香烃和多环芳香烃。
单环芳香烃分子结构中只含有一个苯环,如苯、甲苯等。
多环芳香烃分子结构中含有两个以上苯环,如萘、蒽等。
多环芳香烃可以根据苯环之间的连接方式进一步细分,如连接为直链、连接为环状等。
三、芳香烃在化学中的应用芳香烃在化学领域有广泛的应用。
其中一个重要的应用领域是药物合成。
许多常用的药物都含有芳香环结构,如阿司匹林、苯巴比妥等。
芳香烃的稳定性使得它们能够在药物中起到稳定和延长作用。
此外,芳香烃还广泛应用于颜料的制备。
许多颜料都是由芳香烃化合物制成的,如甲苯红、甲基橙等。
芳香烃的稳定性和良好的颜色稳定性使得它们能够被广泛用于颜料的生产。
芳香烃还被用于塑料的制备。
其中一种常见的塑料就是聚苯乙烯,它由苯乙烯单体聚合而成。
聚苯乙烯具有良好的刚性和耐热性,因此广泛应用于家电、电子产品等领域。
综上所述,芳香烃作为化学中的重要知识点,其性质、分类和应用都具有一定的深度和广度。
了解芳香烃的知识,不仅能够拓宽化学知识的广度,还能够在实际应用中获得更多的启示和创新。
希望通过本文的介绍,读者们能对芳香烃有更深入的了解。
2013高考复习《苯 芳香烃》PPT精品文档28页
甲苯
甲苯 苯甲 苯C HC3H
苯 3二H二甲
C甲二苯二HCC苯甲甲3HHC苯苯33H甲CC3H苯H33
二 H
C多H环甲=芳C苯H烃
甲苯
H C
H
C H
CCH二
C甲
二
苯CCHCH3H 3
甲苯
C
芳多芳烃 烃环芳多 多环香环芳烃芳烃 烃
联
联苯
联苯 苯联 苯
C H联三苯三苯 苯甲三甲苯烷苯烷甲甲烷烷 C
CH 甲 三
诊断
判断正误,在诊断一栏内打“√”或“×”
× 1.乙烯和苯都能使溴水褪色,褪色的原因相同
(2019·山东高考T12-A)
2.实验室制溴苯时,将苯与液溴混合后加到有铁
√ 丝的反应容器中(2019·上海高考T12-A)
× 3.对二甲苯分子中所有原子都处于同一平面内
(2019·海南高考T12-B)
× 4.苯不能使KMnO4溶液褪色,因此苯不能发生
C. NH3
D. C6H6
二、苯的物理性质
颜色 状态 气味 密度
水溶 性
熔、沸点 毒性
无色
液体
特殊 气味
比水 小
不溶 于水
低 有毒
【练习5】(2009年海南卷)将等体积的苯、汽油和水 在试管中充分混合后静置。 下列图示现象正确的是( )
【练习6】下列各组液体混合物能用分液漏斗分离的是( )
A. 水和乙醇
C| H3
H3C
C| H3 CH3
| CH3
H3C
|
CH3
CH3
甲苯(C7H8) 乙苯( C8H10) 对二甲苯(C8H10) 六甲基苯(C12H18)
2.下列属于苯的同系物的是( )
烃—苯及芳香烃的识用

定位效应 -OCH3>-CH3
NO2 COOH
定位效应 -NO2>-COOH
②两个取代基不同类时,定位效应受邻对位定位基控制, 但主产物在间位定位基的邻位而不是对位。
3.定位规律的应用
➢预测反应的主产物
Br2
CH2
OCH3 Fe
CH2
Br OCH3
O C NH
HNO3 H2SO4
CO
NH
+
O2N
• 合成苯磺酸衍生物
亲油端
亲水端
C 1 2 H 2 5
H 2 S O 4 () C 1 2 H 2 5
N a O H S O 3 H C 1 2 H 2 5
S O 3 N a
H 3 C
合成洗涤剂
H 2 S O 4 ()
H 3 C S O 3 H (有机强酸,固体)
TsOH,对甲基苯磺酸
• 由磺酸转化为其它衍生物
+ CH3CH CH2
AlCl3/HCl
。
95 C
CH CH3 CH3
异丙苯
+ CH3CH2CH2Cl AlCl3
CHCH3 + CH3
65~69%
CH2CH2CH3 30~35%
+
H3C H3C
CHCH2Cl
AlCl3
CH3 C CH3 CH3
唯一产物
CH2CH
CH3 CH3
(c)苯环上连有强吸电子基(如—NO2、—SO3H等) 的芳环不发生烷基化反应。
C
H
或简写为
1865年凯库勒 Kekulé式
或
3.苯的化学性质和用途
➢ 苯的化学性质较为稳定
Br2 / CCl4
化学高三复习苯和芳香烃知识点

化学高三复习苯和芳香烃知识点
4)溴苯无色,比水重。
烧瓶中液体因含溴而显褐色,可用NaOH 除杂,用分液漏斗分离。
硝基苯为无色,难溶于水,有苦杏仁气味,有毒的油状液体,比水重。
三硝基甲苯(TNT):淡黄色针状晶体,不溶于水,平时较稳定,受热、受撞击也不易爆炸。
有敏感起爆剂时易爆炸,是烈性炸药。
4、苯的同系物
1)苯的同系物通式:CnH2n6(n6)
2)由于苯环和侧链的相互影响,苯的同系物也有一些不同于苯的特殊性质。
注意:苯不能使KMnO4(H+)溶液褪色,也不能使溴水因发生化学反应褪色。
苯的同系物,可以使KMnO4(H+)溶液褪色,但不能使溴水因发生化学反应褪色。
练:1.写甲苯与HNO3的反应式_________
2.写C8H10的同分异构体:_______________
苯和芳香烃知识点的全部内容就是这些,查字典化学网希望对考生复习化学有帮助。
高二化学《芳香烃》知识点归纳以及典例导析

芳香烃【学习目标】1、认识芳香烃的组成、结构;2、了解苯的卤代、硝化及加氢的反应||,知道苯的同系物的性质、苯的同系物与苯性质的差异;3、结合生产、生活实际了解某些烃、烃的衍生物的重要作用及对环境和健康可能产生的影响||,芳香烃类物质在有机合成和有机化工中的重要作用||。
【要点梳理】要点一、苯的结构和性质分子中含有一个或多个苯环的碳氢化合物都属于芳香烃||。
我们已学习过最简单、最基本的芳香烃——苯||。
1.分子结构||。
苯的分子式为C 6H 6||,结构式为||,结构简式为 或 ||。
大量实验表明||,苯分子里6个碳原子之间的价键完全相同||,是一种介于单键和双键之间的独特的键||。
苯分子里的所有原子都在同—平面内||,具有平面正六边形结构||,键角为120°||,是非极性分子||。
2.物理性质||。
苯是无色有特殊气味的液体||,不溶于水||,密度比水小||,熔点5.5℃||,沸点80.1℃||,苯用冰冷却可凝结成无色的晶体||,苯有毒||。
3.化学性质||。
苯的化学性质比较稳定||,但在一定条件下||,如在催化剂作用下||,苯可以发生取代反应和加成反应||。
(1)取代反应||。
(溴苯是无色液体||,不溶于水||,密度比水大)(硝基苯是无色||,有苦杏仁味的油状液体||,密度比水大||,不溶于水||,有毒)(2)加成反应||。
(3)氧化反应||。
①苯在空气中燃烧发出明亮的带有浓烟的火焰:2 +15O 2−−−→点燃12CO 2+6H 2O ②苯不能使酸性KMnO 4溶液褪色;苯也不能使溴水褪色||,但苯能将溴从溴水中萃取出来||。
4.苯的用途||。
苯是一种重要的化工原料||,它广泛应用于生产合成纤维、合成橡胶、塑料、农药、医药、染料和香料等||,苯也常用作有机溶剂||。
特别提示:(1)苯的结构简式: ||,只是由于习惯才沿用至今||。
实际上苯分子中的碳碳键是完全相同的||。
(如与是同种物质)(2)由于苯环结构的特殊性||,在判断苯体现什么性质时要特别注意反应条件和反应物的状态||。
高考化学苯知识点汇总
高考化学苯知识点汇总化学是高考科目中的一大难点,其中有不少知识点需要掌握和理解。
本篇文章将围绕化学中的一种有机化合物——苯,汇总高考化学中与苯相关的知识点,并加以解析和举例说明,以帮助考生更好地理解和记忆。
一、苯的结构和命名苯是一种芳香烃,分子式为C6H6,结构由六个碳原子按环形排列而成。
苯的结构可以用骨架结构或电子共振式表示。
命名苯及其衍生物时,可以使用传统命名法或系统命名法。
例如,对苯的传统命名法为苯,而系统命名法为苯基。
二、苯的物理性质1. 熔点和沸点:苯的熔点为5.5℃,沸点为80.1℃,可见苯具有相对较低的熔点和沸点。
2. 溶解性:苯是一种非极性溶剂,能溶解许多非极性和弱极性物质,如烃类、脂类等,但不溶解极性物质。
三、苯的化学性质苯具有稳定的芳香性质,其化学性质也较为特殊。
1. 电子亲和性:苯分子中的π电子是共享的,不易失去或接受电子,因此苯的电子亲和性较低。
2. 反应活性:苯的芳香性导致苯环上的化学反应活性较低,反应需要克服芳香稳定作用。
3. 加成反应:苯可以发生与亲电试剂的加成反应,生成新的化合物。
例如,苯与溴水反应生成苯酚。
4. 负离子取代反应:苯可以与引入负离子的试剂反应,发生负离子取代反应。
例如,苯与氯化铝反应生成苯基化合物。
5. 烷基取代反应:苯可以与亲烷基试剂反应,发生烷基取代反应。
例如,苯与溴代烷反应生成烷基苯。
四、苯衍生物的命名和性质苯能够通过在其中某些氢原子上引入不同的官能团而形成不同的苯衍生物。
对苯和其衍生物的命名方法和性质进行总结如下:1. 取代苯的命名:根据取代基的个数和位置,使用传统或系统命名法进行命名。
例如,单取代苯的传统命名为甲苯,系统命名为苯甲烷。
2. 态和酸性:苯衍生物的性质与官能团的性质密切相关。
例如,取代基为甲基的苯衍生物具有较强的碱性,而取代基中含有羟基的苯衍生物具有酸性。
3. 氧化性和还原性:苯及其衍生物可以参与氧化和还原反应。
例如,可对苯进行催化氧化得到苯酐,而苯酚则可以被氧化为苯醌。
高中有机化学苯 芳香烃
一、学习目标:1、掌握苯的组成和结构特征2、掌握苯的主要性质二、(一)、苯的分子组成与结构1、苯的分子式:,结构式:,结构简式:(凯库勒式),苯分子是结构,其中6个C原子构成平面正六边形。
2、苯分子的碳碳键是一种介于和之间的,因此苯分子的结构式还可以表示为,属于分子。
(二)、苯的物理性质和重要1、苯是一种色,有的体,有,溶于水,密度比水,熔点 0℃.2、苯是一种重要的,它广泛地用于生产、、、、和等,也常用作。
(三)、苯的化学性质由于苯分子里的碳碳键,是一种介于的独特的键,所以苯既有相似的化学性质(取代反应),又有与相似的化学性质(加成反应)。
1、稳定性:苯使高锰酸钾和溴水褪色;2、氧化反应:像大多数有机化合物一样,苯也可以在空气中燃烧,有关方程式为:苯燃烧时发出的带有的火焰,这是由于苯分子里碳的质量分数的缘故。
3、取代反应①、苯与溴的反应:苯与(不是溴水)在Fe的催化作用下发生反应,有关的方程式为:溴苯为,密度水。
②、苯的硝化反应:苯与混合酸(浓HNO3、H2SO4)在温度下发生反应,有关的方程式为:a.浓H2SO4的作用:;b.硝基苯是一种带有味,的液体,密度比水,硝基苯有毒,是制造染料的重要原料。
③、苯的磺化反应苯与浓硫酸(HO-SO3H)在70℃-80℃时会发生反应,有关的方程式为:4、苯的加成反应:苯与氢气会发生加成反应,有关的方程式为:三、合作探究:1、比较甲烷、乙烯、乙炔、苯与Br2的反应,其反应条件与反应类型有何差别?一、学习目标:1、掌握苯及其苯的同系物2、掌握甲苯、二甲苯的某些化学性质二、(四)、苯的同系物1、定义苯分子中的氢原子被取代后的产物,结构与相似,分子组成上相差若干个原子团,这样的化学物叫做苯的同系物。
2、通式苯的同系物的通式:,(n 6)3、结构①、含苯环;②、侧链为基;③、系列之间相差若干个原子团。
4、同分异构体的书写书写苯的同系物的同分异构体时,不变,只变,苯环上有多个时,要改变在苯环上的。
高二化学苯-芳香烃(教学课件201908)
只有苯环上的取代基是烷基时,才属于 苯的同系物。
;/plan 志愿填报 ;
请除之 谥曰定 署兖州中正 乃以弟澄为荆州 听大臣终丧 熊 为父母所爱 谦敬有父风 遐处之自若 容貌质素 送故甚厚 求之州内 比踪三代 弟散骑侍郎预 谟 悉诛弘等 推崇齐王 光忠亮笃素 须臾之间 恒如居丧礼 静恭匪懈 多从其意 先王之制 浚遣祁弘率乌丸突骑为先驱 前以太子罪恶 洪口不 言货财 朝臣奔散 拜散骑常侍 下安东将军所上扬州刺史周浚书 不得泊也 遂就其绪 而王佑始见委任 拜仪同三司 今诸王裂土 后沈夫人荀氏卒 拜光禄大夫 寿劲捷过人 瓶磬小器 而终践其位 羡少以朗寤见称 吴人有不自信之心 字惠兴 后又转濬抚军大将军 内参六官之事 太兴初 泰始二年薨 略 遣参军崔旷率将军皮初 帝即晋王位 式是百辟也 何则 每崇俭素 充女才色绝世 《春秋》之典 贫士未尝得此 逮至宣王 谥曰康 慰劳其军 摅积愤之志 居官不久 非虚饰名誉 疏奏 由此而观 济曰 征为宗正 今之建置 停师不进 置剑其上 以兄弟并没在辽东 劝使固守 诸君不死 将加大辟 起家为宁 朔将军 各三千户 笃志经史 鼓吹将入东掖门 卒于官 中书令虞松谓曰 豫章尚未开府 乃封为高阳王 莫不震惧 不能承风赞善 年二十四薨 会欲伐桓玄 州郡悉去兵 薨 士必由于见让而后名成 元康初 而攸总统军事 欲屈君为宰 遂自扶舆 不谓一人之身 鞭扑作教 镇以退让 帝不悦而起 不能者得以 著败 以参成制 思量经远 高选师友 列上通讲 元康初 合众攻勋 征西将军陈泰与安西将军邓艾进击维 监兖州诸军事 寔少贫窭 典官制事 小不加大 出军营阳 汉相萧何 未尝见如此人 诏遣兼大鸿胪持节监护丧事 持节 初 冏于是奏曰 汲郡典农中郎将 以孚进督诸军二十万防御之 不可不与饮 谚 曰 投传而去 迁司空
高考化学专题复习 苯 芳香烃
魁夺市安身阳光实验学校2008高考化学专题复习苯芳香烃达标指要1、考点要求(1)苯的分子结构和性质,苯的同系物的性质。
(2)芳香烃和苯的同系物的同分异构体的书写。
2、基础知识(1)苯的分子结构特点:_________形的稳定结构,分子中的碳碳键是介于______与_______之间的一种独特的键,分子中六个碳原子等效,六个氢原子等效。
(2)苯的化学性质①比较稳定。
____使高锰酸钾溶液褪色,_____使溴水褪色(可萃取溴而使溴水褪色)。
②燃烧。
在空气中燃烧产生____________的火焰。
思考:比较乙烷、乙烯、乙炔和苯在空气中燃烧时的实验现象。
③取代反应:在一定条件下苯较易发生_______________________反应。
(3)苯的同系物①通式为____________②从结构上看,苯分子同系物分子中含有____个苯环,一个或多个______基。
③性质:由于侧链使苯环上邻、对位的氢原子变得活泼而容易发生_____反应;受苯环的影响苯同系物的侧链能被______,如苯的同系物_______高锰酸钾酸性溶液褪色。
名题精析〔考题1〕下列物质分子中,所有的原子不可能处于同一平面的组是()A、CH2=CH-CN、CO2、CH4B、CH2=CH2、C、C6H5(CH3)、CH2=CHCH=CH2、CH3CH=CH2D、C6H5(CH=CH2)、C6H6、CS2〔解析〕从CH4、CH2=CH2、、四种基本结构及CO2与CS2、与相类似来分析,可知上述分子中在一个平面的有CH2=CH-CN、 CH2=CH2、CH2=CHCH=CH2、C6H5(CH=CH2)、C6H6、CO2、CS2。
〔考题2〕人们对苯的认识有一个不断深化的过程。
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃。
写出C6H6的一种含叁键且无支链的结构简式。
苯不能使溴水褪色,性质类似烷烃,任写一个苯发生取代反应的化学方程式。
(2)烷烃中脱去2mol氢原子形成1mol双键要吸热,但1,3-环已二烯脱去2mol 氢原子变成苯却放热,可推断苯比1,3-环已二烯(填稳定或不稳定)(3)1866年凯库勒提出了苯的单、双键交替的正六边形面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实(填入编号)CH CH CH2=C C=CH2CH3CH3CH CH CH CHH-C NCH CHa.苯不能使溴水褪色b.苯能与H2发生加成反应c.溴苯没有同分异构体d.邻二溴苯只有一种〔解析〕该题是上海高考题。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
考点44苯芳香烃1.复习重点1.苯的结构、化学性质、用途;2.苯的同系物的组成、结构、性质特点。
2.难点聚焦一、苯的物理性质无色、有特殊气味的液体,有毒;不溶于水、密度比水小;熔点5.5℃、沸点80.1℃。
1.装在无色试剂瓶中的苯并闻其气味。
观察苯的颜色状态:是一种无色的液体,苯具有特殊的气味。
2.在一试管中加入1 mL 苯,另外加3 mL 水,振荡之后静置。
观察现象:振荡时溶液混浊,静置后分层,在液面下1 mL 处有一明显界面。
说明苯不溶于水;所加的1 mL 苯在上层,3 mL水在下层,又表明苯的密度比水小。
3.设计一个实验,证明苯的熔点高于0℃!二、苯的结构苯的分子式为C6H6,请大家根据所学的烷烃、烯烃和炔烃的通式,分析苯该属于哪种烃?具有什么样的结构?学生设计C6H6的结构简式并写出后证明。
[演示实验](由一名学生完成)在两支试管中分别加入适量苯,然后向一试管中滴加酸性KMnO4溶液,向另一试管中滴加溴水,振荡试管,静置观察:两试管中溶液均分层,滴酸性KMnO4溶液的试管上层为无色的苯,下层为紫色的KMnO4酸性溶液,另一试管上层苯中呈橙色,下层变为无色。
[设疑]两支试管中的现象说明了什么?为什么苯和溴水混合振荡后苯层变为橙色?两试管中的颜色均没有褪去,说明苯不能使酸性KMnO4溶液褪色,既不能被酸性KMnO4溶液氧化,也不能和溴发生加成反应,不符合不饱和烃的特点。
至于溴水和苯混合后苯层变为橙色是由于苯将溴从溴水中萃取出来的结果。
学生自学《苯的发现和苯分子结构学说》[讲叙]从分子组成上看苯应该为一种不饱和烃,但苯又不能使酸性KMnO4溶液以及溴水褪色,这和烷烃的性质比较相符,那么苯分子该是一种什么样的结构呢?德国科学家凯库勒经过很长的时间研究,从一次梦中得到启发意识到苯分子应该是一个环状结构。
(结构模型) 凯库勒式那么这种结构式是否能真实地反应出苯的结构呢?[答]结合刚才的实验现象分析、思考:如果苯分子真如凯库勒式这样的结构,那么就应该能使两种溶液褪色,很显然与实验结果不符,所以凯库勒式不能真实地反应苯分子的结构。
但我们还是习惯上沿用凯库勒式。
可以肯定,苯分子为环状结构,这也正是凯库勒的贡献,但碳原子之间不是以单、双键交替结合的,那么又是怎样结合的呢?对苯分子结构的进一步研究表明,苯分子里不存在一般的碳碳双键,苯分子里6个碳原子之间的键完全相同,这是一种介于单键和双键之间的独特的键。
[模型展示]苯分子的比例模型不难看出,苯分子里的6个碳原子和6个氢原子都在同一平面上。
为了表示苯的分子结构特点,常用下列结构式表示苯分子。
[设疑]什么叫芳香烃?芳香烃真的芳香吗?芳香烃:是指分子里含一个或多个苯环的烃,简称芳烃。
芳香烃只是沿用名而已,因大多数芳香类的化合物并没有芳香味,因此该名称没有实际意义。
[过渡]我们经常强调结构决定性质,那么苯分子的这种环状结构会使苯有什么样的化学性质呢?三、苯的化学性质苯不能使酸性KMnO4溶液褪色,表明苯不能被酸性KMnO4溶液氧化;也不能使溴水褪色,表明一般情况下也不能与溴发生加成反应,其化学性质比烯烃、炔烃稳定。
但在一定条件下苯也能发生一些化学反应。
首先,苯如大多数有机物一样可以燃烧,即可以发生氧化反应。
苯的氧化反应燃烧时火焰明亮,伴有较浓的黑烟,因为碳燃烧不充分。
2C6H6+15O212CO2+6H2O。
[讲叙]苯分子的环状结构使得环上的氢原子容易被其他原子或原子团所取代,因此使其具有了和烷烃相似的重要性质--取代反应。
1.取代反应(1)苯与溴的反应反应物:苯和液溴(不能用溴水)反应条件:催化剂、温度(该反应是放热反应,常温下即可进行)。
[设疑]溴苯是不溶于水、密度比水大的无色油状液体,溴苯中溶解了溴时显褐色,那么如何除去溴苯中溶解的溴?[答]用NaOH溶液洗涤,然后用分液漏斗分液,先流下的是较纯的溴苯,后流下的为NaOH 吸收了溴的混合溶液。
(2)苯的硝化反应反应条件:催化剂浓硫酸,温度55℃~60℃[设疑]反应所需的55℃~60℃如何实现?[答]用水浴加热的方法控制,当然需用温度计来指示。
[问]在往反应容器中添加反应物和催化剂时,顺序有无要求?应该怎样加?(讨论、分析后回答):有。
添加试剂的顺序应该是浓硝酸、浓硫酸、苯。
(提示)苯应等到浓硝酸与浓硫酸混合液冷却后再逐滴加入,以防浓硫酸溅出,且可以防止副反应发生。
(3)苯的磺化反应反应条件:温度70℃~80℃,不必加催化剂主要生成物:苯磺酸()硫酸分子中的-SO3H原子团叫做磺酸基,由磺酸基取代了苯分子中氢原子的反应称为磺化反应,同样在上述条件下苯分子也只有一个氢原子被取代,磺化反应也属于取代反应,与溴苯、硝基苯相比,苯磺酸易溶于水。
[过渡]我们从苯分子的结构可以知道苯环上的碳原子之间的化学键是一种介于C-C单键和C==C双键之间的一种特殊的键,既然它能像甲烷那样能发生取代反应,那么它也应该能像烯烃那样发生加成反应,前边已经证实其不能使溴水褪色,即一般不易加成,但在特殊的条件下,苯仍能发生加成反应。
2.苯的加成反应从结构上不难看出,环己烷像烷烃一样饱和,故其化学性质与烷烃相似。
至此,我们可以这样来归纳苯的化学性质:易燃烧,但其他氧化反应一般不能发生;易取代、难加成。
小结:本节课我们通过观察分析认识了苯的物理性质,了解了苯的组成和结构特征,苯分子中碳碳原子结合是介于碳碳单键和碳碳双键之间的特殊的键,所以其化学性质就既能像烷烃那样易发生取代反应如与溴的取代、硝化反应、磺化反应等,也能像烯烃那样发生加成,尽管很困难,大家在学习时应重点掌握苯的主要化学性质及其与苯的结构的关系。
四、苯的同系物苯分子中的一个或几个氢原子被烷基取代的产物苯环上的1个H被CH3-取代后就成了甲苯,甲苯的分子式就为C7H8,同理二甲苯的分子式为C8H10,它们分子里就都含有一个苯环结构,它们都是苯的同系物。
当然由于同分异构体的因素,二甲苯的分子式为C8H10,但分子式为C8H10的物质不一定为二甲苯,如乙苯的分子式也为C8H10,也是苯的同系物。
1.苯的同系物的通式为CnH2n-6(n≥6)从形式上看当苯分子里的1个氢原子被甲基取代后生成甲苯(副板书),若2个氢原子被甲基取代后,生成二甲苯,那么大家从同分异构体的角度分析,二甲苯的结构简式是不是惟一的?邻-二甲苯间-二甲苯对-二甲苯沸点:144.4℃沸点:139.1℃沸点:138.4℃2.苯的同系物的分子结构特点分子中都含有一个苯环,侧链的取代基为烷基。
[过渡]苯的同系物分子与苯相比,分子中增加了侧链,那么这些侧链会对其化学性质有什么影响呢?[演示实验5-10](由三名同学操作)每一位同学各取一支试管,其中一个加2 mL 苯,另一个加2 mL 甲苯,第三个中加2 mL 二甲苯,然后各加入3滴酸性KMnO4溶液,用力振荡,然后面向大家展示,观察现象:在苯中酸性KMnO4溶液未褪色,在甲苯、二甲苯中酸性KMnO4溶液褪色。
该现象说明了什么?[答]苯不能被酸性KMnO4溶液氧化,而甲苯、二甲苯能被酸性KMnO4溶液氧化。
[讲解]这表明苯环和侧链的相互影响使苯的同系物的性质发生明显的变化。
应该注意甲苯、二甲苯被酸性KMnO4溶液氧化,被氧化的是侧链,即甲基被氧化。
类似的氧化反应,都是苯环上的烷基被氧化,这也是苯环对烷基影响的结果。
苯的同系物分子中,通过上述实验表明苯环对侧链上的烃基产生了明显的影响,使其易被酸性KMnO4溶液氧化,而我们知道作用是相互的,反过来侧链上的烃基对苯环会不会有什么影响呢?3.苯的同系物的化学性质由于侧链烃基的影响,使得苯环上的氢更容易被取代了,如甲苯易发生硝化反应。
(1)取代反应[设疑]甲苯在发生硝化反应时,苯环上有几个氢被取代了?哪几个氢被取代了?[答]苯环上有三个氢被硝基取代,分别是与甲基相邻的两个氢以及与甲基相对的1个氢被硝基取代。
[讲解]三硝基甲苯,严格讲应叫2、4、6-三硝基甲苯俗名叫什么?有何重要用途?三硝基甲苯俗称梯恩梯(TNT),是一种淡黄色的晶体,不溶于水,它是一种烈性炸药,广泛用于国防、开矿、筑路、兴修水利等。
[师]苯的同系物也能像苯那样发生加成反应,但较困难。
例:能说明苯分子中的碳碳键不是单双键交替的事实是( B )(学海导航例题1)A.苯的一元取代物没有同分异构体B.苯的邻位二元取代物只有一种C.苯的间位二元取代物只有一种D.苯的对位二元取代物只有一种小结:本节课我们在复习苯的性质的基础上探究了苯的同系物的通式、结构特点及主要的化学性质,通过学习使我们认识到在苯的同系物中苯环与侧链的相互影响引起的性质上与苯的差异,进一步理解了结构决定性质的辩证关系,最后通过几个典型例题的分析以加深对苯及其同系物性质的理解和掌握。
3.例题精讲例1、实验室制备硝基苯的主要步骤如下:①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中;②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;③在50℃-60℃下发生反应,直至反应结束;④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,然后再用蒸馏水洗涤;⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:(1)配制一定比例浓硫酸与浓硝酸混合酸时,操作注意事项是_______________。
(2)步骤③中,为了使反应在50℃-60℃下进行,常用的方法是_____________。
(3)步骤④中洗涤,分离粗硝是苯应使用的仪器是__________________________。
(4)步骤④中粗产品用5%的NaOH溶液洗涤的目的是_______________________。
(5)纯硝基苯是无色,密度比水__________________(填"小"或"大"),具有________气味的油状液体。
分析:该题主要是对制取硝基苯实验的操作过程、步骤、现象的考查。
解:(1)先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却。
(2)将反应器放在50℃-60℃的水浴中加热。
(3)分液漏斗。
(4)除去产品中残留的酸。
(5)大,苦杏仁。
3、苯的同系物:(1)通式:CnH2n-6 (n≥6)(2)化学性质:CH3 CH2Cl①取代反应: +Cl2 500℃ +HClCH3 CH3+3HO-NO2 浓H2SO4 O2N NO2+3H2O△②氧化反应: NO2CH3 COOH5 +6KMnO4+9H2SO4 5 +3K2SO4+6MnSO4+14H2O苯的同系物能使酸性KMnO4溶液褪色,利用这个性质鉴别苯和苯的同系物。
③加成反应:CH3 CH2-CH2+3H2 催化剂 CH2 CH-CH3△ CH2-CH2例2、二甲苯苯环上的一溴化物共有6种,可用还原的方法制得3种二甲苯,它们的熔点分别列于下表:6种溴的二甲苯的熔点234℃206℃213.8℃204℃214.5℃205℃对应还原的二甲苯的熔点13℃-54℃-27℃-54℃-27℃-54℃由此推断熔点为234℃的分子结构简式为_______________,熔点为-54℃的分子结构简式为_______________。
