高中化学 化学经典除杂考试试题
化学除杂试题及答案

化学除杂试题及答案一、选择题1. 以下哪种试剂可以用来除去铜中的铁杂质?A. 稀硫酸B. 稀盐酸C. 稀硝酸D. 稀氢氧化钠溶液答案:A2. 除去氯化钠溶液中的硫酸钠杂质,应选用的试剂是:A. 氯化钡溶液B. 碳酸钠溶液C. 硝酸银溶液D. 氢氧化钠溶液答案:A3. 欲除去二氧化碳中的一氧化碳,应采用的方法是:A. 通过石灰水B. 通过氢氧化钠溶液C. 通过灼热的氧化铜D. 通过浓硫酸答案:C二、填空题4. 在实验室中,除去硝酸钾溶液中的少量氯化钠,可以采用______的方法。
答案:结晶5. 为了除去铜粉中的氧化铜,可以加入______,然后过滤。
答案:稀盐酸三、简答题6. 描述如何从氯化钠溶液中除去少量的碳酸钠。
答案:首先向溶液中加入适量的稀盐酸,使碳酸钠与盐酸反应生成氯化钠、水和二氧化碳。
反应方程式为:Na2CO3 + 2HCl → 2NaCl +H2O + CO2↑。
然后通过过滤除去生成的二氧化碳气体,最后通过蒸发结晶得到纯净的氯化钠。
7. 说明如何利用化学方法除去粗铜中的锌。
答案:将粗铜与稀硫酸反应,锌会与稀硫酸反应生成硫酸锌和氢气,而铜不会与稀硫酸反应。
反应方程式为:Zn + H2SO4 → ZnSO4 +H2↑。
通过过滤可以分离出未反应的铜,从而得到纯净的铜。
四、实验题8. 实验中,你得到了含有少量铁粉的铜粉样品。
请设计一个实验方案,以除去铜粉中的铁粉。
答案:将铜粉样品放入足量的稀盐酸中,铁粉会与稀盐酸反应生成氯化亚铁和氢气,而铜不会与稀盐酸反应。
反应方程式为:Fe + 2HCl→ FeCl2 + H2↑。
待反应完成后,通过过滤分离出铜粉,洗涤并干燥即可得到纯净的铜粉。
化学除杂分离和提纯单元测试题(含答案)经典

化学除杂分离和提纯单元测试题(含答案)经典一、中考化学除杂分离和提纯1.铝可以被氢氧化钠溶液溶解生成可溶性的偏铝酸钠,下列设计的除杂方案(括号内为杂质)都能达到目的的是()A.A B.B C.C D.D【答案】A【解析】【分析】除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
【详解】A、铁粉能被磁铁吸引,铜粉不能,铁粉和稀硫酸反应生成硫酸亚铁和氢气,铜粉和稀硫酸不反应,故A正确;B、镁粉和铝粉均和稀盐酸反应,把原物质除去了,故B不正确;C、一氧化碳点燃生成二氧化碳,把原物质除去了,故C不正确;D、铁粉和氧化铁均与稀盐酸反应,把原物质除去了,故D不正确。
故选A。
【点睛】除杂条件:加入的试剂只能与杂质反应,不能与原物质反应;反应后不能引入新的杂质。
2.除去CO2气体中少量CO,可采用的方法是()A.把混合气体点燃B.把混合气体通过水中C.把混合气体通过灼热的CuO粉末D.把混合气体通过足量的澄清石灰水【答案】C【解析】【分析】【详解】A、注意CO是杂质含量极少,也就是说二氧化碳很多,二氧化碳不能支持燃烧,同时没有氧气的存在也不会被点燃。
故A错;B、二氧化碳能溶于水,一氧化碳不溶于水,通入水不能除去一氧化碳。
故B错;C、通入灼热氧化铜,CuO+CO 加热Cu+CO2,一氧化碳转化为二氧化碳,既除了一氧化碳又增加了二氧化碳。
故C正确;D、将气体通入澄清石灰水中,发生反应CO2+Ca(OH)2=CaCO3↓+H2O,除去的是二氧化碳。
故D错。
故选:C。
【点睛】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.3.下列四个实验方案设计合理的是。
A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A、羊毛和化学合成纤维的气味区别不大,不能用闻气味的方法来鉴别,可用灼烧闻气味的方法鉴别,羊毛的主要成分是蛋白质,灼烧有烧焦羽毛的气味,化学合成纤维灼烧无此气味,不符合题意;B、除去粗盐中的难溶性杂质,可采取溶解、过滤(除去难溶性杂质)、蒸发得到提纯后的氯化钠,符合题意;C、将混合物置于足量稀盐酸中,氧化铜与稀盐酸反应生成氯化铜和水,铁与稀盐酸反应生成氯化亚铁和氢气,虽然除去了杂质,但是也除去了原物质,不符合题意;D、将两根光亮的镁条分别伸入CuSO4溶液和AgNO3溶液中,镁能与硫酸铜反应生成硫酸镁和铜,有红色固体析出,说明在金属活动性顺序里,镁位于铜之前,镁能与硝酸银反应生成硝酸镁和银,有银白色固体析出,说明在金属活动性顺序里,镁位于银之前,但是无法探究铜、银的金属活动性顺序,不符合题意。
化学除杂分离和提纯中考经典题型带答案经典

化学除杂分离和提纯中考经典题型带答案经典一、中考化学除杂分离和提纯1.欲除去下列物质中的少量杂质,所用试剂及方法不正确的是()A.A B.B C.C D.D【答案】C【解析】【分析】【详解】A、因为二氧化碳不与铜反应,氧气在加热条件下可以与铜反应,所以可以除掉氧气,故正确;B、CO2能与氢氧化钠溶液反应生成碳酸钠和水,CO不与氢氧化钠溶液反应,再通过浓硫酸进行干燥,能除去杂质且没有引入新的杂质,符合除杂原则,故正确;C、铁粉能与稀盐酸反应生成氯化亚铁和氢气,铜不与稀盐酸反应,反而会把原物质除去,不符合除杂原则,故错误;D、碳酸钾能与适量氯化钙溶液反应生成碳酸钙沉淀和氯化钾,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故正确。
故选:C。
【点睛】除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
除杂至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
2.如表中除去物质中少量杂质的方法正确的是A.A B.B C.C D.D【答案】A【解析】试题分析:除杂质的原则:所加的物质只与杂质反应,不能引入新的杂质,A、除去氯化钙溶液中的稀盐酸,加入过量的碳酸钙,发生反应:CaCO3+2HCl==CaCl2+H2O+CO2↑,然后再过滤,即可得到氯化钙溶液,正确,B、除去硫酸钾溶中的氢氧化钾,加入适量的稀盐酸,发生反应:KOH+HCl==KCl+H2O,引入了新的杂质KCl,错误,C、除去二氧化碳中氯化氢,通过足量的氢氧化钠溶液,两者都会发生反应,错误,D、除去二氧化锰中的氯化钾,根据二氧化锰不溶于水,氯化钾溶于水,故加水溶解、过滤、洗涤、烘干即可,不需要蒸发、结晶,错误,故选A考点:物质的除杂3.下列除杂、提纯的方法或选用的试剂中,不正确的是A.A B.B C.C D.D【答案】D【解析】【详解】A、因为硝酸钾的溶解度随温度升高而增大且变化较大,氯化钠的溶解度受温度影响较小,所以硝酸钾中混有少量氯化钠,可以采用降温结晶的方法提纯硝酸钾,选项A正确;B、氮气不能跟灼热的铜反应,氧气通过灼热的铜网时铜和氧气反应生成氧化铜,因此氮气中混有氧气时可以将混合气体通过灼热的铜网,氧气和铜反应生成氧化铜而除去,从而得到纯净的氮气,选项B正确;C、CaCl2溶液中含有稀盐酸,加入过量的碳酸钙,稀盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,然后过滤得到氯化钙溶液,选项C正确;D、铁中混有铁锈,加入稀硫酸,铁和铁锈都能和稀硫酸反应,在除去铁锈的同时也使铁减少,不符合除杂原则,选项D不正确。
最新化学除杂分离和提纯经典例题经典

最新化学除杂分离和提纯经典例题经典一、中考化学除杂分离和提纯1.铝可以被氢氧化钠溶液溶解生成可溶性的偏铝酸钠,下列设计的除杂方案(括号内为杂质)都能达到目的的是()A.A B.B C.C D.D【答案】A【解析】【分析】除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
【详解】A、铁粉能被磁铁吸引,铜粉不能,铁粉和稀硫酸反应生成硫酸亚铁和氢气,铜粉和稀硫酸不反应,故A正确;B、镁粉和铝粉均和稀盐酸反应,把原物质除去了,故B不正确;C、一氧化碳点燃生成二氧化碳,把原物质除去了,故C不正确;D、铁粉和氧化铁均与稀盐酸反应,把原物质除去了,故D不正确。
故选A。
【点睛】除杂条件:加入的试剂只能与杂质反应,不能与原物质反应;反应后不能引入新的杂质。
2.下列各组括号内除杂的方法或试剂错误的是( )A.Cu粉中混有Fe粉(用磁铁吸引) B.Cu粉中混有CuO(稀硫酸)C.CO中混有CO2(氢氧化钙溶液) D.CO2中混有CO(点燃)【答案】D【解析】【分析】【详解】A、铁粉能被磁铁吸引,铜粉不能磁铁吸引,能除去杂质且没有引入新的杂质,符合除杂原则。
B、CuO能与稀硫酸反应生成硫酸铜和水,铜不与稀硫酸反应,能除去杂质且没有引入新的杂质,符合除杂原则。
C、二氧化碳能与氢氧化钙溶液反应生成碳酸钙和水,CO不与氢氧化钙溶液反应,能除去杂质且没有引入新的杂质,符合除杂原则。
D、除去二氧化碳中的一氧化碳不能够点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的,不符合除杂原则。
故选:D。
【点睛】物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键。
3.下列除去杂质所选择的试剂或方法中(括号里为杂质),正确的是()A.CO2(CO):点燃B.CO2(HCl):NaOH溶液C.NaCl(Na2CO3):H2SO4D.N2(O2):通过灼热的铜【答案】D【解析】【分析】【详解】A、除去CO2中少量的CO,点燃是无法除去一氧化碳的,因为混合气体中没有氧气来支持燃烧,A不正确;B、除去CO2中少量的HCl气体,用NaOH溶液来吸收,虽然能把氯化氢气体除去,但也把二氧化碳除去了,B不正确;C、除去NaCl中少量的Na2CO3,滴加适量的H2SO4,碳酸钠与硫酸反应,虽然除去了碳酸钠,但又引进了新的物质硫酸钠,C不正确;D、除去N2中少量O2,把混合气体通过灼热的铜,氧气能与铜反应生成氧化铜,从而除去了氧气,剩余氮气,D正确。
高一化学除杂试题及答案

高一化学除杂试题及答案
一、选择题
1. 在分离下列混合物时,应选择的除杂方法是:
A. 除去食盐中的泥沙
B. 除去海水中的氯化钠
C. 除去二氧化碳中的一氧化碳
D. 除去氯化钠中的氯化钙
答案:A
2. 除去铜粉中的铁粉,应选用的试剂是:
A. 稀盐酸
B. 稀硫酸
C. 稀硝酸
D. 稀氢氧化钠
答案:A
二、填空题
1. 除去氢氧化钠溶液中的碳酸钠,应加入过量的______,再过滤。
答案:氢氧化钙
2. 除去铜粉中的锌粉,应加入过量的______,再过滤。
答案:稀硫酸
三、实验题
1. 实验室中,要除去粗盐中的泥沙,应如何操作?
答案:将粗盐溶解在水中,通过过滤除去泥沙,然后将溶液蒸发结晶得到纯净的氯化钠。
2. 实验室中,要除去二氧化碳中的一氧化碳,应如何操作?
答案:通过将混合气体通过灼热的氧化铜,一氧化碳与氧化铜反应生成二氧化碳,从而除去一氧化碳。
四、计算题
1. 某溶液中含有杂质氯化钙,已知溶液中钙离子的浓度为0.1mol/L,求至少需要多少体积的0.1mol/L的碳酸钠溶液来完全沉淀溶液中的钙离子?
答案:根据化学方程式Ca^{2+} + CO_{3}^{2-} → CaCO_{3}↓,可以计算出需要的碳酸钠溶液体积为0.1L。
五、简答题
1. 在实验室中,如何除去乙醇中的水?
答案:可以通过加入生石灰(CaO)并加热,生石灰会吸收水分,从而将乙醇中的水除去。
2. 描述一种除去铁粉中铜粉的方法。
答案:可以将铁粉和铜粉的混合物放入稀盐酸或稀硫酸中,铁粉会与酸反应生成氢气和铁盐,而铜粉不与酸反应,通过过滤可以分离出铜粉。
(化学)化学化学除杂分离和提纯题20套(带答案)含解析
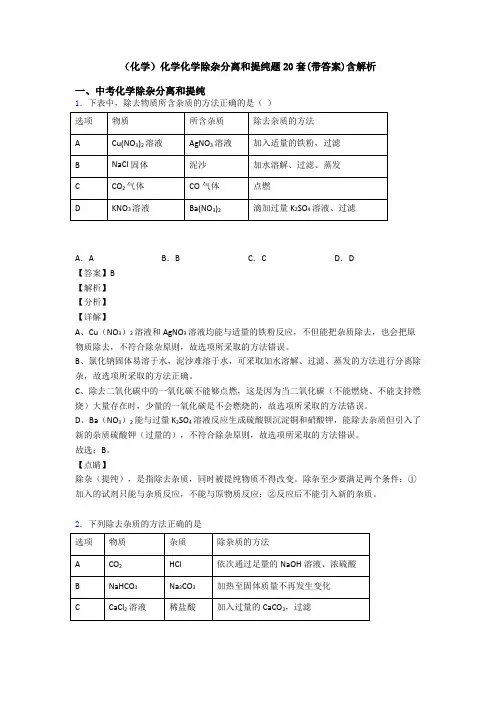
(化学)化学化学除杂分离和提纯题20套(带答案)含解析一、中考化学除杂分离和提纯1.下表中,除去物质所含杂质的方法正确的是()A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A、Cu(NO3)2溶液和AgNO3溶液均能与适量的铁粉反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
B、氯化钠固体易溶于水,泥沙难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,故选项所采取的方法正确。
C、除去二氧化碳中的一氧化碳不能够点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的,故选项所采取的方法错误。
D、Ba(NO3)2能与过量K2SO4溶液反应生成硫酸钡沉淀铜和硝酸钾,能除去杂质但引入了新的杂质硫酸钾(过量的),不符合除杂原则,故选项所采取的方法错误。
故选:B。
【点睛】除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
除杂至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
2.下列除去杂质的方法正确的是A.A B.B C.C D.D【答案】C【解析】【分析】【详解】A、除去二氧化碳中少量的氯化氢气体,把混合气体依次通过足量的NaOH溶液吸收,再用浓硫酸干燥,虽然能把氯化氢气体除去,但二氧化碳气体也被氢氧化钠吸收了,A不正确;B、除去碳酸氢钠固体中少量的碳酸钠,加热至固体质量不再发生变化,碳酸钠受热不易分解,而碳酸氢钠受热易分解生成碳酸钠、水和二氧化碳气体,从而把碳酸氢钠除去了,B 不正确;C、除去氯化钙溶液中少量的稀盐酸,向溶液中加入过量的CaCO3,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳气体,再把过量的碳酸钙固体过滤除去,得到氯化钙溶液,C正确;D、除去硝酸钾溶液中少量的硫酸铜,向溶液中加入适量的NaOH溶液,氢氧化钠溶液与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,然后把沉淀过滤,虽然除去了硫酸铜,但得到的溶液中含有生成的硫酸钠,D不正确。
除杂试题专项训练及答案
除杂试题专项训练及答案一、选择题(共30小题,每小题3分,满分90分)1.(3分)欲除去不纯物质中的杂质(括号内为杂质),所选试剂正确的是()选项待提纯物质选用试剂A NaNO3溶液(NaCl)过量硝酸银溶液B NaCl溶液(CuCl2)适量氢氧化钠溶液C盐酸(硫酸)硝酸钡溶液D Fe粉(Cu粉)稀硫酸A.A B.B C.C D.D2.(3分)下列除去杂质的方法,错误的是()A.除去H2中的少量水蒸气:通过浓硫酸B.除去CO2中的少量HCl:通入足量的NaOH溶液,干燥C.除去NaCl溶液中少量的CaCl2:加入适量Na2CO3溶液,过滤D.除去FeCl3溶液中少量的CuCl2:加入足量的铁屑充分反应后,过滤3.(3分)除去下列物质中的少量杂质,所选试剂及操作都正确的是()序号物质杂质试剂操作A FeCl2溶液CuCl2过量铁粉结晶B CO2H2O浓硫酸洗气C NaNO3溶液Na2CO3适量CaCl2溶液过滤D铜粉铁粉过量盐酸过滤A.A B.B C.C D.D4.(3分)下列实验中利用提供的方案能达到目的是()选项实验目的实验方案A除去CaO中混有的CaCO3先加足量水,然后过滤B除去CO2中的少量HCl气体先通过NaOH溶液,再通过浓硫酸C鉴别棉线和羊毛线点燃,闻产生的气味,观察生成的灰烬D鉴别稀盐酸和氯化钠溶液滴加酚酞溶液颜色变化A.A B.B C.C D.D5.(3分)下列除去物质中所含少量杂质的方法中,错误的是()选项物质杂质除去杂质的方法A CO2气体CO气体通入氧气,点燃.B Na2SO4溶液Na2CO3溶液滴入适量稀硫酸至无气泡产生.C C粉CuO粉加入足量盐酸充分反应后过滤.D Cu(NO3)2溶液AgNO3溶液加足量铜粉充分反应后过滤.A.A B.B C.C D.D6.(3分)除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是()A.CaCO3固体(CaO固体)﹣﹣高温煅烧B.N2气体(O2气体)﹣﹣通过灼热的铜网C.CO气体(CO2气体)﹣﹣依次通过浓硫酸和足量的氢氧化钠溶液D.KCl溶液(CaCl2溶液)﹣﹣滴加碳酸钠溶液至恰好完全反应,过滤7.(3分)某化学兴趣小组设计的下列实验方案不合理的是()选项实验目的实验方案A除去CaO中的CaCO3滴加稀盐酸至不再产生气泡为止B鉴别硝酸铵和氯化钠固体分别取等量的固体溶于水,溶液温度降低的为硝酸铵C检验盐酸中是否含有硫酸滴加氯化钡溶液,若产生白色沉淀,则含有硫酸D分离氯化钾和二氧化锰溶解,过滤,蒸发滤液;洗涤、干燥滤渣A.A B.B C.C D.D8.(3分)下列四个图象分别表示对应的四种操作过程,其中正确的是()A.水的电解B.木炭在密闭容器内燃烧C.加热一定量的高锰酸钾制氧气D。
高中化学物质检验除杂综合题(有答案)_2(1)
⾼中化学物质检验除杂综合题(有答案)_2(1)⽅法归纳检验、鉴别物质的依据:从物质的物理性质⽅⾯:颜⾊、⽓味、溶解性、挥发性从物质的化学性质⽅⾯:发⽣反应时要能产⽣⽓体、沉淀或颜⾊变化等现象从化学⾓度讲,鉴别是对已知物的种类进⾏辨认,其⽬的在于把⼏种物质区别开来。
⼀般说来,不需要将鉴别物质逐⼀进⾏检验,这和鉴定不同。
鉴定是⽤实验⽅法,鉴定物质的组成,然后确定物质是什么,或该物质中含有哪些成分。
根据实验确定某⼀物质的习题是鉴定题,物质的鉴定通常必须分别检验出阳离⼦和阴离⼦;根据实验区别⼏种已知物质的习题是鉴别题。
现谈谈鉴别物质的20种⽅法。
1.沉淀法待鉴别物质的溶液中,加⼊某种试剂,观察是否有沉淀产⽣,进⾏鉴别。
例:如何鉴别Na2SO4溶液和NaNO3溶液。
使⽤BaCl2溶液鉴定。
反应的离⼦⽅程式:Ba2++SO42-=BaSO4↓2.⽓体法根据某物质加⼊某⼀试剂,是否有⽓体产⽣,予以鉴别。
例:有两瓶失落标签的固体,它们是Na2CO3和NaCl,如何鉴别。
使⽤盐酸鉴别。
反应离⼦⽅程式:CO32-+2H+=CO2↑+H2O3.过量法利⽤加⼊某种试剂,产⽣沉淀,继续滴加,沉淀消失,达到鉴别的⽬的。
例:怎样鉴别ZnCl2溶液和MgCl2溶液。
解:将两种待鉴别的溶液分别放⼊⼆⽀试管中,加⼊NaOH溶液,可观察到均有⽩⾊沉淀产⽣,继续滴加NaOH溶液,可看到有⼀⽀试管内的⽩⾊沉淀逐渐消失,另⼀⽀试管内⽆此现象。
则先产⽣⽩⾊沉淀后逐渐消失的试管内放的是ZnCl2溶液,另⼀⽀试管内是MgCl2溶液。
反应的离⼦⽅程式:Mg2++2OH-=Mg(OH)2↓Zn2++2OH-=Zn(OH)2↓Zn(OH)2+2OH-=ZnO22-+2H2O4.相互法利⽤物质间反应,现象不同⽽予以鉴别。
例:不⽤任何化学试剂,也不能加热,如何鉴别NaOH溶液和AlCl3溶液。
解:根据NaOH溶液滴⼊AlCl3溶液中和AlCl3溶液滴⼊NaOH溶液中现象不同进⾏鉴别。
高中化学常见物质鉴别除杂题目
高中化学常见物质除杂1、化学方法分离和提纯物质(1)生成沉淀法例如NaCl溶液里混有少量的MgCl2杂质,可加入过量的NaOH溶液,使Mg2+离子转化为Mg(OH)2沉淀(但引入新的杂质OH-),过滤除去Mg(OH)2,然后加入适量盐酸,调节pH为中性。
(2)生成气体法例如Na2SO4溶液中混有少量Na2CO3,为了不引入新的杂质并增加SO42-,可加入适量的稀H2SO4,将CO32-转化为CO2气体而除去。
(3)氧化还原法例如在 FeCl3溶液里含有少量 FeCl2杂质,可通入适量的Cl2气将FeCl2氧化为FeCl3。
若在 FeCl2溶液里含有少量 FeCl3,可加入适量的铁粉而将其除去。
(4)正盐和与酸式盐相互转化法例如在Na2CO3固体中含有少量NaHCO3杂质,可将固体加热,使NaHCO3分解生成Na2CO3,而除去杂质。
若在NaHCO3溶液中混有少量Na2CO3杂质,可向溶液里通入足量CO2,使Na2CO3转化为NaHCO3。
(5)利用物质的两性除去杂质例如在Fe2O3里混有少量的Al2O3杂质,可利用Al2O3是两性氧化物,能与强碱溶液反应,往试样里加入足量的 NaOH溶液,使其中 Al2O3转化为可溶性 NaAlO2,然后过滤,洗涤难溶物,即为纯净的Fe2O3。
2、物质的鉴别1.常见气体的检验常见气体检验方法H2纯净的氢气在空气中燃烧呈淡蓝色火焰,混合空气点燃有爆鸣声,生成物只有水。
不是只有氢气才产生爆鸣声;可点燃的气体不一定是氢气O2可使带火星的木条复燃Cl2黄绿色,能使湿润的碘化钾淀粉试纸变蓝(O3、NO2也能使湿润的碘化钾淀粉试纸变蓝)HCl 无色有刺激性气味的气体。
在潮湿的空气中形成白雾,能使湿润的蓝色石蓝试纸变红;用蘸有浓氨水的玻璃棒靠近时冒白烟;将气体通入AgNO3溶液时有白色沉淀生成。
SO2无色有刺激性气味的气体。
能使品红溶液褪色,加热后又显红色。
能使酸性高锰酸钾溶液褪色。
高中化学常见物质鉴别除杂题目
高中化学常见物质除杂1、化学方法分离和提纯物质(1)生成沉淀法2+离子例如N&CI溶液里混有少量的MgCL杂质,可加入过量的N&OH溶液,使Mg转化为Mg(OH)2沉淀(但引入新的杂质0H'),过滤除去Mg(OH)2,然后加入适量盐酸,调节PH为中性。
(2)生成气体法例如N&2SO4溶液中混有少量NMCh,为了不引入新的杂质并增加S042_,可加入适的稀HSO4,将CO32「转化为CO2气体而除去。
(3)氧化还原法例如在Fe*溶液里含有少量FeCb杂质,可通入适量的凶气将FeC.氧化为FeCI3O若在Fe*溶液里含有少量FeCI 3,可加入适量的铁粉而将其除去。
(4)正盐和与酸式盐相互转化法例如在gCOs固体中含有少量NaHQ杂质,可将固体加热,使N&HC命解生成NaQOs,而除去杂质。
若在NaHCpg液中混有少量N^CC^杂质,可向溶液里通入足量C02>使Na2CO3转化为NaHCQ(5)利用物质的两性除去杂质例如在Fe?。
里混有少量的A.Q杂质,可利用A.Q是两性氧化物,能与强碱溶液反应,往试样里加入足量的20H溶液,使其中AI 2。
转化为可溶性NaAIO2, 然后过滤,洗涤难溶物,即为纯净的FezQL物质的鉴别1 •常见气体的检验检验方法常见—气体纯净的氢气在空气中燃烧呈淡蓝色火焰,混合空气点燃有爆呜声,生成物只有水。
不是只有氢气才产生爆鸣声;可点燃的气体不一定是氢Q 可使带火星的木条复燃Cl2黄绿色,能使湿润的碘化钾淀粉试纸变蓝(Q、NO?也能使湿润的碘化2>能使紫色石蕊试液或橙色的甲基橙试液变为红色。
(1)H(2)Na;k+用焰色反应来检验时,它们的火焰分别呈黄色、浅紫色(通过钻玻片)o2+ 能使稀硫酸或可溶性硫酸盐溶液产生白色BaSO(3)Ba4沉淀,且沉淀不溶于稀硝酸。
(4)Mg 能与NeOH溶液反应生成白色Mg(OH)2沉淀,该沉淀能溶于NHQ溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子共存高考试题1.(91全国化学,21)在某无色透明的酸性溶液中,能共存的离子组是A.NH4+、NO3-、Al3+、Cl-B.Na+、Al3+、K+、NO3-C.MnO4-、K+、SO42-、Na+D.K+、SO42-、HCO3-、NO3-2.(92全国化学,15)若某溶液跟甲基橙作用呈红色,则下列离子在该溶液中浓度不可能很大的是A.SO42-B.S2-C.CO32-D.Cl-3.(93全国化学,16)下列各组离子:(1)I—、ClO—、NO3—、H+(2)K+、NH4+、HCO3—、OH—(3)SO32—、SO42—、Cl—、OH— (4)Fe3+、Cu2+、SO42—、Cl— (5)H+、K+、AlO2—、HSO3—(6)Ca2+、Na+、SO42—、CO32—在水溶液中能大量共存的是A.(1)和(6) B.(3)和(4) C.(2)和(5) D.(1)和(4)4.(94全国化学,13)在PH=3的无色透明溶液中不能..大量共存的离子组A.Al3+ Ag+ NO3— Cl—B.Mg2+ NH4+ NO3—Cl—C.Ba2+ K+ S2— Cl—D.Zn2+ Na+ NO3— SO42—5.(95全国化学,11)在pH=1的溶液中,可以大量共存的离子组是A.Na+、K+、S2-、Cl-B.Al3+、Mg2+、SO42-、Cl-C.K+、Na+、AlO2-、NO3-D.K+、Na+、SO42-、S2O32-6.(96全国化学,11)下列各组离子,在强碱性溶液中可以大量共存的是A.K+、Na+、HSO3-、Cl-B.Na+、Ba2+、AlO2-、NO3-C.NH4+、K+、Cl-、NO3-D.K+、Na+、ClO-、S2-7.(06江苏,5)下列反应的离子方程式正确的是BA.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O△Fe(OH)3↓+3H+B.用小苏打治疗胃酸过多:HCO3-+H+===CO2↑+H2OC.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-△Cl2↑+Mn2++H2OD.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu===Fe2++Cu2+8.(96全国化学,18)某溶液中有NH4+、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( ).A.NH4+B.Mg2+C.Fe2+D.Al3+9.(97全国化学,9)下列各组离子,在强碱性溶液中可以大量共存的是A.I-、AlO2-、Cl-、S2-B.Na+、K+、NH4+、Ba2+C.Br-、S2-、Cl-、CO32-D.SO32-、NO3-、SO42-、HCO3-10.(99全国化学)下列各组离于在溶液中既可以大量共存,且加入氨水后也不产牛沉淀的是A.Na+、Ba2+、Cl-、SO42-B.K+、AlO2-、NO3-、OH-C .H +、NH 4+、Al 3+、SO 42-D .H +、Cl -、CH 3COO -、NO 3-11.(2004全国)在pH =l 含+2Ba 离子的溶液中,还能大量存在的离子是A .-2AlOB .-ClOC .-ClD .-24SO12、(2004年广东卷)下列反应完成后没有..沉淀的是 A 、BaCl 2溶液与Na 2CO 3溶液加足量稀CH 3COOH B 、Ba(OH)2溶液与KNO 3溶液加足量稀H 2SO 4 C 、AgNO 3溶液与Na 2CO 3溶液加足量稀HCl D 、Ca(OH)2溶液与FeCl 3溶液加足量稀HNO 313、(2004年江苏卷)巳知某溶液中存在较多的H +、SO 42—、NO 3—,则该溶液中还可能大量存在的离子组是A .Al 3+、CH 3C00—、Cl —B .Mg 2+、Ba 2+、Br —C .Mg 2+、Cl —、I —D .Na +、NH 4+、Cl —14.(2005年广东)下列各组离子一定能大量共存的是A .在含大量Fe 3+的溶液中:NH 4+、Na +、Cl —、SCN —B .在强碱溶液中:Na +、K +、AlO 2—、CO 32—C .在c (H +) =10—13mol/L 的溶液中:NH 4+、Al 3+、SO 42—、NO 3—D .在pH =1的溶液中:K +、Fe 2+、Cl —、NO 3—15.(2005年江苏)某溶液既能溶解Al(OH)3,又能溶解H 2SiO 3,在该溶液中可以大量共存的离子组是A .K +、Na +、HCO -3、NO -3 B .Na +、SO -24、Cl —、ClO —C.H+、Mg2+、SO-24、NO-3D.Ag+、K+、NO-3、Na+16、(2005年天津卷)下列各组离子在溶液中能大量共存的是A 酸性溶液Na+、K+、MnO4-、Br- B 酸性溶液Fe3+、NH4+、SCN-、NO3-C 碱性溶液Na+、K+、AlO2-、SO42- D 碱性溶液Ba2+、Na+、CO32-、Cl-17.下列各组离子在溶液中能大量共存的是()A.酸性溶液Na+、K+、MnO4-、Br-B.酸性溶液Fe3+、NH4+、SCN-、NO3-C.碱性溶液Na+、K+、AlO2-、SO-24D.碱性溶液Ba2+、Na+、CO-23、Cl-18、(2006年江苏卷).一定能在下列溶液中大量共存的离子组是A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-B.c(H+)=1×10-13mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-19、(2006年上海卷)已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是A A13+、CH3COO-、C1- B Na+、NH4+、C1-C Mg2+、C1-、Fe2+D Mg2+、Ba2+、Br-20.(2006年四川卷)室温下,在强酸性和强碱性溶液中都不能..大量共存的离子组是A. NH4+、Cu2+、Cl一、N03- B. K+、Na+、S032一、S2—C. K+、Na+、A102-、S042- D. Ba2+、Fe2+、N03-、Br-21、(2007北京卷).在由水电离产生的H +浓度为1×10-13mol·L -1的溶液中,一定能大量共存的离子组是① K +、Cl -、NO 3-、S 2- ② K +、Fe 2+、I -、SO 42- ③ Na +、Cl -、NO 3-、SO 42- ④Na +、Ca 2+、Cl -、HCO 3- ⑤ K +、Ba 2+、Cl -、NO 3- A .①③B .③⑤C .③④D .②⑤22. (2007年江苏向存在大量Na +、Cl -的溶液中通入足量的NH 3后,该溶液中还可能大量存在的离于组是A .K +、Br -、CO 32-B .Al 3+、H +、MnO 4-C .NH 4+、Fe 3+、SO 42-D .Ag +、Cu 2+、NO 3- 23.(2008年江苏)在下列溶液中,各组离子一定能够大量共存的是A .使酚酞试液变红的溶液: Na +、Cl -、SO 42-、Fe 3+B .使紫色石蕊试液变红的溶液:Fe 2+、Mg 2+、NO 3-、Cl -C . c (H +)=10-12 mol ·L -1的溶液:K +、Ba 2+、Cl -、Br -D .碳酸氢钠溶液:K +、SO 42-、Cl -、H +24.(2008年广东卷理科基础)下列各组离子一定能大量共存的是A .在含有大量[Al(OH)3]-的溶液中:NH 4+、Na +、Cl -、H +B .在强碱溶液中:Na +、K +、CO 32-、NO 3-C .在pH =12的溶液中:NH 4+、Na +、SO 42-、Cl -D .在c(H +)=0.1mol ·L -1的溶液中:K +、I -、Cl -、NO 3- 25、(2008年重庆)下列各组离子在给定条件下能大量共存的是A、在pH=1溶液中:NH4+、K+、ClO—、Cl—B、有SO42—存在的溶液中:Na+、Mg2+、Ca2+、I—C、有NO3—存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br—D、在c(H+) =1.0×10—13mol/L的溶液中:Na+、S2—、AlO2—、SO32—26.(2008年全国I)在溶液中加入中量Na2O2后仍能大量共存的离子组是A.NH+4、Ba2+、Cl-、NO-3B.K+、AlO-2、Cl-、SO2-4C.Ca2+、Mg2+、NO-3、HCO-3D.Na+、Cl-、CO2-3、SO2-327、(2008年海南)在pH=13的无色溶液中,可以大量共存的一组离子是:A、NH4+、NO3—、K+、SO42—B、CO32_、NO3—、HCO3—、Na+C、Na+、ClO—、AlO2—、NO3—D、CrO42—、K+、Na+、SO42—28.(02上海,19)下列离子方程式书写正确的是BA.FeCl2溶液中通入Cl2:Fe2++Cl2===Fe3++2Cl-B.澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-===CaCO3↓+H2OC.FeS固体放人稀硝酸溶液中:FeS+2H+===Fe2++H2S↑D.AlCl3溶液中加入过量氨水:Al3++4OH-===AlO2-+2H2O29.(99全国,2)下列离子方程式书写正确的是ABA.过量氯气通入溴化亚铁溶液中 3Cl2+2Fe2++4Br-===6Cl-+2Fe3++2Br2B.过量二氧化碳通入偏铝酸钠溶液中 CO2+2H2O+AlO-2===Al(OH)3↓+HCO-3C.在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合NH+4+HSO-3+2OH—===SO-23+NH3↑+2H2OD.碳酸氢镁溶液中加入过量石灰水 Mg2++2HCO-3+Ca2++2OH—===CaCO3↓+2H2O+MgCO3↓30.(96上海,9)下列离子方程式书写正确的是CA.氯化铁溶液中通入硫化氢气体:2Fe3++S2-=2Fe2++S↓B.碳酸钡中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2OC.偏铝酸钠溶液中加入过量盐酸:AlO2-+4H+=Al3++2H2OD.碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O 31.(01上海,12)下列离子在溶液中因发生氧化还原反应而不能大量共存的是AA.H3O+、NO3-、Fe2+、Na+B.Ag+、NO3-、Cl-、K+C.K+、Ba2+、OH-、SO42-D.Cu2+、NH4+、Br-、OH-32.(00广东,16)某溶液中含有大量Fe2+、Fe3+、Mg2+和NH4+,其[H+]=10-2mol·L-1,在该溶液中可以大量存在的阴离子是AA.SO42-B.NO3-C.SCN-D.CO32-33、(2007全国卷II)27. (15分)现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:为鉴别它们,分别完成以下实验,其结果是: a .B 和D 都不溶于水,也不溶于酸;b .A 溶于水后,与上述某阳离子反应可生成B ,且A 溶液与过量氨水反应生成白色沉淀c .C 溶于水后,与上述某阳离子反应可生成D ,且C 溶液与过量氨水反应生成白色沉淀d .E 溶于水后,与上述某阴离子反应可生成B ;e .A 溶液与适量E 溶液反应生成沉淀,再加过量E 溶液,沉淀是减少,但不消失。
