高中化学-完全版化学方程式总结归纳
高中化学方程式归纳总结大全

高中化学方程式归纳总结大全
一、酸-碱反应:
1、金属与碱反应:金属与强碱反应,产生金属离子和氢气,其反应方
程式为:M+2OH--->M(OH)2+H2↑
2、无机酸与碱反应:无机酸与碱反应,发生交换反应,产生对应的
盐和水,其反应方程式为:HX+M(OH)Y--->M(X)Y+H2O
3、盐酸反应:盐酸与碱反应,会发生水解反应,产生碱性盐和氢气,其反应方程式为:HCl+M(OH)2--->MCl+H2O+H2↑
4、有机酸与碱反应:有机酸与碱反应会发生碱溶解反应,产生对应
的盐和水,其反应方程式为:R-COOH+M(OH)Y--->RCOO-M+H2O
二、碱与金属盐反应:
1、金属碱与氧化物反应:金属碱与氧化物反应,产生金属盐和水,
其反应方程式为:M(OH)2+MO--->M2O+H2O
2、金属碱与酸反应:金属碱与酸反应,产生金属盐和水,其反应方
程式为:M(OH)2+HX--->MX+H2O
3、金属碱与溶液反应:金属碱与溶液反应,产生金属盐和水,其反
应方程式为:M(OH)2+MX--->M2X+H2O
三、水的溶解反应:
1、非金属氧化物溶解:非金属氧化物溶解于水,可以产生质子和氧
离子,其反应方程式为:MO+H2O--->H3O++M
2、金属氧化物溶解:金属氧化物溶解于水,会产生金属离子和氢氧离子,其反应方程式为:M2O+2H2O--->2H3O++2M。
高中化学方程式总结7篇

高中化学方程式总结7篇篇1一、非金属单质(F2,Cl2,O2,S,N2,P4,C,Si)二、非金属氧化物(SO2,SO3,CO2,CO,NO2,N2O,P4O6,P4O10)三、金属氧化物(Na2O,Na2O2,MgO,Al2O3,FeO,Fe2O3,CuO)四、盐(氯化物、硫酸盐、硝酸盐、碳酸盐、硅酸盐)五、碱(NaOH,KOH,Ba(OH)2,NH3·H2O)六、酸(HCl,H2SO4,HNO3,H3PO4)在化学学习和实验中,我们经常接触到各种化学方程式。
掌握化学方程式是理解化学反应原理、进行化学计算和解决化学问题的关键。
以下是对高中化学方程式的总结:一、非金属单质氟气与水的反应:2F2 + 2H2O = 4HF + O2;氯气与氢氧化钠的反应:2Cl2 + 2NaOH = NaCl + NaClO + H2O;氧气的还原反应:O2 + 2H2 = 2H2O;硫的燃烧反应:S + O2 = SO2;氮气与氧气的反应:N2 + O2 = 2NO;磷与氧气的反应:4P + 5O2 = 2P2O5;碳的燃烧反应:C + O2 = CO2;硅与氧气的反应:Si + 2O2 = SiO2。
二、非金属氧化物二氧化硫与氧气的反应:2SO2 + O2 = 2SO3;二氧化碳与水的反应:CO2 + H2O = H2CO3;一氧化碳与氧气的反应:CO + O2 = CO2;二氧化氮与水的反应:3NO2 + H2O = 2HNO3 + NO;四氧化三铅与氧气的反应:4PbO3 + O2 = 6PbO。
三、金属氧化物钠与氧气的反应:4Na + O2 = 2Na2O;过氧化钠与水的反应:2Na2O2 + 2H2O = 4NaOH + O2↑;氧化镁与水的反应:MgO +H2O = Mg(OH)2;氧化铝与水的反应:Al2O3 + 3H2O = 6HAlO;氧化亚铁与氧气的反应:4FeO + O2 = 6FeO;氧化铁与氧气的反应:3FeO + O2 = 3Fe;氧化铜与水的反应:CuO + H2O = Cu(OH)2。
高中化学公式总结归纳

【学习总结】高中化学方程式归纳整理一、钠及其化合物的性质反应(1)Na 与 O2 反应(常温):4Na+O2===2Na2O(2)Na 与 O2 反应(加热):2Na+O2===Na2O2(3)Na 与 Cl2 反应:2Na+Cl2===2NaCl(4)Na 与 S 反应:2Na+S===Na2S(5)Na 与水反应:2Na+2H2O===2NaOH+H2↑(6)Na 与盐酸反应:2Na+2H+===2Na++H2↑(7)Na 与 CuSO4 溶液反应:2Na+CuSO4+2H2O===Cu(OH)2↓+H2↑+Na2SO4(8)Na 与 TiCl4 反应:4Na+TiCl4===4NaCl+Ti(9)Na 与乙醇反应化学方程式:2Na+2C2H5OH―→2C2H5ONa+H2↑(10)电工业冶炼钠:2NaCl (融化)===2Na+Cl2↑(11)Na2O 与 H2O 反应:Na2O+H2O===2NaOH(12)Na2O 与 CO2 反应: Na2O+CO2===Na2CO3(13)Na2O 与盐酸反应:Na2O+2HCl===2NaCl+H2O(14)Na2O 与 SO2 反应:Na2O+SO2===Na2SO3(15)Na2O2 与 H2O 反应:2Na2O2+2H2O===4NaOH+O2↑(16)Na2O2 与 CO2 反应: 2Na2O2+2CO2===2Na2CO3+O2↑(17)Na2O2 与盐酸反应:2Na2O2+4HCl===4NaCl+2H2O+O2↑(18)Na2O2 与 SO2 反应:Na2O2+SO2===Na2SO4(19)Na2CO3 与足量盐酸反应:Na2CO3+2HCl===2NaCl+H2O+CO2↑(20)Na2CO3 与少量盐酸反应:Na2CO3+HCl===NaHCO3+NaCl(21)Na2CO3 与 Ca(OH)2 反应:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH(22)Na2CO3 与 CaCl2 反应:Na2CO3+CaCl2===CaCO3↓+2NaCl(23)Na2CO3 与 BaCl2 反应:Na2CO3+BaCl2===BaCO3↓+2NaCl(24)将 CO2 通入稀 Na2CO3 溶液中: Na2CO3+H2O+CO2===2NaHCO3(25)将 CO2 通入饱和 Na2CO3 溶液中: Na2CO3+H2O+CO2===2NaHCO3↓(26)NaHCO3 与盐酸反应:HCO3-+H+===H2O+CO2↑(27) NaHCO3 与 NaOH 溶液反应:NaHCO3+NaOH==Na2CO3+H2O(28)NaHCO3 与过量 Ca(OH)2 溶液反应:HCO3-+OH-+Ca2+===CaCO3↓+H2O(29)NaHCO3 与少量 Ca(OH)2 溶液反应:2HCO3-+2OH-+Ca2+===CaCO3↓+CO32-+2H2O(30)NaHCO3 与 NaHSO4 溶液反应:HCO3-++H+===H2O+CO2↑(31)NaHCO3 与少量 SO2 反应:2HCO3-+SO2===SO32-+H2O+2CO2↑(32)NaHCO3 与 NaAlO2 溶液反应:HCO3-+AlO2-+H2O===Al(OH)3↓+CO32-(33)加热 NaHCO3 的反应:2NaHCO3≜Na2CO3+H2O+CO2↑(34)侯氏制碱法原理:二、铁及其化合物的性质反应(一)铁单质和铁的氧化物的性质反应NaCl+NH3·H2O+CO2===NaHCO3↓+NH4Cl(1)Fe 与 O2 反应:3Fe+2O2===Fe3O4(2)Fe 与 Cl2 反应:2Fe+3Cl2===2FeCl3(3)Fe 与 Br2 反应:2Fe+3Br2 == 2FeBr3(4)Fe 与 I2 反应:Fe+I2 ≜FeI2(5)Fe 与 S 反应(加热):Fe+S≜FeS(6)Fe 与 H2O 反应(高温):3Fe+4H2O===Fe3O4+4H2(7)Fe 与盐酸反应(离子方程式):Fe+2H+===Fe2++H2↑(8)Fe 与稀 H2SO4 反应:Fe+H2SO4===FeSO4+H2↑(9)Fe 与浓 H2SO4(常温钝化)反应:2Fe+3H2SO4(浓)==Fe2O3+3SO2↑+3H2O(10)Fe 与浓 H2SO4(加热)反应:2Fe+6H2SO4(浓)≜Fe2(SO4)3+3SO2↑+6H2O(11) Fe 与稀 HNO3(过量)反应:Fe+4HNO3==Fe(NO3)3+NO↑+2H2O(12)Fe 与稀 HNO3(少量)反应:3Fe+8HNO3(稀)==3Fe(NO3)2+2NO↑+4H2O(13)Fe 与浓 HNO3(加热)反应:Fe+6HNO3(浓)≜Fe(NO3)3+3NO2↑+3H2O(14)Fe 与浓 HNO3(常温钝化)反应:2Fe+6HNO3==Fe2O3+6NO2↑+3H2O(15)Fe 与 CuSO4 溶液反应(离子方程式):Fe+Cu2+==Fe2++Cu(16)Fe 与 FeCl3 溶液反应(离子方程式):Fe+2Fe3+===3Fe2+(17)Fe2O3 与 Al 反应:Fe2O3+2Al===2Fe+Al2O3(18)Fe2O3 与 C 反应:2Fe2O3+3C===4Fe+3CO2(19)Fe2O3 与 CO 反应:Fe2O3+3CO===2Fe+3CO2(20)FeO 与盐酸反应:FeO+2H+===Fe2++H2O(21)Fe2O3 与盐酸反应:Fe2O3+6H+===2Fe3++3H2O(22)Fe3O4 与盐酸反应:Fe3O4+8H+===Fe2++2Fe3++4H2O(23)FeO 与 HI 溶液反应:FeO+2HI===FeI2+H2O(24)FeO 与稀 HNO3 反应:3FeO+10HNO3===3Fe(NO3)3+NO↑+5H2O(25)Fe2O3 与稀 HNO3 反应:Fe2O3+6HNO3===2Fe(NO3)3+3H2O(26)Fe2O3 与 HI 溶液反应:Fe2O3+6HI===2FeI2+I2+3H2O(27)Fe3O4 与 HI 溶液反应:Fe3O4+8HI===3FeI2+I2+4H2O(28)Fe3O4 与稀 HNO3 反应:(三)铁的氢氧化物化学性质3Fe3O4+28HNO3===9Fe(NO3)3+NO↑+14H2O(1)Fe(OH)2 悬浊液与 O2 反应:4Fe(OH)2+O2+2H2O===4Fe(OH)3(2)Fe(OH)2 与盐酸反应:Fe(OH)2+2H+===Fe2++2H2O(3)Fe(OH)2 与稀 HNO3 反应:3Fe(OH)2+10HNO3==3Fe(NO3)3+NO↑+8H2O(4)Fe(OH)2 与 HI 溶液反应:Fe(OH)2+2HI===FeI2+2H2O(5)Fe(OH)3 与盐酸反应:Fe(OH)3+3H+===Fe3++3H2O(6)Fe(OH)3 与稀 HNO3 反应:Fe(OH)3+3HNO3===Fe(NO3)3+3H2O(7)Fe(OH)3 与 HI 溶液反应:2Fe(OH)3+6HI===2FeI2+I2+6H2O(8)Fe(OH)3 受热分解的反应:2Fe(OH)3≜Fe2O3+3H2O(9)Fe(OH)2 在空气中加热解:(四)亚铁盐(Fe2+)和铁盐(Fe3+)的化学性质4Fe(OH)2+O2≜2Fe2O3+4H2O(1)FeSO4 溶液与 Zn 反应(离子方程式,下同):Fe2++Zn==Fe+Zn2+(2)FeCl2 溶液与 Cl2 反应:2Fe2++Cl2===2Fe3++2Cl 一(3)FeBr2 溶液与 Br2 反应:2Fe2++Br2===2Fe3++2Br 一(4)酸化 FeSO4 溶液与 O2 反应:4Fe2++O2+4H+==4Fe3++2H2O(5)酸化 FeSO4 溶液与 H2O2 :2Fe2++H2O2+2H+==2Fe3++2H2O(6)Fe(NO3)2 溶液与稀 HNO3:3Fe2++NO3 一+4H+=3Fe3++NO↑+2H2O(7)FeSO4 溶液与酸性 KMnO4 溶液:MnO4-+5Fe2++8H+==5Fe3++Mn2++4H2O(8)FeSO4 与酸性 K2Cr2O7 溶液:Cr2O72-+6Fe2++14H+===6Fe3++2Cr3++7H2O(9)FeSO4 溶液与氨水反应:Fe2++2NH3*H2O===Fe(OH)2↓+2NH4+(10)FeSO4 溶液与 NaOH 溶液反应:Fe2++2OH 一===Fe(OH)2↓(11)Fe2(SO4)3 溶液与少量 Zn:2Fe3++Zn==Fe2++Zn2+(12)Fe2(SO4)3 溶液与过量 Zn2Fe3++3Zn==Fe+3Zn2+(13)FeCl3 溶液与 Fe 反应:2Fe3++Fe==3Fe2+(14)FeCl3 溶液与 Cu 反应:2Fe3++Cu==2Fe2++Cu2+(15)Fe2(SO4)3 溶液与 SO2 反应:2Fe3++SO2+2H2O==2Fe2++SO42-+4H+(16)FeCl3 溶液与 H2SO3 反应:2Fe3++H2SO3+H2O==2Fe2++SO42-+4H+(17)FeCl3 溶液与 H2S 反应:2Fe3++H2S===2Fe2++S↓+2H+(18)FeCl3 溶液与 HI 反应:2Fe3++2I 一===2Fe2++I2(19)FeCl3 溶液与少量 Na2SO3 溶液:2Fe3++SO32-+H2O==2Fe2++SO42-+2H+(20)FeCl3 溶液与少量 Na2S 溶液:2Fe3++S2-===2Fe2++S↓(21)FeCl3 溶液与 KI 溶液反应:2Fe3++2I 一===2Fe2++I2(22)Fe2(SO4)3 溶液与氨水反应:3Fe3++3NH3*.H2O==Fe(OH)3↓+3NH4+(23)Fe2(SO4)3 与 NaOH 溶液反应:三、铝及其重要化合物的化学性质Fe3++3OH 一===Fe(OH)3↓(1)Al 与 O2 反应:4Al+3O22Al2O3(2)Al 与 S 反应:2Al+3SAl2S3(3)Al 与 Fe3O4 反应:8Al+3Fe3O4Al2O3+9Fe(4)Al 与盐酸反应:2Al+6H+===2Al3++3H2↑(5)Al 与稀 H2SO4 溶液反应:2 Al+3H2SO4=2Al(SO4)3+3H2↑(6)Al 与浓 H2SO4(加热)反应:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O(7)Al 与浓 H2SO4(常温)反应:2Al+3H2SO4==Al2O3+3SO2↑+3H2O(8)Al 与稀 HNO3 溶液反应:Al+4HNO3(稀)==Al(NO3)3+NO↑+2H2O(9)Al 与浓 HNO3(加热)反应:Al+6HNO3(浓)Al(NO3)3+3NO2↑+3H2O(10)Al 与浓 HNO3(常温)反应:2Al+6HNO3(浓)===Al2O3+6NO2↑+3H2O(11)Al 与 NaOH 溶液(化学方程式):2Al+2NaOH+2H2O=2NaAlO2+3H2↑(12)Al 与 KOH 溶液(离子方程式):2Al+2OH 一+2H2O=2AlO2 一+3H2↑(13)Al2O3 与 H2SO4 溶液反应:Al2O3+3H2SO4===2Al2(SO4)3+3H2O(14)Al2O3 与 NaOH 溶液反应:Al2O3+2NaOH=2NaAlO2+2H2O(15)Al(OH)3 与盐酸反应:Al(OH)3+3HCl===AlCl3+3H2O(16)Al(OH)3 与 NaOH 溶液反应:Al(OH)3+NaOH=NaAlO2+2H2O(17)Al(OH)3 加热的反应:2Al(OH)3≜Al2O3+3H2O(18)AlCl3 溶液与氨水反应:AlCl3+3NH3*H2O=Al(OH)3↓+3NH4Cl(19)AlCl3 与少量 NaOH 溶液反应:Al3++3OH-==Al(OH)3↓(20)AlCl3 与过量 NaOH 溶液反应:Al3++4OH-==AlO2 一+2H2O(21)NaAlO2 溶液与少量 CO2:2AlO2 一+CO2+3H2O==2Al(OH)3↓+CO32 一(22)NaAlO2 溶液与过量 CO2:AlO2 一+CO2+2H2O==Al(OH)3↓+HCO3 一(23)NaAlO2 溶液与少量盐酸:AlO2 一+H++H2O==Al(OH)3↓(24)NaAlO2 与过量盐酸反应:AlO2 一+4H+==Al3++2H2O(25)NaAlO2 与 AlCl3 溶液反应:3AlO2 一+Al3++6H2O==4Al(OH)3↓(26)NaAlO2 与 NaHCO3 溶液:AlO2 一+HCO3 一+H2O==Al(OH)3↓+CO32 一(27)工业冶炼铝反应:2Al2O3 (融化)4Al+3O2↑四、铜及其重要化合物的化学性质(1)Cu 与 Cl2 反应(加热):Cu+Cl2CuCl2(2)Cu 与 S 反应(加热): 2Cu+SCu2S(3)Cu 与潮湿的空气(生锈):2Cu+O2+CO2+H2O===Cu2(OH)2CO3(4)Cu 与浓 H2SO4 溶液反应:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O(5)Cu 与稀 HNO3 反应:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O(6)Cu 与浓 HNO3 反应:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O(7)Cu 与 FeCl3 溶液反应:Cu+2FeCl3==CuCl2+2FeCl2(8)Cu 与 AgNO3 溶液:Cu+2AgNO3==Cu(NO3)2+2Ag(9)CuO 与 H2 的反应:CuO+H2Cu+H2O(10)CuO 与 C 的反应:2CuO+C2Cu+CO2(11)CuO 与 Al 的反应:3CuO+2Al3Cu+Al2O3(12)CuO 与 CO 的反应:CuO+COCu+CO2(13)CuO 与稀 H2SO4 溶液的反应:CuO+H2SO4==CuSO4+H2O(14)Cu2O 与 H2 的反应:Cu2O+H22Cu+H2O(15)Cu2O 与 C 的反应:2Cu2O+C4Cu+CO2(16)Cu2O 与 Al 的反应:3Cu2O+2Al6Cu+Al2O3(17)Cu2O 与 CO 的反应:Cu2O+CO2Cu+CO2(18)Cu2O 与稀 H2SO4 溶液的反应:Cu2O+H2SO4==CuSO4+Cu+H2O(19)Cu2O 与稀 HNO3 反应:3Cu2O+14HNO3(稀)==6Cu(NO3)2+2NO↑+7H2O(20)Cu(OH)2 与稀 H2SO4 溶液反应:Cu(OH)2+H2SO4==CuSO4+2H2O(21)Cu(OH)2 与乙醛溶液反应:CH3CHO+2Cu(OH)2+NaOHCH3COONa+Cu2O↓+2H2O(22)CuSO4 溶液与 Fe 反应:CuSO4+Fe==FeSO4+Cu(23)CuSO4 与 NaOH 溶液反应:CuSO4+2NaOH==Cu(OH)2↓+Na2SO4(24)CuSO4 与少量氨水反应:CuSO4+2NH3*H2O==Cu(OH)2↓+(NH4)2SO4(25)CuSO4 固体吸收水应的反应:CuSO4+5H2O==CuSO4*5H2O(26)CuSO4 晶体加热反应:五、镁及其重要化合物的化学性质CuSO4*5H2OCuSO4+5H2O(1)Mg 与 N2 反应:3Mg+N2Mg3N2(2)Mg 与 H2O 反应:Mg+2H2OMg(OH)2+H2↑(3)Mg 与 CO2 反应:2Mg+CO22MgO+C(4)Mg 与盐酸反应:Mg+2HCl===MgCl2+H2↑(5)Mg 与稀 H2SO4 反应:Mg+H2SO4==MgSO4+H2↑(6)Mg 与浓 H2SO4 反应:Mg+2H2SO4==MgSO4+SO2↑+2H2O(7)Mg 与稀 HNO3 反应:3Mg+8HNO3==3Mg(NO3)2+2NO↑+4H2O(8)Mg 与浓 HNO3 反应:Mg+4HNO3==Mg(NO3)2+2NO2↑+2H2O(9)MgO 与盐酸反应:MgO+2HCl===MgCl2+H2O(10)Mg(OH)2 与 H2SO4 溶液:Mg(OH)2+H2SO4===MgSO4+2H2O(11)Mg(OH)2 加热的反应:Mg(OH)2MgO+H2O(12)MgCl2 与氨水反应:Mg2++2NH3.H2O===Mg(OH)2↓+2NH4+(13)MgCl2 溶液与 NaOH 溶液反应:Mg2++2OH 一===Mg(OH)2↓(14)MgCO3 与盐酸反应:MgCO3+2HCl===MgCl2+H2O+CO2 ↑(15)工业冶炼镁:六、氯及其化合物的性质反应MgCl2 (融化)Mg+Cl2↑(1)Cl2 与 Fe 反应:3Cl2+2Fe2FeCl3(棕褐色烟)(2)Cl2 与 Cu 反应:Cl2+CuCuCl2(棕黄色烟)(3)Cl2 与 H2 反应:Cl2+H22HCl(苍白色火焰)(4)Cl2 与 Si 反应:2Cl2+SiSiCl4(5)Cl2 与 H2O 反应:Cl2+H2O⇌HCl+HClO(6)Cl2 与 NaOH 溶液反应:Cl2+2NaOH==NaCl+NaClO+H2O(7)Cl2 与 Ca(OH)2 反应:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O(8)Cl2 与 H2S 溶液反应:Cl2+H2S===S+2HCl(9)Cl2 与 H2SO3 溶液反应:Cl2+H2SO3+H2O===H2SO4+2HCl(10)Cl2 与 SO2 溶液反应:Cl2+SO2+2H2O==H2SO4+2HCl(11)Cl2 与 FeCl2 反应:Cl2+2FeCl2==2FeCl3(12)Cl2 与 KI 溶液反应:Cl2+2KI==2KCl+I2(13)Cl2 与 Na2SO3 溶液反应:Cl2+Na2SO3+H2O==Na2SO4+2HCl(14)HClO 分解反应:2HClO2HCl+O2↑(15)NaClO 溶液与 CO2 反应:NaClO+CO2+H2O===HClO+NaHCO3(16)Ca(ClO)2 溶液与少量 CO2 反应:Ca(ClO)2+CO2+H2O==2HClO+CaCO3↓(17)Ca(ClO)2 溶液与过量 CO2 反应:Ca(ClO)2+2CO2+2H2O===2HClO+Ca(HCO3)2(18)MnO2 与浓盐酸反应:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O(19)KMnO4 与浓盐酸反应:2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O(20)KClO3 与浓盐酸反应:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O(21)Ca(ClO)2 与浓盐酸反应:Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O(22)电解饱和 NaCl 溶液反应:七、硫及其化合物的性质(一)硫单质的性质反应2NaCl+2H2O2NaOH+Cl2↑+H2↑(1)S 与 Fe 反应:S+FeFeS(2)S 与 Cu 反应:S+CuCuS(3)S 与 Hg 反应:S+Hg== HgS(4)S 与 O2 反应:S+O2SO2(5) S 与 NaOH 溶液反应: 3S+6NaOH==Na2SO3+2Na2S+3H2O(6)S 与 Ca(OH)2 溶液反应:3S+3Ca(OH)2==CaSO3+2CaS+3H2O(7)S 与浓 H2SO4 溶液反应:S+2H2SO4(浓)==3SO2↑+2H2O(8)S 与浓 HNO3 溶液反应:S+6HNO3(浓)H2SO4+6NO2↑+2H2O(9)S 与 Na2SO3 溶液反应:S+Na2SO3==Na2S2O3(10)S 与 Na2S 溶液反应:(二)硫的氧化物性质反应S+Na2S==Na2S2(1)SO2 与 O2 反应:2SO2+ O22SO3(2)SO2 与 Cl2 溶液反应:SO2+Cl2+2H2O==H2SO4+2HCl(3)SO2 与 Br2 溶液反应:SO2+Br2+2H2O==H2SO4+2HBr(4)SO2 与 I2 溶液反应:SO2+I2+2H2O==H2SO4+2HI(5)SO2(少量)与 NaOH 溶液反应:SO2+2NaOH==Na2SO3+H2O(6)SO2(过量)与 NaOH 溶液反应:SO2+NaOH==NaHSO3(7)SO2(少量)与 Ca(OH)2 溶液反应:SO2+Ca(OH)2==CaSO3+H2O(8)SO2(过量)与 Ca(OH)2 溶液反应:2SO2+Ca(OH)2==Ca(HSO3)2(9)SO2(少量)与氨水反应:SO2+2NH3*H2O==(NH4)2SO3+H2O(10)SO2(过量)与氨水反应:SO2+NH3*H2O==NH4HSO3(11)SO2 与 H2S 反应:SO2+2H2S==3S+2H2O(12)SO2 与稀 HNO3 溶液反应:3SO2+2HNO3+2H2O==3H2SO4+2NO↑(13)SO2 与 HClO 溶液反应:SO2+HClO+H2O==H2SO4+HCl(14)SO2 与 Na2SO3 溶液反应:SO2+Na2SO3+H2O==2NaHSO3(15)SO2 与 CaSO3 悬浊液反应:SO2+CaSO3+H2O==Ca(HSO3)2(16)SO2(少量)与 NaHCO3 溶液反应:SO2+2NaHCO3==Na2SO3+2CO2↑+H2O(17)SO2(过量)与 Na2S 溶液反应:5SO2+2Na2S+2H2O==4NaHSO3 +3S↓(18)SO2 与 FeCl3 溶液反应:SO2+2Fe3++2H2O==SO42-+2Fe2++4H+(19)SO2 与 KMnO4 溶液:5SO2+2MnO4-+2H2O==5SO42-+2Mn2++4H+(20)SO2 与酸性 K2Cr2O7 溶液:3SO2+Cr2O72-+2H+==3SO42-+2Cr3++H2O(21)SO2(少量)与 NaClO 溶液:SO2+3ClO-+H2O==SO42-+Cl-+2HClO(22)SO2(过量)与 NaClO 溶液:SO2+ClO-+H2O==SO42-+Cl-+ 2H+(23)SO2(过量)与Ca(ClO)2溶液:2SO2+Ca2++2ClO-+2H2O==CaSO4↓+SO42-+2Cl-+ 4H+(24)SO2(少量)与Ba(NO3)2溶液:3SO2+3Ba2++2NO3-+2H2O==3BaSO4↓+2NO↑+ 4H+(25)SO2 与水反应:SO2+H2OH2SO3(26)SO2 与 Na2O 反应:SO2+Na2O ==Na2SO3(27)SO2 与 CaO 反应:SO2+CaO ==CaSO3(28)SO2 与 Na2O2 反应:SO2+Na2O2 ==Na2SO4(29)SO2 与 H2O2 溶液反应:SO2+H2O2 ==H2SO4(30)SO2 与 NO2 气体反应:SO2+NO2 ==SO3 +NO(31)SO3 与 H2O 反应:SO3+H2O ==H2SO4(32)SO2)与 CaO 反应SO3+CaO ==CaSO4(33)SO3 与 NaOH 溶液反应:SO3+2NaOH ==Na2SO4+H2O(34)SO3 与 Ca(OH)2 溶液反应:SO3+Ca(OH)2 ==CaSO4+H2O(35)SO3 催化分解反应:2SO32SO2+ O2(三)硫酸的性质反应(1)稀 H2SO4 与 Mg 反应:H2SO4+ Mg == MgSO4+H2↑(2)稀 H2SO4 与 Al 反应:3H2SO4+ 2Al == Al2(SO4)3+3H2↑(3)稀 H2SO4 与 Zn 反应:H2SO4+ Zn == ZnSO4+H2↑(4)稀 H2SO4 与 Fe 反应:H2SO4+ Fe ==FeSO4+H2↑(5)稀 H2SO4 与 NaOH 溶液反应: H2SO4+ 2NaOH ==Na2SO4+2H2O(6)稀 H2SO4 与 Ba(OH)2 溶液反应:H2SO4+Ba(OH)2==BaSO4↓+2H2O(7)稀 H2SO4 与 BaCl2 溶液反应:H2SO4+BaCl2==BaSO4↓+2HCl(8)稀 H2SO4 与 NaHCO3 溶液反应:H2SO4+2NaHCO3==Na2SO4+2H2O+2CO2↑(9)稀 H2SO4 与 Na2SO3 溶液反应:H2SO4+Na2SO3==Na2SO4+H2O+SO2↑(10)稀 H2SO4 与 Al2O3 反应:3H2SO4+ Al2O3== Al2(SO4)3+3H2O(11)稀 H2SO4 与 Fe2O3 反应:3H2SO4+ Fe2O3== Fe2(SO4)3+3H2O(12)稀 H2SO4 与 CuO 反应:H2SO4+CuO==CuSO4+H2O(13)稀 H2SO4 与 Cu2O 反应:H2SO4+Cu2O==CuSO4+Cu+H2O(14)浓 H2SO4 与 Mg 反应:Mg+2H2SO4(浓) == MgSO4+SO2↑+2H2O(15)浓 H2SO4 与 Zn 反应:Zn+2H2SO4(浓) == ZnSO4+SO2↑+2H2O(16)浓 H2SO4 与 Al(常温)反应:2Al+3H2SO4(浓) ==Al2O3+3SO2↑+3H2O(17)浓 H2SO4 与 Al(加热)反应:2Al+6H2SO4(浓)Al2(SO4)3+3SO2↑+6H2O(18)浓 H2SO4 与 Fe(常温)反应:2Fe+3H2SO4(浓) ==Fe2O3+3SO2↑+3H2O(19)浓 H2SO4 与 Fe(加热)反应:2Fe+6H2SO4(浓)Fe2(SO4)3+3SO2↑+6H2O(20)浓 H2SO4 与 Cu 反应:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O(21)浓 H2SO4 与 C 反应:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O(22)浓 H2SO4 与 S 反应: S+2H2SO4(浓)3SO2↑+2H2O(23)浓 H2SO4 与 H2S 反应:H2S+H2SO4(浓) ==S↓+SO2↑+H2O(24)浓 H2SO4 与 HI 反应:2HI+H2SO4(浓) ==I2+SO2↑+2H2O(25)浓 H2SO4 与 FeO 反应:2FeO+4H2SO4(浓)==Fe2(SO4)3+SO2↑+4H2O (27)浓 H2SO4 与 Fe(OH)2 反应: 2Fe(OH)2+4H2SO4(浓)==Fe2(SO4)3+SO2↑+6H2O(27)浓 H2SO4 与 Na2SO3 反应:八、氮及其化合物的性质(一)氮及氮的氧化物的性质反应Na2SO3+H2SO4(浓)==Na2SO4+SO2↑+H2O(1)N2 与 Mg 反应:N2 +3MgMg3N2(2)N2 与 O2 反应:N2+O22NO(3)N2 与 H2 反应:N2+3H22NH3(4)N2 与 Li 反应:N2+6Li2Li3N(5)NO 与 O2 反应: 2NO+O2 == 2NO2(6)NO 和 O2 与 H2O 溶液反应:4NO+3O2 +2H2O== 4HNO3(7)NO 与 NH3 反应:6NO+4NH3==5N2 + 6H2O(8)NO2 与 H2O 反应:3NO2+2H2O== 2HNO3+NO(9)NO2 和 O2 与 H2O 溶液反应:4NO2+O2 +2H2O== 4HNO3(10) NO2 与 NaOH 溶液溶液反应:2NO2+2NaOH == NaNO3 +NaNO2+ H2O(10)NO2 和 NO 与 NaOH 溶液反应:NO2+NO+2NaOH == 2NaNO2+ H2O(11)NO2 与 NH3 反应:6NO2+8NH3==7N2 + 12H2O(12)NO2 与 SO2 反应:(二)氨及铵盐的性质反应NO2+SO2== 2SO3+NO(1)NH3 与 O2 反应:4NH3+5O24NO+6H2O(2)NH3 与 Cl2 反应:8NH3+3Cl2===N2+6NH4Cl(3)NH3 与 H2O 反应NH3 + H2O ⇌ NH3·H2O(4)NH3 与 HCl 气体反应:NH3+HCl===NH4Cl(5)NH3 与 H2SO4 溶液反应:2NH3+H2SO4==(NH4)2SO4(6)NH3 与 MgCl2 溶液反应:2NH3+2H2O+Mg2+==2NH4++Mg(OH)2↓(7)NH3 与 AlCl3 溶液反应:3NH3+3H2O+Al3+==3NH4++Al(OH)3↓(8)NH3 与 FeCl3 溶液反应:3NH3+3H2O+Fe3+==3NH4++Fe(OH)3↓(9)NH3 与 CuO 反应:2NH3+3CuO3Cu+N2+3H2O(10)NH3 与 NO 反应:6NO+4NH35N2+6H2O(11)NH3 与 NO2 反应:6NO2+8NH37N2+12H2O(12)氨水与 SO2(少量)反应:2NH3*H2O+SO2==(NH4)2SO3+H2O(13)氨水与 SO2(过量)反应NH3*H2O+SO2==NH4HSO3(14)氨水与 CaO 反应:NH3*H2O+CaO==NH3↑+Ca(OH)2(15)NH4Cl 加热反应:NH4Cl≜NH3↑+HCl↑(16)NH4HCO3 加热反应:NH4HCO3≜ NH3↑+CO2↑+H2O(17)(NH4)2CO3 加热反应:(NH4)2CO3≜ 2NH3↑+CO2↑+H2O(18)加 NH4NO3 热反应:NH4NO3 ≜N2O↑+2H2O(19)NH4Cl 与 NaOH 溶液反应:NH4Cl+NaOH==NaCl+NH3*H2O(20)NH4Cl 与 NaOH 溶液(加热)反应:NH4Cl+NaOH≜NaCl+NH3↑+H2O(21)(NH4)2CO3 与 Ca(OH)2 溶液反应:(NH4)2CO3+Ca(OH)2==CaCO3↓+2NH3*H2O(22)(NH4)2SO4 与 Ba(OH)2 溶液反应:(NH4)2SO4+Ba(OH)2==BaSO4↓+2NH3*H2O(23)NH4HCO3 与 NaOH 溶液(过量)反应:NH4++HCO3-+2OH-==CO32-+2NH3*H2O(24)NH4HCO3 与 NaOH 溶液(少量)反应:HCO3-+OH-==CO32-+H2O(25) NH4Cl 与 Ca(OH)2 加热反应:2NH4Cl+Ca(OH)2≜CaCl2+2NH3↑+2H2O(26)NH4Cl 与 Ba(OH)2*8H2O 反应:2NH4Cl+Ba(OH)2∗ 8��2�� =BaCl2+2NH3↑+10H2O(27)侯氏制碱法反应:NaCl+NH3·H2O+CO2==NaHCO3↓+NH4Cl(28)NH4+的检验(离子)反应:(三)硝酸的性质反应NH4++OH-≜NH3↑+H2O(1)HNO3 与 NaOH 反应:HNO3+NaOH==NaNO3+H2O(2)HNO3 与 Fe(OH)3 反应:3HNO3 +Fe(OH)3==Fe(NO3)3+3H2O(3)HNO3 与 NH3 反应:HNO3+NH3==NH4NO3(4)HNO3 与 CuO 反应:2HNO3+CuO==Cu(NO3)2+H2O(5)HNO3 与 Fe2O3 反应: 6HNO3 +Fe2O3==2Fe(NO3)3+3H2O(6)HNO3 与 CaCO3 反应:2HNO3+CaCO3==Ca(NO3)2+H2O+CO2↑(7)稀 HNO3 与 Mg 反应:8HNO3(稀)+3Mg==3Mg(NO3)2+2NO↑+4H2O(8)浓 HNO3 与 Mg 反应:4HNO3(浓)+Mg==Mg(NO3)2+2NO2↑+2H2O(9)稀 HNO3 与 Al 反应:4HNO3(稀)+Al==Al(NO3)3+NO↑+2H2O(10)浓 HNO3 与 Al(加热)反应:6HNO3(浓)+AlAl(NO3)3+3NO2↑+3H2O(11)浓 HNO3 与 Al(常温)反应:6HNO3(浓)+2Al==Al2O3+6NO2↑+3H2O(12)稀 HNO3 与 Fe(少量)反应:4HNO3(稀)+Fe==Fe(NO3)3+NO↑+2H2O(13)稀 HNO3 与 Fe(过量)反应:8HNO3(稀)+3Fe==Fe(NO3)2+2NO↑+4H2O(14)浓 HNO3 与 Fe(加热)反应:6HNO3(浓)+FeFe(NO3)3+3NO2↑+3H2O(15)浓 HNO3 与 Fe(常温)反应:6HNO3(浓)+2Fe==Fe2O3+6NO2↑+3H2O(16)稀 HNO3 与 Cu 反应:8HNO3(稀)+3Cu==Cu(NO3)2+2NO↑+4H2O(17)浓 HNO3 与 Cu 反应:4HNO3(浓)+Cu==Cu(NO3)2+2NO2↑+2H2O(18)浓 HNO3 与 C 反应: 4HNO3(浓)+CCO2↑+4NO2↑+2H2O(19)浓 HNO3 与 S 反应:6HNO3(浓)+SH2SO4+6NO2↑+2H2O(20)稀 HNO3 与 H2S 反应:2HNO3(稀)+3H2S==3S+2NO↑+4H2O(21)稀 HNO3 与 H2SO3 反应:2HNO3(稀)+3H2SO3==3H2SO4+2NO↑+H2O(22)稀 HNO3 与 HI 反应:2HNO3(稀)+6HI==3I2+2NO↑+4H2O(23)稀 HNO3 与 Fe(OH)2 反应:10HNO3(稀)+3Fe(OH)2==3Fe(NO3)3+NO↑+8H2O(24)稀 HNO3 与 FeO 反应:10HNO3(稀)+3FeO==3Fe(NO3)3+NO↑+5H2O(25)稀 HNO3 与 SO2 反应:2HNO3(稀)+3SO2+2H2O==3H2SO4+2NO↑(26)稀 HNO3 与 Fe(NO3)2 反应:九、硅及其化合物的性质反应4HNO3(稀)+3Fe(NO3)2==3Fe(NO3)3+NO↑+2H2O(1)Si 与 F2 反应:Si+2F2===SiF4(2)Si 与 Cl2 反应:Si+2Cl2≜SiCl4(3)Si 与 O2 反应:Si+O2≜SiO2(4)Si 与 NaOH 溶液反应: Si+2NaOH+H2O===Na2SiO3+2H2↑(5)Si 与 HF 溶液反应:Si+4HF===SiF4+2H2↑(6)SiO2 与 NaOH 溶液反应:SiO2+2NaOH===Na2SiO3+H2O(7)SiO2 与 HF 溶液反应:SiO2+4HF===SiF4+2H2O(8)SiO2 与 C 反应:SiO2+2CSi+2CO↑(9)Si 与 HCl 反应:Si+3HCl≜SiHCl3+H2(10)SiHCl3 与 H2 反应:SiHCl3+H2Si+3HCl(11)SiO2 与 Na2CO3 反应:SiO2 +Na2CO3Na2SiO3+CO2↑(12)SiO2 与 CaCO3 反应:SiO2 +CaCO3CaSiO3+CO2↑(13)Na2SiO3 溶液与 CO2(少量)反应:Na2SiO3+CO2+H2O==H2SiO3↓+Na2CO3(14)Na2SiO3 溶液与 CO2(过量)反应:Na2SiO3+2CO2+2H2O==H2SiO3↓+2NaHCO。
高中所有化学方程式总结大全

下面是高中化学所有方程式进行了总结整理,太全了,包含了高中所有的方程式,大家可以学习参考化合反应1、镁在空气中燃烧:2Mg + O2 点燃 2MgO2、铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43、铝在空气中燃烧:4Al + 3O2 点燃 2Al2O34、氢气在空气中燃烧:2H2 + O2 点燃 2H2O5、红磷在空气中燃烧:4P + 5O2 点燃 2P2O56、硫粉在空气中燃烧: S + O2 点燃 SO27、碳在氧气中充分燃烧:C + O2 点燃 CO28、碳在氧气中不充分燃烧:2C + O2 点燃 2CO9、二氧化碳通过灼热碳层: C + CO2 高温 2CO10、一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO3 -12、生石灰溶于水:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4?5H2O14、钠在氯气中燃烧:2Na + Cl2点燃 2NaCl分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑16、加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑17、水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温CaO + CO2↑置换反应20、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu21、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑22、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑23、氢气还原氧化铜:H2 + CuO 加热 Cu + H2O24、木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑25、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O26、水蒸气通过灼热碳层:H2O + C 高温 H2 + CO27、焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO4 -29、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O30、酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O31、一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO232、一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 + 2HCl === CaCl2 + H2O + CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热:2Cu + O2 加热 2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O57. 硫粉在空气中燃烧: S + O2 点燃 SO28. 碳在氧气中充分燃烧:C + O2 点燃 CO29. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O二.几个分解反应:13. 水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热2CuO + H2O + CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑16. 加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑17. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑18. 高温煅烧石灰石:CaCO3 高温CaO + CO2↑几个氧化还原反应:19. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O20. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温3Fe + 2CO2↑23. 一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO225. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸 -------- 盐 + 氢气(置换反应)26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑其它反应:71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl 72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4?5H2O 加热 CuSO4 + 5H2O77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4?5H2化学方程式反应现象应用2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe + 3O2高温2Fe2O3C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2 Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgOΔ2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O +CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4 =MgSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO4)3+3H2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2 Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2 Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2 点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2C O+O2点燃2CO2 蓝色火焰煤气燃烧C + CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 高温4Fe+ 3CO2↑ 冶炼金属Fe3O4+2C高温3Fe + 2CO2↑ 冶炼金属43、一氧化氮与氧气反应:2NO + O2 = 2NO244、二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NO45、二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2 催化剂 2SO346、三氧化硫与水反应:SO3 + H2O = H2SO447、浓硫酸与铜反应:Cu + 2H2SO4(浓) △ CuSO4 + 2H2O + SO2↑48、浓硫酸与木炭反应:C + 2H2SO4(浓) △ CO2 ↑+ 2SO2↑ + 2H2O49、浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑50、稀硝酸与铜反应:3Cu + 8HNO3(稀) △ 3Cu(NO3)2 + 4H2O + 2NO↑51、氨水受热分解:NH3·H2O △ NH3↑ + H2O52、氨气与氯化氢反应:NH3 + HCl = NH4Cl53、氯化铵受热分解:NH4Cl △ NH3↑ + HCl↑54、碳酸氢氨受热分解:NH4HCO3 △ NH3↑ + H2O↑ + CO2↑55、硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △ NH3↑ + NaNO3 + H2O56、氨气的实验室制取:2NH4Cl + Ca(OH)2 △ CaCl2 + 2H2O + 2NH3↑57、氯气与氢气反应:Cl2 + H2 点燃 2HCl58、硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △ 2NH3↑ + Na2SO4 + 2H2O59、SO2 + CaO = CaSO360、SO2 + 2NaOH = Na2SO3 + H2O61、SO2 + Ca(OH)2 = CaSO3↓ + H2O62、SO2 + Cl2 + 2H2O = 2HCl + H2SO463、SO2 + 2H2S = 3S + 2H2O64、NO、NO2的回收:NO2 + NO + 2NaOH = 2NaNO2 + H2O65、Si + 2F 2 = SiF466、Si + 2NaOH + H2O = NaSiO3 +2H2↑67、硅单质的实验室制法:粗硅的制取:SiO2 + 2C 高温电炉 Si + 2CO (石英沙)(焦碳)(粗硅)粗硅转变为纯硅:Si(粗)+ 2Cl2 △ SiCl4SiCl4 + 2H2 高温 Si(纯)+ 4HCl。
(完整版)高中有机化学方程式总结
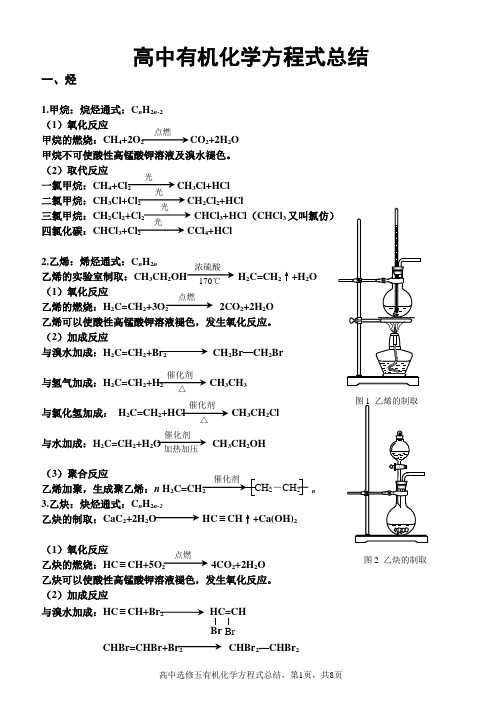
高中有机化学方程式总结一、烃1.甲烷:烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯:烯烃通式:C n H 2n乙烯的实验室制取:CH 3CH 2OH H 2C=CH 2↑+H 2O (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2 n3.乙炔:炔烃通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CHBr点燃光光光光浓硫酸170℃ 点燃催化剂△催化剂加热加压 2-CH 2点燃图2 乙炔的制取Br 催化剂△与氢气加成:HC ≡CH+H 2 H 2C=CH2与氯化氢加成:HC ≡CH+HCl CH2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯:苯的同系物通式:C n H 2n-6(1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
高中化学方程式全部归纳

高中化学方程式全部归纳1、电石上滴加饱和氯化钠溶液(实验室制乙炔)2、苯乙烯发生加聚反应3、乙炔与溴水物质的量1:1 加成反应4、苯的硝化反应5、甘油与足量钠的反应6、乙醇与灼热的氧化铜反应7、苯酚与碳酸钠的反应8、溴乙烷与氢氧化钠醇溶液加热9、在热NaOH 溶液中的水解10、a -羟基丙酸缩聚11 、葡萄糖与新制氢氧化铜浊液混合加热12、与NaOH 溶液反应13、油酸甘油酯酸性条件下水解14、乙炔和丙烯1:1 共聚15、硬脂酸甘油酯皂化反应16、蔗糖水解17、两分子a -羟基丙酸脱水成环18、以水杨酸和乙酸酐制阿司匹林19、草酸使酸性重铬酸钾溶液褪色20、铁和水蒸气反应21、向偏铝酸钠溶液中通入足量CO222、实验室制氨气23、硝酸分解24、C与浓硝酸反应25、电解饱和食盐水26、硫酸铜溶液除去乙炔中的硫化氢27、氢氧化铁与氢碘酸28、高锰酸钾和浓盐酸反应制氯气29、NaOH与少量Ca(HCO3)2溶液反应30、过氧化钠与水反应(单线桥)31、工业上冶炼镁32、碳酸钠溶液呈碱性的原因33、氨气在纯氧中燃烧34、SO2通入氢硫酸35、1molFeBr2 溶液中通入1mol 氯气36、向明矶溶液中滴入Ba(OH)2至AI3+恰好沉淀完全37、三氯化铁溶液中加入硫氰化钾38、实验室制SO239、钠与水反应40、硫与铜反应B1、乙烷与氯气在光照条件下反应2、2-丁烯与氯化氢加成3、甲苯制TNT4、乙炔与水加成5、甲苯与氢气加成6、异戊二烯加聚7、淀粉水解8、油酸甘油酯硬化9、B -羟基丙酸分子内脱水成环10、与稀硫酸溶液反应11、乙二醇和对苯二甲酸缩聚12、软脂酸甘油酯皂化反应13、苯酚与甲醛反应制酚醛树脂14、葡萄糖的催化加氢15、乙二酸二甲酯在酸性条件下水解16、丙醛与新制氢氧化铜浊液混合加热17、在热NaOH 溶液中的水解18、以阿司匹林和NaOH 制可溶性阿司匹林19、草酸使酸性高锰酸钾溶液褪色20、氢氧化铝的电离方程式21、NO2 与水22、铝热反应23、Cu 与浓硝酸反应24、汽车尾气NO、CO 的催化转化25、硫代硫酸钠溶液中加稀硫酸26、铁的吸氧腐蚀及铁锈生成过程27、四氧化三铁与氢碘酸28、SO2 通入硝酸钡溶液出现白色浑浊29、NaOH与足量Ca(HCO3)2溶液反应30、AI3+与足量氢氧化钠溶液反应31、接触法(工业)制硫酸32、氯化铁溶液呈酸性的原因33、浓氨水检验氯气管道泄露34、1moIFeI2 溶液中通入1moI 氯气35、向明矶溶液中滴入Ba(OH)2至SO42-恰好沉淀完全36、少量偏铝酸钠溶液滴到盐酸中37、酸雨的形成38、工业冶炼金属钠39、石灰乳与海水制取氢氧化镁40、氯气通入氢硫酸溶液中C1、甲苯制苯基溴代甲烷2、1,2,3-丁三醇的催化氧化3、乙烯与苯乙烯1:1 共聚4、苯酚与足量钠的反应5、丙醛的催化氧化6、丙烯酸加聚7、麦芽糖水解8、乙二酸和乙二醇脱水成环9、溶液中通入CO210、硬脂酸甘油酯酸性条件下水解11、乙二酸和对苯二甲醇缩聚12、实验室制乙烯13、葡萄糖在酒化酶的作用下发酵成乙醇14、苯酚与浓溴水的反应15、丙醛发生银镜反应16、在热NaOH 溶液中的水解17、甲醇与浓硫酸混合加热反应18、以阿司匹林和NaOH 制可溶性阿司匹林19、SO2 使酸性重铬酸钾溶液褪色20、铁和水蒸气反应21、实验室制氢氧化铝22、NH4HCO3溶液与过量NaOH反应23、实验室制氯气24、稀硝酸除银镜25、SO2使溴水褪色26、制玻璃27、向NaHSO4溶液中逐滴加入Ba(OH)2至刚好沉淀完全28、实验室制备氢氧化铁胶体29、1molFeBr2溶液中通0.2mol氯气30、Cu2O溶于稀硫酸31、S2O32-脱氯32、氨气与水反应显碱性33、向AlCl3 溶液中滴入偏铝酸钠34、除FeCI2 中的FeCI335、硝酸银溶液中逐滴滴氨水36、铝与氢氧化钠溶液反应37、Fe与足量稀硝酸38、碳和浓硫酸39、NO2与NaOH溶液反应40、硫酸铅溶于醋酸溶液D1 、甲苯制对溴甲苯2、乙醇的催化氧化3、纤维素水解4、溴乙烷与氢氧化钠水溶液混合反应5、1,3-丁二烯加聚6、丙烯腈加聚7、乙二醇与甲酸1:2 酯化8、两分子3 -羟基丙酸脱水成环9、葡萄糖与发生银镜反应10、油酸甘油酯酸性条件下水解11、油酸甘油酯硬化12、与NaHCO3 溶液反应13、苯酚钠溶液与二氧化碳的反应14、在热NaOH 溶液中的水解15、 a -羟基丙酸分子内脱水成环16、乙醇与浓硫酸混合加热到140 C17、 3 -羟基丙酸缩聚18、以水杨酸和乙酸酐制阿司匹林19、SO2 使酸性高锰酸钾溶液褪色20、氢氧化铝的电离方程式21、工业合成氨22、镁与CO2 反应23、氨的催化氧化24、铜和浓硫酸25、工业制粗硅26、制水煤气27、工业上冶炼铝28、氯气通入NaOH溶液(单线桥)29、硝酸亚铁溶液中滴入稀硫酸30、1molFeI2 溶液中通0.3mol 氯气31、向醋酸铅[(CH3COO)2Pb溶液中通入H2S气体32、工业上制硝酸33、SO2使紫色石蕊试液变红的原因34、除FeCI3 中的FeCI235、向NH4HSO4溶液中逐滴加入Ba(OH)2至刚好沉淀完全36、Fe与少量稀硝酸37、久置的铜表面生成铜绿38、高炉炼铁39、NO、NO2 尾气一起通入NaOH 溶液40、氯气和水。
高中化学方程式大全(完整版)
第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃3、32FeCl 2Cl 3Fe 2−−→−+点燃4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()( 9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)(10、O H NaCl NaClO Cl NaOH 222++→+11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 412、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢14、↑+→+HCl NaHS O S O H NaCl 442(浓) 15、↑+−→−+∆HCl S O Na NaCl NaHS O 42416、↑+−→−+∆HCl 2S O Na S O H NaCl 24242(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+18、33NaNO AgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO 4CO HNO 4C 2223+↑+↑→+23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀) 24、4243324S O H 15PO H 6P Cu 5O H 24CuS O 15P 11++→++ 25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓)26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀)27、O H 31S O K S O Fe 9S O Cr S O H 31O Fe 6O Cr K 2423423424243722+++→++)()( 28、↑+↑+→++2223CO 3N S K S C 3KNO 2第四节 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃 43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆48、S H H S 22−→−+∆49、2CS C S −−→−+高温50、22S O O S −−→−+点燃51、O H 3S O K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物52、↓+−→−∆S H S H 2253、2222S O 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足)55、↓+−−→−+S 3O H 2S O S H 2222点燃56、HBr 2S Br S H 22+↓→+57、↑+→+S H FeCl HCl 2FeS 2258、4224S O H CuS S H CuS O +↓→+59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合) 63、HCl 2FeCl 2S FeCl 2S H 232++↓→+64、↑+→+S H FeS O FeS S O H 2442(稀) 65、3222S O H O H S O ⇔+66、3OV 22SO 2O SO 252∆−−→←+ 67、4223S O H O H S O →+68、↑++→+22424232S O O H S O Na S O H S O Na69、O H S O Na NaOH 2S O 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2S O 2322+↓→+)( 72、23232HS O Ca O H CaS O S O )(→++73、O H 2S 3S H 2S O 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++75、42222SO H HBr 2O H 2Br SO +→++76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++第三节 硫酸的工业制法77、↑+−−→−+23222S O 8O Fe 2O 11FeS 4高温78、3OV 22SO 2O SO 252∆−−→←+ 79、4232S O H S O O H →+第四节 硫酸 硫酸盐80、O H 2S O 2CO S O H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2S O 3S O H 2S 2242+↑−→−+∆(浓)82、O H 2S O PO H S O H P 224342+↑+−→−+∆(浓) 83、O H 2S O S S O H S H 22422++−→−+∆(浓) 84、O H 2S O CuS O S O H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaS O S O H BaCl 4422+↓→+86、NaCl 2BaS O S O Na BaCl 4422+↓→+87、NaCl 2BaCO CO Na BaCl 3322+↓→+88、↑++→+2223CO O H BaCl HCl 2BaCO89、↑++→+222333CO O H NO Ba HNO 2BaCO )( 90、↑++→+2223232CO O H S Na S O H CO Na91、42232S O H 2O S O H 2→+92、42232S O Na 2O S O Na 2→+93、423CaS O 2O CaS O 2→+94、O H 6SO 3S O Fe S O H 6Fe 22234242+↑+−→−+∆)((浓) 95、O H S O Na S O Br S O H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2S O Na S O H NaCl 24242(浓) 97、O H 11C 12O H C 2SOH 11221142+−−−→−浓 第四章 碱金属第一节 钠98、O Na 2O Na 422→+99、222O Na O Na 2→+100、NaCl 2Cl Na 22−−→−+点燃101、S Na S Na 22−−→−+研磨102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuS O O H 2Na 2)( 第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+111、O H CO NaCl HCl NaHCO 223+↑+→+112、O H CO CO Na NaHCO 222323+↑+−→−∆113、O H CO Na NaOH NaHCO 2323+−→−+∆114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+117、NaCl 2CaCO CaCl CO Na 3232+↓→+118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)( 119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)( 120、O H S O NaCl HCl NaHS O 223+↑+→+第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃122、22KO O K −−→−+点燃123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素)124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
高中化学方程式完全版
高中化学方程式汇编无机化学部分非金属单质(F2,Cl2 , O2 , S, N2 , P , C , Si)1.氧化性:F2 + H2 === 2HF2F2 +2H2O===4HF+O2Cl2 +2FeCl2 ===2FeCl32Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I2Cl2+SO2 +2H2O===H2SO4 +2HCl(2004北京高考)2.还原性S+6HNO3(浓)===H2SO4+6NO2↑+2H2O3S+4 HNO3(稀)===3SO2+4NO↑+2H2OPX3+X2===PX5C+CO2===2CO(生成水煤气)(制得粗硅)Si+2NaOH+H2O===Na2SiO3+2H2↑3.(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O金属单质(Na,Mg,Al,Fe)的还原性4Na+O2===2Na2O2Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H2↑Mg+H2SO4===MgSO4+H2↑2Al+6HCl===2AlCl3+3H2↑2Al+3H2SO4===Al2(SO4)3+3H2↑2Al+6H2SO4(浓、热)===Al2(SO4)3+3SO2↑+6H2O(Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO3(稀)===Al(NO3)3+NO↑+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H2↑Fe+2HCl===FeCl2+H2↑Fe+CuCl2===FeCl2+Cu非金属氢化物(HF,HCl,H2O,H2S,NH3)1.还原性:16HCl+2KMnO4==2KCl+2MnCl2+5Cl2↑+8H2O(实验室常用)2H2S+SO2===3S↓+2H2O2NH3+3Cl2===N2+6HCl8NH3+3Cl2===N2+6NH4Cl4NH3+3O2(纯氧)===2N2+6H2O4NH3+6NO===5N2+6H2O(用氨清除NO)2.酸性:4HF+SiO2===SiF4+2H2O(HF保存在塑料瓶的原因,此反应广泛应用于测定矿样或钢样中SiO2的含量)H2S+CuCl2===CuS↓+2HClH2S+FeCl2===(不反应)3.碱性:NH3+HCl===NH4ClNH3+HNO3===NH4NO32NH3+H2SO4===(NH4)2SO4NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(此反应用于工业制备小苏打,苏打)4.不稳定性:2H2O2===2H2O+O2↑非金属氧化物1.低价态的还原性:2SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O===H2SO4+2HCl2NO+O2===2NO22CO+O2===2CO22.氧化性:NO2+2KI+H2O===NO+I2↓+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)3.与水的作用:SO2+H2O===H2SO3SO3+H2O===H2SO43NO2+H2O===2HNO3+NON2O5+H2O===2HNO3P2O5+H2O(冷)===2HPO3P2O5+3H2O(热)===2H3PO4(P2O5极易吸水,可作气体干燥剂)4.与碱性物质的作用:SO2+(NH4)2SO3+H2O===2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,再用H2SO4处理: 2NH4HSO3+H2SO4=== (NH4)2SO4 + 2H2O+ 2SO2生成的硫酸铵作化肥,SO2循环作原料气)SO2+Ca(OH)2===CaSO3+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+Ca(OH)2===CaSO4+H2OCO2+2NaOH(过量)===Na2CO3+H2OCO2(过量)+NaOH===NaHCO3CO2+Ca(OH)2(过量)===CaCO3↓+H2O2CO2(过量)+Ca(OH)2===Ca(HCO3)2CO2+2NaAlO2+3H2O===2Al(OH)3↓+Na2CO3CO2+C6H5ONa+H2O===C6H5OH↓+NaHCO3SiO2+2NaOH===Na2SiO3+H2O (强碱缓慢腐蚀玻璃)金属氧化物1.低价态的还原性:FeO+4HNO3===Fe(NO3)3+NO2↑+2H2O2。
高中所有化学方程式总结(全)
⾼中所有化学⽅程式总结(全)⾼中所有化学⽅程式总结(全)第⼀部分⾦属⼀、碱⾦属1.钠Na4Na+O2=2Na2O 2Na+S =Na2S(爆炸) 2Na+2H2O=2NaOH+H2↑ 2Na+2NH3=2NaNH2+H2 4Na+TiCl4(熔融)=4NaCl+TiNa2ONa2O+H2O=2NaOH Na2O+SO3=Na2SO4 Na2O+CO2=Na2CO3 Na2O+2HCl=2NaCl+H2ONa2O2+2Na=2Na2O(此反应⽤于制备Na2O) 2Na2O2+2CO2=2Na2CO3+O2 Na2O2+H2SO4(冷、稀)=Na2SO4+H2O22Na2O2+2H2O=4NaOH+O2↑(此反应分两步Na2O2+2H2O=2NaOH+H2O2;2H2O2=2H2O+O2↑。
H2O2的制备可利⽤类似的反应)NaHNaH+H2O=NaOH+H2↑NaOH2NaOH+Si+H2O=Na2SiO3+2H2↑2NaOH+2Al+2H2O=2NaAlO2+3H2↑2NaOH(过量)+CO2=Na2CO3+H2O NaOH+CO2(过量)=NaHCO32NaOH+SiO2=Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)2NaOH+Al2O3=2NaAlO2+H2O 2NaOH+Cl2=NaCl+NaClO+H2ONaOH+HCl=NaCl+H2O NaOH+H2S(⾜量)=NaHS+H2O2NaOH+H2S(少量)=Na2S+2H2O3NaOH+AlCl3=Al(OH)3↓+3NaCl NaOH+Al(OH)3=NaAlO2+2H2O2NaOH+P2O5=2NaPO3+H2O 6NaOH+P2O5=2Na3PO3+3H2ONaAlO22NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3 3NaAlO2+AlCl3+6H2O=4Al(OH)3↓NaCl、NaClO、NaBr、NaINaI+Cl2=2NaCl+I2NaBr+H3PO4(浓)=NaH2PO4+HBr NaI+H3PO4(浓)=NaH2PO4+HI Na2CO3、NaHCO3Na2CO3 +HCl=NaHCO3+NaClNaHCO3+HCl=NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O=2Al(OH)3↓+3CO2↑+6NaCl3Na2CO3+2FeCl3+3H2O=2Fe(OH)3↓+3CO2↑+6NaCl3NaHCO3+AlCl3=Al(OH)3↓+3CO2↑3NaHCO3+FeCl3=Fe(OH)3↓+3CO2↑NaHCO3+HCl=NaCl+CO2↑+H2O3Na2CO3+2Br2+H2O=2NaHCO3+2NaBrO+2NaBr+CO2↑NaHCO3+Br2=NaBr+HBrO+CO2↑NaNO3、NaNO2KClO3+6HCl =KCl+3Cl2↑+3H2ONaNO2+NH4Cl=NaCl+N2↑+2H2O Na3PO4、NaH2PO4、Na2HPO4 Na3PO4+HCl=Na2HPO4+NaCl Na2HPO4+HCl=NaH2PO4+NaCl NaH2PO4+HCl=H3PO4+NaClNa2S、NaHSNa2S+Cl2=2NaCl+S↓3Na2S+8HNO3(稀)=6NaNO3+2NO+3S↓+4H2O3Na2S+Al2(SO4)3+6H2O=2Al(OH)3↓+3H2S↑Na2SO4、Na2SO3、Na2S2O33Na2SO3+2HNO3(稀)=3Na2SO4+2NO↑+H2O2Na2SO3+O2=2Na2SO4 Na2S2O3+H2SO4=Na2SO4+S+SO2+H2O Na2SO3+SO2+H2O=2NaHSO3Na2SiO3Na2SiO3+2HCl=H2SiO3↓+2NaClC6H5ONaC6H5ONa+CO2+H2O=C6H5OH+NaHCO32.钾K 2K+2H2O=2KOH+H2↑K2O、K2O2K2O+H2O=2KOH K2O+CO2=K2CO3 2K2O2+2CO2=K2CO3+O2 2K2O2+2H2O=4KOH+O2 KOH 2KOH+CO2=K2CO3+H2O KOH+CO2=KHCO3K2CO3K2CO3+2HCl=2KCl+CO2↑+H2O K2CO3+CaCl2=CaCO3↓+2KCK2CO3+2AgNO3=Ag2CO3↓+2KNO3KHCO3 KHCO3+HCl=KCl+CO2↑+H2OKClO3 KClO3+6HCl=KCl+3Cl2↑+3H2OKI 2KI+Cl2=2KCl+I2 KI+AgNO3=AgI↓+KNO3KAl(SO4)22KAl(SO4)2+6NaOH=K2SO4+3Na2SO4+2Al(OH)3↓2KAl(SO4)2+3Ba(OH)2=K2SO4+3BaSO4↓+2Al(OH)3↓KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓KSCN 3KSCN+FeCl3=Fe(SCN)3+3KClKH KH+H2O=KOH+H2↑3.锂Li 2Li+2H2O=2LiOH+H2↑Li2O Li2O+CO2=Li2CO3 Li2O+H2O=2LiOHLiOH 2LiOH+CO2=Li2CO3↓+H2O LiOH+CO2=LiHCO3Li2CO3 Li2CO3+2HCl=2LiCl+CO2↑+H2OLiHCO3 LiHCO3+HCl=LiCl+CO2↑+H2O⼆、常见⾦属1.镁MgMg+2H2O=2Mg(OH)2↓+H2↑ Mg+S=MgS Mg+Br2=MgBr2Mg+2HCl=MgCl2+H2↑ Mg+H2SO4=MgSO4+H2↑2Mg+TiCl4(熔融)=Ti+2MgCl2 Mg+2RbCl(熔融)=MgCl2+2RbMgOMgO+2HCl=MgCl2+H2O MgO+H2O=Mg(OH)2↓Mg(OH)2 Mg(OH)2+2HCl=MgCl2+2H2OMgCO3 MgCO3+2HCl=2MgCl2+CO2↑+H2OMg(HCO3)2 Mg(HCO3)2+2HCl=MgCl2+2CO2↑+2H2OMgSO4MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓ MgSO4+2NaOH=Mg(OH)2↓+Na2SO4↓2.铝Al2Al+6HCl=2AlCl3+3H2↑2Al+3H2SO4=Al2(SO4)3+3H2↑2Al+2NaOH+2H2O=2NaAlO2+3H2↑Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O(Al、Fe在冷、浓的H2SO4、HNO3中钝化)Al2O3、Al(OH)3Al2O3+3H2SO4=Al2(SO4)3+3H2O(Al2O3是两性氧化物)Al2O3+2NaOH=2NaAlO2+H2OAl(OH)3+3HCl=AlCl3+3H2O 2Al(OH)3+3H2SO4=Al2(SO4)3+6H2OAl(OH)3+NaOH=NaAlO2+2H2O铝盐AlCl3+3NaOH=Al(OH)3↓+3NaClAlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl2AlCl3+3Na2CO3+3H2O=2Al(OH)3↓+3CO2↑+6NaClAlCl3+3NaHCO3=Al(OH)3↓+3CO2↑AlCl3+3NaAlO2+6H2O=4Al(OH)3↓ Al2(SO4)3+3Na2S+6H2O=2Al(OH)3↓+3H2S↑Al4C3+12H2O=4Al(OH)3↓+3CH4↑3.铁Fe2Fe+3Br2=2FeBr3Fe+2HCl=FeCl2+H2↑Fe+CuCl2=FeCl2+Cu Fe+SnCl4=FeCl2+SnCl2 Fe+H2S=FeS+H2↑2Fe+6H2SO4(浓)=Fe2(SO4)3+3SO2↑+6H2O Fe+H2SO4(稀)=FeSO4+H2↑Fe+6HNO3=Fe(NO3)3+3NO2↑+3H2OFe+4HNO3=Fe(NO3)3+NO↑+2H2O8Fe+30HNO3=8Fe(NO3)3+3N2O↑+15H2O 10Fe+36HNO3=10Fe(NO3)3+3N2↑+18H2O8Fe+30HNO3=8Fe(NO3)3+3NH4NO3+9H2O Fe+(CH3COO)2Cu=Cu+(CH3COO)2FeFeOFeO+4HNO3=Fe(NO3)3+NO2↑+2H2OFe2O3Fe2O3+3H2=2Fe+3H2O(制还原铁粉) Fe2O3+6HCl=2FeCl3+3H2OFe3O4Fe(OH)2、Fe(OH)34Fe(OH)2+O2+2H2O==4Fe(OH)3FeCl22FeCl2+Cl2=2FeCl3 FeCl2+Mg=Fe+MgCl2FeCl32FeCl3+Fe=3FeCl2 2FeCl3+Cu=2FeCl2+CuCl2(⽤于雕刻铜线路版) 2FeCl3+H2SO3+H2O=H2SO4+2FeCl2+2HCl2FeCl3+Zn=2FeCl2+ZnCl2 2FeCl3+H2S=2FeCl2+2HCl+S↓2FeCl3+2KI=2FeCl2+2KCl+I2 FeCl3+3NH3·H2O=Fe(OH)3↓+3NH4Cl2FeCl3+3Na2CO3+3H2O=2Fe(OH)3↓+3CO2↑+6NaClFeCl3+3NaHCO3=Fe(OH)3↓+3CO2↑ 2FeCl3+SO2+2H2O=2FeCl2+H2SO4+2HCl BaCl2+H2SO4=BaSO4↓+2HCl FeCl3+3KSCN=Fe(SCN)3+3KClFeSFeS+2HCl=FeCl2+H2S↑ FeS+H2SO4=FeSO4+H2S↑4FeS2+11O2=2Fe2O2+8SO2H2FeO4 4H2FeO4+2H2O=4Fe(OH)3+3O2↑4Na2FeO4+10H2O=4Fe(OH)3+3O2↑+8NaOH2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2OFe2O3+3Na2O2=2Na2FeO4+Na2O其它Fe化合物Fe2(SO4)3+2Ag=FeSO4+Ag2SO4(较难反应)三、其他⾦属1.锰KMnO42. 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O3. 2KMnO4+5H2O2+6HCl=2KCl+2MnCl2+5O2↑+8H2OMnO22.铜CuCuO+2HCl=CuCl2+H2OCuO+H2SO4=CuSO4+H2O Cu(OH)2+2HCl=CuCl2+2H2OCu(OH)2+H2SO4=CuSO4+2H2OCuCl2+H2S=CuS↓+2HCl CuCl2+2NaOH=Cu(OH)2↓+2NaClCuSO4+H2S=CuS↓+H2SO4 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4CuSO4+Ba(OH)2=Cu(OH)2↓+BaSO4↓3.钙CaCaO+H2O=Ca(OH)22Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O Ca(OH)2+SO3=CaSO4+H2OCaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑(⽤HNO3和浓H2SO4不能制备H2S、HI、HBr、SO2等还原性⽓体) CaF2+H2SO4(浓)=CaSO4+2HF↑Ca3(PO4)2+3H2SO4(浓)=3CaSO4+2H3PO4Ca3(PO4)2+2H2SO4(浓)=2CaSO4+Ca(H2PO4)2Ca3(PO4)2+4H3PO4=3Ca(H2PO4)2(重钙) CaH2+2H2O=Ca(OH)2+2H2↑4.钡BaBa(OH)2+CO2=BaCO3↓+H2O Ba(OH)2+2CO2(过量)=Ba(HCO3)25. Ba(OH)2+H2SO4=BaSO4↓+2H2O3Ba(OH)2+2H3PO3=Ba3(PO4)2↓+6H2OBaCl2+H2SO4=BaSO4↓+2HCl BaCl2+Na2SO4=BaSO4↓+2NaClBaCO3+2HCl=BaCl2+CO2↑+H2OBaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O BaO2+H2SO4(稀)=BaSO4↓+H2O2)5.铅Pb、PbO2Pb+2HCl=PbCl2+H2↑铅盐Pb(NO3)2+H2S=PbS↓+2HNO3(CH3COO)2Pb+H2S=PbS↓+CH3COOH6.锌ZnZn+2HCl=ZnCl2+H2↑ Zn+H2SO4=ZnSO4+H2↑Zn+2NaOH=Na2ZnO2+H2↑ Zn+2FeCl3=2FeCl2+ZnCl2ZnOZnO+2HCl=ZnCl2+H2O ZnO+2NaOH=Na2ZnO2+H2OZn(OH)2 Zn(OH)2+2HCl=ZnCl2+2H2O Zn(OH)2+2NaOH=Na2ZnO2+2H2OZn(OH)2+4NH3·H2O=Zn(NH3)4(OH)2+4H2O7.铍BeBe+2HCl=BaCl2+H2↑ Be+2NaOH=Na2BO2+H2↑8. BeCl2+2NaOH=Be(OH)2↓+2H2O Be(OH)2+2HCl=BeCl2+2H2OBe(OH)2+2NaOH=Na2BO2+2H2O8.汞Hg3Hg+8HNO3(稀)=3Hg(NO3)2+2NO2↑+4H2O Hg+4HNO3(浓)=Hg(NO3)2+2NO2↑+2H2O第⼆部分卤族元素、氮族元素⼀、卤族元素1.氟F2F2+H2=2HF 2F2+2H2O=4HF+O2HF 4HF+SiO2=SiF4+2H2O2.氯Cl2Cl2+H2=2HCl(光照或点燃)Cl2+2FeCl2=2FeCl3 2Cl2+2NaBr=2NaCl+Br2Cl2+2KI=2KCl+I2 5Cl2+I2+6H2O=2HIO3+10HClCl2+Na2S=2NaCl+S↓ Cl2+H2S=2HCl+S↓Cl2+SO2+2H2O=H2SO4+2HCl Cl2+H2SO3+H2O=H2SO4+2HClCl2+H2O=HCl+HClO Cl2+H2O2=2HCl+O2Cl2+2NaOH=NaCl+NaClO+H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O3Cl2+6KOH(热、浓)=5KCl+KClO3+3H2OHCl6HCl+2Al=2AlCl3+3H2↑ 2HCl+Fe=FeCl2+H2↑16HCl+2KMnO4=2KCl+2MnCl2+5Cl2+8H2O 14HCl+K2Cr2O7=2KCl+2CrCl3+3Cl2+7H2O HCl+NH3=NH4Cl(⽩烟)2HCl+FeO=FeCl2+3H2O6HCl+Fe2O3=2FeCl3+3H2OHCl+Na3PO4=Na2HPO4+NaClHCl+Na2HPO4=NaH2PO4+NaCl HCl+NaH2PO4=H3PO4+NaCl HCl+Na2CO3=NaHCO3+NaCl HCl+NaHCO3=NaCl+H2O+CO2HClO HClO=HCl+O2↑3.溴Br2 Br2+Fe=FeBr3 Br2+2FeBr2=2FeBr34.Br2+NaI=NaBr+I2 Br2+HI=HBr+I2 Br2+H2O=HBr+HBrOBr2+NaOH=NaBr+NaBrO+H2O Br2+SO2+2H2O=H2SO4+2HBr5. Br2+H2S=S↓+2HBr2Br2+3Na2CO3+H2O=2NaHCO3+2NaBrO+2NaBr+CO2↑HBrHBr+NaOH=NaBr+H2O2HBr+Cl2=2HCl+Br24.碘I2 I2+2NaOH=NaI+NaIO+H2OHI 2HI+Cl2=2HCl+I2 HI+NaOH=NaI+H2O⼆、氮族元素1.氮N2N2+6Na=2Na3NNO、NO2、N2O52NO+O2=2NO2 NO+NO2+2NaOH=2NaNO2(⽤于制硝酸⼯业中吸收尾⽓中的NO和NO2)NO2+2KI+H2O=NO+I2+2KOH(不能⽤淀粉KI溶液鉴别溴蒸⽓和NO2)4NO2+H2S=4NO+SO3+H2ONO2+SO2=SO3+NO 3NO2+H2O=2HNO3+NO N2O5+H2O=2HNO3HNO33HNO3+Ag3PO4=H3PO4+3AgNO3Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O3As2S3+28HNO3+4H2O=6H3AsO4+9H2SO4+28NO↑2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑ 6HNO3+Fe=Fe(NO3)3+3NO2↑+3H2O4HNO3+Fe=Fe(NO3)3+NO↑+2H2O30HNO3+8Fe=8Fe(NO3)3+3N2O↑+15H2O36HNO3+10Fe=10Fe(NO3)3+3N2↑+18H2O30HNO3+8Fe=8Fe(NO3)3+3NH4NO3+9H2OFeO+4HNO3=Fe(NO3)3+NO2↑+2H2O 3H2S+2HNO3(稀)=3S↓+2NO+4H2O4HNO3=4NO2+O2+2H2O(见光或受热分解)NH3+HNO3=NH4NO3(⽩烟)(⽤HNO3和浓H2SO4不能制备H2S、HI、HBr、(SO2)3Na2S+8HNO3(稀)=6NaNO3+2NO+3S↓+4H2O3Na2SO3+2HNO3(稀)=3Na2SO4+2NO↑+H2O 5HNO3(浓)+P=H3PO4+5NO2↑+H2O P4+20HNO3(浓)=4H3PO4+20NO2+4H2OS+6HNO3(浓)=H2SO4+6NO2↑+2H2O 3S+4HNO3(稀)=3SO2↑+4NO↑+2H2OS+6HNO3(浓)=H2SO4+6NO2↑+2H2ONH32NH3+3Cl2=N2+6HCl 8NH3+3Cl2=N2+6NH4ClNH3+H Cl=NH4Cl(⽩烟) NH3+HNO3=NH4NO3(⽩烟)2NH3+H2SO4=(NH4)2SO4 NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl(侯⽒制碱法) 2NH3+SO2+H2O=(NH4)2SO3NH4HCO3、(NH4)2CO3NH4HCO3=NH3+H2O+CO2 (NH4)2CO3=2NH3↑+H2O+CO2↑NH4Cl NH4Cl=NH3+HClNH4Cl+NaOH==NaCl+NH3·H2ONH4NO3NH4NO3+NaOH==NaNO3+NH3·H2O(NH4)2SO3、(NH4)2SO4(NH4)2SO3+SO2+H2O=2NH4HSO3 (NH4)2SO4+2NaOH==Na2SO4+2NH3·H2OPPH3+2O2=H3PO4P4+20HNO3(浓)=4H3PO4+20NO2+4H2O 11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 P2O3、P2O5 P2O5+H2O(冷)=2HPO3 P2O5+3H2O(热)=2H3PO4(P2O5极易吸⽔、可作⽓体⼲燥剂) P2O5+3H2SO4(浓)=2H3PO4+3SO3P2O5+2NaOH=2NaPO3+H2O P2O5+6NaOH=2Na3PO3+3H2OH3PO44H3PO4+Ca3(PO4)2=3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr=NaH2PO4+HBr H3PO4(浓)+NaI=NaH2PO4+HI3.砷AsAs2O3+6Zn+12HCl=2AsH3↑+6ZnCl2+3H2O4. 3As2S3+28HNO3(稀)+4H2O=6H3AsO4+9H2SO4+28NO↑As2S3+28HNO3(浓)=2H3AsO4+3H2SO4+28NO2↑+8H2O第三部分碳族元素、氧族元素⼀、碳族元素1.碳CC+2F2=CF4 C+2Cl2=CCl4CO2CO2+H2O=H2CO32.CO2+2NaOH(过量)=Na2CO3+H2O CO2(过量)+NaOH=NaHCO3CO2+Ca(OH)2(过量)=CaCO3↓+H2O3.2CO2(过量)+Ca(OH)2=Ca(HCO3)2 CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3 CO2+C6H5ONa+H2O=C6H5OH+NaHCO3 CO2+Na2O=Na2CO34. 2CO2+2Na2O2=2Na2CO3+O2CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl(侯⽒制碱法)5.H2CO3H2CO3=CO2↑+H2O2.硅SiSi+2NaOH+H2O=Na2SiO3+2H2SiO24HF+SiO2=SiF4+2H2OSiO2+2NaOH=Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃) 2NaOH+SiO2=Na2SiO3+H2O⼆、氧族元素1.氧O24Na+O2=2Na2O 2Na+O2=Na2O22H2SO3+O2=2H2SO4 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Na2SO3+O2=2Na2SO4 O3 2O3=3O2 O3+2HI==I2+O2+H2OH2O 2F2+2H2O=4HF+O2 Cl2+H2O=HCl+HClO2Na+2H2O=2NaOH+H2↑ Mg+2H2O=Mg(OH)2+H2↑SO2+H2O=H2SO3 SO3+H2O=H2SO43NO2+H2O=2HNO3+NO N2O5+H2O=2HNO3P2O5+H2O(冷)=2HPO3 P2O5+3H2O(热)=2H3PO4 CO2+H2O=H2CO3H2O22H2O2=2H2O+O2↑ H2O2+Cl2=2HCl+O25H2O2+2KMnO4+6HCl=2MnCl2+2KCl+5O2↑+8H2O2.硫SS+6HNO3(浓)=H2SO4+6NO2↑+2H2O3. 3S+4HNO3(稀)=3SO2↑+4NO↑+2H2OS+2Na=Na2S(爆炸) S+Mg=MgS S+2H2SO4(浓)=3SO2↑+2H2OSO2SO2+2H2S=3S+2H2O 2SO2+O2+2H2O=2H2SO4 SO2+Cl2+2H2O=H2SO4+2HCl SO2+Br2+2H2O=H2SO4+2HBrSO2+I2+2H2O=H2SO4+2HI SO2+NO2=SO3+NO SO2+2H2S=3S+2H2O SO2+H2O=H2SO3 SO2+2NH3+H2O=(NH4)2SO3SO2+(NH4)2SO3+H2O=2NH4HSO3 SO2+Ca(OH)2=CaSO3↓+H2O(不能⽤澄清⽯灰⽔鉴别SO2和CO2.可⽤品红鉴别)4.2NaOH+SO2(少量)=Na2SO3+H2O NaOH+SO2(⾜量)=NaHSO35. Cl2+SO2+2H2O=H2SO4+2HClSO3SO3+H2O=H2SO4 SO3+MgO=MgSO4 SO3+Ca(OH)2=CaSO4+H2O6. SO3+Na2O=Na2SO4 SO3+2KI=K2SO3+I2H2SH2S+Cl2=2HCl+S↓ H2S+Mg=MgS+H22H2S+3O2(⾜量)=2SO2+2H2O 2H2S+O2(少量)=2S+2H2O2H2S+SO2=3S+2H2O H2S+H2SO4(浓)=S↓+SO2+2H2O3H2S+2HNO3(稀)=3S↓+2NO+4H2O5H2S+2KMnO4+3H2SO4=2MnSO4+K2SO4+5S+8H2O3H2S+K2Cr2O7+4H2SO4=Cr2(SO4)3+K2SO4+3S+7H2OH2S+4Na2O2+2H2O=Na2SO4+6NaOH H2S+Fe=FeS+H2↑H2S+CuCl2=CuS↓+2HCl H2S+2AgNO3=Ag2S↓+2HNO3H2S+HgCl2=HgS↓+2HCl H2S+Pb(NO3)2=PbS↓+2HNO3H2S+4NO2=4NO+SO3+H2OH2SO3H2SO3+X2+H2O=H2SO4+2HX(X表⽰Cl2、Br2、I2) 2H2SO3+O2=2H2SO4 H2SO3+H2O2=H2SO4+H2O5H2SO3+2KMnO4=2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O=H2SO4+2FeCl2+2HClH2SO3=H2O+SO2↑ 2H2SO3+2H2S=3S↓+2H2OH2SO4Zn+H2SO4=ZnSO4+H2↑ Fe+H2SO4=FeSO4+H2↑Mg+H2SO4=MgSO4+H2↑ 2Al+3H2SO4=Al2(SO4)3+3H2↑2NH3+H2SO4=(NH4)2SO4 H2S+H2SO4(浓)=S↓+SO2+2H2OP2O5+3H2SO4(浓)=2H3PO4+3SO3 BaO2+H2SO4(稀)=BaSO4+H2O2) Na2O2+H2SO4(冷、稀)=Na2SO4+H2O2MgO+H2SO4=MgSO4+H2O Al2O3+3H2SO4=Al2(SO4)3+3H2O2H2SO4(浓)+S=3SO2↑+2H2O6H2SO4(浓)+2Fe=Fe2(SO4)3+3SO2↑+6H2OH2SO4(浓)+CaF2=CaSO4+2HF↑3H2SO4(浓)+Ca3(PO4)2=3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2=2CaSO4+Ca(H2PO4)2第四部分有机反应⼀、烃1.甲烷甲烷的制取:烷烃通式:CnH2n-2(1)氧化反应甲烷的燃烧:甲烷不可使酸性⾼锰酸钾溶液及溴⽔褪⾊。
高中化学方程式大全
高中化学方程式大全一、氧化还原反应方程式1.金属与非金属的氧化反应例如:2Na+Cl₂→2NaCl2Mg+O₂→2MgO2.金属与酸的反应例如:Zn+2HCl→ZnCl₂+H₂3.金属与水的反应例如:2Na+2H₂O→2NaOH+H₂4.非金属与氧气的反应例如:C+O₂→CO₂5.过氧化氢分解例如:2H₂O₂→2H₂O+O₂6.还原剂与氧化剂的反应例如:Cl₂+2KBr→2KCl+Br₂二、酸碱中和反应方程式1.强酸与强碱的中和反应例如:HCl+NaOH→NaCl+H₂O2.强酸与弱碱的中和反应例如:HCl+NH₄OH→NH₄Cl+H₂O3.弱酸与弱碱的中和反应例如:CH₃COOH+NH₄OH→CH₃COONH₄+H₂O三、水解反应方程式1.盐的水解例如:NaCl+H₂O→NaOH+HCl2.酸酐的水解例如:(CH₃CO)₂O+H₂O→2CH₃COOH3.酯的水解例如:CH₃COOCH₃+H₂O→CH₃COOH+CH₃OH四、氧气化反应方程式1.元素与氧气的直接反应例如:S+O₂→SO₂C+O₂→CO₂2.含氢的有机物燃烧反应例如:CH₄+2O₂→CO₂+2H₂O五、重组反应方程式1.单质重组反应例如:2Na+Cl₂→2NaClN₂+3H₂→2NH₃2.高低价金属的重组反应例如:Cu+2AgNO₃→Cu(NO₃)₂+2Ag3.过氧化物分解例如:2H₂O₂→2H₂O+O₂六、酸反应方程式1.均一催化酸解例如:2H₂O₂→2H₂O+O₂2.酸与金属氧化物反应例如:2HCl+Mg(OH)₂→MgCl₂+2H₂O七、氧化反应方程式1.金属与氧反应生成金属氧化物例如:2Na+O₂→2Na₂O2.非金属与氧反应生成非金属氧化物例如:C+O₂→CO₂八、盐酸与金属氧化物反应方程式例如:2HCl+CuO→CuCl₂+H₂O九、铜与含氧化剂的反应方程式例如:2Cu+O₂→2CuO。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无机化学部分非金属单质(F2,Cl2 , O2 , S, N2 , P , C , Si)1.氧化性:F2 + H2 === 2HF2F2 +2H2O===4HF+O2Cl2 +2FeCl2 ===2FeCl32Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I2Cl2+SO2 +2H2O===H2SO4 +2HCl(2004北京高考)2.还原性S+6HNO3(浓)===H2SO4+6NO2↑+2H2O3S+4 HNO3(稀)===3SO2+4NO↑+2H2OPX3+X2===PX5C+CO2===2CO(生成水煤气)(制得粗硅)Si+2NaOH+H2O===Na2SiO3+2H2↑3.(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O金属单质(Na,Mg,Al,Fe)的还原性4Na+O2===2Na2O2Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H2↑Mg+H2SO4===MgSO4+H2↑2Al+6HCl===2AlCl3+3H2↑2Al+3H2SO4===Al2(SO4)3+3H2↑2Al+6H2SO4(浓、热)===Al2(SO4)3+3SO2↑+6H2O(Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO3(稀)===Al(NO3)3+NO↑+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H2↑Fe+2HCl===FeCl2+H2↑Fe+CuCl2===FeCl2+Cu非金属氢化物(HF,HCl,H2O,H2S,NH3)1.还原性:16HCl+2KMnO4==2KCl+2MnCl2+5Cl2↑+8H2O(实验室常用)2H2S+SO2===3S↓+2H2O2NH3+3Cl2===N2+6HCl8NH3+3Cl2===N2+6NH4Cl4NH3+3O2(纯氧)===2N2+6H2O4NH3+6NO===5N2+6H2O(用氨清除NO)2.酸性:4HF+SiO2===SiF4+2H2O(HF保存在塑料瓶的原因,此反应广泛应用于测定矿样或钢样中SiO2的含量)H2S+CuCl2===CuS↓+2HClH2S+FeCl2===(不反应)3.碱性:NH3+HCl===NH4ClNH3+HNO3===NH4NO32NH3+H2SO4===(NH4)2SO4NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(此反应用于工业制备小苏打,苏打)4.不稳定性:2H2O2===2H2O+O2↑非金属氧化物1.低价态的还原性:2SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O===H2SO4+2HCl2NO+O2===2NO22CO+O2===2CO22.氧化性:NO2+2KI+H2O===NO+I2↓+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)3.与水的作用:SO2+H2O===H2SO3SO3+H2O===H2SO43NO2+H2O===2HNO3+NON2O5+H2O===2HNO3P2O5+H2O(冷)===2HPO3P2O5+3H2O(热)===2H3PO4(P2O5极易吸水,可作气体干燥剂)4.与碱性物质的作用:SO2+(NH4)2SO3+H2O===2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,再用H2SO4处理: 2NH4HSO3+H2SO4=== (NH4)2SO4 + 2H2O+ 2SO2生成的硫酸铵作化肥,SO2循环作原料气)SO2+Ca(OH)2===CaSO3+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+Ca(OH)2===CaSO4+H2OCO2+2NaOH(过量)===Na2CO3+H2OCO2(过量)+NaOH===NaHCO3CO2+Ca(OH)2(过量)===CaCO3↓+H2O2CO2(过量)+Ca(OH)2===Ca(HCO3)2CO2+2NaAlO2+3H2O===2Al(OH)3↓+Na2CO3CO2+C6H5ONa+H2O===C6H5OH↓+NaHCO3SiO2+2NaOH===Na2SiO3+H2O (强碱缓慢腐蚀玻璃)金属氧化物1.低价态的还原性:FeO+4HNO3===Fe(NO3)3+NO2↑+2H2O2。
氧化性:MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.,一般通过电解制Mg和Al.(制还原铁粉)3.与水的作用:Na2O+H2O===2NaOH2Na2O2+2H2O===4NaOH+O2↑4.与酸性物质的作用:Na2O+CO2===Na2CO32Na2O2+2CO2===2Na2CO3+O2Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2MgO+SO3===MgSO4MgO+H2SO4===MgSO4+H2OAl2O3+3H2SO4===Al2(SO4)3+3H2OAl2O3+2NaOH===2NaAlO2+H2O (Al2O3是两性氧化物)FeO+2HCl===FeCl2+3H2OFe2O3+6HCl===2FeCl3+3H2OFe3O4+8HCl===FeCl2+2FeCl3+4H2O含氧酸1.氧化性:HClO+H2SO3===H2SO4+HCl (X2表示F2,Cl2,Br2)HClO+H 2O 2===HCl+H 2O+O 2(氧化性:HClO>HClO 2>HClO 3>HClO 4, 但浓,热的HClO 4氧化性很强)H 2SO 4+Fe(Al) 室温下钝化H 2SO 4(浓)+2HBr===SO 2↑+Br 2↑+2H 2O H 2SO 4(稀)+Fe===FeSO 4+H 24HNO 3(浓)+C===CO 2↑+4NO 2↑+2H 2O 6HNO 3(浓)+S===H 2SO 4+6NO 2↑+2H 2O 5HNO 3(浓)+P===H 3PO 4+5NO 2↑+H 2O6HNO 3(浓、热)+Fe===Fe(NO 3)3+3NO 2↑+3H 2O 4HNO 3(稀)+Fe (不足)===Fe(NO 3)3+NO ↑+2H 2O 8HNO 3(稀)+3Fe (过量)===3Fe(NO 3)2+2NO ↑+4H 2O 2.还原性:H 2SO 3+X 2+H 2O===H 2SO 4+2HX (X 表示Cl 2,Br 2,I 2) 2H 2SO 3+O 2===2H 2SO 4H 2SO 3+H 2O 2===H 2SO 4+H 2OH 2SO 3+2FeCl 3+H 2O===H 2SO 4+2FeCl 2+2HCl 3.酸性:H 2SO 4(浓) +CaF 2===CaSO 4+2HF ↑ H 2SO 4(浓)+NaCl===NaHSO 4+HCl ↑ H 2SO 4(浓) +2NaCl===Na 2SO 4+2HCl ↑ H 2SO 4(浓)+NaNO 3===NaHSO 4+HNO 32HNO 3+CaCO 3===Ca(NO 3)2+H 2O+CO 2↑(用HNO 3和浓H 2SO 4不能制H 2S ,HI ,HBr ,SO 2等还原性气体) 4H 3PO 4+Ca 3(PO4)2===3Ca(H 2PO 4)2(重钙) 3. 不稳定性:2HClO===2HCl+O 2↑碱1.低价态的还原性:4Fe (OH )2+O 2+2H 2O===4Fe(OH)3 2.与酸性物质的作用:2NaOH+SO 2(少量)===Na 2SO 3+H 2O NaOH+SO 2(足量)===NaHSO 3 2NaOH+SiO 2===Na 2SiO 3+H 2O 2NaOH+Al 2O 3===2NaAlO 2+H 2O NaOH+HCl===NaCl+H 2ONaOH+H 2S (足量)===NaHS+H 2O 2NaOH+H 2S (少量)===Na 2S+2H 2O 3NaOH+AlCl 3===Al (OH )3↓+3NaCl NaOH+Al(OH)3===NaAlO 2+2H 2O NaOH+NH 4Cl===NaCl+NH 3↑+H 2OMg(OH)2+2NH 4Cl===MgCl 2+2NH 3·H 2O Al(OH)3+NH 4Cl (或NH 3·H 2O 不溶解) 3.不稳定性:盐1.氧化性:2FeCl 3+Fe===3FeCl 22FeCl 3+Cu===2FeCl 2+CuCl 2 (用于雕刻铜线路版) 2FeCl 3+H 2S===2FeCl 2+2HCl+S ↓ 2FeCl 3+2KI===2FeCl 2+2KCl+I 2↓ FeCl 2+Mg===Fe+MgCl 2 2.还原性:2FeCl 2+Cl 2===2FeCl 33Na 2S+8HNO 3(稀)===6NaNO 3+2NO ↑+3S ↓+4H 2O 3Na 2SO 3+2HNO 3(稀)===3Na 2SO 4+2NO ↑+H 2O 2Na 2SO 3+O 2===2Na 2SO 4 3.与碱性物质的作用:MgCl 2+2NH 3·H 2O===Mg(OH)2↓+NH 4Cl AlCl 3+3NH 3·H 2O===Al(OH)3↓+3NH 4Cl FeCl 3+3NH 3·H 2O===Fe(OH)3↓+3NH 4Cl 4. 与酸性物质的作用:Na 2CO 3+HCl===NaHCO 3+NaCl NaHCO 3+HCl===NaCl+H 2O+CO 2↑3Na 2CO 3+2AlCl 3+3H 2O==2Al(OH)3↓+3CO 2↑+6NaCl 3Na 2CO 3+2FeCl 3+3H 2O==2Fe(OH)3↓+3CO 2↑+6NaCl 3NaHCO 3+AlCl 3===Al(OH)3↓+3CO 2↑ + 3NaCl 3NaHCO 3+FeCl 3===Fe(OH)3↓+3CO 2↑+ 3NaCl3NaAlO 2+AlCl 3+6H 2O===4Al(OH)3↓+ 3 NaCl 5. 不稳定性:Na 2S 2O 3+H 2SO 4===Na 2SO 4+S ↓+SO 2↑+H 2O有机化学部分+HO -NO 2+H 2O +Br 2 催化剂 2+HBr3H H 2C 2CCH 2 H 2C CH 2C 23HONO 2浓H2SO 4 22+3H 2O Δ浓H 2SO 4140℃ C 2H 5- -OH +H- -O -C 2H 5 C 2H 5-O -C 2H 5+H 2O 2CH 3CH 2OH+2Na2CH 3CH 2ONa+H 2↑ C 2H 5- -OH +H- -Br C 2H 5Br +H 2OΔC 2H 5OH(液)+3O 2(气) 2CO 2(气)+3H 2O (液)点燃2CH 3CH 2OH +O 2 2CH 3CHO +2H 2O催化剂 Δ Δ CH 3CHO +2Cu(OH)2 CH 3COOH +Cu 2O ↓+2H 2O 催化剂2CH 3CHO +O 2 2CH 3COOH + 3H 2C C 17H 33 O CH 2 C O CH C OO CH 2 C 17H 33 C 17H 33 OO H 2SO 43C 17H 35COOH + OH CH 2 OH CH OH 2 + 3H 2 C C 17H 33 O CH 2C O CH C O O 2C 17H 33 C 17H 33 O O C C 17H 35 O CH 2C O CHC OO CH 2 C 17H 35 C 17H 35 O O+ 3NaOH C C 17H 33 OCH 2C OCH C O O2C 17H 33 C 17H 33 O O 3C 17H 35COONa + OHCH 2 OHCH OH2 +H 2O + CO 2 +NaHCO3 3Br 2↓+3HBr +NaOH +H 2O。
