一氧化碳的性质与用途
一氧化碳的性质和用途

一氧化碳的性质和用途一氧化碳(CO)是一种无色、无味的气体,由一个碳原子和一个氧原子组成。
它是一种具有毒性的气体,在环境中和人体健康方面都有重要的影响。
然而,一氧化碳也具有一些重要的工业和医学应用。
下面将详细介绍关于一氧化碳的性质和用途。
性质:1.物理性质:一氧化碳是一种无色、无味、无臭的气体。
它的密度较大,比空气重,会向低处移动。
在室温下,一氧化碳非常稳定,不易燃烧。
2.化学性质:一氧化碳具有较强的亲电性和还原性,在一些化学反应中可以作为氧化还原的还原剂。
它可以与氧气反应生成二氧化碳,放出大量的能量。
一氧化碳也可与金属形成配合物,例如与铁形成气态的五羰基合铁。
效应:1.环境效应:一氧化碳是由于燃烧不完全产生的主要污染物之一、它是空气中的有害气体之一,容易形成雾霾。
高浓度的一氧化碳会对人体造成严重危害,导致窒息、中毒甚至死亡。
一氧化碳也对温室效应有贡献,它是温室气体之一,具有较高的大气稳定性。
2.健康效应:一氧化碳对人体的健康有重要影响。
当一氧化碳进入人体后,它与血红蛋白形成一氧化碳血红蛋白(COHb),阻止血红蛋白与氧气结合,导致体内氧供不足。
这会导致一系列健康问题,包括中毒症状、头晕、嗜睡、胸痛、呼吸困难等。
应用:1.工业应用:一氧化碳在工业生产中有广泛的应用。
例如,一氧化碳可以用作还原剂,用于冶炼金属,制备合金等。
它还可以用作工业气体,用于气体焊接、切割和金属表面的处理。
此外,一氧化碳可用于制备其他化学物质,例如醋酸甲酯。
2.医疗应用:尽管一氧化碳对人体有毒,但它在一些医疗领域也有应用。
一氧化碳可以用作血红蛋白的灌注剂,用于处理一些心血管疾病,如缺血性心脏病和血管性头痛。
它还可以用作药物的剂量控制和气体释放的载体。
3.燃料和能源应用:一氧化碳也是一种重要的燃料,可以用于发电、供热和燃料电池。
一氧化碳作为一种可燃气体,在配合适当的氧气浓度下,可以产生大量的热能。
它在工业生产和家庭供暖中被广泛应用。
6.32 一氧化碳性质与用途
课堂练习一
2、现有下列四种气体:氧气、氢气、二氧化碳、 一氧化碳。试回答: 一氧化碳 (1)只能用排水法收集的是________ 二氧化碳 (2)只能用向上排空气法收集的是_______ (3)既可用向上排空气法又可用排水法收 氧气 集的是_______ (4)即可用向下排空气法又可用排水法收 集的是_______ 氢气
3、CO具有 还原性 2、CO的用途: 1、可以用于冶金工业
2、可作燃料
返回
课堂练习二
1、在使用燃气热水器时,若通风不畅,易使人中 毒,造成中毒的气体是( D )
A、氧气 B、氮气 C、二氧化碳 D、一氧化碳 2、氢气和一氧化碳有相似的物理性质,它们都是
没有 颜色,_____ 没有气味的气体,_____ 难 溶于水。相 ______ 还原 性。工业 可燃 性和_______ 似的化学性质是都有_______ 还原 性, 上常用它们冶炼金属,主要是利用它们的______ 可燃 性。 还常用作气体燃料,是利用它们的______
返回
CO的化学性质
一、CO 具有可燃性
燃烧现象 CO在空气中燃烧,发出蓝色火焰,
烧杯内壁上澄清的的石灰水变浑浊
写出CO在空气中燃烧的化学方程式 2CO + O2 =
点燃
2 CO2
写出CO2和石灰水反应的化学方程式
CO2 + Ca(OH)2 = CaCO3 + H2O
二、一氧化碳的毒性
想一想
CO为什么会使人中毒呢? 中毒的生理过程如何? (详见教材P121)
4、宣传科学知识,揭露伪科学是化学工作者 的义务。下列各项中,属于伪科学的是 ( C ) A、用液态氢作燃料发射火箭 B、用干冰进行人工降雨 C、用催化剂把水变成汽油 D、CO气体可用来冶炼金属
一氧化碳的性质

溶解性
能溶于水(1体积水 难溶于水(1体积水 溶解约1体积CO2 ) 溶解约0.02体积CO )
1、有人用炉火取暖,为防止煤气中毒,在火炉上 放一盆水,这样做行吗?
答:不行,因为一氧化碳难溶于水。
2、有人说他身强力壮,不会煤气中毒,等到一 闻到煤气味就把火炉搬出去,这样做行吗? 答:不行。因为一氧化碳没有气味。
(3)既可用向上排空气法又可用排水法收集的是_______ 氧气
氢气 (4)即可用向下排空气法又可用排水法收集的是_______
二、CO的化学性质
1、可燃性:
用作燃料
2CO O2 点燃2CO2
CO CuOCu CO2
燃烧现象 CO在空气中燃烧,发出蓝色火焰,烧杯内
壁上澄清的的石灰水变浑浊
CO中毒的生理原因:一氧化碳与血液中的 血红蛋白结合,使血红蛋白丧失输氧的功能,人 缺氧窒息死亡
课堂练习:
1、在使用燃气热水器时,若通风不畅,易使人中 毒,造成中毒的气体是(
D )
A、氧气 B、氮气 C、二氧化碳 D、一氧化碳
2、氢气和一氧化碳有相似的物理性质,它们都是
没有 颜色,_____ 没有气味的气体,_____ 难 溶于水。相 ______
D
C、CO2能灭火,施用后可防止火灾
D、施用CO2,可促进植物的光合作用
ቤተ መጻሕፍቲ ባይዱ CO的化学性质
1、可燃性:
用作燃料
2CO O2 点燃2CO2
燃烧现象 CO在空气中燃烧,发出蓝色火焰,烧杯内
壁上澄清的的石灰水变浑浊
2、还原性: 3CO Fe2O3高温2Fe 3CO2
现象:
工业上用于 冶炼金属
6、CO和CO2相同的是 (
一氧化碳的性质

3、还原性
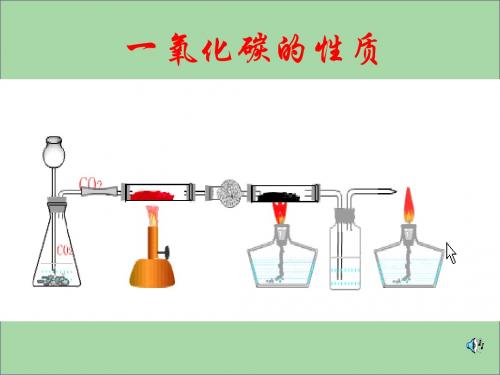
实验现象:
黑色固体逐渐变为红 色,澄清石灰水变浑 浊,有气泡产生。
②
③
①
注意事项; 1、先通入CO,再点燃酒精灯的 原因:防止加热时引起空气和CO的混 合气体爆炸
2、实验完毕后先熄灭酒精灯,再通入 一会CO直到试管冷却的原因:
防止生成的热的铜重新被氧化成氧化 铜
尾气处理:
1、CO燃烧转化为无毒的CO2 2、用气球收集备用
第四课时
一氧化碳的性质
一、物理性质
无色、无味、气体、难溶于水、密度 比空气略小
二、化学性质
1、可燃性 化学方程式:
2C+O2
点燃
2CO
煤炉里煤层上方的蓝色火焰,就是一 氧化碳在燃烧
纯净的一氧化碳在燃烧时的现象
安静的燃烧, 放出大量的热, 发出蓝色的火焰, 生成的能够使澄 清的石灰水变浑浊的气体。
CO还原氧化铜
•验纯以后再通气 •通气以后再点灯 •由黑变红先撤灯 •继续通气直到冷
三、用途 1、冶金工业 2、作气体燃料
讨论(一):
1、在什么条件下容易发生煤气中毒?
[解答] 如果煤气泄漏,室内通风不良,或生煤炉火
的房间不装烟囱,都有可能导致煤气中毒。
2、有人用煤火取暖,又担心煤气中毒,临睡前在
[解答]因为一氧化碳无色无味,煤气泄漏 不易被察觉,所以煤气厂常在家用煤气中 掺入微量具有难闻气味的气体。如果发生 煤气泄漏,应立即关闭煤气阀门,然后开 窗通风。
煤炉上和地上放两大盆冷水,这样做能预防煤气 中毒吗? [解答] 水不能预防煤气中毒,因为一氧化碳难用 于水。
讨论(二)
3、用煤火取暖时,怎样预防煤气中毒?
[解答]首先室内应装烟囱,其次应注意睡觉 时头不要靠墙边,因为一氧化碳的密度略小 于空气,它会沿着墙壁慢慢地向上飘。
一氧化碳的化学性质是什么

一氧化碳的化学性质是什么
一氧化碳是一种碳氧化合物,化学式为CO,化学式量为28.0101,通常状况下为是无色、无臭、无味的气体。
本文整理了一氧化碳的化学性质,欢迎阅读。
一氧化碳的化学性质
1、可燃性:2CO + O22CO2
2、还原性:
一氧化碳还原氧化铜:CO+ CuOCu + CO2
一氧化碳还原氧化铁:3CO+ Fe2O32Fe + 3CO2
一氧化碳还原四氧化三铁:4CO+ Fe3O43Fe + 4CO2
物理性质
在通常状况下,一氧化碳是无色、无臭、无味、难溶于水的气体,熔点-199℃,沸点-191.5℃。
标准状况下气体密度为l.25g/L,和空气密度(标准状况下1.293g/L)相差很小,这也是容易发生煤气中毒的因素之一。
它为中性气体。
分子结构:一氧化碳分子为极性分子,但由于存在反馈电子,分子的极性很弱。
一氧化碳主要用途有
1、一氧化碳可用于制甲酸钠。
2、在冶金工业中作还原剂,如工业还原氧化铁(制备铁)。
3、用于做气体燃料,如水煤气(一氧化碳和氢气等气体的混合物)。
CO的性质和用途

CO的性质和用途CO(一氧化碳)是一种无色、无味、无臭的气体,化学式为CO。
它的分子由一个碳原子和一个氧原子组成,呈线性分子结构。
CO是一种具有重要意义的化合物,具有多种性质和用途。
首先,CO是一种强还原剂。
它能和很多金属形成配合物,如铁的配合物羰基铁(Fe(CO)5)、镍的配合物羰基镍(Ni(CO)4)等。
这些配合物在有机合成、催化反应和工业生产中有重要用途。
此外,CO还具有一定的燃烧性能。
CO能够与氧气发生剧烈的燃烧反应,生成二氧化碳(CO2)。
这种燃烧反应常用于一些燃料和燃气的燃烧过程中,如天然气、木材和石油等的燃烧产生的CO。
CO的主要用途之一是作为工业原料。
它可以用于合成一些有机化合物,如醋酸、甲醇、乙醇等。
此外,CO还可用作金属的还原剂和催化剂,在一些重要的工业过程中发挥重要作用,如合成氨、氢氰酸和甲醇制备等。
CO还广泛应用于一些传感器和检测装置中。
由于CO无色、无味、无臭,在空气中很难察觉,因此很容易引起一氧化碳中毒。
为了保护人类的生命和健康,使用CO传感器和检测装置能够及时监测环境中CO的含量,报警并采取相应的安全措施。
除了工业和安全应用外,CO也在医学和环保领域有相关的用途。
在医学上,CO被用作一种治疗方法,例如高压氧治疗和一氧化碳治疗。
在环保领域,CO的排放和浓度也成为监测和控制的对象,以减少对环境的污染和对人体健康的危害。
综上所述,CO是一种具有多种性质和用途的化合物。
它既是一种有害气体和强还原剂,又是一种工业原料和燃料,在工业过程中发挥着重要作用。
此外,CO还用于一些传感器和检测装置中,用来监测和控制CO的浓度。
在医学和环保领域,CO也有相应的应用。
因此,对CO的性质和用途的研究和了解对于人类的生活和工业生产都有重要意义。
一氧化碳
三、一氧化碳的用途 ① 作燃料
一氧化碳燃烧时会放出大量的热, 一氧化碳燃烧时会放出大量的热,它是许 多气体燃料的主要成分。 多气体燃料的主要成分。
② 冶炼金属
一氧化碳具有还原性质,可用于还原CuO、 一氧化碳具有还原性质,可用于还原CuO、 CuO ZnO、 等金属氧化物。 ZnO、Fe2O3、 Fe3O4等金属氧化物。
点燃
2CO2
2.一氧化碳的毒性 2.一氧化碳的毒性
2.一氧化碳的毒性 2.一氧化碳的毒性
一氧化碳有剧毒。 一氧化碳有剧毒。这是因为一氧化碳吸 进肺里很容易跟血液里的血红蛋白结合,使 进肺里很容易跟血液里的血红蛋白结合, 血红蛋白不能很好地跟氧气结合, 血红蛋白不能很好地跟氧气结合,人体就缺 少氧气。如果吸入较多的一氧化碳, 少氧气。如果吸入较多的一氧化碳,会因缺 少氧气而死亡。 少氧气而死亡。
二、一氧化碳的化学性质
1.一氧化碳的可燃性 1.一氧化碳的可燃性
现 象 分 析 一氧化碳在空气里燃烧, 一氧化碳在空气里燃烧, 发出蓝色的火焰, 发出蓝色的火焰,并生成 能使烧杯壁澄清的石灰水 变浑浊的气体。 变浑浊的气体。 一氧化碳在空气里能够 燃烧生成二氧化碳。 燃烧生成二氧化碳。 2CO+O2 CO+
1.下列关于CO的叙述,错误的是:( D ) 下列关于CO的叙述,错误的是:( CO的叙述
A.CO能降低血红蛋白的载氧能力。 CO能降低血红蛋白的载氧能力。 能降低血红蛋白的载氧能力 B.含碳燃料在燃烧过程中可能产生CO。 含碳燃料在燃烧过程中可能产生CO。 CO C.CO常常是许多气体燃料的主要成分。 CO常常是许多气体燃料的主要成分。 常常是许多气体燃料的主要成分 D.CO可夺取CuO中的氧,因而CO被还原。 CO可夺取CuO中的氧,因而CO被还原。 可夺取CuO中的氧 CO被还原
一氧化碳的性质与用途
一氧化碳的性质与用途一氧化碳(CO)是一种无色、无味、无臭的气体,是由碳和氧反应生成的产物。
它具有一些独特的性质和多种用途。
一氧化碳是一种强大的毒性气体,其主要通过呼吸道吸入进入人体。
当一氧化碳进入血液后,它会与血红蛋白结合,阻断氧气与血红蛋白的结合,从而影响氧气的输送到身体的组织和器官。
这会导致中毒,症状包括头痛、眩晕、恶心、呕吐、失去意识甚至死亡。
由于本身无色无味无臭,所以一氧化碳很难被人体察觉到,增加了危险。
然而,一氧化碳在一些特殊情况下也具有一些重要的用途。
以下是一些常见的用途:1.工业用途:一氧化碳是工业过程中一些化学反应的重要中间体。
它被用于合成多种有机化学品,如甲醇、乙醇、醚类化合物等。
此外,一氧化碳还是制造合成气的重要原料之一,合成气可以被进一步转化为氨、甲醇、乙醇和亚甲基二氧化物等。
2.能源制备:一氧化碳可以作为燃料,在燃烧时产生大量的热能。
通过与空气中的氧气反应,一氧化碳可以产生二氧化碳和水,同时释放出大量的能量。
这一特性使得一氧化碳常被用作内燃机的燃料,如汽车发动机。
3.金属提取:一氧化碳可以作为还原剂,在冶金工业中用于提取金属。
它可以与金属的氧化物反应,将金属从其氧化物中还原出来,得到纯净的金属。
4.化学分析:一氧化碳可以用于分析化学试剂。
由于一氧化碳与一些金属离子形成稳定的络合物,因此常被用于分析金属离子的浓度。
5.其他应用:一氧化碳还被用作制造一些化学品的原料,如醋酸和甲酸。
此外,一氧化碳的反应性使其在一些催化剂的制备中发挥了重要作用。
尽管一氧化碳具有重要的工业和化学应用,但人们在使用和处理一氧化碳时必须注意其毒性和危险性。
在工业和家庭环境中,必须采取措施确保适当的通风和防护装备,以减少一氧化碳的危害。
此外,一氧化碳探测器也被广泛应用于监测室内和工业场所中的一氧化碳浓度,以提醒人们及时采取相应的安全措施。
总结起来,一氧化碳是一种具有毒性的气体,主要用于工业化学反应以及作为燃料和还原剂的能源制备。
一氧化碳性质与用途
一氧化碳性质与用途一氧化碳(CO)是一种无色、无味、无臭的气体,其化学性质稳定而活泼。
以下将详细介绍一氧化碳的性质和用途。
1. 物理性质:- 单质一氧化碳是一个低沸点气体,常温下压缩气体具有明显的液化和固化现象。
- 一氧化碳的密度为0.9682 g/L,比空气轻,能够漂浮在空气中。
- 一氧化碳的熔点为-205.14,沸点为-191.5,在常温下转化为液态或固态。
- 一氧化碳与空气中的氧气在高温高压条件下能够发生爆炸,释放大量能量。
2. 化学性质:- 一氧化碳易与氧气发生反应形成二氧化碳(CO2),并释放大量热量:2CO + O2 →2CO2。
- 一氧化碳与许多金属氧化物反应生成金属等离子和二氧化碳或二氧化碳和金属:CO + CuO →Cu + CO2。
- 一氧化碳可被电弧、紫外线照射和高温催化剂作用下直接与水蒸气反应生成氢气和二氧化碳:CO + H2O →CO2 + H2。
- 一氧化碳与氢气在高温和催化剂的作用下进行水煤气反应生成一氧化碳和氢气:CO + H2 →H2 + CO。
3. 环境和生物学性质:- 一氧化碳是一种毒性气体,对人体和动物具有很高的毒性。
吸入过多的一氧化碳会与人体血红蛋白结合,阻碍了正常的氧气输送,导致中毒甚至窒息。
- 一氧化碳对环境也有很强的污染作用。
一氧化碳是大气中的主要污染物之一,它与空气中的氧气反应生成二氧化碳,不仅造成人工燃烧排放物增加,还加剧了温室效应,对大气环境和人类健康产生负面影响。
4. 用途:- 工业上,一氧化碳是许多化学反应的重要原料,如制造甲酸、丙烯醛、乙烯酮等有机化合物的合成。
- 一氧化碳可作为还原剂用于金属冶炼中,例如铁的冶炼过程中,一氧化碳作为还原剂将铁矿石中的氧气去除,生成纯净的金属铁。
- 一氧化碳广泛用于激光器的激发气体,激光切割、焊接以及一些高精度仪器的加工过程中。
- 一氧化碳还可应用于汽车尾气处理中,通过催化剂将其转化为无害的二氧化碳。
总结为一氧化碳是一种具有毒性和化学活性的气体,其用途广泛,包括工业合成、金属冶炼、激光切割和汽车尾气处理等领域。
中考化学考点一氧化碳的性质和用途
中考化学考点一氧化碳的性质和用途知识点1、一氧化碳的物理性质一氧化碳通常是无色、无味、有毒的气体,密度比空气略小,难溶于水。
知识点2、一氧化碳的化学性质(1)可燃性:一氧化碳能燃烧,发出蓝色火焰,放出热量,罩在火焰上方的烧杯内壁上附着的澄清石灰水变浑浊;化学方程式:2CO+O2 2CO2;注意:点燃一氧化碳等可燃气体前前要验纯。
(2)还原性:一氧化碳能将金属氧化物还原成金属单质,同时生成二氧化碳。
一氧化碳还原氧化铜的化学方程式:CO+CuOCu+CO2,因此一氧化碳可用于冶金工业。
知识点3、一氧化碳还原氧化铜的实验操作顺序:与H2还原CuO的实验操作顺序一样,先通CO,再加热;实验完毕,先停止加热,连续通CO至试管冷却。
尾气处理:因CO有剧毒,不能随意排入空气中,处理的差不多原则是将CO燃烧掉,转化为无毒的CO2或收集备用。
知识点4、一氧化碳的毒性、产生方式及用途(1)一氧化碳的毒性:CO和人体血红蛋白的结合力比氧与血红蛋白的结合力强,人吸入CO会造成人体缺氧,严峻者会致死。
(2)产生CO的三种要紧方式:a.氧气的量不足,碳燃烧不充分:b.CO2遇到酷热的碳;C+CO2=2CO;c.碳与水蒸气高温条件下反应:C+H2O=CO+H2 (水煤气)。
(3)一氧化碳的用途:CO具有可燃性,可作燃料;CO具有还原性,可用来冶炼金属,如炼铁等。
知识点5、一氧化碳的检验方法(1)点燃待检气体,若火焰呈蓝色,则先用干燥小烧杯罩在火焰上方,无水珠,再用内壁涂有澄清石灰水的小烧杯罩在火焰上方,若显现白色浑浊物,则气体为CO。
(2)将待检气体通过灼热的CuO,若显现红色的物质,且产生的气体不能使无水CuSO4变色而能使澄清石灰水变浑浊,则气体为CO。
相关举荐中考化学知识考点复习:周围的化学物质中考化学考点训练:走进溶液世界。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
学习了本节课你有什 么收获?
精品课件
1、一氧化碳主要化学性质是_可__燃____性、__毒_____性和
__还__原___性。它的主要用途是做_燃__料____和在冶金工业中做 __还__原___剂。 2、用纯净的CO还原CuO时,试管中的CuO由______黑_色逐渐 变为_____红__色;将生成的气体通入澄清的石灰水中,可以 看到澄清的石灰水___变__浑__浊。
精品课件
二、CO化学性质
2)CO的毒性:
一氧化碳极易与血液中的血红 蛋白结合,使血红蛋白不能很 好地和氧气结合,造成生物体 内缺氧,严重危及生命。
精品课件
精品课件
一氧化碳还原氧化铜实验
步骤: 1、检验CO的纯度; 2、通入纯净的CO,排尽玻璃管内的空气 3、点燃酒精灯,加热; 4、熄灭酒精灯; 5、停止通入CO。
精品课件
精品课件
精品课件
精品课件
1)CO 具有可燃性。
现象:
2CO + O点2 燃 2CO2
⑴CO燃烧,产生蓝色火焰,放出 热量。
⑵澄清石灰水变浑浊。
注:点燃前一定要验纯
精品课件
你知道吗?
煤炉里的煤在燃烧
过程中,发生了哪些化学反
应?
点燃
2CO + O2
2CO2
点燃
2C + O2
2CO
高温
C + CO2
2CO
点燃
C + O2
CO2
D、水
精品课件
8、长期盛放澄清石灰水的试剂瓶内壁往往附 着一层白色固体,这层白色固体是怎样形成的? 主要成分是什么?石灰水用完以后,如何除去 瓶壁上的白色固体?写出有关反应的化学方程 式。
精品课件
9、在牙膏中,常用轻质碳酸钙粉末作摩擦剂。人 们常用下列方法生产轻质碳酸钙:将石灰石煅烧 制得氧化钙,再将氧化钙加水制成石灰乳【主要 成分是Ca(OH)2】,然后将净化后的石灰乳与二氧 化碳作用得到碳酸钙。试用化学方程式表示上述 反应的原理。
3、下列关于CO的说法中,错误的是( D )
A.在空气中燃烧发出蓝色火焰
B.是排放量很大
的空气污染物
C.能降低血红蛋白的制氧能力
D.能使紫色石蕊
试液变红色
4、下列各种气体中,只能用向上排空气法收集的是 A
()
精品课件
A.CO
B.CO
C.O
5、下列CO和CO2的性质比较中正确的是 A、均是有氧化性、还原性、毒性
(C )
B、都能使澄清石灰水变浑浊
C、通常均为无色、无味的气味
D、均能溶于水
6、CO和CO2性质不同的原因是 A、分子排列不同
( B)
B、分子构成不同
C、组成元素种类不同
D、相对分子质量不同
7、除去CO中混有的少量CO2,可将该混合气体通过( B )
A、灼热的氧化铜
B、足量的澄清石灰水
C、紫色的石蕊试液
一氧化碳
精品课件
一氧化碳和二氧化碳在组 成和构成上有什么相同点 和不同点?
精品课件
一、CO物理性质
比较 CO 和 CO2 的物理性质
CO 无色无味的气体 比空气略小 难溶于水
性
气C体O2
质无色色、无态味、的味气体
比密空气度大
能溶溶解于性水
相同
不相同 不相同
异同点
精品课件
精品课件
二、CO化学性质
2、 实验结束时,是先熄灭酒精灯,还是先停止通入
CO气体?为什么?
答:先熄灭酒精灯,待冷却至室温再停止通一 氧化碳。防止灼热的铜被氧化。同时防止石 灰水倒流入热的玻璃精管品课使件 玻璃管炸裂。
将CO还原氧化铜的实验装置稍作改进,有 什么优点?
co
cuo
C co A cuo
A
澄清的
石灰水 B
B
澄清的石灰水
既能避免CO对环境的污染, C
又能充分利用能源。
利用一氧化碳的还原性炼铁
3CO+Fe2O3
高温
====
2
Fe+3CO2
精品课件
一氧化碳与二氧化碳化学性质的比较
一氧化碳 具有可燃性
具有毒性
不燃烧
能与水反应
能与澄清石灰 水反应
精品课件
一氧化碳和二氧化碳 性质差异很大,原因 是什么?
精品课件
二、CO化学性质
3) CO具有还原性。
CO + CuO △ Cu + CO2
现象:
⑴黑色的粉末逐渐变成红色。 ⑵澄清石灰水精变品课件浑浊。
C
co
cuo
A
澄清的
石灰水 B
1、 开始实验时应该先点燃A处的酒精灯,还是先通入一
氧化碳?为什么?
答:先通入一氧化碳,目的是排净玻璃管内 的空气,防止混合气体加热时发生爆炸
