烃类有机物性质总结
四种简单烃的性质总结

四种简单烃的性质总结(1)有机物种类繁多的原因:1.碳原子以4个共价键跟其它原子结合;2.碳与碳原子之间,形成多种链状和环状的有机化合物;3. 同分异构现象(2) 有机物:多数含碳的化合物(3) 烃:只含C、H元素的化合物烃类名称通式代表物结构特点物理性质化学性质用途烷烃CnH2n+2CH4甲烷碳碳单键呈空间正四面体无色、无味,不溶于水,是天然气、沼气(坑气)和石油气的主要成分甲烷性质稳定,不与强酸强碱反应,在一定条件下能发生以下反应:(1)可燃性(2)取代反应(3)高温分解CH3Cl气体CH2Cl2液体CHCl3(氯仿) CCl4很好的燃料;制取H2、炭黑、氯仿等。
烯烃CnH2n(n≥2) C2H4①2个C原子和4个氢原子处于同一平面。
②乙烯分子里的双键里的一个键易于断裂无色稍有气味,难溶于水(1)加成反应可使溴水褪色(2)氧化反应:1)可燃性:空气中火焰明亮,有黑烟;2)可以使KMnO4(H+)溶液褪色(3)聚合反应:乙烯加聚为聚乙烯制取酒精、塑料等,并能催熟果实。
炔烃CnH2n-2(n≥2)C2H2①2个C原子和2个氢原子处于同直线。
②分子里的C≡C键里有两个是不稳定的键乙炔又名电石气。
纯乙炔是无色、无臭味的气体,因含PH3、H2S等杂质而有臭味;微溶于水,易溶于有机溶剂。
①氧化反应:1)可燃性:空气中,明亮火焰,有浓烟;乙炔在O2里燃烧时,产生的氧炔焰的温度很高(3000℃以上),可用来切割和焊接金属。
2)可被KMnO4溶液氧化②加成反应:可使溴水褪色;乙炔和HCl可制得聚氯乙烯塑料。
芳香烃CnH2n-6(n≥6)C6H6 苯分子里不存在一般的C=C,苯分子里6个C原子之间的键完全相同,这是一种介于C—C和C=C之间的独特的键。
②苯分子里6个C和6个H都在同一平面,无色、有特殊气味的液体,比水轻,不溶于水由于苯分子中的碳碳键介于C—C和C=C之间,在一定条件下,苯分子既可以发生取代反应,又能发生加成反应。
有机物性质归纳

一.烃的结构与化学性质类别通式官能团烷C n H2n+2(n≥ 1)————烃烯C n H2n(n≥2)烃〔单烯烃〕炔C n H2n-2(n≥ 2)代表物分子结构结点由 C、H 构成,碳碳之间为单键连接成CH4链状,任何结构的〔 Mr :16〕所有原子不可能共面!①链状〔可以带支链〕CH2=CH2(Mr :28〕②有CH3— CH=CH2③分子中与碳碳双〔 Mr :42〕键相连的所有原子在同一个平面上①、链状〔可以带H— C≡ C—H〔Mr:支链〕②有主要化学性质1.光照下的卤代;2.裂化;3.不使酸性 KMnO4溶液或溴水褪色; 4.可燃1、加成:X2、H2、HX、HCN2、加聚:一般条件催化剂〔△〕。
3.易被氧化。
与 O2〔条件:PbCl2、CuCl2、加压、加热〕反响生成 CH3CHO.4.使 Br2水〔或 Br2/CCl4〕、酸性 KMnO4褪色5.燃烧现象:黑烟〔炔类是.浓黑烟〕..1、加成:X2、H2、HX、HCN 2、聚合 : 一般条件催化剂。
〔△〕3.易被氧化。
与 HO2〔条件:HgSO 〕反应生成4烃〔单〕—C≡C—26〕—C≡C—③、分子成直线型CH3CHO.4.使 Br2水〔或 Br2/CCl4〕、酸性 KMnO4褪色5.燃烧现象:浓黑烟〔烯类..是黑烟〕.苯及n 2n-6(n≥ 6)C H同系〔不包括萘————物等〕(Mr : 78〕或甲苯①、六元环。
②、一个分子只有一个苯环,侧链为烷基。
③、 12 个原子共面1、取代:与 Br2在Fe〔实际是Fe3+〕做催化剂生成溴苯。
2、加成:与H2〔 Ni 催化〕环己烷;与Cl2〔紫外线〕生成“六六六〞。
3典型反响:卤代、硝化。
二.烃的衍生物的结构与化学性质类别通式一卤代烃:卤代R—X烃多元饱和卤代烃:Cn H2n+2-m X m一元醇:R—OH醇饱和多元醇:C n H2n+2O m醚R—O—R′酚醛酮羧酸酯官能团卤原子—X醇羟基—OH醚键酚羟基—OH醛基羰基羧基酯基代表物C2H5Br(Mr : 109〕CH3OH(Mr : 32〕C2 H5 OH(M r : 46〕C2H5O C2H5(M r : 74〕(M r : 94〕HCHO(M r : 30〕(M r : 44〕(M r : 58〕(M r : 60〕HCOOCH3(M r : 60〕(M r : 88〕分子结构结点主要化学性质卤素原子直接与烃基 1.与 NaOH 水溶液共热发生取结合代反响生成醇β-碳上要有氢原子才 2.与 NaOH 醇溶液共热发生消能发生消去反响去反响生成烯羟基直接与链烃基结1.跟活泼金属反响产生 H22.跟卤化氢或浓氢卤酸反响生合, O—H 及 C—O 均成卤代烃有极性。
有机专题一烃
b.能被酸性 b.苯的同系物 KMnO4 被酸性KMnO4 溶液氧化 溶液氧化
质 ②取代 ③裂化
②加成 ③加聚
②加成 ③聚合
②取代 ③加成
(一)甲烷
3(、一化)学甲性烷质
⑴氧化反应 CH4+2O2 点燃 CO2+2H2O 不能使酸性KMnO4溶液褪色
⑵取代反应 CCCCHHHH432C+ CCl3ll+2+C+l2CCCll22l光2 光照光光照照照CHCCC3HCCH2llCC+4+ll32H++HCCHHl lCCll
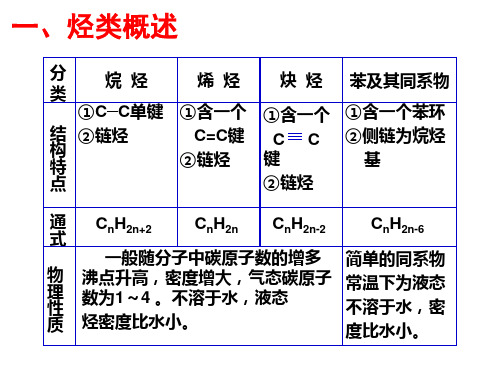
一、烃类概述
分
烷烃
类
①C—C单键
结 ②链烃 构 特 点
烯烃
①含一个 C=C键
②链烃
炔烃
①含一个 CC
键 ②链烃
苯及其同系物
①含一个苯环 ②侧链为烷烃
基
通 式
CnH2n+2
CnH2n
CnH2n-2
CnH2n-6
一般随分子中碳原子数的增多 简单的同系物
物 理 性
沸点升高,密度增大,气态碳原子 常温下为液态
线上的原子有 个4 ,至少 个5 有碳原子共面。
6.检验直馏汽油中含有不饱和烃的方法是 A.加入溴水后观察溴水是否褪色 B.加入溴水振荡后,观察汽油层是否为红棕色 C.加入酸性KMnO4溶液振荡后,观察是否褪色 D.通入H2,观察是否发生反应
7.找出下列高聚[ 物CH的2单-C体H=CH-CH2-CH2CH ]
⑵加成反应
Br2+CH2=CH2→CH2Br—CH2Br
CH2=CH2+H2
Ni △
CH3CH3
CH2=CH2+HCl 催化剂 CH3—CH2Cl
烷烃和烯烃知识点总结

烷烃和烯烃知识点总结一、烷烃的性质1、物理性质烷烃是碳与氢通过单键相连而成的有机化合物,分子结构呈直链或支链结构。
烷烃的物理性质主要包括沸点、密度和熔点等。
(1)沸点烷烃的沸点随着碳链长度的增加而增加。
这是由于长链烷烃分子间的分子力增强。
在同类烃族中,链烷的沸点要高于支链烷烃。
(2)密度烷烃的密度较小,随着碳链长度的增加而增大。
这是由于长链烷烃的分子量大、分子间的引力增强。
(3)熔点烷烃的熔点与沸点规律相似,随着分子量的增加而增加。
2、化学性质(1)不活泼烷烃中的碳碳单键结构使其化学性质较为不活泼。
在常温下,烷烃不易发生化学反应。
(2)易燃烷烃是烃类中的最易燃物质。
这是由于烷烃中碳碳单键的能量较低,易被氧化剂氧气击穿,形成大量的热,导致燃烧的产生。
3、命名规则(1)选出最长的碳链,作为主链。
(2)对主链中的碳原子进行编号,以便于表示连续的取代基。
(3)给出取代基及其所在的碳原子位置,按照字母表的顺序进行排列。
(4)用连字符号(-)将所有的碳原子编号、取代基和主链名相连,主链名的最后一个字母要加“-ane”。
4、反应特点烷烃在高温、催化剂的作用下,发生烷基脱氢反应。
该反应是由于烷烃中的烷基碳原子被脱氢剂(如铜、铬、铝等)吸附,使其脱去氢原子而生成不饱和烃。
(2)烷烃氧化烷烃在氧气的存在下,经催化作用(如钼酸铵、钒酸铵、过渡金属盐类等)发生氧化反应,生成相应的醇、醛和酮等。
(3)烷烃与卤素反应由于烷烃中的氢原子较活泼,易被卤素取代,生成卤代烷。
5、应用领域烷烃在石油化工行业中应用非常广泛,主要用于制备烷烃、醇、醛、酮、以及其他有机物的合成和催化剂的生产。
二、烯烃的性质1、物理性质烯烃的物理性质与烷烃相似,但由于烯烃中含有不饱和的碳碳双键结构,因此烯烃的沸点、密度和熔点等物理性质往往较烷烃要低。
2、化学性质(1)不稳定烯烃中的碳碳双键结构使其对氧气、一氧化氯等氧化剂具有较强的亲和力,容易发生加成反应而生成不稳定的产物。
有机化合物化学性质总结(精华版).

有机化合物化学性质总结(精华版).
一、烃类:
1、烷烃:
由单一的碳链和氢原子组成的构成,是饱和的有机化合物,只有单键,没有明显双键,极易析出极性,易溶于有机溶剂,在常温下可析出单质,不溶于水,碱下析出,常
ch2cl2 中溶解,能形成极性分子间相互作用,由于碳链构型的不同,烷烃的化学性质有
一定差异,如丁烷小容易溶于水,而较大碳链烷烃如环氧戊烷,极不易溶于水。
2、烯烃:
具有环状碳链的有机物,由于对电子需要有一定的要求,所以在常温下大部分烯烃是
含有稳定非极性的碳-碳双键,但易析出极性。
它们大部分是不溶于水,形成极少量的分
子间相互作用,但可与有机溶剂混合溶解或共溶。
二、醛类:
由醛基与醇基所组成的有机物,具有特殊的δ+醛δ-醇化合物结构,多用于有机化
学的合成。
醇以存在着一个极性空间的形式存在于有机溶剂中,它们极易与水反应,形成盐,破坏极性空间,有其特殊的分子间作用和无色的现象,所以可以极易溶于水中,但不
溶于有机的溶剂。
三、酯类:
具有羟基组成碳官能团的有机物,主要由酯基和其它某种有机物组成,具有极性碳-
羰基极性空间,可与有机溶剂混合溶解或共溶,但极不溶于水,因为在水中形成羰基,使
得酯类极难溶于水中,但与碱质有相当大的溶解度,具有一定的把水离子弱化的作用,因此,它们主要用于各种特殊目的。
烃类化合物的结构与性质

烃类化合物的结构与性质烃类化合物是由碳和氢元素构成的有机化合物家族,它们拥有多种不同的结构和性质。
本文将探讨烃类化合物的结构和性质,并通过实例说明其在日常生活和工业中的应用。
一、直链烃的结构与性质直链烃是由一条碳链构成的烃类化合物,分为饱和直链烃和不饱和直链烃两种。
1. 饱和直链烃饱和直链烃的碳原子之间通过单键连接。
最简单的饱和直链烃是甲烷(CH4),它在常温下为无色气体。
饱和直链烃的物理性质主要受碳链长度的影响,碳链越长,沸点和密度越高。
在燃烧时,饱和直链烃会产生大量的热能和二氧化碳。
2. 不饱和直链烃不饱和直链烃分为烯烃和炔烃两类。
烯烃中含有一个或多个碳碳双键,如乙烯(C2H4),它是无色气体,常用于工业原料的制备。
炔烃中含有一个或多个碳碳三键,如乙炔(C2H2),它是无色气体,在焊接中具有重要的应用。
二、环状烃的结构与性质环状烃是由碳原子形成环状结构的烃类化合物,分为脂环烃和芳香烃两类。
1. 脂环烃脂环烃由一个或多个碳原子构成的环状结构,如环丁烷(C4H8)和环己烷(C6H12)。
脂环烃通常具有较高的沸点和密度,且在燃烧时能够释放出大量的能量。
2. 芳香烃芳香烃由苯环(C6H6)和其衍生物组成,是一类具有特殊结构的环烃。
苯的化学性质较为稳定,对电子和取代基的作用具有一定的选择性。
芳香烃广泛应用于医药、染料和香料等工业领域。
三、烃类化合物在日常生活和工业中的应用烃类化合物在生活和工业中具有广泛的应用。
1. 石油和天然气石油和天然气是由各种烃类化合物组成的混合物,是重要的能源来源。
石油在工业中被用于燃料的生产、润滑油的制备以及塑料和合成纤维的生产。
而天然气被广泛使用于家庭供暖和工业生产中。
2. 烃类溶剂由于烃类化合物具有良好的溶解性,许多烃类被用作溶剂,如丙酮、甲苯等。
它们在化工、制药和画家领域被广泛使用。
3. 塑料和橡胶许多塑料和橡胶制品是由烃类聚合物制成的。
例如,聚乙烯是一种常见的塑料,广泛应用于包装材料、塑料袋和瓶子等。
有机化合物知识点总结三

有机化合物知识点总结(三)绝大多数含碳的化合物称为有机化合物,简称有机物。
像CO、CO2、碳酸、碳酸盐、金属碳化物等少数化合物,它们属于无机化合物。
一、烃1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、甲烷、乙烯和苯的性质比较:1.氧化反应 I .燃烧C 2H 4+3O 2点燃> 2CO 2+2H 2O (火焰明亮,伴有黑烟)II .能被酸性KMnO4溶液氧化为CO 2,使酸性KMnO 4溶液褪色。
2.加成反应CH 2=CH 2+Br 2 ------->CH 2Br-CH 2Br (能使滨水或澳的四氯化碳溶液褪色)在一定条件下,乙烯还可以与H 2、Cl 2、HCl 、H 2O 等发生加成反应CH2=CH2+H2 催化剂,CH3cH3CH 2=CH 2+HCl 催化剂"CH 3cH 2cl (氯乙烷:一氯乙烷的简称) CH, = CH,+H,O —催化剂尸 CH.CH.OH (工业制乙醇) 22 2高温高压 3 23 .加聚反应nCH =CH 一催化剂一^一匚三一匚三二一:,(聚乙烯)22△注意:①乙烯能使酸性KMnO 4溶液、滨水或澳的四氯化碳溶液褪色。
常利用该反应鉴别烷烃 和烯烃,如鉴别甲烷和乙烯。
②常用澳水或澳的四氯化碳溶液来除去烷烃中的烯烃,但是不 能用酸性KMnO 4溶液,因为会有二氧化碳生成引入新的杂质。
1 .不能使酸性高镒酸钾褪色,也不能是澳水发生化学反应褪色,说明苯的化学性质比较稳定。
但可以通过萃取作用使滨水颜色变浅,液体分层,上层呈橙红色。
2 .氧化反应(燃烧) 2C 6H 6+15O 2点燃> 12CO 2+6H .O (现象:火焰明亮,伴有浓烟,说明含碳量高)3 .取代反应 (1)苯的漠代:。
+ Br 2*BrR0]- Br (溴苯)+HBr (只发生单取代反应,取代一个H )①反应条件:液澳(纯澳);FeBr 3、FeCl 3或铁单质做催化剂②反应物必须是液澳,不能是滨水。
有机烃类知识点归纳总结

有机烃类知识点归纳总结一、基本概念有机烃是由碳和氢元素构成的化合物,是有机化学的基本研究对象,也是一类重要的化工原料。
有机烃可以按其分子结构和性质分类,常见的有脂肪烃和环烃两大类,它们又可以按碳原子的排列方式分为直链烃和支链烃、按碳原子间的连接及所含的功能基团分为脂环烃和芳香烃。
有机烃广泛存在于自然界中,在石油、煤炭和天然气等矿产资源中含有丰富的有机烃化合物,是重要的化工原料。
二、结构特点1. 脂肪烃脂肪烃是由一条或多条直链所构成,其中所有的碳原子都是以单键连接,没有含有其他结构基团。
脂肪烃包括一元脂肪烃、二元脂肪烃和多元脂肪烃,按其分子结构可分为碳数相等的直链异构体和碳数不等的链状异构体。
2. 环烃环烃是由一个或多个环状结构所构成,其中碳原子以及氢原子组成环状的分子结构。
根据环的数量和结构,环烃可以分为单环烃、多环烃和多环杂环烃。
3. 活性基团有机烃中常含有一些具有活性的功能基团,如双键、三键、卤素、羟基、氨基等,这些功能基团的存在会影响有机烃的化学性质和反应活性。
三、性质1. 物理性质有机烃通常是无色无味的液体或气体,部分有机烃也可以是固体。
它们的密度较小、不溶于水、易溶于有机溶剂、易挥发,具有易燃性和毒性。
2. 化学性质有机烃的化学性质较为活泼,易发生氧化、加成、取代、裂解等反应。
例如,脂肪烃可和氧气发生燃烧反应,烯烃可以发生加成反应,芳香烃可以发生取代反应等。
3. 热化学性质有机烃易燃、易氧化和易裂解,烃类燃烧时通常伴随有明亮的火焰,放出大量的热能。
不同种类的有机烃发生燃烧反应时放热量不同,反映了其分子内部化学键的强度和稳定性。
四、应用1. 石油化工有机烃是石油、煤炭和天然气等矿产资源中含有的主要成分,是石油化工生产的重要原料之一。
通过裂解、重整、合成和加氢等工艺,可以将原油中的有机烃转化为石油、汽油、润滑油等多种化工产品。
2. 化学合成有机烃是化学合成的重要原料,包括取代烃基团的合成、有机溶剂的制备、有机合成反应的催化剂等方面。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
本章重难点专题突破1 各类烃的结构与性质归纳解读类别烷烃烯烃炔烃苯和苯的同系物通式C n H2n+2(n≥1)C n H2n(n≥2)C n H2n-2(n≥2)C n H2n-6(n≥6)碳碳键结构特点仅含C—C键含有键含有键含有苯环主要化学反应取代反应热分解反应氧化反应加成反应氧化反应加成反应氧化反应取代反应加成反应氧化反应代表物CH4CH2===CH2C6H6对应的空间构型正四面体形平面形直线形平面形物理性质一般随分子中碳原子数的增多,熔、沸点升高,密度增大。
碳原子数为1~4的烃,常温下是气态,不溶于水。
液态烃的密度比水的小简单的同系物常温下为液态,不溶于水,密度比水小同分异构体碳链异构碳链异构位置异构碳链异构位置异构侧链大小及相对位置产生的异构[特别提示] ①烷烃与苯和苯的同系物都能发生取代反应,但反应条件不同,前者为光照,后者为铁粉。
②苯不能使酸性高锰酸钾溶液褪色,但苯的同系物一般能被氧化而使酸性高锰酸钾溶液褪色。
类别液溴溴水溴的四氯化碳溶液酸性高锰酸钾溶液烷烃与溴蒸气在光照条件下发生取代反应不反应,液态烷烃可以萃取溴水中的溴从而使溴水层褪色不反应,互溶不褪色不反应烯烃常温加成褪色常温加成褪色常温加成褪色氧化褪色炔烃常温加成褪色常温加成褪色常温加成褪色氧化褪色苯一般不反应,催化条件下可取代不反应,发生萃取而使溴水层褪色不反应,互溶不褪色不反应苯的同系物一般不反应,光照条件下发生侧链上的取代,催化条件下发生苯环上的取代不反应,发生萃取而使溴水层褪色不反应,互溶不褪色氧化褪色[特别提示] 应用上述性质可以解决不同类型烃的鉴别问题,同时要特别注意条件(如液溴、溴水、溴的四氯化碳溶液、光照、催化剂等)对反应的影响。
2 烃类燃烧规律集锦1.烃完全燃烧前后气体体积变化规律烃完全燃烧的通式:C x H y+(x+y4)O2――→点燃x CO2+y2H2O(1)燃烧后温度高于100 ℃,即水为气态ΔV=V后-V前=y4-1①y=4时,ΔV=0,体积不变②y>4时,ΔV>0,体积增大③y<4时,ΔV<0,体积减小(2)燃烧后温度低于100 ℃时,即水为液态ΔV=V前-V后=1+y4,总体积减小[特别提示] 烃完全燃烧时,无论水是气态还是液态,燃烧前后气体体积变化都只与烃分子中的氢原子数有关,而与烃分子中碳原子数无关。
2.烃完全燃烧时耗氧量规律(1)等物质的量的烃(C x H y)完全燃烧时,其耗氧量的大小取决于(x+y4)的值,其值越大,耗氧量越多。
(2)等质量的烃完全燃烧,其耗氧量大小取决于该烃分子中氢的质量分数,其值越大,耗氧量越多。
相同碳原子数的烃类,碳的质量分数越大,耗氧量越多。
(3)最简式相同的烃,不论它们以何种比例混合,只要总质量一定,完全燃烧时所消耗的氧气为定值。
(4)3(1)质量相同的烃,碳的质量分数越大,完全燃烧生成的CO2越多。
(2)碳的质量分数相同的烃,只要总质量一定,以任意比混合,完全燃烧后,产生的CO2的量总是一个定值。
4.燃烧时火焰亮度与含碳量的关系比较规律(1)含碳量越高,燃烧现象越明显,表现为火焰越明亮,黑烟越浓。
如C2H2、苯、甲苯等燃烧时火焰明亮,并伴有大量浓烟;而含碳量越低,燃烧现象越不明显,无黑烟,如甲烷;对于C2H4及单烯烃的燃烧则是火焰较明亮,并伴有少量黑烟。
(2)含碳原子较少的各类烃,燃烧时的现象是不同的,烷烃无黑烟产生,烯烃有少量黑烟产生,炔烃及芳香烃有浓黑烟产生。
应用燃烧来鉴别简单的烷烃、烯烃和炔烃是一种简单而有效的方法。
3、确定混合烃组成的四种方法1.平均相对分子质量法假设混合烃的平均相对分子质量为M,则必含相对分子质量比M小或相等(由同分异构体组成的混合气体)的烃。
如M<26(烷、炔相混),则混合烃中一定有CH4,或M<28(烷、烯相混),则混合烃中一定有CH4,等等。
2.平均分子组成法假设混合烃的平均分子式为C x H y,根据其平均分子组成情况有以下规律:若1<x<2,则混合烃中一定有CH4;若2<y<4,则混合烃中一定有C2H2;若混合烃由两种气体组成,当x=2且其中一种分子中含有两个碳原子,则另一种气体分子中也必含有两个碳原子。
3.根据烃燃烧规律分析遇到烃类物质的燃烧问题时,有很多规律可直接应用于解题,如最简式相同的烃,无论以何种比例混合,当总质量一定时,耗氧量不变且生成CO2和H2O的质量均不变;又如分子式为C x H y的烃,当y=4时,完全燃烧反应前后物质的量相等,等等。
4.讨论法当解决问题的条件不够时,可以从烃类物质的组成情况(如碳原子或氢原子多少关系)、结构特点(如是否饱和)、各类烃的通式等方面出发进行讨论,得出结果。
典例3a mL三种气态烃的混合物与足量氧气混合点燃充分反应后,恢复到原来的状况(常温、常压下),体积共缩小2a mL。
则这三种烃可能是( )A.CH4、C2H4、C3H4 B.C2H6、C3H6、C4H6C.CH4、C2H6、C3H8 D.C2H4、C3H4、C3H6解析如果分别写出各选项中烃对应的燃烧反应的化学方程式,我们会发现只要烃分子中的氢原子数为4,a mL该烃完全燃烧后恢复至常温常压就一定缩小2a mL体积,实际上就是常温下水为液态,是水蒸气占有的体积,所以A项为正确选项。
答案A典例4完全燃烧质量相同的:①甲烷②丙烷③乙烯④乙炔⑤苯⑥间二甲苯时,耗氧量由多到少的顺序是 (用序号表示)。
解析先将各烃转化成CH y/x的形式,①CH4;②CH8/3;③CH2;④CH;⑤CH;⑥C H5/4,因为等质量的烃燃烧时耗氧量取决于y/x的大小,y/x越大,耗氧量越多,所以耗氧量由多到少的顺序为①>②>③>⑥>④=⑤。
答案①>②>③>⑥>④=⑤典例5 400 K 、 kPa 时, L 某烃蒸气能在a L氧气中完全燃烧,体积增大至(a +3) L(相同条件下)。
请回答下列问题: (1)该烃在组成上必须满足的基本条件是 。
(2)当a =10 L 时,该烃可能的分子式为 。
(3)当该烃的分子式为C 7H 8时,a 的取值范围为 。
解析 (1)根据烃完全燃烧的通式和差量法可以求解,即: C x H y +(x +y4)O 2――→点燃x CO 2+y 2H 2O(g) ΔV =(y4-1) L1 L (y4-1) L1.5 L [a +3-(a +] L 根据正比关系解得y =8。
(2)由于该烃在O 2中完全燃烧,故O 2足量,即(x +y4)≤10,且y =8,解得x ≤14/3,且x为整数,结合该烃中的氢原子数为8,可知该烃可能为C 4H 8或C 3H 8。
(3)当烃的分子式为C7H8时,烃完全燃烧,即:a≥(x+y4),且y=8,求得a≥。
答案(1)该烃分子中氢原子数为8 (2)C4H8、C3H8 (3)a≥典例6某温度和压强下,有三种炔烃(分子中均只含一个—CC—键)组成的混合气体4 g,与足量的H2充分加成后生成 g三种对应的烷烃,则所得烷烃中一定有( )A.乙烷B.异丁烷C.丁烷D.丙烷解析设混合炔烃的平均相对分子质量为M,根据题设条件,可得以下关系式:C n H2n-2~2H2~C n H2n+2 M2×24 g g-4 g 解得M=40乙炔的相对分子质量为26,丙炔的相对分子质量为40,显然,混合气体中必含乙炔,其加成可得乙烷。
答案A典例8两种气态烃以任意比例混合,在105 ℃时,1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体的体积仍是10 L。
下列各组混合烃中不符合此条件的是()A.CH4、C2H4B.CH4、C3H4 C.C2H4、C3H4D.C2H2、C3H6解析据题意,t>100 ℃(水为气态),在此状况下气态烃充分燃烧,混合气体的总体积始终为10 L(未变),即ΔV=0,故两种气态烃分子中的平均氢原子数均为4;又因为两种气态烃是以任意比例混合的,D选项中的两种烃除1∶1的情况外,氢原子的平均数都不为4,故D项符合题意。
答案D典例9常温下,一种烷烃A和一种单烯烃B组成混合气体;A和B分子最多只含有4个碳原子,且B分子的碳原子数比A分子的多。
将1 L该混合气体充分燃烧,在同温、同压下得到 L CO2气体。
试推断原混合气体中A和B所解析设混合气体的平均分子式为C x H y,因为同温、同压下气体的体积之比等于物质的量之比。
所以1 mol的混合烃充分燃烧后可生成 mol CO2,即x=,故混合烃的平均分子式可表示为。
由于该混合气体是由烷烃A和单烯烃B组成,且B分子的碳原子数比A多。
由此可推断,混合气体只能由碳原子数小于的烷烃(CH4和C2H6)和碳原子数大于的烯烃(C3H6和C4H8)组成。
它们有四种可能的组合,根据每一种组合中烷烃和烯烃的碳原子个数及平均分子式中碳原子数,可以确定A和B的体积比。
以第①组为例,用十字交叉法确定V A∶V B的大小:V A V B =1 3其他组同样可以用十字交叉法确定V A∶V B大小。
组合编号A的分子式B的分子式A和B的体积比V(A)∶V(B)①CH4C3H61∶3②CH4C4H81∶1③C2H6C3H61∶1④C2H6C4H83∶11.等质量的下列烷烃,完全燃烧消耗氧气最多的是( )A.CH4B.C2H6C.C3H8D.C6H14答案A解析判断等质量的不同烃燃烧时的耗氧量,可先简化其分子式为CH x,x越大,氢的质量分数就越大,耗氧量就越多。
本题中A项最简式为CH4;B项最简式为CH3;C项最简式为;D项最简式为。
故答案为A。
2.将1 mol两种气态烃组成的混合气体完全燃烧后得到 mol CO2和2 mol H2O。
下列说法正确的是( B )A.一定有乙烷 B.一定有甲烷 C.一定没有甲烷 D.不一定有甲烷3.一种气态烷烃和一种气态烯烃的混合物9 g,其密度是相同条件下氢气密度的倍,当混合气体通过足量溴水时,溴水增重 g,则这两种气态烃是( )A.甲烷和乙烯 B.乙烷和乙烯 C.甲烷和丙烯 D.甲烷和丁烯答案C解析根据已知条件,先求出混合气体的平均相对分子质量,即×2=。
由于烷烃中只有甲烷的相对分子质量小于,则该混合物中一定含有甲烷。
混合气体通过溴水时溴水增重,说明该混合气体中烯烃的质量为 g,则甲烷的质量为9 g- g= g,即n(CH4)= mol。
设该不饱和烃的物质的量为x,则有9 gmol+x mol=g·mol-1,解得:x= mol,即该不饱和烃的摩尔质量为42 g·mo l-1,为丙烯。
4.某一氯代烷 g,与足量NaOH水溶液混合加热后用硝酸酸化,再加入足量的AgNO3溶液,生成白色沉淀 g。
