硝酸根测定方法(高锰酸钾滴定法)
地表水硝酸根测试方法

地表水硝酸根测试方法
地表水中硝酸根的测试方法一般有以下几种:
1. 紫外光谱法:硝酸根在紫外光谱中吸收较强的峰位在200-220nm,可以通过紫外光谱仪测定水样中硝酸根的吸光度,进
而计算出硝酸根的浓度。
2. 离子选择电极法:使用硝酸盐选择电极,将其插入水样中,根据电极测量电位变化来判断硝酸根的浓度。
3. pH指示剂法:将pH指示剂加入水样中,当硝酸根浓度较
高时,水样呈现碱性,指示剂颜色发生改变,通过颜色的变化来判断硝酸根的浓度。
4. 高效液相色谱法:通过高效液相色谱仪分离和检测水样中的硝酸根,通过峰面积或峰高来计算硝酸根的浓度。
5. 倍卤法:将水样与含有Cl-、Br-、HNO3溶液混合,硝酸根
通过氯、溴与亚铁离子生成五卤化合物沉淀,通过测定沉淀的重量或测定亚铁离子的浓度来计算硝酸根的浓度。
需要注意的是,不同的测试方法适用于不同范围的硝酸根浓度,选择合适的测试方法确保准确度和可靠性。
同时,测试前应提前校准所用仪器和检测试剂,遵循相应的操作规程。
硝酸根,亚硝酸根的测定

硝酸(根)钠、亚硝酸(根)钠的测定准确量取10.00mL吸收液于200mL容量瓶中,用蒸馏水定容,摇匀,装入滴定管中。
取10.00mL稀释液于三角瓶中,加10mL饱和硫酸铵溶液,加热出现白色固体(干固),取下冷却至室温。
加入25.00mL硫酸亚铁铵标准溶液、10mL浓硫酸,加热煮沸1-2分钟驱赶NO2后,用高锰酸钾标准溶液滴定至微红色,30秒不变色即为终点。
同时做空白。
NaNO3(g/L)=(A-B)×N×0.02833×1000×20/10A—空白校对毫升数B –试样耗用毫升数N--高锰酸钾标准溶液的当量浓度0.02833—NaNO3的毫克当量:单位:克20—稀释倍数10—取样体积(mL)NO3-(g/L)=(C1V1-C2V2)×62×20/(3×10)C1,V1—硫酸亚铁铵的体积(mL)和浓度C2,V2—高锰酸钾的体积(mL)和当量浓度20—稀释倍数10—取样体积取50mL(1+5)硫酸于三角瓶中,加入高锰酸钾至微红色,加热至40-60℃,再准确加入25.00mL 高锰酸钾标准溶液,用稀释液滴定至微红色,半分钟不退色即为终点。
NaNO2(g/L)= 25×N×0.0345×1000×20/VN--高锰酸钾标准溶液的当量浓度0.0345—1mL高锰酸钾相当NaNO2的克数。
单位:克V—滴定稀释液的体积(mL)20—稀释倍数NO2-(g/L)= C2V2×46×20/(2×V)C2,V2—高锰酸钾的体积(mL)和当量浓度V—耗用稀释液体积(mL)20—稀释倍数10—取样体积注意:①高锰酸钾当量浓度C2=0.1(高锰酸钾摩尔浓度0.02mol/L);②硫酸亚铁铵浓度0.1mol/L;③计算结果均为原吸收液浓度;④(1+5)硫酸必须加热至40-60℃;⑤加硫酸亚铁铵溶液前必须冷却到室温。
硝酸根测定方法

硝酸根测定方法嘿,朋友们!今天咱来聊聊硝酸根的测定方法,这可真是个有趣又重要的事儿呢!你想想看,硝酸根就像是个调皮的小精灵,在各种物质里藏着,我们得想办法把它给揪出来。
那怎么揪呢?这就得靠一些巧妙的办法啦。
比如说,有一种方法就像是猎人追踪猎物的足迹一样。
我们通过一些化学反应,让硝酸根现形。
就好像猎物总会在地上留下脚印,硝酸根在特定的条件下也会露出马脚。
然后我们根据这些迹象,就能判断出它到底在不在那里。
还有一种方法呢,就像是给硝酸根做个独特的标记。
利用一些特殊的试剂,和硝酸根产生特别的反应,就好像给它贴上了一个只有我们能认得出来的标签。
这样一来,我们就能轻松地找到它啦。
你说这是不是很有意思呀?就好像我们在玩一个找宝藏的游戏,而硝酸根就是我们要找的那个大宝藏!测定硝酸根的过程也像是一场冒险呢。
有时候可能会遇到一些小挫折,就像路上的小石子会绊你一下,但咱可不能怕呀!要鼓起勇气继续往前冲。
想象一下,如果我们没有掌握好这些方法,那岂不是就像在黑暗中摸索,找不到方向呀?那可不行,我们得把这个小调皮给抓住,搞清楚它的情况。
而且呀,这些方法都不是随随便便就能成功的,得细心,得耐心。
就跟做饭一样,火候不到不行,调料放错了也不行。
咱得认真对待,才能得到准确的结果。
在实际操作中,每一步都要小心谨慎,可不能马虎大意哦。
就像走钢丝一样,稍有不慎就可能掉下去。
但只要我们掌握了技巧,保持平衡,就能顺利走到对岸。
总之呢,硝酸根的测定方法可真是一门大学问呀!我们要不断地学习、实践,才能把这个小精灵给牢牢抓住。
朋友们,加油吧,让我们一起在这个奇妙的化学世界里探索,找出那些隐藏的硝酸根!相信自己,我们一定能行!原创不易,请尊重原创,谢谢!。
硝酸根的测定方法

硝酸根的测定方法嘿,朋友们!今天咱来聊聊硝酸根的测定方法。
这可真是个有意思的事儿呢!你想想看,硝酸根就像个调皮的小精灵,藏在各种物质里,我们得想办法把它给揪出来。
那怎么揪呢?有一种常见的方法是分光光度法。
就好像我们拿着一个特别的“照妖镜”,让硝酸根在特定的光线照射下现形。
通过一系列的操作和试剂的加入,让它乖乖地显色,然后我们就能根据颜色的深浅来判断硝酸根的含量啦。
这是不是很神奇?就像我们能看到肉眼看不到的东西一样。
还有一种离子色谱法,这就像是给硝酸根开辟了一条专属通道,让它顺着这条道儿跑出来,然后我们在终点等着抓住它。
这个方法可厉害了,能把硝酸根分得清清楚楚,一点都不含糊。
再说说还原滴定法吧,这就像是一场和硝酸根的“捉迷藏”游戏。
我们先把它变成别的形态,然后再通过滴定的方式慢慢找到它,就像一点点揭开它的神秘面纱。
哎呀,这硝酸根的测定方法可真是各有各的妙处啊!你说要是没有这些方法,我们怎么能知道那些物质里到底有多少硝酸根呢?那岂不是像在黑暗中摸索一样。
在实际操作中,可得小心谨慎哦!每一步都要像走钢丝一样稳稳当当的,不然一不小心就可能出错啦。
就好比搭积木,一块没放好,可能整个就垮了。
而且,不同的方法适用的情况也不一样哦,就像不同的鞋子适合不同的场合,我们得根据具体情况来选择合适的方法。
总之,硝酸根的测定可不是一件简单的事儿,但也绝对不是什么难到登天的任务。
只要我们认真对待,掌握好方法,就一定能把这个调皮的小精灵给抓住。
大家可别小瞧了这小小的硝酸根测定,它在很多领域都有着重要的作用呢!比如环境监测、化工生产等等。
所以啊,学会它,用处可大着呢!这就是我对硝酸根测定方法的一些分享啦,大家觉得怎么样呢?。
水中硝酸根的测定
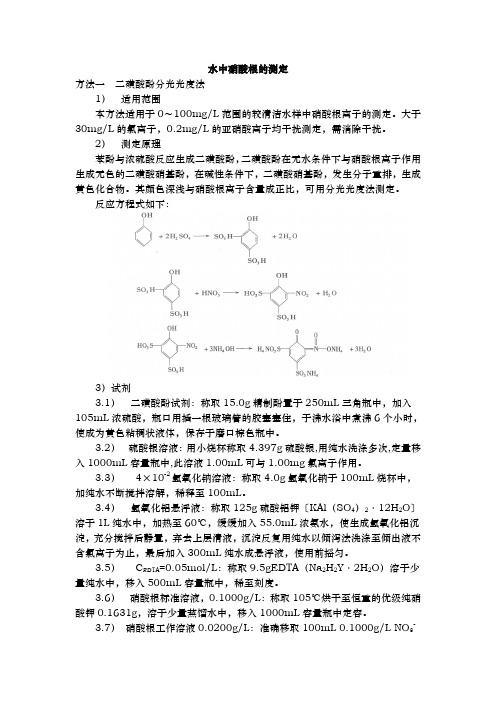
水中硝酸根的测定方法一二磺酸酚分光光度法1)适用范围本方法适用于0~100mg/L范围的较清洁水样中硝酸根离子的测定。
大于30mg/L的氯离子,0.2mg/L的亚硝酸离子均干扰测定,需消除干扰。
2)测定原理苯酚与浓硫酸反应生成二磺酸酚,二磺酸酚在无水条件下与硝酸根离子作用生成无色的二磺酸硝基酚,在碱性条件下,二磺酸硝基酚,发生分子重排,生成黄色化合物。
其颜色深浅与硝酸根离子含量成正比,可用分光光度法测定。
反应方程式如下:3)试剂3.1)二磺酸酚试剂:称取15.0g精制酚置于250mL三角瓶中,加入105mL浓硫酸,瓶口用插一根玻璃管的胶塞塞住,于沸水浴中煮沸6个小时,使成为黄色粘稠状液体,保存于磨口棕色瓶中。
3.2)硫酸银溶液:用小烧杯称取4.397g硫酸银,用纯水洗涤多次,定量移入1000mL容量瓶中,此溶液1.00mL可与1.00mg氯离子作用。
3.3)4×10-2氢氧化钠溶液:称取4.0g氢氧化钠于100mL烧杯中,加纯水不断搅拌溶解,稀释至100mL。
3.4)氢氧化铝悬浮液:称取125g硫酸铝钾〔KAl(SO4)2·12H2O〕溶于1L纯水中,加热至60℃,缓缓加入55.0mL浓氨水,使生成氢氧化铝沉淀,充分搅拌后静置,弃去上层清液,沉淀反复用纯水以倾泻法洗涤至倾出液不含氯离子为止,最后加入300mL纯水成悬浮液,使用前摇匀。
3.5)C EDTA=0.05mol/L:称取9.5gEDTA(Na2H2Y·2H2O)溶于少量纯水中,移入500mL容量瓶中,稀至刻度。
3.6)硝酸根标准溶液,0.1000g/L:称取105℃烘干至恒重的优级纯硝酸钾0.1631g,溶于少量蒸馏水中,移入1000mL容量瓶中定容。
3.7)硝酸根工作溶液0.0200g/L:准确移取100mL 0.1000g/L NO3-标准溶液于500mL容量瓶中,用水稀释至刻度即可。
(20mg/L)3.8)1+1氨水。
硝酸根测定方法(高锰酸钾滴定法)

硝酸根的测定方法(高锰酸钾滴定法)
1、测试原理
用高锰酸钾溶液去除水样中亚铁离子的干扰,后加入硫酸亚铁铵和硫酸溶液,
加热,使亚铁离子和硝酸根反应完全,后加入高锰酸钾溶液反滴定。
3Fe2++NO3-+4H+=3Fe3++NO+2H2O
NO+FeSO4=Fe(NO)SO4(棕色)
Fe(NO)SO4=NO↑+FeSO4
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
2、测定仪器及试剂
硫酸溶液(1:1水溶液)、硫酸亚铁铵(0.25mol/L标准溶液)、KMnO4溶液
(0.02mol/L标准溶液)、移液管。
3、标准溶液的配制
A 硫酸溶液(1:1水溶液)。
B 0.25mol/L硫酸亚铁铵溶液的配制:5.7克硫酸亚铁铵加入100毫升的容量
瓶中,冲至刻度,摇匀。
C 0.02mol/L KMnO4标准溶液的配制:0.79克KMnO4加入250毫升的容量瓶中,冲至刻度,摇匀。
4、实验过程
用移液管移取10毫升水样置于250毫升干燥的锥形瓶中,加入100毫升去离子水,滴加1:1硫酸水溶液调PH值0~1,用0.02mol/L KMnO4标准溶液滴定至溶
液成粉红色,再在上述溶液中加入已知量的硫酸亚铁铵,补加5~8毫升1:1硫酸,加热煮沸数分钟,使Fe2+和NO3-充分反应完全,冷却后,用0.02mol/L KMnO4标准溶液滴定至溶液成粉红色为终点。
5、计算公式
式中:V1—加入硫酸亚铁铵标准溶液的体积(ml)
V2—加入KMnO4标准溶液滴定的体积(ml) C1--硫酸亚铁铵标准溶液的浓度(mol/L) C2-- KMnO4标准溶液的浓度(mol/L)
V—取样量(ml)。
硝酸根离子检测方法

硝酸根离子检测方法硝酸根离子(NO3-)是一种常见的无机阴离子,广泛存在于自然界中的土壤、水体和空气中。
然而,硝酸根离子的过度积累会导致水体和土壤的污染,对环境和人类健康造成潜在的危害。
因此,准确检测硝酸根离子含量是环境保护和水质监测的重要任务之一。
为了检测硝酸根离子,科学家们发展了多种方法,下面将介绍其中一些常用的检测方法。
1. 纳氏法纳氏法是一种常用的检测硝酸根离子的定性和定量分析方法。
该方法基于硝酸根离子与亚硫酸铵反应生成硫酸根离子的化学反应。
在适当的pH条件下,硝酸根离子与亚硫酸铵反应生成氨气,氨气可以通过氨电极进行检测。
根据生成的氨气量可以确定硝酸根离子的含量。
2. 紫外光谱法紫外光谱法是一种常用的检测硝酸根离子的定性和定量分析方法。
硝酸根离子在紫外光谱中有一定的吸收峰,根据吸收峰的强度可以确定硝酸根离子的浓度。
这种方法无需特殊试剂,操作简便,但需要专业的紫外光谱仪器进行分析。
3. 离子色谱法离子色谱法是一种常用的检测硝酸根离子的定性和定量分析方法。
该方法基于硝酸根离子在特定条件下与色谱柱中的固定相发生离子交换反应。
通过调节流动相的组成和pH值,硝酸根离子可以与其他离子分离,进而进行定量分析。
离子色谱法具有高灵敏度和准确性,适用于复杂样品的分析。
4. 光度法光度法是一种常用的检测硝酸根离子的定量分析方法。
该方法基于硝酸根离子与邻苯二甲酸二乙酯反应生成紫色化合物的化学反应。
通过测量反应产物的吸光度,可以确定硝酸根离子的浓度。
光度法操作简便,结果准确可靠,适用于大批量样品的分析。
除了上述方法,还有许多其他方法可以用于检测硝酸根离子,如荧光法、电化学法等。
每种方法都有其优缺点,选择合适的检测方法需要考虑样品性质、目标浓度范围、设备可用性等因素。
总结起来,硝酸根离子的检测方法多种多样,通过选择合适的方法可以实现对硝酸根离子含量的准确分析。
这些方法在环境保护、水质监测和农业管理等领域起着重要作用,为我们提供了科学依据,以保护环境和维护人类健康。
硝酸根离子含量检测方法

硝酸根离子含量检测方法嘿,你问硝酸根离子含量检测方法啊?这事儿咱得好好说说。
先得准备一些东西哇。
比如说要有检测试剂,还有一些玻璃器皿啥的。
可不能随便找些东西就来检测,那可不行。
就像你做饭得有锅碗瓢盆一样,检测也得有合适的工具。
然后呢,可以用一种比较常见的方法,就是比色法。
把要检测的样品弄一点出来,放到一个容器里。
加上一些特定的试剂,这些试剂会和硝酸根离子发生反应,然后产生颜色变化。
就像变魔术一样,不过这可不是为了好玩,是为了检测硝酸根离子呢。
接着观察颜色的变化。
如果颜色变得很深,那可能硝酸根离子含量就比较高;如果颜色比较浅,那含量可能就比较低。
这就像看红绿灯一样,颜色不同代表的意思也不同。
还可以用仪器来检测。
有那种专门检测硝酸根离子的仪器,把样品放进去,仪器就会告诉你硝酸根离子的含量是多少。
这就像用温度计测量体温一样,很方便。
在检测的过程中,要注意一些问题哦。
比如说样品要取好,不能有杂质混进去,不然会影响检测结果。
还有操作要规范,不能乱搞一气。
就像你做作业得认真,不能乱写乱画。
我记得有一次我们做实验,就是检测硝酸根离子含量。
大家都很认真地准备东西,按照步骤来操作。
看着试剂和样品发生反应,颜色慢慢变化,心里可紧张了。
最后得出了结果,大家都很兴奋。
通过这次实验,我们也学会了怎么检测硝酸根离子含量。
总之啊,检测硝酸根离子含量有方法。
准备好工具,用对方法,注意细节。
这样就能准确地知道硝酸根离子的含量啦。
赶紧试试吧。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硝酸根的测定方法(高锰酸钾滴定法)
1、测试原理
用高锰酸钾溶液去除水样中亚铁离子的干扰,后加入硫酸亚铁铵和硫酸溶液,
加热,使亚铁离子和硝酸根反应完全,后加入高锰酸钾溶液反滴定。
3Fe2++NO3-+4H+=3Fe3++NO+2H2O
NO+FeSO4=Fe(NO)SO4(棕色)
Fe(NO)SO4=NO↑+FeSO4
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
2、测定仪器及试剂
硫酸溶液(1:1水溶液)、硫酸亚铁铵(0.25mol/L标准溶液)、KMnO4溶液
(0.02mol/L标准溶液)、移液管。
3、标准溶液的配制
A 硫酸溶液(1:1水溶液)。
B 0.25mol/L硫酸亚铁铵溶液的配制:5.7克硫酸亚铁铵加入100毫升的容量
瓶中,冲至刻度,摇匀。
C 0.02mol/L KMnO4标准溶液的配制:0.79克KMnO4加入250毫升的容量瓶中,冲至刻度,摇匀。
4、实验过程
用移液管移取10毫升水样置于250毫升干燥的锥形瓶中,加入100毫升去离子水,滴加1:1硫酸水溶液调PH值0~1,用0.02mol/L KMnO4标准溶液滴定至溶
液成粉红色,再在上述溶液中加入已知量的硫酸亚铁铵,补加5~8毫升1:1硫酸,加热煮沸数分钟,使Fe2+和NO3-充分反应完全,冷却后,用0.02mol/L KMnO4标准溶液滴定至溶液成粉红色为终点。
5、计算公式
式中:V1—加入硫酸亚铁铵标准溶液的体积(ml)
V2—加入KMnO4标准溶液滴定的体积(ml) C1--硫酸亚铁铵标准溶液的浓度(mol/L) C2-- KMnO4标准溶液的浓度(mol/L)
V—取样量(ml)。
