玉米细菌性条斑病非寄主抗性基因Rxo1转化水稻的研究
生物学新研究方法

一、图位克隆相关汇总1、用于QTL初定位群体的类型有哪些以及各群体的特点F2群体易于配制,需要时间短,所提供的遗传信息最为丰富,可以估算加性效应及显性效应。
但F2群体由单株组成且尚未达到纯合,提供的材料有限,很难对其进行连续性研究。
由于每个基因型只有一株,由此得到的数量性状数据可靠性差。
补救办法是利用F2代单株衍生的F2:3家系,选取同一家系中的若干个体进行分析,但这样做不仅加大了工作量,而且容易造成抽样误差。
回交(BC)群体:低代回交群体重组交换的信息量比F2少,为了弥补回交群体的不足现在多采用先回交再自交的方式,对回交后代进行自交。
DH系群体:加倍单倍体群体,是通过诱导F1单倍体并加倍形成的群体,群体内基因完全纯合,群体内的差异构成了分离群体的遗传特性,是永久群体,但重组交换的信息较少。
RIL系:RIL群体基因基本纯合,群体结构稳定,也是一个永久性分离群体,重组程度高于F2群体,因此,RIL 群体构建的图谱比F2的有着更高的解析度。
但建立一套RIL需要多年的工作。
而且,在基因组的某些区域的纯合比理论预期需要更长的时间,而且不能估计显性效应。
2、简答图位克隆常见的群体(至少三个)及其特点。
根据分离群体的特点,图位克隆作图群体分为临时性分离群体、永久性分离群体和回交近交系群体三大类。
临时性分离群体:包括单交组合产生的F2及其衍生的F3、F4家系回交群体。
其显著特征时群体中每一个个体后代均可发生分离,除非自交不亲和性,F2易配制。
而且提供给遗传分析的信息最为丰富,可以同时估计加性效应和显性效应。
但由于F2存在分离,很难进行多年多点研究。
永久性分离群体:主要包括重组自交系群体(RIL)和加倍单倍体群体(DH)。
其显著特征是群体中每一个体其后代稳定,不发生分离,可重复进行试验,将区组效应、重复效应和随机误差最小化或分解,增加检测QTL准确性。
但构建RIL 群体需很长时间;构建DH群体受基因型限制,难度较大,且它们不能估计显性效应。
水稻细菌性条斑病防治研究进展

0引言水稻细菌性条斑病(Bacterial leaf streak)是由稻黄单孢菌(Xanthomonas oryzae pv.Oryzicola )引起的一种水稻病害。
最早在菲律宾发现[1],后来在亚洲的热带,亚热带及非洲西部水稻种植区广泛传播[2-3]。
中国于1955年在广东地区首次发现该病的存在[4]。
水稻发生该病后一般减产15%~25%,严重时可达40%~60%[5]。
并且由于该病具有发病早,病情易扩展,病害破坏性大等特点,对水稻的高产稳产造成严重的威胁。
目前,对该病的防治主要集中在遗传育种方面的研究,即抗病基因与抗性品种的筛选、抗性品种的培育。
唐定中等[6]通过抗性基因标记技术目前已成功定位了13个与水稻细菌性条斑病抗性相关的QTL ;王侯聪等[7]也通过辐射诱变育种成功培育了水稻细菌性条斑病抗病品种佳辐占;Zhao 等[8]发现了水稻细菌性条斑病的非寄主抗病基因Rox1。
这些工作对通过遗传育种控制水稻基金项目:湖南省自然科学基金“水稻热激转录因子OsHSF18调节水稻抗逆性的分子机制研究”(2016JJ3071);湖南省大学生科技创新项目“拟南芥Copine 蛋白BON1在PUB13调控的细胞死亡和抗病反应中的功能研究”(G)(SCN1622)。
第一作者简介:汤帅,男,1996年出生,本科,研究方向:植物抗病机制的研究。
通信地址:410128湖南省长沙市芙蓉区农大路1号湖南农业大学植物保护学院,Tel :0731-********,E-mail :186********@ 。
通讯作者:李魏,男,1986年出生,湖南岳阳人,教授,博士,研究方向,植物抗病机制的研究。
通信地址;410128湖南省长沙市芙蓉区农大路1号湖南农业大学植物保护学院,Tel :0731-********,E-mail :liwei350551@ 。
收稿日期:2017-08-31,修回日期:2017-10-16。
水稻细菌性条斑病防治研究进展汤帅1,杨远航1,潘素君2,林木青3,戴良英1,2,李魏1,2(1湖南农业大学植物保护学院,长沙410128;2作物基因工程湖南省重点实验室,长沙410128)摘要:水稻细菌性条斑病是水稻上最重要的病害之一,在中国南方大部分水稻种植区都有发生,严重危害水稻产量,但目前仍未发现非常有效的防治方法。
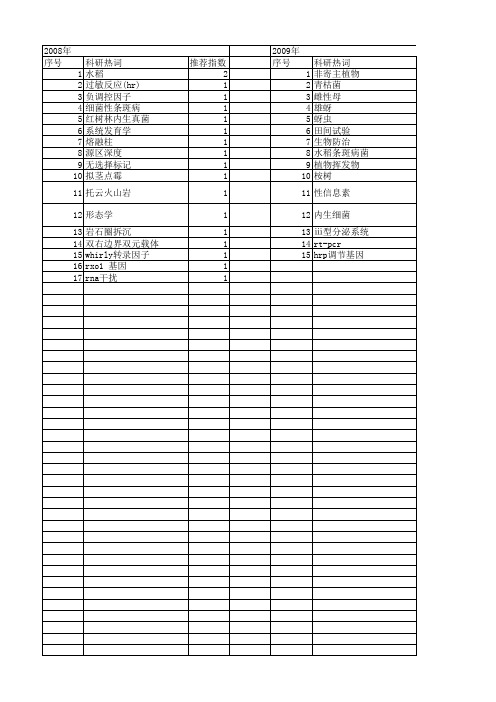
【国家自然科学基金】_非寄主_基金支持热词逐年推荐_【万方软件创新助手】_20140801
科研热词 推荐指数 蓖麻 2 黑麦草 1 黄瓜炭疽病菌 1 黄瓜 1 高丹草 1 非寄主 1 金龟甲 1 过敏性反应 1 辣椒 1 触角电位(eag) 1 行为 1 绿叶挥发性物质 1 烟草 1 植物挥发物 1 微管骨架 1 寄主定位 1 发育进度 1 南方根结线虫 1 促生 1 云南松 1 云南切梢小蠹 1 乳突 1 丁香假单胞大豆致病变种 1 harpin编码基因 1 gst融合表达 1 "y"型嗅觉仪 1
推荐指数 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2009年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
科研热词 非寄主植物 青枯菌 雌性母 雄蚜 蚜虫 田间试验 生物防治 水稻条斑病菌 植物挥发物 桉树 性信息素 内生细菌 ⅲ型分泌系统 rt-pcr hrp调节基因
2012年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31
科研热词 非寄主抗性基因 非寄主抗性 防御机制 防御信号 转录因子 西瓜食酸菌 蒸腾速率 莲子草假隔链格孢 芙新姬小蜂 致病毒素 致病性 致病力 胞外多糖 群体感应 空心莲子草 病毒诱导的基因沉默 甜瓜 泛素融合降解蛋白 水稻白叶枯病菌 气孔导度 本氏烟 控害效应 抗逆性 抗病性 叶绿素含量 叶绿体超微结构 叶片细胞 叶片光合作用 卵育型寄生蜂 净光合速率 tatb基因
推荐指数 6 5 4 3 2 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2011年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23
水稻细菌性条斑病监测方法(试行)

水稻细菌性条斑病监测方法(试行)水稻细菌性条斑病监测方法(试行)为规范水稻细菌性条斑病疫情监测工作,及时掌握疫情发生、发展动态,特制定本方法。
本方法规定了水稻细菌性条斑病监测区域、监测布点、监测时期、监测方法等。
本方法适用于我省各地水稻细菌性条斑病的监测。
1 监测准备收集当地水稻等植物的种植情况,水稻细菌性条斑病发生历史和现状等有关资料;制定简便易行的水稻细菌性条斑病监测计划。
2 监测区域重点监测疫情发生高风险区域,如:从疫情发生区调入水稻的种子及产品的地区,水稻植物种子繁育基地等高风险区域。
主要监测水稻细菌性条斑病的发生发展情况。
3 监测作物重点监测水稻植物。
4 监测工具剪刀、取样袋、手套、鞋套、小镊子、荧光记录笔、标签纸、记录表、消毒液等。
5 监测时期在水稻四叶期、拔节期、孕穗至抽穗阶段、齐穗后至叶片枯黄前,对水稻秧田和本田进行田间症状目测踏查。
发现感染水稻细菌性条斑病典型症状和疑似症状的植株叶片,则取样送实验室检验鉴定。
6 监测方法6.1未发生区6.1.1 访问调查向水稻种植户、农技人员等相关人员询问有关水稻植株矮缩和非正常枯萎的情况,初步了解疫情可能发生地点、时间、危害情况。
对询问过程发现的水稻细菌性条斑病可疑性地区,进行深入重点调查。
6.1.2踏查在水稻作物生长期进行2-3次踏查,代表面积占种植面积的50%以上。
踏查发现可疑病害症状立即进行标记,踏查结果记入水稻细菌性条斑病监测调查记录表(见附表1)。
6.2 发生区6.2.1 发生区范围监测采取访问调查和踏查方法(具体方法见6.1.1和6.1.2),发现可疑疫情进行定点调查。
6.2.2 发生区发生动态监测采取定点调查法。
每县选3-5个调查点,在水稻四叶期、拔节期、孕穗至抽穗阶段、齐穗后至叶片枯黄前进行调查。
填写水稻细菌性条斑病监测调查表(见附表1)。
7 疫情诊断7.1现场诊断整个水稻生育期的叶片均可受害。
病菌侵入后,开始显症为细小水渍状短条点斑,渐形成叶脉间透明条斑,后由于受叶脉限制,形成宽约0.25 mm,长约1 mm-5 mm的条斑,随后,单个病斑可扩大到宽1 mm、长10mm以上,颜色由黄转黄褐色,对光观察呈油渍状半透明。
玉米大斑病的研究进展

病呈现加重 的趋 势[ 2 - , 引起 了广大育种工作 者 的 高度重视 。国 内外 的专家学者对 玉米 大斑病进行 了多 方 面 的 研 究 , 而且 随着 科 学 技 术 的发 展 , 取 得
天津农业科学 死 删i n A g r i c u l t u r a l S c i e n c e s
・作 物 栽 培 与 设 施 园 艺
玉米大斑病 的研 究进展
王慧慧 , 张文忠, 芦 明, 连培红 , 申海斌
( 山西 省农业 科 学院 谷子 研究 所 , 山西 长治 0 4 6 0 1 1 )
摘
要: 近年来玉米大斑病连年发生 , 给玉米生产造成严重损失 。 为 了给抗玉米大斑病育种提供可靠的依据 , 本文从 玉米大斑病
的发生与危害 、 玉米大斑病菌生理小种的分化 、 玉米大斑病抗性基 因的研究进展和抗性材料的筛选等方面 阐述了关 于玉米大斑
病 的相关研究进展 , 并对存在 的问题进行分析 和展望 。 关键 词: 玉米 大斑病 ; 生理小 种 ; 抗性基因 ; 分子标记 中图 分类号 : ¥ 4 3 5 . 1 3 1 文献标 识码 : A D O I编码 : 1 0 . 3 9 6 9  ̄ . i s s n . 1 o 0 6 —6 5 0 0 . 2 0 1 6 . 1 2 . 0 3 2
g i v e a r e l i a b l e b a s i s f o r r e s i s t a n c e b r e e d i n g t o NC L B, t h i s p a p e r i n t r o d u c e d t h e d e v e l o p me n t a n d d a ma g e o f NC L B, t h e p h y s i o l o g i c a l
水稻细菌性条斑病和抗性育种研究进展

Key words:Rice;Bacterial leaf streak;Gene;Breeding
水稻细菌性条斑病(bacterial leaf streak,BLS,简 称细条病)是由Xanthomonas oryzae pv.oryzicola,(简 称XooC)侵染引起的细菌性病害。该病是目前威胁 我国南方稻区水稻生产的重要病害,也是我国、美国 和澳大利亚等国重要的检疫性水稻病害…。据估 计,当气候条件适宜时,水稻细条病能在感病品种上 引起15%一25%损失,严重时可达40%一60%¨1。 发掘利用新抗源,培育抗病品种是控制该病害最经
辐射诱变结合常规选育和新兴的水稻无融合生 殖育种技术,无形中推动了水稻细条病抗性育种的 发展,足见多种育种方法综合利用在细条病抗性育 种中的潜力。分子标记辅助选择(molecular marker. assisted selection,MAS)技术,在细条病抗性育种中 也得到初步的应用。陈志伟等日3j筛选出3个细条 病抗性QTL紧密连锁的SSR标记,并应用于把高抗 细条病的品种Acc8558中的抗病基因导人到高感细 条病的品种珍汕97B中的回交育种中,感病亲本抗 性得到明显提高。用这种方法可实现选育持久抗病 品种,如将多个不等位的抗病基因聚合到同一品种
水稻细菌性条斑病的防控技术
水稻细菌性条斑病的防控技术发布时间:2023-03-30T05:22:32.023Z 来源:《科学与技术》2023年1期作者:王凤瑛[导读] 水稻一旦感染细菌性条斑病,会造成产量降低,如果大面积发生,其后果非常严重。
王凤瑛临高县农业技术推广服务中心海南临高571800摘要:水稻一旦感染细菌性条斑病,会造成产量降低,如果大面积发生,其后果非常严重。
为此,应当对细菌性条斑病的发生症状进行分析,并采取有效的方法和措施加以防治,从而对此类病害进行控制,这对于水稻的增产增收具有重要的现实意义。
关键词:细菌性条斑病危害症状发病原因防控措施细菌性条斑病一旦产生,会给生长期的水稻作物造成严重的威胁,导致水稻作物出现成片感染与枯萎。
近年来,绿色综合防治技术手段已经被推广运用于防控水稻细菌性条斑病中,并达到了良好的作物病害防控实效。
农业技术部门在实施绿色综合防控水稻作物病害的实践过程中,应当确保密切关注水稻生长区域的气候条件与土壤理化性质,通过实施严格的水稻病害防控措施来杜绝水稻病害的蔓延,将水稻感染条斑病的风险消除于萌芽状态中。
1危害症状主要危害水稻叶片。
水稻秧苗期即可发病,带菌种子播种育苗后,叶片上出现长约1厘米的透明条斑,大田期发病更重,感病品种上的病斑纵向扩展可达4~6厘米。
植株受侵染后,开始显症为细小水渍状短条点斑,后由于受叶脉限制,发展成为1~2厘米的纵向条斑,病斑颜色由黄转至黄褐,对光观察呈油半透明状,严重时可连接成片以致全叶枯黄,湿度大时病斑上出现许多黄色菌脓,干燥后呈黄色小珠状,是田间再侵染的主要来源。
2发病的原因2.1种子带菌带菌的种子是感染细菌性条斑病的主要原因之一,同时也会造成该病的远距离传播。
如果在某一个地区大面积种植容易感染病菌的水稻品种也会造成大量发病,导致水稻细菌性条斑病大规模流行并且难以控制。
2.3环境条件的影响高温和高湿的环境条件很容易造成水稻细菌性条斑病的发生和流行。
如连续降雨的天气,尤其是台风和暴雨过后会造成水稻细菌性条斑病大范围的扩散。
浙江1株水稻细菌性条斑病菌株的分离鉴定
浙江1株水稻细菌性条斑病菌株的分离鉴定路梅;凌丹燕;张发成;辛德东【摘要】细菌性条斑病(简称细条病)是水稻的重要病害之一,随着气候的变暖,某些水稻品种有逐年发生加重的趋势,对产量影响较大。
2013年浙江省金华市部分水稻种植区域发生细条病,发病严重的田块减产30%以上。
采用组织分离法从发病水稻叶片分离获得6株细菌菌株,选择典型菌株JH01回接水稻幼苗,进行柯赫法则验证。
接种后发病症状与自然发病症状一致,并重新分离得到此菌株,证明菌株JH01为水稻细条病的致病菌。
通过形态学观察、常规生理生化指标测定、16S rDNA序列测定和同源性分析,鉴定菌株JH01为稻黄单胞菌水稻致病变种( Xanthomonas oryzae pv.oryzicola ,Xoc)。
%Bacterial leaf streak( BLS) is one of the most important diseases of rice, and as the climate warming; it has a worsening tendency to occur year by year that greatly affect the production.In 2013, BLS broke out in some rice planting areas of Jinhua City, Zhejiang Province, and caused decline over 30%of rice yield in some field with serious disease.Adopting the method of plant tissue pathogen isolation from pathogenic leaves, 6 bacterial strains were isola-ted and purified, the typical strain JH01 was selected to inoculate the rice seedlings to validate Koch ’ s law.The dis-ease symptoms of inoculation were consistent with the disease occurred in nature , and the same strain was rei-solated from the infected rice leaves.And proved that strain JH01 was the pathogen of rice BLS.The strain JH01 was charac-terized as Xanthomonas o ryzae pv.oryzicola by morphological observation, routinephysiological and biochemical indi-ces tests, and 16S rDNA sequences and homology analyses.【期刊名称】《微生物学杂志》【年(卷),期】2015(000)004【总页数】6页(P13-18)【关键词】水稻;细条病;分离;鉴定;稻黄单胞菌【作者】路梅;凌丹燕;张发成;辛德东【作者单位】浙江师范大学化学与生命科学学院,浙江金华 321004;浙江师范大学化学与生命科学学院,浙江金华 321004;金华市植保站,浙江金华 321017;浙江师范大学化学与生命科学学院,浙江金华 321004【正文语种】中文【中图分类】Q939.96稻黄单胞菌水稻致病变种(Xanthomonas oryzae pv. oryzicola,Xoc)引起的水稻细菌性条斑病(bacterial leaf streak,BLS;简称细条病或条斑病)是水稻的重要细菌病害,是全国农业植物检疫性对象之一。
CRISPR
朱宗财,王志军,高 能,等.CRISPR/Cas9基因编辑技术在植物抗病性改良中的应用综述[J].江苏农业科学,2024,52(3):1-11.doi:10.15889/j.issn.1002-1302.2024.03.001CRISPR/Cas9基因编辑技术在植物抗病性改良中的应用综述朱宗财,王志军,高 能,武冬梅(新疆农垦科学院生物技术研究所/作物种质创新与基因资源利用兵团重点实验室,新疆石河子832000) 摘要:植物病害是影响作物生长的重要因素之一,对世界粮食安全构成很大的威胁,培育优良的抗病品种成为最优策略。
CRISPR/Cas9基因编辑技术自问世以来备受关注,因该系统简单、高效、稳定的特点,逐渐成为分子育种领域重要的技术手段。
本综述简单回顾了CRISPR/Cas9基因编辑技术的技术原理和在植物中的应用情况,系统总结了该技术在植物抗真菌、细菌和病毒方面的应用。
还列举了可用于提高植物抗病性的基因位点以及真菌、细菌和病毒等病原物的致病相关基因位点编辑应用情况,探讨了该技术主要的优势和不足,以及未来应用的前景和挑战,以期为今后研究提供参考和借鉴。
关键词:CRISPR/Cas9;基因编辑技术;植物抗病性;抗病性改良;抗病育种 中图分类号:S432.1 文献标志码:A 文章编号:1002-1302(2024)03-0001-11收稿日期:2023-03-27基金项目:新疆生产建设兵团重点领域科技攻关计划(编号:2021AB004);新疆农垦科学院院级项目(编号:03110004)作者简介:朱宗财(1994—),男,甘肃皋兰人,硕士,助理研究员,主要从事植物病理学研究。
E-mail:826610782@qq.com。
通信作者:武冬梅,博士,副研究员,主要从事应用微生物学及生物技术应用研究。
E-mail:wdm0999123@sina.com。
植物病害是影响作物生长的重要因素之一,因植物病害引起的作物减产高达20%左右,对世界粮食安全构成很大的威胁[1]。
转录组分析研究不同水稻品种对细菌条斑病的侵染
转录组分析研究不同水稻品种对细菌条斑病的侵染导读细菌性条斑病(BLS)是目前水稻的第四大疾病。
Dular和H359是两种对BLS有明显的水稻品种。
Dular品种抗性较高而H359品种易感。
本研究使用RNA-seq研究接种细菌性条斑菌不同时间后Dular 和H359的抗性反应的早期分子过程。
差异表达基因分析发现,在12和24小时后,Dular中有3031个DEGs和H359中有7161个DEGs。
H359中的差异表达基因明显多于Dular,下调基因明显多于上调基因。
GO和KEGG富集分析显示,Dular品种中的一些上调差异表达基因在苯基丙烷代谢通路中显著富集。
进一步比较和分析表明,两个品种中抗性相关的基因数量在感染BLS24小时后明显下降,抗性相关基因在早期阶段主要包括WRKY转录因子、受体激酶和MAPK信号通路相关基因。
本研究表明,抗性相关基因在感染早期发挥重要作用,本丙烷代谢相关基因可能响应Dular对BLS的抗性,从而为今后水稻BLS抗性的分子机制研究提供重要信息。
实验设计结果1 H359对BLS易感而Dular具有较高抗性B LS病变初期呈很小,深绿色的斑点,很快扩散到叶脉之间的深绿色到黄褐色的小斑点。
病变部位会有大量黄色液体小珠。
在感染严重下,条纹会呈现不规则的黄褐色斑点,类似于细菌性叶枯病。
Dular感染BLS后会表现出较强的抗性,会抑制病变的扩散。
BLS感染10天后,Dular病变长度一般小于0.5cm,然后H359的病变会快速扩散并达到5cm以上(图1)。
图1. Dular和H359表型。
a.两种水稻感染10天后表型。
b.病灶长度统计分析。
误差线表示重复。
2 Dular和H359接种BLS不同时间后DEGs的鉴定使用BGISEQ-500平台测序24个样本。
使用Trimmomatic对raw data进行过滤,得到clean reads。
每个样本平均数据量为6.27G,平均比对效率为90.58%(表1)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
#&$
/0-.121 3&4#.!5 &6 7-&81+0.&5&9:
生物工程学报
H&&C, _,@GH:, M,G’
性改良尚无进展, 主要原因在于国内外鉴定的大量 水稻资源中尚未发现抗细条病主效基因。在植物与 病原菌协同进化过程中, 病原菌为适应不同植物种 通常以近缘种或致病型复合体存在, 非寄主植物则 可能存在一些基因, 其产物能够特异性识别该种植 物非典型病原菌的激发子而启动与防御反应有关的 信号级联反应。生产实践表明任何一个物种中可直 接利用的主效抗病基因都是有限的, 并且有效性随 病菌种群变化易于丧失。随着异种无毒基因 !"# 与 非 寄 主 ! 基 因 互 作 产 生 "! 实 例 的 不 断 发 [#, $, %&, %%, %’, %(] , 非寄主抗性基因的克隆及其在作物 现 抗性改良中的作用备受关注。来自玉米的 $%&’ 基 因可以与细条病菌的 !"#$%&’ 基因互作激活防御反 应, 导 致 玉 米 叶 片 对 (&& 产 生 典 型 的 过 敏 性 反 [%’, 应 %(]。)*+, 等 将 $%&’ 导 入 了 日 本 粳 稻 品 种 初步的功能分析结果表明转基因植株接种 -./++01, [%#] 接种点周围的叶片细胞迅速坏死 。 (&& 菌液后, 本研究采用农杆菌介导的遗传转化系统, 将 $%&’ 基因转到我国不同遗传背景的水稻品种中, 分析了 该基因的抗性表达和遗传, 上述结果将为促进 $%&’ 在水稻抗细条病育种中的应用提供信息。
RSO R,/LT/D, UV +1DC, RV +1BDLW’DC, XYZV U’DCLW1" BD3 WS X>1L[BDC
中国农业科学院作物科学研究所 农作物基因资源与基因改良国家重大科学工程, 北京 <$$$K<
4$&/#/)/% (- !*(5 60#%$0%& \ 7+/#($+, 8%2 9+0#,#/2 -(* !*(5 :%$% ;%&()*0%& +$< :%$%/#0 4=5*(>%=%$/ , !"#$%&% ?0+<%=2 (- ?1*#0),/)*+, 60#%$0%& , .%#@#$1 <$$$K<, !"#$+
!
!"!
材料与方法
质粒和水稻品种 含有 203 $%&’ 基因的 4567896%:&(;% $%&’ 质 粒由美国堪萨斯州立大学 <=,/ "> "?@31A/ 博 士 提 供。 4567896%:&(;% 质粒是由澳大利亚 567896 研 究中心构建的含有 :(< 启动子和细菌卡那霉素抗性 基因的双元载体。采用的农杆菌菌株为 B"6%&(。 转化的受体水稻品种包括常规品种 2$&’、 中花 , 粳型恢复系 和籼型恢复系明恢 。 %% 5’%$ $# !"# 转化 [%:] 采用 )*+. 等 的方法, 对 ’ 个水稻品种的成熟 胚愈伤组织进行转化。将去壳的水稻种子用 C&D 乙醇灭菌 %E.F, 再用 &G%D 升汞溶液灭菌 %&E.F, 无 接种于含有 HG&EIJK H, 菌水冲洗 : 次, ’;L 的 7< 和 培养基上, 于 暗培养, 诱导愈伤组织。 M8 H#N HO’ 周后切下胚盾片处产生的愈伤组织, 转到继代培养 选 的 基 7< 或 M8 继代培养一次, 愈伤组织用于转化。带 $%&’ 基因的农杆菌菌株在 含 (&EIJK 卡那霉素和 (&EIJK 潮霉素的 PBQ 培养基 中培养 %H O %#* 至 )(2( 为 &G$, 离心收集农杆菌细 胞, 用 667 培养基洗涤 % 次, 再悬浮于 667 中至 为 。将待转化的愈伤组织于 )(2( &G( 667 农杆菌菌 悬液中侵染 %& O :&E.F, 经无菌水洗涤后转移到共培
养基上于 H(N 暗培养 :R。然后将愈伤组织经含有 转移到选择培 (&&EIJK 噻孢霉素的无菌水漂洗后, 经 H O : 次选择培养后, 将新长出 养基上培养 : 周, 的抗性愈伤组织转移到预分化培养基上培养 H O : 周, 再转移到分化培养基上持续光照下 H#N 继续培 养至分化出苗, 当幼苗生长至 %&=E 左右高时转移至 土壤中, 在人工气候室中缓苗后移到温室中。 !"$ %&’ 提取与 ()* 分析 水稻基因组的 LM6 提取参照 7=5,?=* 等人的 方法, 采用 S96MTBM 公司 S96M4A14 7.F. 提取试剂 盒提取质粒 LM6。根据 $%&’ 序列设计了特异性引 物 !% 和 !H : !% (U;65S5TTS666 55S65TT65ST6; 扩增片 :U, !H (U;5SS55ST56TTS6S65565 S55;:U, 段长度为 %G’(03。 Q5! 反应体系为 H( 含有 (&FI K, ! 模 板 LM6, %& V Q5! 反 应 缓 冲 液 HG( K,RMSQW ! (%&EE,@JK)H 引物 ($ K, E,@JK) H K, S+X LM6 聚合 ! ! ! HY 酶 (:?J! , ( ) K) &GH K 7I H(EE,@JK H K ! ! 。以未转化的 受体水稻品种的 LM6 作阴性对照, 以携带 $%&’ 的 4567896%:&(;% 质粒 LM6 为阳性对照。 采用两对引物分析目的基因在 S% 代转基因植 株中的 分 离 情 况, 一对是扩增潮霉素基因的引物 "IZ[: (U;65S6S5TT5T6TS65SS5S65656T;:U 和 "IZ : 扩增片 ! (U;T6TSSS6T5T6T6T55ST655S6S ;:U, 段长度为 C%$34, 另一对是扩增 $&%’ 的引物 !,\ [: (U;T6S5666TS6T6655S5STTTSTS5;:U和 !,\ !: (U; 565S665S55556SS5S566T65S5;:U, 扩 增 片 段 2:$34。扩增反应在 QS5;%&&S7 QA,IA+EE+3@1 S*1AE+@ (7] !1W1+A=* 9F=G )进行。扩增反应程序为 5,F/A,@@1A (2(N :&W, 2(N (E.F, ($N ’(W, CHN %G(E.F) :& 个循 环, 最后 CHN 保温 %&E.F。 Q5! 产物在 %D 琼脂糖凝 胶上于 % V S6B 缓冲液中电泳检测。 !"+ ,-./0123 杂交 然 ( I 基因组 LM6 用 *+& ! " 和 ,-. R # 酶切, ! 后在 %D 琼脂糖凝胶上电泳。 <,?/*1AF 杂交按文献 [C] 等 方 法 进 行, 所 用 探 针 是 Q:H 标 记 的 %G’(03 的 $%&’ Q5! 扩增片段。 !"4 抗性鉴定 接种试验在隔离的网室中进行。选用广东和福 在水稻分 建的细条病菌强毒力菌株 TL&’ 和 [];), 蘖期采用针刺法接种转基因 S& 和 S% 植株。接种前 先将保存于 ^ $&N 的菌株纯化, 然后在 Q<6 培养基 上于 H$N 培养 ’$*, 接种后 H O : 周, 病斑趋于稳定 时, 调查各植株的抗性反应。 !"5 病原菌的生长曲线 [2] 参考 <,FI 等的方法 。在水稻分蘖盛期, 采用
=>1? @’6A @B? ?,99’6:/3 5- :>/ C6BD: E6’4 :>/ *B:1’DB( *B:,6B( F01/D0/ G’,D3B:1’D ’E H>1DB( *’) "$I%<!$$) ) GBM: J K7L<$L7KN<KIIN; OL4B1(:P>’,-(Q 0BB?) D/: ) 0D " H’66/?9’D31DC B,:>’6 ) =/(: J K7L<$L7!<"K$I", 国家自然科学基金 ( *’) "$I%<!$$) 资助。
细菌性条斑病 ( B+$/"(=($+& (*2C+% 92 (*2C#0(,+ ) 是我国水稻生产中危害严重的检疫性病害, 也是当 前我国南方稻区造成损失最重的细菌病害之一。!$ 世纪 N$ 年代以来, 在华南、 西南、 长江流域稻区以及 海南岛南繁基地频繁爆发成灾, 杂交稻受害尤其严 重。目前尚无防治细条病的高效药剂, 种植抗病品
./0/12/3:*’2/45/6 "$, !$$7;800/9:/3:;/0/45/6 "<, !$$7 )
种是控制作物病害最经济有效的措施。然而生产中 大多数主栽杂交稻组合和常规品种都对细条病感 [!] , 改良细菌性条斑病抗性是我国 病、 甚至高度感病 水稻育种中亟待解决的问题。 近二十年中, 我国一直在进行水稻抗细条病基 因发掘和抗性遗传研究, 但是迄今水稻对细条病抗
玉米细菌性条斑病非寄主抗性基因 !"#3 转化水稻的研究
!"#$%&’(#)%" %* + ,%"-.%/# 01"1 !"#3 23%"1& *$%4 5+)61 71/)/#+"# #% 7)(1 8+(#1$)+3 91+* :#$1+; )"#% 7)(1 <+$)1#)1/
