_物质构成的奥秘复习课课件
合集下载
物质构成的奥秘复习 课件-2024-2025学年九年级化学人教版(2024)上册

元素具有相同的核电荷数,具有相同核电荷数的粒子一定属于同种元素
④同种元素的原子质子数相同,则质子数相同的原子一定是同种元素
A.1个
B.2个
C.3个
D.4个
123456789
2.下列有关分子的说法错误的是( D ) A.物质发生化学变化时,分子发生改变 B.“酒香不怕巷子深”,说明分子是不断运动的 C.分子可以由不同种原子构成 D.“热胀冷缩”说明分子的大小随温度的升降而变化 3.下列有关分子、原子、离子、元素的说法中正确的是( C ) A.原子的质量几乎集中在核外电子上 B.同种元素的原子核内质子数和中子数一定相等 C.氯化钠由氯离子和钠离子构成 D.保持水的化学性质的最小粒子是氢原子和氧原子
二、非选择题(共4小题,13题每空0.5分,14~16题每空1分,共 30分)
13.(7分) (一) 有A、B、C、D、E五种元素,A、B两种元素的原子最外层电 子数相同,A是地壳中含量最丰富的元素。B、C、D三种元素的原子电 子层数相同,核电荷数依次相差1;D元素共有三个电子层,每个电子 层均达到饱和的稳定结构。E元素的原子核电荷数是所有元素中最小的。
12.研究分子运动,做如下实验,下列实验现象或结论错误的是( C )
A.实验1:说明温度越高,分子的运动速率越快 B.实验2:可观察到无色纸花变红 C.实验2:说明分子之间有间隔 D.实验3:放置一段时间后,电子秤示数减小,是因为水分子运动到空 气中
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
B.该反应中分子改变,原子不改变 D.每个分子都是由两个原子构成
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
8.下列化学符号及对化学符号表示的意义解释都正确的是( B )
第三单元 物质构成的奥秘 复习课(24张PPT)

在分子、原子、原子核、质子、中子、电子 等粒子中找出符合下列条件的粒子填空。
分子、原子 能保持物质化学性质的粒子是_____________ 原子 化学变化中的最小粒子__________ 原子核、质子 带正电的粒子_______________ 分子、原子、中子 不显电性的粒子______________ 电子 质量最小的粒子______________ 原子核或质子和中子 决定原子质量的粒子_______________ 质子、电子 同一原子中数目相等的粒子___________
2个氮原子 2个镁离子
用符号表示 钠离子_____ 氧离子______ 2个氯离子_____ 亚铁离子_______ 2个铁离子______
分子
质子(+)
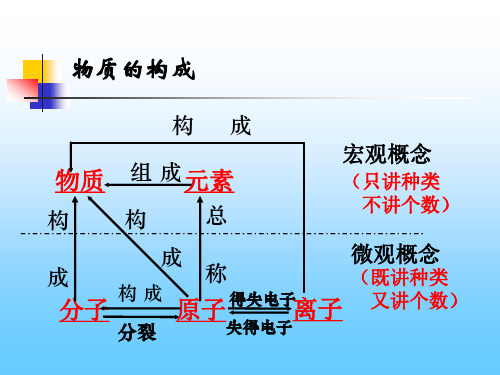
元 素
组成
物 质
构成
构 成 原子核
原子 离子
(+) 中子(不带电) ( -)
得 失 核外电子 电 子
练习
汞元素 组成 1.汞由________ 汞原子 构成 汞由________ 氢元素和氧元素组成 2.过氧化氢由_____________
3.元素周期表的起始 金属(第一周期除外)→非金属→稀有气体
4.原子序数=核电荷数=核外电子数
原子序数 =质子数 =核电荷数 =核外电子数
元素符号
元素名称
元素相对原 子质量
原子结构规律
同一周期元素原子的电子层数相同,最外层电子 数从左到右依次递增 同一族元素原子的最外层电子数相同,电子层数 从上到下依次递增
相对原子质量
3.相对原子质量≈质子数+中子数
4.相对原子质量是一个比值,没有单位
5.相对原子质量与原子的实际质量成正比关系
人教版九年级化学第三章复习《物质构成的奥秘》(共21张PPT)

C.50
D.272
16 3 2、某原子结构示意图如右,该原子的核电荷数为_____,核外有______ 8 6 个电子层,第二层上有______个电子,最外层上有______个电子。该
原子在化学变化中容易_得___到__(“得到”或“失去”)电子。
+16 28 6
四.离子的形成 钠 + 氯气 Na Cl2
课题3元素
一、元素
质子数相同的一类原子的总称元素是宏观概念,只 概念: 讲种类,不讲个数。
金属元素:Fe、Cu、Al、Au…… 分类: 非金属元素:O、H、N、Cl……
意义:
稀有气体元素;He、Ne、Ar…… 宏观: 表示一种元素或一种物质 微观: 表示该元素的一个原子
符号: 用元素拉丁文名称的第一个大写字母来表示,若几种元素的 第一个字母相同时,就附加一个小写字母来区别,这样的符 号叫元素符号。第一个字母必须大写,第二个字母必须小写。
钠原子Na +11 2 8 1
失 电 子 钠离子Na+ +11 2 8
点燃 氯化钠 NaCl
氯原子Cl
+17 2 8 7
得 电 子
+17 2 8 8 氯离子Cl-
Na+Cl- 氯化钠
Na Cl
四.离子的形成
概念:带电荷的原子(或原子团) 带负电荷的原子叫做阴离子。如:O2- 、S2-、 F-
分类: 带正电荷的原子叫做阳离子。如:H+ 、Na+、Mg2+、Al3+
芦老师的课堂
复习课
第三单元
物质构成的奥秘
课题1分子和原子
一.分子
概念:分子是保持物质化学性质的一种粒子。
《物质构成的奥秘》第一课时复习课件(共29张PPT)

第1课时┃ 构成物质的基本微粒 类型2 构成物质的微粒
考点梳理
考向探究
课堂检测
例3 【2017· 泰州】下列微粒的叙述错误的是( C ) A.金刚石由碳原子构成 B.水蒸发,分子间隙增大 C.氯化钠晶体由分子构成
带正电或
负电 原子团在某些变化 中可以再分
可以再分
不能再分
原子 构成 构成 一般由______
符号 化学式,如 表示 水H2O
原子核 和 由________
核外电子 _________ 构成
元素符号,如
得失 电子 由原子______
形成 离子符号,如 钠离子Na+
碳原子C
第1课时┃ 构成物质的基本微粒
分子本身没有变化,只是分子间的空隙发生了变化;当物质发生化学变
化时,原物质的分子发生了变化,生成了新物质的分子。 【注意】热胀冷缩、三态变化是微粒之间间隔大小发生变化,而不是微 粒体积大小发生变化。
第1课时┃ 构成物质的基本微粒
考点梳理
考向探究
课堂检测
考点2 构成物质的微粒:分子、原子、离子
分子 电性 化学 不 同 点 变化 不显电性 原子 不显电性 离子
易______ 失去 电子
不稳定 不稳定
原子
得到 电子 一般多于或等于4个 易_______
第1课时┃ 构成物质的基本微粒 类型1 微粒的性质及应用
考点梳理
考向探究
课堂检测
例1 【2017· 海南】下列事实的微观解释不正确的是( B ) A. 干冰升华——分子间隔变大
B.水烧开后把壶盖顶开——分子数目变多
第1课时┃ 构成物质的基本微粒
2.微粒性质的应用 (1)解释现象
考点梳理
人教版第三单元 物质构成的奥秘 复习课(24张PPT)

钠原子结构示意图
质子数
电子层 最外层电子数
原子核
决定元素种类
决定元素的 化学性质
核外电子的排布规律
1.先排内层,后排外层。 2.第一层上最多排2个电子。 3.第二层上最多排8个电子。 4.最外层上最多排8个电子。
相对稳定结构
【稳定结构】像稀有气体元素原子这样最外层电 子数为8的结构叫相对稳定结构。(若只有一个 电子层,则2个电子也是相对稳定结构。如:He)
过氧化氢分子 构成 过氧化氢由_____________ 氢原子和氧原子 构成 过氧化氢分子由______________
个氢原子和1个氧原子 1个过氧化氢分子由2 _________________ 构成 氯元素和钠元素 组成 3.氯化钠由_____________
氯离子和钠离子 构成 氯化钠由_____________
ห้องสมุดไป่ตู้元素
金属元素:“钅”,汞
元素 非金属元素:“石”“氵”“气” 稀有气体元素
元素
3.元素含量
地壳中:氧、硅、铝、铁 生物细胞中:氧、碳、氢、氮、钙 空气中:氮、氧
元素周期表
1.周期 每一横行叫一个周期,共七个横行,即七个周期 2.族 每一纵行叫一个族。共18个纵行,16个族(其中 8,9,10三个纵行共同组成一个族)
离子的形成
1.离子的形成
原子得到和失去电子
2.离子分类 阳离子:质子数>电子数 阴离子:质子数<电子数 3.离子的表示——离子子符号
离子所带电荷数(得失电 子数,当n=1时省略不写)
元素符号
离子带正电或负电
元素符号的书写及其意义
化学用语
离子符号的书写及其意义
原子(离子)结构示意图
第三单元 物质构成的奥秘单元复习课件

(3) 离 子 的 表 示
【知识归纳】原子与离子的区别和联系
原子
阳离子
离子
阴离子
核内质子数
构成微粒 □5 _=_=__核外 核内质子数 □6 _>_> 核内质子数 □7 <__<
间的关系
核外电子数
核外电子数
电子数
电性
粒子符号 表示法 相互转 化关系
不显电性
带□8 __正正__电
带□9 _负_负__电
5
负负
电荷)
(3)
原 子 核 外 电 子 的 排 布
(3)
原 子 核 外 电 子 的 排 布
知识点4:离子(☆☆☆) (1)概念:带电的原子(或原子团) (2)分类□□12 阴阳阴阳离离离离子子子子::带带负正电电的的原原子子((或或原原子子团团)),,如如::CCla-2+、、CNOH23+ 4-等等
在远处可闻到花香、酒香;湿衣服在 分子在 3 不不断断地地运运动动,且温度
阳光下干得更快
越高,分子运动速率越快
水的三态变化;物体的热胀冷缩 (2)现象;气体可压缩储存在钢瓶中
分子间4有间隔 。一般情况下,温 度越高,分子间的间隔越5大大 ; 压强越大,分子间的间隔越6小小
性 液态氧和气态氧都具有助燃性,
(3)图2是图1的改进装置,优点是节勤约俭药药品品,,减减少少污污染染等等((合合理理即即可可))。
Hale Waihona Puke 知识点3:原子(☆☆☆)(1)概念:□1 化化学学变变化化中的最小粒子
□ □ (2)原子的
□ 构成
2 原原子子核核 质子(每个质子带一个单位
(带正电) 4 中中子子 (不带电)
3
正正
电荷)
□
物质构成的奥秘专题复习PPT课件
4. 实验室中运用2008年诺贝尔化学奖的研究成果,可依据生物发光现象检测超微量钙的存在。这里的“钙”是 ( ) A.原子 B.元素 C.分子 D.离子 5. 下列说法正确的是:( ) A.分子是化学变化中的最小粒子 B.原子失去电子后变成阴离子 C.元素间最本质的区别是中子数不同 D.分子、原子、离子都可以直接构成物质
决定元素种类质子数(即核电荷数) 。
元素符号
宏观:表示一种元素
2、元素符号表示的意义
微观:表示该元素的一个原子
元素符号前有数字,只表示原子的个数,只具有 微观意义。
质子数(即核电荷数)相同的一类原子的总称。
3、元素周期表
②同一族: 电子层数从上到下依次递增。
4、1996年科学家在宇宙深处发现了H3+离子和H3分子。请回答: (1)1个H3+离子中含有 个质子和 个电子; (2)H3分子的原子的结构示意图是 ; (3)H3属于 (填混合物或纯净物)。
12.2011年福岛核电站发生重大核事故。 核电站中核燃料铀或钚在中子的撞击下,原子核发生分裂,产生钡、氙、碘、等原子和一些粒子及射线。
①从物质的变化上看,核变化与化学变化的相同 点 ;从原子的变化上看,核变化与化学变化的不同点是 。 ②右图为钚元素的相关信息,下列说法正确的是 ( ) A.钚是非金属元素 B.钚原子核外有94个电子 C.钚元素的中子数94 D.钚的相对原子质量为244g
A
B
C
D
总结:1、质子数=核外电子数:原子 质子数>核外电子数:阳离子 质子数<核外电子数:阴离子 2、相对稳定结构:最外层电子数是 8 (只有一层是2)
9.对于Fe、Fe2+、Fe3+三种微粒的判断,正确的是( ) ①核电荷数相同 ②核外电子数相等 ③电子层结构完全相同 ④质量几乎相等 ⑤三种粒子的化学性质相似 A.①④ B.①③⑤ C.②③④ D.①②③④⑤
决定元素种类质子数(即核电荷数) 。
元素符号
宏观:表示一种元素
2、元素符号表示的意义
微观:表示该元素的一个原子
元素符号前有数字,只表示原子的个数,只具有 微观意义。
质子数(即核电荷数)相同的一类原子的总称。
3、元素周期表
②同一族: 电子层数从上到下依次递增。
4、1996年科学家在宇宙深处发现了H3+离子和H3分子。请回答: (1)1个H3+离子中含有 个质子和 个电子; (2)H3分子的原子的结构示意图是 ; (3)H3属于 (填混合物或纯净物)。
12.2011年福岛核电站发生重大核事故。 核电站中核燃料铀或钚在中子的撞击下,原子核发生分裂,产生钡、氙、碘、等原子和一些粒子及射线。
①从物质的变化上看,核变化与化学变化的相同 点 ;从原子的变化上看,核变化与化学变化的不同点是 。 ②右图为钚元素的相关信息,下列说法正确的是 ( ) A.钚是非金属元素 B.钚原子核外有94个电子 C.钚元素的中子数94 D.钚的相对原子质量为244g
A
B
C
D
总结:1、质子数=核外电子数:原子 质子数>核外电子数:阳离子 质子数<核外电子数:阴离子 2、相对稳定结构:最外层电子数是 8 (只有一层是2)
9.对于Fe、Fe2+、Fe3+三种微粒的判断,正确的是( ) ①核电荷数相同 ②核外电子数相等 ③电子层结构完全相同 ④质量几乎相等 ⑤三种粒子的化学性质相似 A.①④ B.①③⑤ C.②③④ D.①②③④⑤
物质构成的奥秘复习一PPT课件

元素-----宏观概念,只有种类,没有个数
原子-----微观概念,既有种类,又有个数
4.元素周期表 : 横行-----周期 纵行-----族 5.元素化学性质与原子结构的关系
最外层电子数决定元素化学性 金质属元素: 最外层电子小于4个易失电子 化学性质不稳定
非金属元素: 最外层电子大于4个易得电子 化学性质不稳定 稀有气体元素:最外层电子8个(氦2个) 化学性质稳定•3
•16
2、知道分子、原子、离子等都是构成
物质的微粒,能用微粒的观点解释某
些常见的现象。知道原子是由原子核
和核外电子构成的,初步认识核外电
子在化学反应中的作用。
•6
典型题1
❖ 1、我们生活的世界由丰富多彩的物质组 成,物质是由微小的粒子构成的。请你 分别写出符合下列要求的一种物质:由 原子构成的物质__铁_____,由分子构成 的物质__水_____。分子总是在不断运动 着,请举出一个具体的例子来说明 __墙_内__开_花_墙__外_香______。
•1
知识点归纳
一、元素和原子
1.原子的构成
质子 带一个单位正电核
原 原子核
子
中子 不带电 电子 带一个单位负电核
原子中:质子数= 核电荷数= 电子数
相对原子质量= 质子数+中子数
•2
2.元素: 具有相同核电荷数的一类原子的总称
宏观: 表示一种元素
元素符号意
义
微观: 表示这种元素的一个原子
3.二者区别
•7
典型题2
2、(07南通)据报导,科学家发现了新的氢微粒。 这种氢微粒由3个氢原子核(只含质子)和2个 电子构成。下列说法中正确的是( D )
A.该微粒不显电性 B.该微粒比一个普通H2分子相对分子质量多3 C.该微粒的组成可用H3 表示 D.该微粒比一个普通H2分子多一个氢原子核
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
考点三 物质组成、构成的描述 合作探究
知识资料:请先填一填:
水是由 氢、氧 元素组成的,是由 水分子 构成 的,水分子是由 氢、氧原子 构成的。铁是由 铁 元素 组成的,是由铁原子 直接构成的。氯化钠是由钠、氯 元 素组成的,是由 钠离子和氯离子 构成的。钠原子的最外
层电子数是1,参加化学反应时易失
空气、黄泥水、自来水 混合物:
。
。 。
单 质: Mg、 H2、O2、Au、C、He 化合物:MgO、 H2O、CO2、NaCl
合作探究(四)相信你会分类
物质分类:请将物质进行分类并写出分类依据。 单 质 纯净物 物质 混合物
组成物质 物质 的种类是否单一
混合物 单 质 组成纯净物 纯净物 的元素种类是否单一 化合物
用于描述物质的微 观结构。1个水分子 是由2个氢原子和1 个氧原子构成
区别
举
合作探究 (三)相信你会总结
问题要求:说出下列符号中数字2的含义,你能否总 结化学符号中各位置数字的含义规律? 2H 2Na+ H 2O
2个氢原子 2个钠离子 每个水分子中含有2个氢原子
; ; ;
Mg2+
镁离子带2个正电荷
本质 化学变化中分子可分 区别
构 同种或不同种原子构成 由原子核(质子和 成 中子)和核外电子
联 系
分子由原子构成
原子是电中性的!
质子(带正电)
原 子
原子核
中子(不带电)
核外电子 (带负电)
质子数 =核外电子数= 核电荷数= 原子序数
考点二:原子结构示意图
原子核 电子层
该电子层上的电子数
核内质子数 (核电荷数) Na原子结构示意图
化合物
温馨回顾
直击中考
A.空气 C.纯净水
自我测评——相信你能过关
B.二氧化碳 D.高锰酸钾 ( )
1. (2012年济宁,11题下列物质中含有氧分子的是:
2.分子是构成物质的一种粒子.“闻酒知香”体现了(
A.分子是由原子构成的B.分子是不断运动的 C.分子之间有间隙 D.分子可以再分
)
3.对下列符号意义的表述,正确的是: (
5. (2012年四川宜宾,2题)2012年4月15日,央视曝光河北一
些企业生产的药用胶囊里重金属铬(Cr)超标,即震惊全国的 “毒胶囊”事件。已知铬原子核内有24个质子,铬元素的相对原 子质量为52。下列有关铬元素的说法中不正确的是( ) A.铬原子的核外电子数为24 B.铬元素的原子序数是52 C.铬原子核由质子和中子构成 D.铬原子呈电中性
A.N2 两个氮原子B.2H
)
两个氢元素
C.2H2O
两个水分子
D.Ca2+ 钙元素的化合价为+2价
自我测评——相信你能过关 直击中考 4. (2012年湖南衡阳,8题)下列有关分子、原子、离子
的说法正确的是( ) A.分子是保持物质性质的最小粒子 B.物质都是由分子构成 的 C.原子是由原子核、中子、电子构成的 D.原子得失电子 后形成离子
1.知道分子、原子、离子是构成物质的微观粒
子,理解三种粒子与物质、元素之间的关系,知 道原子的内部结构,能用微粒的观点解释某些日 常现象。 2.知道物质多样性,能进行简单的分类和区分。
3.记住常见元素的名称和符号及相关意义,知
道元素的简单分类,初步认识元素周期表。
自主复习——相信你还记得 合作探究
。
化学符号周围数字表示的意义
表示化合价的 数值、正负
表示粒 子个数
3Mgn
+2
2+
一个离子所 带电荷的数 值、正负
一个分子中所 含原子的个数
合作探究(四)相信你会分类
问题要求: 化学是研究物质的一门科学,在学习中,我 们学到了不少的化学物质,它们是:镁 Mg 、氧化镁 MgO、水 H2O、氢气 H2、氧气 O2、金 Au、金刚石 C、 氦气 He、空气、二氧化碳 CO2、氯化钠 NaCl、黄泥水、 自来水等。以上物质均属于什么类物质呢?请将他们分 类。
参加化学反应时易 变成 。 氯离子
(填“得”或
“失”)电子,变成 钠离子。氯原子的最外层电子数是7, 得 (填“得”或“失”)电子,
合作探究
(二)相信你会归纳
根据以上资料归纳出物质、元素、分子、原子、 离子之间的关系?
分子 构成
原子 得失电 子形成 离子 构成
分裂
构成 构成
物 组成
元 素
质
同类原子的总称微观概念 既Fra bibliotek种类,也讲个数
宏观概念 只讲种类,不讲个数
元素与原子的比较 元素 原子
联系
具有相同核电菏数 化学变化中的 (即核内质子数) 最小粒子 的一类原子的总称 只表示种类,不表 示个数,没有数量 多少的含义。 用于描述物质的 例 宏观组成。 水由氢元素和氧元素 组成。
即表示种类, 有讲个数, 有数量含义
6(2012年湖北武汉,30题) 某元素的原子结构示意
图如右图所示,该元素符号为Br。 (1)右图中x=_______。Br属于______元素(填“ 金属”或“非金属”)。 (2)下图表示的微粒中,具有相对稳定结构的是 ______(填序号,下同),与Br化学性质相似的是 _____。
带负电荷
S2-、Cl-
联 系
失电子
原子
得电子
阴离子
核电荷数=质子数=电子数(分子、原子) 核电荷数=质子数≠电子数(离子) 相对原子质量≈质子数+中子数
原子的质子数 元素种类由_________决定,
原子的最外层电子数 元素化学性质主要由_____________决定,
质子数、中子数的和 元素的相对原子质量由_____________决定。
(一)相信你会归纳 (二)相信你会总结 (三)相信你会分类 (四)相信你会分析
自我测评——相信你能过关 自我反思——相信你有收获
自主复习——相信你还记得
考点一:构成物质的粒子
物质与构成其粒子分子、原子和离子之 间的关系如下: ______ 分子
______
原子
______
物质 离子
构成物质的基本粒子:原子、分子、离子
原子种类
最外层电子 数 一般少于4个.
得失电子情况 是否形成离子
金属元素原子
易 失 电子
形成阳离子 .
非金属元素原子
一般多于4个.
一般为8个
易 得 电子
阴离子 形成
.
稀有气体元素原子
.
不易得失电子 相对稳定
2个 ) (He为
不易形成离子
离子的形成
1、离子 带电的原子或原子团 阴离子 阳离子
(电子数>质子数) (电子数<质子数)
2、离子分类
3、离子的表示——离子符号
X
n±
离子带正或负电
离子所带电荷数(得失电子 数;当n=1时略去不写 )
离子与原子的区别与联系
粒子种类
区 结构
别 粒子电性 粒子符号
原 子
离 子
阳离子 阴离子
质子数=电子数 质子数>电子数 质子数<电子数
不呈电性
S、Cl、Na 阳离子
带正电荷
Mg2+、Na +
NaOH,NH4NO3等。
合作探究 (一)相信你会分析
水通电分解的微 观示意图
化 学 变 化 的 实 质
旧分子 原子 新分子
旧分子分裂,原子重新组合成新分子的过程。
相信你会归纳分子与原子的区别和联系
分子 相 似 点 原子
分子质量、体积很小, 不停运动,之间有间隙;同左(原子不一 定比分子小) 分子能保持物质 化学性质。 化学变化中原 子不可分
构 成 物 质 的 基 本 粒 子
原子:金属单质、固态非金属单质、稀有气体, 如:Fe、Cu、Na、C、Si、He、Ne等。
分子:气态非金属单质、由非金属元素组成的
化合物,如:O2、H2、N2、H2O、CO2 、NH3等 有机物CH4,C2H5OH
离子:金属氧化物,碱和盐如: Fe2 O3、NaCl、
