物质构成的奥秘专题复习 .ppt
合集下载
物质构成的奥秘复习 课件-2024-2025学年九年级化学人教版(2024)上册

元素具有相同的核电荷数,具有相同核电荷数的粒子一定属于同种元素
④同种元素的原子质子数相同,则质子数相同的原子一定是同种元素
A.1个
B.2个
C.3个
D.4个
123456789
2.下列有关分子的说法错误的是( D ) A.物质发生化学变化时,分子发生改变 B.“酒香不怕巷子深”,说明分子是不断运动的 C.分子可以由不同种原子构成 D.“热胀冷缩”说明分子的大小随温度的升降而变化 3.下列有关分子、原子、离子、元素的说法中正确的是( C ) A.原子的质量几乎集中在核外电子上 B.同种元素的原子核内质子数和中子数一定相等 C.氯化钠由氯离子和钠离子构成 D.保持水的化学性质的最小粒子是氢原子和氧原子
二、非选择题(共4小题,13题每空0.5分,14~16题每空1分,共 30分)
13.(7分) (一) 有A、B、C、D、E五种元素,A、B两种元素的原子最外层电 子数相同,A是地壳中含量最丰富的元素。B、C、D三种元素的原子电 子层数相同,核电荷数依次相差1;D元素共有三个电子层,每个电子 层均达到饱和的稳定结构。E元素的原子核电荷数是所有元素中最小的。
12.研究分子运动,做如下实验,下列实验现象或结论错误的是( C )
A.实验1:说明温度越高,分子的运动速率越快 B.实验2:可观察到无色纸花变红 C.实验2:说明分子之间有间隔 D.实验3:放置一段时间后,电子秤示数减小,是因为水分子运动到空 气中
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
B.该反应中分子改变,原子不改变 D.每个分子都是由两个原子构成
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
8.下列化学符号及对化学符号表示的意义解释都正确的是( B )
人教版九年级化学第三章复习《物质构成的奥秘》(共21张PPT)

C.50
D.272
16 3 2、某原子结构示意图如右,该原子的核电荷数为_____,核外有______ 8 6 个电子层,第二层上有______个电子,最外层上有______个电子。该
原子在化学变化中容易_得___到__(“得到”或“失去”)电子。
+16 28 6
四.离子的形成 钠 + 氯气 Na Cl2
课题3元素
一、元素
质子数相同的一类原子的总称元素是宏观概念,只 概念: 讲种类,不讲个数。
金属元素:Fe、Cu、Al、Au…… 分类: 非金属元素:O、H、N、Cl……
意义:
稀有气体元素;He、Ne、Ar…… 宏观: 表示一种元素或一种物质 微观: 表示该元素的一个原子
符号: 用元素拉丁文名称的第一个大写字母来表示,若几种元素的 第一个字母相同时,就附加一个小写字母来区别,这样的符 号叫元素符号。第一个字母必须大写,第二个字母必须小写。
钠原子Na +11 2 8 1
失 电 子 钠离子Na+ +11 2 8
点燃 氯化钠 NaCl
氯原子Cl
+17 2 8 7
得 电 子
+17 2 8 8 氯离子Cl-
Na+Cl- 氯化钠
Na Cl
四.离子的形成
概念:带电荷的原子(或原子团) 带负电荷的原子叫做阴离子。如:O2- 、S2-、 F-
分类: 带正电荷的原子叫做阳离子。如:H+ 、Na+、Mg2+、Al3+
芦老师的课堂
复习课
第三单元
物质构成的奥秘
课题1分子和原子
一.分子
概念:分子是保持物质化学性质的一种粒子。
2024年中考化学总复习课件:物质构成的奥秘

×
9.同种元素的核电荷数相同,所以核电荷数相同的粒子一定为同一种元素。( )
×
10.钠元素和镁元素的本质区别是质子数不同。( )
√
命题点1 分子和原子
例题1 (2022·山东临沂)从分子的角度分析,下列解释<zzd>不合理</zzd>的是( )
B
A.品红在水中扩散,说明分子在不断运动B.水受热变为水蒸气体积变大,说明分子的大小随温度的升高而增大C.将氧气压缩贮存于钢瓶中,说明分子之间有间隔D.在中燃烧生成 ,说明化学变化中分子发生改变
2.表示方法(元素符号) (1)概念:每种元素都可以用一个国际通用的符号来表示。
(2)写法:“一大二小”,即只用一个字母表示的元素字母要大写;用两个字母表示的元素中,第一个字母要大写,第二个字母要小写。
宏观:①表示__________;②对于由原子直接构成的物质,如 一些金属单质、固态非金属单质和稀有气体,元素符号还 可以表示__________,如、、 微观:表示这种元素的一个原子
化学性质
分子
原子
分子
原子
相互联系
续表
二、原子的构成
1.原子的构成:原子是由原子核和核外电子构成的(或者说原子一般由质子、中子和核外电子构成)。
(1)在原子中,核电荷数________ ____________。
(2)因为原子核所带的正电荷总数与核外电子所带的负电荷总数相等,所以整个原子不显电性。
续表
一、分子和原子
分子
原子
概念
保持物质__________的最小粒子
化学变化中的最小粒子
举例
水、氢气
铁、硅、汞
特性
①很小且真实存在#b#②不停地运动#b#③分子间有一定间隔#b#④同种分子化学性质相同,不同种分子化学性质不同
9.同种元素的核电荷数相同,所以核电荷数相同的粒子一定为同一种元素。( )
×
10.钠元素和镁元素的本质区别是质子数不同。( )
√
命题点1 分子和原子
例题1 (2022·山东临沂)从分子的角度分析,下列解释<zzd>不合理</zzd>的是( )
B
A.品红在水中扩散,说明分子在不断运动B.水受热变为水蒸气体积变大,说明分子的大小随温度的升高而增大C.将氧气压缩贮存于钢瓶中,说明分子之间有间隔D.在中燃烧生成 ,说明化学变化中分子发生改变
2.表示方法(元素符号) (1)概念:每种元素都可以用一个国际通用的符号来表示。
(2)写法:“一大二小”,即只用一个字母表示的元素字母要大写;用两个字母表示的元素中,第一个字母要大写,第二个字母要小写。
宏观:①表示__________;②对于由原子直接构成的物质,如 一些金属单质、固态非金属单质和稀有气体,元素符号还 可以表示__________,如、、 微观:表示这种元素的一个原子
化学性质
分子
原子
分子
原子
相互联系
续表
二、原子的构成
1.原子的构成:原子是由原子核和核外电子构成的(或者说原子一般由质子、中子和核外电子构成)。
(1)在原子中,核电荷数________ ____________。
(2)因为原子核所带的正电荷总数与核外电子所带的负电荷总数相等,所以整个原子不显电性。
续表
一、分子和原子
分子
原子
概念
保持物质__________的最小粒子
化学变化中的最小粒子
举例
水、氢气
铁、硅、汞
特性
①很小且真实存在#b#②不停地运动#b#③分子间有一定间隔#b#④同种分子化学性质相同,不同种分子化学性质不同
物质构成的奥秘专题复习PPT课件
4. 实验室中运用2008年诺贝尔化学奖的研究成果,可依据生物发光现象检测超微量钙的存在。这里的“钙”是 ( ) A.原子 B.元素 C.分子 D.离子 5. 下列说法正确的是:( ) A.分子是化学变化中的最小粒子 B.原子失去电子后变成阴离子 C.元素间最本质的区别是中子数不同 D.分子、原子、离子都可以直接构成物质
决定元素种类质子数(即核电荷数) 。
元素符号
宏观:表示一种元素
2、元素符号表示的意义
微观:表示该元素的一个原子
元素符号前有数字,只表示原子的个数,只具有 微观意义。
质子数(即核电荷数)相同的一类原子的总称。
3、元素周期表
②同一族: 电子层数从上到下依次递增。
4、1996年科学家在宇宙深处发现了H3+离子和H3分子。请回答: (1)1个H3+离子中含有 个质子和 个电子; (2)H3分子的原子的结构示意图是 ; (3)H3属于 (填混合物或纯净物)。
12.2011年福岛核电站发生重大核事故。 核电站中核燃料铀或钚在中子的撞击下,原子核发生分裂,产生钡、氙、碘、等原子和一些粒子及射线。
①从物质的变化上看,核变化与化学变化的相同 点 ;从原子的变化上看,核变化与化学变化的不同点是 。 ②右图为钚元素的相关信息,下列说法正确的是 ( ) A.钚是非金属元素 B.钚原子核外有94个电子 C.钚元素的中子数94 D.钚的相对原子质量为244g
A
B
C
D
总结:1、质子数=核外电子数:原子 质子数>核外电子数:阳离子 质子数<核外电子数:阴离子 2、相对稳定结构:最外层电子数是 8 (只有一层是2)
9.对于Fe、Fe2+、Fe3+三种微粒的判断,正确的是( ) ①核电荷数相同 ②核外电子数相等 ③电子层结构完全相同 ④质量几乎相等 ⑤三种粒子的化学性质相似 A.①④ B.①③⑤ C.②③④ D.①②③④⑤
决定元素种类质子数(即核电荷数) 。
元素符号
宏观:表示一种元素
2、元素符号表示的意义
微观:表示该元素的一个原子
元素符号前有数字,只表示原子的个数,只具有 微观意义。
质子数(即核电荷数)相同的一类原子的总称。
3、元素周期表
②同一族: 电子层数从上到下依次递增。
4、1996年科学家在宇宙深处发现了H3+离子和H3分子。请回答: (1)1个H3+离子中含有 个质子和 个电子; (2)H3分子的原子的结构示意图是 ; (3)H3属于 (填混合物或纯净物)。
12.2011年福岛核电站发生重大核事故。 核电站中核燃料铀或钚在中子的撞击下,原子核发生分裂,产生钡、氙、碘、等原子和一些粒子及射线。
①从物质的变化上看,核变化与化学变化的相同 点 ;从原子的变化上看,核变化与化学变化的不同点是 。 ②右图为钚元素的相关信息,下列说法正确的是 ( ) A.钚是非金属元素 B.钚原子核外有94个电子 C.钚元素的中子数94 D.钚的相对原子质量为244g
A
B
C
D
总结:1、质子数=核外电子数:原子 质子数>核外电子数:阳离子 质子数<核外电子数:阴离子 2、相对稳定结构:最外层电子数是 8 (只有一层是2)
9.对于Fe、Fe2+、Fe3+三种微粒的判断,正确的是( ) ①核电荷数相同 ②核外电子数相等 ③电子层结构完全相同 ④质量几乎相等 ⑤三种粒子的化学性质相似 A.①④ B.①③⑤ C.②③④ D.①②③④⑤
物质构成的奥秘复习一PPT课件

元素-----宏观概念,只有种类,没有个数
原子-----微观概念,既有种类,又有个数
4.元素周期表 : 横行-----周期 纵行-----族 5.元素化学性质与原子结构的关系
最外层电子数决定元素化学性 金质属元素: 最外层电子小于4个易失电子 化学性质不稳定
非金属元素: 最外层电子大于4个易得电子 化学性质不稳定 稀有气体元素:最外层电子8个(氦2个) 化学性质稳定•3
•16
2、知道分子、原子、离子等都是构成
物质的微粒,能用微粒的观点解释某
些常见的现象。知道原子是由原子核
和核外电子构成的,初步认识核外电
子在化学反应中的作用。
•6
典型题1
❖ 1、我们生活的世界由丰富多彩的物质组 成,物质是由微小的粒子构成的。请你 分别写出符合下列要求的一种物质:由 原子构成的物质__铁_____,由分子构成 的物质__水_____。分子总是在不断运动 着,请举出一个具体的例子来说明 __墙_内__开_花_墙__外_香______。
•1
知识点归纳
一、元素和原子
1.原子的构成
质子 带一个单位正电核
原 原子核
子
中子 不带电 电子 带一个单位负电核
原子中:质子数= 核电荷数= 电子数
相对原子质量= 质子数+中子数
•2
2.元素: 具有相同核电荷数的一类原子的总称
宏观: 表示一种元素
元素符号意
义
微观: 表示这种元素的一个原子
3.二者区别
•7
典型题2
2、(07南通)据报导,科学家发现了新的氢微粒。 这种氢微粒由3个氢原子核(只含质子)和2个 电子构成。下列说法中正确的是( D )
A.该微粒不显电性 B.该微粒比一个普通H2分子相对分子质量多3 C.该微粒的组成可用H3 表示 D.该微粒比一个普通H2分子多一个氢原子核
物质构成的奥秘复习PPT课件1 人教版

A.该元素原子的质子数为57 B.该元素原子的核电荷数为57 C.该元素原子的核外电子数为57 D.该元素为非金属元素
20.现有①液态氧,②铁锈,③食盐水,④纯碱, ⑤氢氧化钾,⑥石油。对上述物质的分类全部正确的 是( )
A.盐——③④ B.纯净物——④⑤⑥ C.碱——①⑤ D.混合物——②③⑥
21.X可发生下列所示的两个反应,则X是( ) ①X+酸→盐+水 ②X+水→碱
A.该物质只含有碳元素和氢元素 B.该物质中碳元素与氯元素的质量比为12:1 C.该物质一定含有碳元素和氢元素,可能含有氧元素 D.该物质的分子中碳原子与氢原子的个数比为1:2
11.下列微粒结构示意图中.表示钠原子的是( )
12.下列粒子在化学反应中容易得到电子的是 ()
A.
B.
C.
D.
13.2008年1月份的雪灾对我国南方的电力、交通 造成很大的危害。有一种融雪剂含有Na2SiO3(硅酸 钠),Na2SiO3中Si元素的化合价是( )
40.08
D.该元素的相对原子质量为40.08
24.下列对分子、原子、离子的认识,正确的是( ) A.分子是保持物质性质的最小粒子 B.原子是最小的粒子,不可再分 C.原子得到或失去电子后形成离子 D.CO2和CO性质的差异主要是由于分子间的间隔不 同
25. 2008年北京奥运会主体育场的外形好似“鸟巢”(The Bird Nest),有一类物质也好似鸟巢,如化学式是B5H9的五 硼烷(见右图)。下列有关五硼烷的说法错误的是( ) A.五硼烷属于化合物 B.五硼烷的相对分子质量是64 C.五硼烷中硼元素和氢元素的质量比为5∶9 D.1个五硼烷分子由5个硼原子和9个氢原子构成
A、+1价 B、+2价 C、+3价 D、+4价
20.现有①液态氧,②铁锈,③食盐水,④纯碱, ⑤氢氧化钾,⑥石油。对上述物质的分类全部正确的 是( )
A.盐——③④ B.纯净物——④⑤⑥ C.碱——①⑤ D.混合物——②③⑥
21.X可发生下列所示的两个反应,则X是( ) ①X+酸→盐+水 ②X+水→碱
A.该物质只含有碳元素和氢元素 B.该物质中碳元素与氯元素的质量比为12:1 C.该物质一定含有碳元素和氢元素,可能含有氧元素 D.该物质的分子中碳原子与氢原子的个数比为1:2
11.下列微粒结构示意图中.表示钠原子的是( )
12.下列粒子在化学反应中容易得到电子的是 ()
A.
B.
C.
D.
13.2008年1月份的雪灾对我国南方的电力、交通 造成很大的危害。有一种融雪剂含有Na2SiO3(硅酸 钠),Na2SiO3中Si元素的化合价是( )
40.08
D.该元素的相对原子质量为40.08
24.下列对分子、原子、离子的认识,正确的是( ) A.分子是保持物质性质的最小粒子 B.原子是最小的粒子,不可再分 C.原子得到或失去电子后形成离子 D.CO2和CO性质的差异主要是由于分子间的间隔不 同
25. 2008年北京奥运会主体育场的外形好似“鸟巢”(The Bird Nest),有一类物质也好似鸟巢,如化学式是B5H9的五 硼烷(见右图)。下列有关五硼烷的说法错误的是( ) A.五硼烷属于化合物 B.五硼烷的相对分子质量是64 C.五硼烷中硼元素和氢元素的质量比为5∶9 D.1个五硼烷分子由5个硼原子和9个氢原子构成
A、+1价 B、+2价 C、+3价 D、+4价
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《物质构成的奥秘》 专题复习
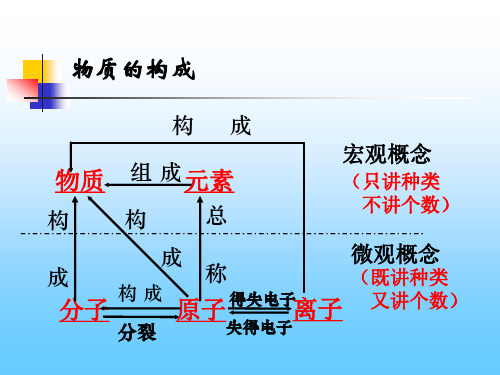
物质的构成
构成
物质 组 成元素
构构
总
宏观概念
(只讲种类 不讲个数)
成
微观概念
成
称
(既讲种类
构成
分子
原子 得失Hale Waihona Puke 子离子又讲个数)分裂
失得电子
一、构成物质的微粒——分子
1、分子的特点
(1)分子体积、质量很小 (2)分子在不断运动 温度越高,分子能量越大,分子运动速率就越快. (3)分子间有间隔
原子结构
决定
质子
元素种类
原子核 (+)
原 (+) 中子
决定 原子质量
子
(不带电)
电子 最外层电子数决定元素化学性质
(-)
核电荷数= 质子数=电子数
相对原子质量 = 质子数+中子数
某种原子的质量 =
一种碳原子质量的(1/12 )
知识迁移
4、下列微粒的性质与质子数、电子数、 中子数、电子层数、最外层电子数等 有关,请你用它们填空
元素种类__质_子__数________; 元素分类__最_外__层__电__子__数___; 相对原子质量_质__子_数__、__中__子_数__; 元素的化学性质_最__外__层_电__子__数_;
5、物质的组成、结构和性质关系归纳错误的
是(
)
A.核内质子数决定了元素的种类
B.元素的化学性质与原子最外层电子数目关
知识迁移
1. 用分子的观点解释,错误的是( ) A.花香四溢—分子在不停运动 B.热胀冷缩—分子的大小随温度变化而改变 C.酒精挥发—分子间距增大 D.氢气和氧气反应生成水—分子发生了变化
2. 航天员专用的小分子团水具有饮用量少、在人体 内储留时间长、排放量少等特点。下列关于小分子团
水的说法中正确的是( )
元素符号 微观:表示该元素的一个原子
元素符号前有数字,只表示原子的个数,只具有 微观意义。
3、元素周期表
①同一周期:从左到右,最外层电子数依次增大 电子层数等于周期数
②同一族:最外层电子数相同 电子层数从上到下依次递增。
③.原子序数= 核电荷数=核内质子数=核外电子数
原子序数(核电荷数)
元素名称
①从物质的变化上看,核变化与化学变化的相同
点
;从原子的变化上看,核变化与化学变化
的不同点是
。
②右图为钚元素的相关信息,下列说法正确的是 ( )
A.钚是非金属元素
B.钚原子核外有94个电子
C.钚元素的中子数94
D.钚的相对原子质量为244g
13、(2013年日照市)下图中A、B、C、D是四种粒子 的结构示意图,E是银元素在元素周期表中的信息
D.和普通氮原子属于同种元素
7、 下列四种微粒中,具有相似的化学性 质的是( )
规律:同类1原子2最外层电子数相同3化学性质 相似 (He.Ne.Ar特殊)
三、构成物质的微粒——离子
1. 定义:带电的原子或原子团叫做离子。
2. 离子形成的过程
阳
失电子
离
子 得电子
原 子
得电子 失电子
阴 离 子
3. 离子符号:
A.水分子的化学性质被改变了 B.小分子团水中水分子间没有间隙 C.小分子团水中水分子停止了运动 D.小分子团水的部分物理性质与普通水有所不同
3、从分子的角度分析水的蒸发与水的分解两 种变化的不同之处。
变化或现象
解释
水蒸发时,水分子本身没有变化,变 水的蒸发 化的只是分子间的间隔。
过氧化氢分解时,过氧化氢分子变成 过氧化氢分 了水分子和氧分子。
系密切
C.原子是化学反应中最小的粒子,因此原子
不可再分
D.物质是由分子、原子、离子等粒子构成
6.今年3月日本发生了核泄漏事故。事故发
生时,放射性原子氮-16能短暂存在。氮-16
的质子数为7,中子数为9。下列有关氮-16
的说法,正确的是(
)
A.核外电子数为9
B.相对原子质量为14
C.和普通氮原子是完全相同的原子
的粒子,则该粒子符号为 ___。 ③.如果该图表示的是带2个单位负电荷
的粒子,则该粒子符号为___。
总结:确定原子种类采用将离子还原成原子的方法
四、物质组成--元素
1、定义: 质子数(即核电荷数)相同的一类原子的总称。 决定元素种类质子数(即核电荷数) 。
2、元素符号表示的意义 宏观:表示一种元素
26 Fe
铁
55.847
元素符号
相对原子质量
11. 下列判断正确的是( ) A.元素所在的周期数等于其最外层电子数 B.钠离子核外有三个电子层 C.第二、三周期元素的原子从左至右最外 层电子数逐渐增多 D.镁原子容易失去最外层2个电子形成镁离 子:Mg+2
12.2011年福岛核电站发生重大核事故。 核电站 中核燃料铀或钚在中子的撞击下,原子核发生分裂, 产生钡、氙、碘、等原子和一些粒子及射线。
阳离子:Xn+ 阴离子:Xn-(n=1时省略)
4. 离子符号里的数字的意义:
mXn+
表示每个某离子带n个单位的正电荷
(右上角数字)
表示m个某离子(前面数字)
8、下列微粒是阳离子的有
离子的有
;原子的有
; 是阴 ;
为稳定结构的有
。
A
B
C
D
总结:1、质子数=核外电子数:原子
质子数>核外电子数:阳离子 质子数<核外电子数:阴离子
气体分子间隙>液体分子间隙>固体分子间隙(通常状况) (4)同种分子化学性质相同,反之不同
2、分子的定义:
分子是保持物质的化学性质的最小粒子(分子构成)
3、化学反应的实质
原物质的分子 分解成 原子 重新组合 新物质的分子
4、分子与物质变化的关系
物理变化——对于分子构成的物质,分子本身不发生改变; 化学变化——对于分子构成的物质,分子本身发生改变, 生成新的分子
解
总结:物变:分子间隔、运动(分子本身不变)
化变:分子变成了其它分子
二、构成物质的微粒——原子
1、原子的特征 (1)原子的体积和质量很小。 (2)原子在不断的运动。 (3)原子间有间隔。
2、原子的定义:是化学变化中的最小微粒。 “最小”指在化学反应中不能再分。
3、分子与原子的主要区别: 化学变化中分子可分,而原子不可再分
2、相对稳定结构:最外层电子数是 8 (只有一层是2)
9.对于Fe、Fe2+、Fe3+三种微粒的判断,
正确的是( 最外层电子
)
①核电荷数相同
②核外电子数相等
③电子层结构完全相同
④质量几乎相等
⑤三种粒子的化学性质相似
A.①④ C.②③④
B.①③⑤ D.①②③④⑤
10、根据右边的结构图回答: ①.如果该图表示的是原子,X值为___ ②.如果该图表示的是带2个单位正电荷
请回答下列问题:
(1)图中A、B、C、D粒子共表示
物质的构成
构成
物质 组 成元素
构构
总
宏观概念
(只讲种类 不讲个数)
成
微观概念
成
称
(既讲种类
构成
分子
原子 得失Hale Waihona Puke 子离子又讲个数)分裂
失得电子
一、构成物质的微粒——分子
1、分子的特点
(1)分子体积、质量很小 (2)分子在不断运动 温度越高,分子能量越大,分子运动速率就越快. (3)分子间有间隔
原子结构
决定
质子
元素种类
原子核 (+)
原 (+) 中子
决定 原子质量
子
(不带电)
电子 最外层电子数决定元素化学性质
(-)
核电荷数= 质子数=电子数
相对原子质量 = 质子数+中子数
某种原子的质量 =
一种碳原子质量的(1/12 )
知识迁移
4、下列微粒的性质与质子数、电子数、 中子数、电子层数、最外层电子数等 有关,请你用它们填空
元素种类__质_子__数________; 元素分类__最_外__层__电__子__数___; 相对原子质量_质__子_数__、__中__子_数__; 元素的化学性质_最__外__层_电__子__数_;
5、物质的组成、结构和性质关系归纳错误的
是(
)
A.核内质子数决定了元素的种类
B.元素的化学性质与原子最外层电子数目关
知识迁移
1. 用分子的观点解释,错误的是( ) A.花香四溢—分子在不停运动 B.热胀冷缩—分子的大小随温度变化而改变 C.酒精挥发—分子间距增大 D.氢气和氧气反应生成水—分子发生了变化
2. 航天员专用的小分子团水具有饮用量少、在人体 内储留时间长、排放量少等特点。下列关于小分子团
水的说法中正确的是( )
元素符号 微观:表示该元素的一个原子
元素符号前有数字,只表示原子的个数,只具有 微观意义。
3、元素周期表
①同一周期:从左到右,最外层电子数依次增大 电子层数等于周期数
②同一族:最外层电子数相同 电子层数从上到下依次递增。
③.原子序数= 核电荷数=核内质子数=核外电子数
原子序数(核电荷数)
元素名称
①从物质的变化上看,核变化与化学变化的相同
点
;从原子的变化上看,核变化与化学变化
的不同点是
。
②右图为钚元素的相关信息,下列说法正确的是 ( )
A.钚是非金属元素
B.钚原子核外有94个电子
C.钚元素的中子数94
D.钚的相对原子质量为244g
13、(2013年日照市)下图中A、B、C、D是四种粒子 的结构示意图,E是银元素在元素周期表中的信息
D.和普通氮原子属于同种元素
7、 下列四种微粒中,具有相似的化学性 质的是( )
规律:同类1原子2最外层电子数相同3化学性质 相似 (He.Ne.Ar特殊)
三、构成物质的微粒——离子
1. 定义:带电的原子或原子团叫做离子。
2. 离子形成的过程
阳
失电子
离
子 得电子
原 子
得电子 失电子
阴 离 子
3. 离子符号:
A.水分子的化学性质被改变了 B.小分子团水中水分子间没有间隙 C.小分子团水中水分子停止了运动 D.小分子团水的部分物理性质与普通水有所不同
3、从分子的角度分析水的蒸发与水的分解两 种变化的不同之处。
变化或现象
解释
水蒸发时,水分子本身没有变化,变 水的蒸发 化的只是分子间的间隔。
过氧化氢分解时,过氧化氢分子变成 过氧化氢分 了水分子和氧分子。
系密切
C.原子是化学反应中最小的粒子,因此原子
不可再分
D.物质是由分子、原子、离子等粒子构成
6.今年3月日本发生了核泄漏事故。事故发
生时,放射性原子氮-16能短暂存在。氮-16
的质子数为7,中子数为9。下列有关氮-16
的说法,正确的是(
)
A.核外电子数为9
B.相对原子质量为14
C.和普通氮原子是完全相同的原子
的粒子,则该粒子符号为 ___。 ③.如果该图表示的是带2个单位负电荷
的粒子,则该粒子符号为___。
总结:确定原子种类采用将离子还原成原子的方法
四、物质组成--元素
1、定义: 质子数(即核电荷数)相同的一类原子的总称。 决定元素种类质子数(即核电荷数) 。
2、元素符号表示的意义 宏观:表示一种元素
26 Fe
铁
55.847
元素符号
相对原子质量
11. 下列判断正确的是( ) A.元素所在的周期数等于其最外层电子数 B.钠离子核外有三个电子层 C.第二、三周期元素的原子从左至右最外 层电子数逐渐增多 D.镁原子容易失去最外层2个电子形成镁离 子:Mg+2
12.2011年福岛核电站发生重大核事故。 核电站 中核燃料铀或钚在中子的撞击下,原子核发生分裂, 产生钡、氙、碘、等原子和一些粒子及射线。
阳离子:Xn+ 阴离子:Xn-(n=1时省略)
4. 离子符号里的数字的意义:
mXn+
表示每个某离子带n个单位的正电荷
(右上角数字)
表示m个某离子(前面数字)
8、下列微粒是阳离子的有
离子的有
;原子的有
; 是阴 ;
为稳定结构的有
。
A
B
C
D
总结:1、质子数=核外电子数:原子
质子数>核外电子数:阳离子 质子数<核外电子数:阴离子
气体分子间隙>液体分子间隙>固体分子间隙(通常状况) (4)同种分子化学性质相同,反之不同
2、分子的定义:
分子是保持物质的化学性质的最小粒子(分子构成)
3、化学反应的实质
原物质的分子 分解成 原子 重新组合 新物质的分子
4、分子与物质变化的关系
物理变化——对于分子构成的物质,分子本身不发生改变; 化学变化——对于分子构成的物质,分子本身发生改变, 生成新的分子
解
总结:物变:分子间隔、运动(分子本身不变)
化变:分子变成了其它分子
二、构成物质的微粒——原子
1、原子的特征 (1)原子的体积和质量很小。 (2)原子在不断的运动。 (3)原子间有间隔。
2、原子的定义:是化学变化中的最小微粒。 “最小”指在化学反应中不能再分。
3、分子与原子的主要区别: 化学变化中分子可分,而原子不可再分
2、相对稳定结构:最外层电子数是 8 (只有一层是2)
9.对于Fe、Fe2+、Fe3+三种微粒的判断,
正确的是( 最外层电子
)
①核电荷数相同
②核外电子数相等
③电子层结构完全相同
④质量几乎相等
⑤三种粒子的化学性质相似
A.①④ C.②③④
B.①③⑤ D.①②③④⑤
10、根据右边的结构图回答: ①.如果该图表示的是原子,X值为___ ②.如果该图表示的是带2个单位正电荷
请回答下列问题:
(1)图中A、B、C、D粒子共表示
